Стратегия лечения ревматоидного артрита
Целью рандомизированного клинического исследования ORAL Strategy было сравнение различных стратегий лечения больных средне-тяжелым или тяжелым ревматоидным артритом, не ответивших на терапию метотрексатом: присоединение тофацитиниба или ингибитора фактора некроза опухоли-α или переход на монотерапию тофацитинибом. Две схемы комбинированной терапии не отличались по эффективности и безопасности. Частота ответа на монотерапию была достаточно высокой, но ниже таковой у пациентов, получавших тофацитиниб или адалимумаб в сочетании с метотрексатом. Результаты исследования свидетельствуют о том, что при отсутствии ответа на стандартные базисные противовоспалительные препараты больным активным ревматоидным артритом следует назначать комбинированную терапию тофацитинибом и метотрексатом. Монотерапия тофацитинибом возможна у пациентов, которые не переносят метотрексат или другие базисные противовоспалительные препараты или имеют противопоказания к их применению
Всоответствии с последними рекомендациями Европейский антиревматической лиги (EULAR) и Американской коллегии ревматологов (ACR) пациентам с ревматоидным артритом (РА), не ответившим на монотерапию или комбинированную терапию стандартными базисными противовоспалительными препаратами (БПВП), необходимо назначить генноинженерный биологический препарат (ГИБП), такой как ингибитор фактора некроза опухоли-α (ФНО), или таргетный БПВП [1,2]. К последней группе относятся ингибиторы янус-киназ – низкомолекулярные синтетические препараты, предназначенные для приема внутрь и оказывающие селективное действие на внутриклеточную сигнальную систему JAK/STAT, которая опосредует действие многих цитокинов, участвующих в патогенезе РА 3. В России единственным зарегистрированным препаратом этой группы является тофацитиниб (Яквинус). Эффективность и безопасность тофацитиниба в дозе 5 мг и 10 мг два раза в день в виде монотерапии или в комбинации со стандартными БПВП, прежде всего метотрексатом, у больных активным РА установлены в нескольких плацебоконтролируемых исследованиях 3 фазы и длительных наблюдательных исследования (до 105 мес) [7]. В двух исследованиях была сопоставлена эффективность тофацитиниба и ингибитора ФНО-α адалимумаба у больных РА, однако оба этих исследования имели определенные ограничения, что не позволило сделать окончательные выводы [8,9]. Недавно были опубликованы результаты рандомизированного контролируемого исследования 3b/4 фазы (Oral Rheumatoid Arthritis triaL [ORAL] Strategy), которое предполагало прямое сравнение трех стратегий лечения у больных РА, не ответивших на метотрексат, – монотерапии тофацитинибом или комбинированной терапии тофацитинибом с метотрексатом или адалимумабом с метотрексатом [10].
Дизайн исследования
ORAL Strategy было 12-месячным, двойным слепым, прямым сравнительным исследованием, которое проводилось в 194 центрах в 25 странах, включая Россию. Целью исследования было доказать, что монотерапия тофацитинибом в дозе 5 мг два раза в день или комбинированная терапия тофацитинибом внутрь в дозе 5 мг два раза в сутки и метотрексатом по эффективности не уступает (non-inferiority) комбинированной терапии адалимумабом в дозе 40 мг подкожно каждые 2 недели и метотрексатом у больных активным ревматоидным артритом (счет болезненных или опухших суставов по крайней мере 4 и концентрация высокочувствительного С-реактивного белка >3 мг/л). Критерием включения было также отсутствие ответа на лечение метотрексатом в дозе 15-25 мг/нед в течение по крайней 4 мес (в стабильной дозе в течение по крайней мере 6 последних недель). Пациентов рандомизировали на три равные группы и назначали монотерапию тофацитинибом или добавляли тофацитиниб или адалимумаб к метотрексату в прежней дозе. Чтобы обеспечить слепую маскировку, использовали тройное плацебо.
Первичной конечной точкой исследования была частота ответа по критериям Американской коллегии ревматологов (АКР) 50 через 6 мес у всех рандомизированных пациентов. Кроме того, оценивали частоту ответа по критериям АКР20 и АКР70, частоту достижения низкой активности и ремиссии РА, динамику качества жизни (короткая форма [SF] 36, EuroQol) и усталости, а также ряд других вторичных конечных точек через 6 мес и в другие сроки исследования. Критериями ремиссии служили значения SDAI ≤3,3, CDAI ≤2,8, DAS28-4[СОЭ]
Результаты
Характеристика больных. В исследование были включены 1146 больных; 384 из них получали монотерапию тофацитинибом, 376 – тофацитиниб в сочетании с метотрексатом и 386 – адалимумаб в сочетании с метотрексатом. По демографическим и исходным клиническим показателям, в том числе активности и тяжести РА, три группы были сопоставимыми (табл. 1). Эффективность. Во всей выборке через 6 мес ответ по критериям АКР50 был достигнут у 38% больных, получавших монотерапию тофацитибином, 46% пациентов, получавших тофацитиниб и метотрексат, и 44% больных, получавших адалимумаб и метотрексат (рис. 1,2). Комбинированная терапия тофацитинибом и метотрексатом по эффективности не уступала комбинации ингибитора ФНО-α и метотрексата: разница частоты ответа по критериям АКР50 между группами составила 2% (98,34% доверительный интервал [ДИ] от -6 до 11), а нижняя граница указанного ДИ находилась выше точки, предусмотренной протоколом (-13%). В то же время сопоставимая эффективность монотерапии тофацитинибом по сравнению с комбинацией тофацитиниба и метотрексата (разница между группами -8%; 98,34% ДИ от -16 до 1) или адалимумаба и метотрексата (разница -6%; 98,34% ДИ от -14 до 3) на основании приведенного выше критерия не была подтверждена. Сходные результаты были получены в выборке пациентов, выполнивших протокол. В этой выборке частота ответа по критерия АКР50 у больных, получавших только тофацитиниб или комбинированную терапию тофацитинибом и метотрексатом или адалимумабом и метотрексатом, составила 41%, 51% и 47%, соответственно.
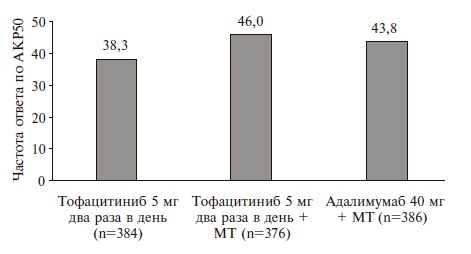
Рис. 1. Первичная конечная точка в исследовании ORALStrategy - частота ответа по критериям АКР50 (%) через 6 месвтрехгруппах. МТ - метотрексат 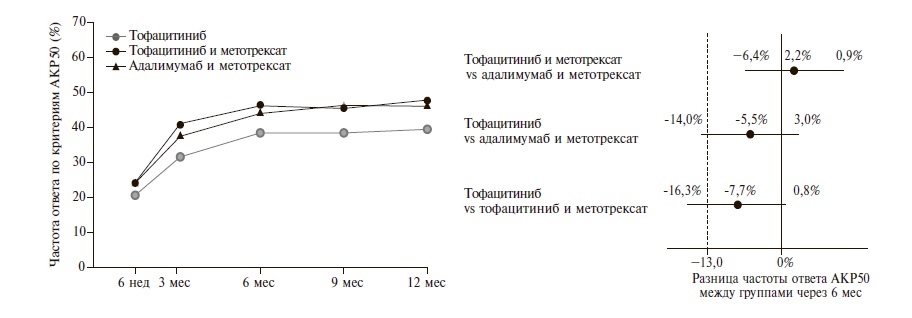
Рис. 2. Частота ответа по критериям АКР50 (%) на лечение в трех группах. На правом графике: меньшая эффективность = правая граница ДИ 0
| Тофацитиниб (n=384) | Тофацитиниб + метотрексат (n=376) | Адалимумаб + метотрексат (n=386) | |
|---|---|---|---|
| Примечание: АЦПП - антитела к цитруллинированному пептиду, вчСРБ - высокочувствительный С-реактивный белок | |||
| Женщины | 319 (83%) | 311 (83%) | 320 (83%) |
| Возраст, лет | 49,7±12,2 | 50,0±13,4 | 50,7±13,4 |
| Длительность РА, лет | 6,1 (0,2–41,6 | 5,4 (0,0–43,5) | 6,0 (0,3–42,8 |
| Предыдущая терапия | |||
| Стандартный БПВП (помимо метотрексата) | 122 (32%) | 115 (31%) | 142 (37%) |
| ГИБП (исключая ингибиторы ФНО) | 17 (4%) | 14 (4%) | 20 (5%) |
| Ингибитор ФНО | 28 (7%) | 16 (4%) | 19 (5%) |
| Доза метотрексата, мг/нд | 0 | 16,7±3,7 | 16,4±3,7 |
| Глюкокортикостероиды исходно | 223 (58%) | 214 (57%) | 218 (57%) |
| Суточная доза глюкокортикостероидов, мг | 7,3±13,3 | 6,5±2,5 | 6,5±2,6 |
| Счет болезненных суставов (28) | 15,4±6,5 | 15,6±6,5 | 15,2±6,7 |
| Счет опухших суставов (28) | 11,2±5,6 | 11,8±5,7 | 11,0±5,4 |
| Общая оценка активности пациентом | 60,1±21,4 | 61,7±22,0 | 60,2±23,5 |
| Общая оценки активности врачом | 59,7±17,7 | 60,7±18,0 | 60,3±19,6 |
| Боль по визуальной аналоговой шкале | 61,2±21,7 | 60,7±22,4 | 60,6±22,6 |
| DAS28-4(СОЭ) | 6,5±0,9 | 6,6±0,9 | 6,5±1,0 |
| DAS28-4(CРБ) | 5,7±0,9 | 5,8±0,9 | 5,7±1,0 |
| SDAI | 40,2±13,0 | 41,6±13,2 | 39,8±13,3 |
| CDAI | 38,6±12,6 | 39,7±12,7 | 38,2±12,9 |
| HAQ-DI | 1,6±0,6 | 1,6±0,6 | 1,6±0,6 |
| вчСРБ, мг/дл | 16,6±19,3 | 18,7±21,9 | 16,7±21,3 |
| АЦПП | 291 (76%) | 282 (75%) | 299 (78%) |
Через 12 мес частота ответа по критериям АКР50 в выборке intention-to-treat существенно не изменилась и составила 39% в группе тофацитиниба, 48% в группе тофацитиниба и метотрексата и 46% в группе адалимумаба и метотрексата. В конце исследования частота ответа по критериям АКР20, АКР50 и АКР70 в группах больных, получавших комбинированную терапию, была сопоставимой и превышала таковую у пациентов, которым проводили монотерапию тофацитинибом (табл. 2).
Обсуждение
Исследование ORAL Strategy было призвано ответить на вопрос, какую стратегию терапии следует выбрать, если пациент с активным РА не отвечает на лечение метотрексатом или другими стандартными БПВП: добавить к метотрексату тофацитиниб или ингибитор ФНО-α, такой как адалимумаб, или перевести больного на монотерапию тофацитинибом. Соответственно, пациенты, включенные в исследование, были распределены на три равные группы и получали только тофацитиниб или комбинированную терапию тофацитинибом или адалимумабом с метотрексатом. Примерно 60% пациентов исходно принимали глюкокортикостероиды в низкой дозе. Одна первичная конечная точка исследования была достигнута – через 6 мес частота ответа по критериям АКР50 была сопоставимой в двух группах больных, которым проводилась комбинированная терапия. Это свидетельствовало о том, что при присоединении к метотрексату тофацитиниба или ингибитора ФНО-α адалимумаба можно ожидать сходных результатов лечения.
В определенной степени эти результаты были ожидаемыми. В ранее опубликованном рандомизированном контролируемом исследовании ORAL Standard, в котором сравнивали эффективность и безопасность тофацитиниба и плацебо у больных РА, не ответивших на метотрексат в стабильной дозе, была выделена группа пациентов, получавших адалимумаб [11]. Пациенты всех трех групп продолжали прием метотрексата в прежней дозе. По частоте ответа по критериям АКР20 через 6 мес (первичная конечная точка) схемы комбинированной терапии тофацитинибом или адалимумабом с метотрексатом достоверно не отличались (52% и 47%, соответственно). Частота ответа по критериям АКР50 при лечении тофацитинибом с метотрексатом была выше (37%), чем при комбинированной терапии адалимумабом и метотрексатом (28%), однако разница не достигла статистической значимости. Необходи мость в дополнительном сравнительном анализе комбинированной терапии тофацитинибом или ингибитором ФНО-α была связана с тем, что дизайн исследования ORAL Standard не предполагал подтверждение сходной эффективности тофацитиниба и адалимумаба.
Второй целью исследования ORAL Strategy было показать сопоставимую эффективность (non-inferiority) монотерапии тофацитинибом и комбинированной терапии препаратами сравнения и метотрексатом. Эта конечная точка не была достигнута. Как по первичному, так и различным вторичным показателям эффективности, которые оценивали через 6 и 12 мес, монотерапия ингибитором янус-киназ уступала комбинированной терапии как тофацитинибом и метотрексатом, так и адалимумабом и метотрексатом. Тем не менее, полученные данные не указывают на неэффективность монотерапии тофацитинибом. Дизайн исследования не предполагал подтверждение более высокой эффективности той или иной схемы лечения, поэтому полученные данные не позволяют сделать вывод о том, что комбинированная терапия превосходила монотерапию.
Результаты применения ингибитора янус-киназ в исследовании ORAL Strategy были сходными с результатами плацебо-контролируемого исследования ORAL Solo, в котором изучалась эффективность монотерапии тофацитинибом у 611 пациентов с РА, прекративших лечение по крайней мере одним БПВП и ГИБП из-за недостаточного ответа или плохой переносимости [12]. Большинство пациентов до включения в это исследование получали метотрексат (более 80%) или другие БПВП, в то время как опыт применения ГИБП имелся примерно у одной пятой больных. Пациенты двух основных групп на протяжении всего исследования получали тофацитиниб в дозах 5 или 10 мг два раза в день, в то время как у пациентов двух групп сравнения в течение первых 3 месяцев применяли плацебо, после чего их переводили на тофацитиниб в дозах 5 или 10 мг два раза в сутки. Соответственно, первичные показатели эффективности оценивали через 3 месяца после начала лечения. Монотерапия тофацитинибом в обеих дозах по эффективности достоверно превосходила плацебо, а после перевода пациентов контрольной группы на лечение ингибитором янус-киназ наблюдалось быстрое увеличение частоты ответа на терапию. В группе пациентов, получавших тофацитиниб в дозе 5 мг два раза в день, через 3 мес частота ответа по критериям АКР20, АКР50 и АКР70 составила 59,8%, 31,1% и 15,4%. Эти показатели более чем в два раза превышали таковые в группе плацебо (p 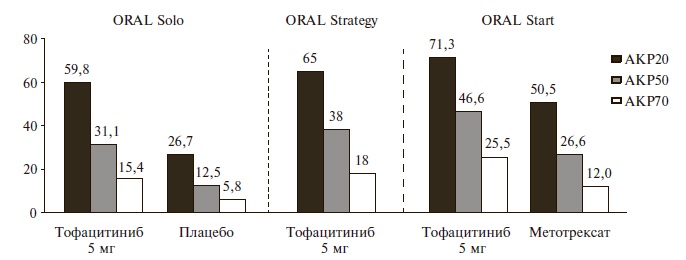
Рис. 3. Частота ответа (по критериям АКР) на монотерапию тофацитинибом в дозе 5 мг два раза в день у пациентов, получавших (ORALStrategyи ORAL Solo) и не получавших (ORAL Start) ранее БПВП
Еще одним исследованием, в котором пациенты с РА получали монотерапию тофацитинибом, было ORAL Start [13]. В отличие от предыдущих исследований, в нем изучали эффективность терапии первой линии, а тофацитиниб сравнивали с метотрексатом у 958 больных РА, не получавших ранее метотрексат или не принимавших его в терапевтических дозах. В этом исследовании частота ответа на лечение тофацитинибом через 6 мес была несколько выше, чем в исследованиях ORAL Strategy и ORAL Solo, что отражало особенности выборки – пациенты с ранним РА, не получавшие ранее БПВП или принимавшие их в низких дозах. Основным результатом исследования ORAL Start было достоверное превосходство тофацитиниба над метотрексатом по эффективности. Например, через 6 мес частота ответа по критериям АКР70 при лечении тофацитинибом в дозе 5 мг два раза в день (25,5%) была в два раза выше, чем в группе метотрексата (12,0%; p
Заключение
В исследовании ORAL Strategy у больных активным РА, не ответивших на метотрексат, комбинированная терапия тофацитинибом в дозе 5 мг два раза в день и метотрексатом по эффективности и безопасности не отличалась от терапии адалимумабом и метотрексатом. Монотерапия тофацитинибом по эффективности уступала обеим схемам комбинированной терапии, хотя результаты применения одного ингибитора янус-киназ были сопоставимыми с таковыми в рандомизированных клинических исследованиях, подтвердивших более высокую эффективность монотерапии тофацитинибом по сравнению с плацебо или метотрексатом. Полученные данные свидетельствуют о том, что тофацитиниб может применяться у больных тяжелым и среднетяжелым РА, не отвечающих на метотрексат или другие стандартные БПВП, наравне с ингибиторами ФНО-α. Тофацитиниб следует назначать в комбинации с метотрексатом, однако монотерапия тофацитинибом возможна, если пациент не переносит метотрексат и другие стандартные БПВП или имеет противопоказания к их применению.
Ревматоидный артрит (РА) – системное аутоиммунное ревматическое заболевание, характеризующееся развитием эрозивного симметричного полиартрита и поражением различных органов и систем.
Современная стратегия лечения РА базируется на ранней диагностике заболевания. Это позволяет своевременно (окно возможности) инициировать активную терапию для максимально быстрого достижения ремиссии (лечение до достижения цели) [1, 2].
В настоящее время сформулированы четыре принципа лечения РА:
- решение о выборе терапии принимается совместно – и врачом, и пациентом;
- решение о лечении должно основываться на активности заболевания, степени повреждений, наличии сопутствующих патологий и его безопасности;
- ведущую роль в ведении таких больных играют ревматологи;
- следует учитывать высокие индивидуальные, медицинские и социальные издержки.
В рекомендациях EULAR-2016 особый акцент сделан на применении базисных противовоспалительных препаратов (БПВП). Отмечено, что терапия ими должна быть начата, как только будет поставлен диагноз РA. Лечение должно быть направлено на достижение устойчивой ремиссии или низкой активности болезни.
Одним из представителей класса ГИБП, применяемых при РА, является инфликсимаб (ИФ) – химерное моноклональное антитело против фактора некроза опухоли альфа (ФНО-альфа).
Данные о преимуществах комбинированной терапии ИФ и МТ перед монотерапией МТ в отношении влияния на показатели качества жизни пациентов с рРА немногочисленны [9, 10].
Поэтому целью настоящего исследования стала оценка показателей клинической активности, иммунологических параметров и показателей рентгенологического прогрессирования рРА при применении в течение 12 месяцев СС, МТ и ЛФ в качестве первых БПВП, а также сравнение эффективности комбинированной терапии ИФ и МТ с монотерапией МТ у пациентов с активным течением РА.
Материал и методы
Проведено клинико-лабораторное и инструментальное обследование 151 пациента с рРА. Диагноз РА ставился на основании критериев Европейской антиревматической лиги и Американской коллегии ревматологов (American College of Rheumatology – ACR) (2010 г.) [11, 12].
Длительность заболевания на момент первичного обследования составляла от трех недель до 12 месяцев (в среднем 6,5 ± 0,3 месяца).
Средний возраст больных – 58,2 ± 5,5 года. Большая часть пациентов (51,2%) была серонегативной по ревматоидному фактору (РФ). Антитела к циклическим цитруллинированным пептидам выявлены у 76% участников исследования. Отмечены преимущественно средняя и высокая степени активности иммуновоспалительного процесса по индексу активности болезни (Disease Activiti Score – DAS 28) – DAS 28 > 3,2 балла, I и II рентгенологические стадии РА по классификации Штейнброкера (23,2 и 60,5% соответственно), второй функциональный класс (59,7%).
После постановки диагноза больным методом случайной выборки была назначена базисная терапия. Первая группа (n = 55) получала СС в дозе 2 г в сутки, вторая (n = 55) – МТ per os или в/м в дозе 1,0–12,5 мг в неделю, третья (n = 41) – три дня ЛФ в дозе 100 мг в сутки, затем по 20 мг в сутки.
Наряду с базисной терапией назначался нестероидный противовоспалительный препарат (НПВП).
Длительность наблюдения составила 12 месяцев.
Второй этап исследования предполагал отбор 46 пациентов с рРА с умеренной (DAS 28 > 3,2, но 5,1 балла) степенями активности болезни, несмотря на проведенную терапию СС, МТ и ЛФ.
Обследованные пациенты методом слепой выборки были разделены на две группы. Первой (n = 30) назначили МТ (15–20 мг/нед), второй (n = 16) – МТ (15–20 мг/нед) в комбинации с инфликсимабом (Ремикейд) из расчета 3 мг на 1 кг в/в капельно. Схема введения: нулевая, вторая и шестая недели, затем через каждые восемь недель.
Группы были сравнимы по полу, возрасту, длительности заболевания, активности РА по DAS 28 и его рентгенологической стадии.
Длительность второго этапа наблюдения составила 24 недели.
Оценивались суставной синдром, выраженность боли по Визуальной аналоговой шкале (ВАШ), индекс Ричи, количество болезненных и припухших суставов, функциональный индекс оценки здоровья (Health Assessment Questionnaire – HAQ), показатели качества жизни по опроснику SF-36 (Short Form Medical Outcomes Study).
Эффективность лечения определялась с помощью индекса активности DAS 28 и критериев АСR по 20, 50 и 70%-ному улучшению.
Иммунологическое обследование включало оценку уровней интерлейкинов (ИЛ) 1-бета, 2, 4, 6, 10 и ФНО-альфа с помощью диагностических наборов фирмы Randox и автоматизированного иммунохемилюминесцентного анализатора Evidence с использованием биочиповой технологии. Оценивались фенотипические характеристики лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+, CD25+, CD56+ и HLA-DR+) методом проточной цитометрии на проточном цитофлуориметре FACScan (Becton Dickinson, США).
Исследование иммуноглобулинов (Ig) A, M, G в сыворотке крови осуществлялось методом жидкофазной иммунопреципитации, циркулирующих иммунных комплексов (ЦИК) – методом преципитации с раствором полиэтиленгликоля.
Состояние суставов у больных оценивалось по результатам рентгенографии, которая проводилась на аппарате Sireskop CX (Siemens). Рентгенологические стадии РА определялись по классификации Штейнброкера.
Рентгенологическое прогрессирование заболевания – по методу Шарпа (1985 г.) в модификации M.F.M. van der Heijde (1999 г.). Статистическая обработка данных проводилась с помощью компьютерной программы Statistica 5,5 для Windows с использованием критериев Стьюдента, Манна – Уитни, Фишера, медианного хи-квадрата, модуля ANOVA, коэффициента корреляции по Спирмену.
- Средние значения представлены в виде M ± m.
- Достоверными считались различия при p 3,2, но
В настоящее время не существует методов лечения, которые позволяли бы достигнуть полного выздоровления пациентов с РА, в связи с чем все методы терапии носят в общей сложности паллиативный характер (Fauci A.S., Langford C.A., 2010). Однако существует утверждение, что различные терапевтические опции, в том числе методы фармакотерапии, ставшие доступными в настоящее время, в купе с существенным прогрессом в понимании иммунологии РА, обеспечивают гораздо более позитивные эффекты на дальнейшее прогрессирование РА, прогноз и исходы в случаях их агрессивного применения уже на ранних этапах заболевания (Saag KG, 2008).
Основными целями антиревматической терапии, являются:
- устранение болевого синдрома и припухлости суставов (симптоматическая терапия);
- подавление воспаления;
- протектирование суставных тканей от последующей деструкции;
- предотвращение деформации суставов и костной эрозии;
- улучшение или сохранение функционального статуса, предотвращение нетрудоспособности, оптимизация качества жизни;
- предотвращение развития экстрасуставных проявлений/осложнений.
Сразу после постановки диагноза и исключения воспалительных артритов, которые могут быть обусловлены иными причинами, в частности инфекциями, онкологическими заболеваниями,метаболическими заболеваниями, с целью превентирования и и/или контроля дальнейшего повреждения суставов и ухудшения функционального статуса назначаются препараты из группы заболевание-модифицирующих антиревматических средств (DMARD33). DMARD составляют основу лечения пациентов с воспалительными артритами, при этом прочие ЛС, в том числе анальгетики рассматриваются в качестве средств адъювантной (вспомогательной) терапии. Так, согласно современным зарубежным и отечественным клиническим рекомендациями, разработанным с учетом принципов медицины, основанной на доказательствах, метотрексат – препарат из группы DMARD следует рассматривать в качестве средства первой линии терапии пациентов с РА при отсутствии противопоказаний.
В случаях же непереносимости метотрексата и/или его недостаточной эффективности могут назначаться другие DMARD или же включаться другие DMARD в комбинации с метотрексатом (сульфасалазин, лефлуномид, реже циклоспорин, азатиоприн и препараты золота) (Kyburz D., Finckh A., 2013) (Scott DL, Rheumatoid arthritis, 2010). Так, по данным некоторых авторов, применение DMARD в качестве стартовой терапии уже на ранних этапах развития РА ассоциируется с ремиссией почти у 50% пациентов и у большинства пациентов – с улучшением исходов (Gramling A, O'Dell JR, 2012).
В то же время в последних рекомендациях ACR по использованию биологических и небиологических DMARD предлагается использовать на выбор метотрексат или лефлуномид. Назначение последнего в стандартной схеме с применением насыщающих доз позволяет создавать терапевтическую концентрацию вещества в крови уже в течение 1-й недели лечения и добиться отчетливого клинического улучшения в течение 1-го месяца. Таким образом, в сравнении с метотрексатом лефлуномид действует гораздо быстрее, и может представлять особый интерес для лечения раннего РА (Олюнин Ю.А., 2010).
Биологическая терапия, главным образом, в комбинации с метотрексатом (или в некоторых случаях с лефлуномидом) рекомендуется для пациентов с недостаточным ответом на лечение последним (по прошествии 3 мес) (Moya A & al., 2009) (Scott DL, Rheumatoid arthritis, 2010), а также при наличии факторов риска прогрессирования эрозивных повреждений. Так, в рамках клинических исследований было установлено, что включение биологической терапии в лечение пациентов с РА ассоциируется с существенным снижением клинической активности заболевания, а также его радиографических признаков.
При этом интересно, что прогрессирование деструкции суставных тканей, регистрируемой методом радиографии, существенно замедляется даже у пациентов с остаточной активностью воспалительного процесса, что указывает на относительную разобщенность синовита и эрозивного процесса. В таких случаях биологические лекарственные средства показаны в качестве терапии первой линии, когда метотрексат ассоциируется с недостаточной эффективностью (KyburzD., FinckhA., 2013).
Оптимальный план лечения пациентов РА, разработанный по итогам диагностики заболевания, помимо DMARD должен также включать и иные терапевтические опции, в том числе средства адъювантной антиревматической терапии, в частности препараты НПВС, анальгетики, глюкокортикостероиды в малых дозах (перорально, внутрисуставно или внутримышечно), средства для лечения/коррекции сопутствующих заболеваний/состояний (например, при анемии), а также иные нефармакологические методы терапии, в том числе программы обучения пациентов, консультации с физиотерапевтами и врачами-остеопатами, социальными работниками и специалистами из области профессиональной медицины и психиатрии (когнитивно-поведенческая терапия) (Fauci A.S., Langford C.A., 2010) (Bope E.T., 2011).
На ранних фазах развития РА в качестве нефармакологических метолов лечения пациентов могут быть рекомендованы хирургические ортопедические вмешательства, в частности открытая синовэктомия, то есть удаление синовиальной оболочки, подвергнутой воспалительному повреждению. Подобные манипуляции направлены на предотвращение быстро прогрессирующей деструкции сустава. В некоторых случаях поврежденный сустав может потребовать операции по замене сустава (например коленного) (Bope E.T., 2011). Согласно данным ретроспективного анализа медицинских данных, проводившегося MassardoL. и соавт. (Massardo L, 2002),в последние годы ортопедическая хирургия приобретает все большее значение: хирургические операции за последние 30 лет были проведены в среднем в отношении 35% пациентов с РА. Из них 32% по замене сустава.
Оценка эффективности применяемого терапевтического подхода к терапии каждого отдельного пациента с РА имеет критически важное значение. При этом согласно руководящим принципам и рекомендациям, разработанным ACR, а также отечественным национальным рекомендациям каждый пациент с РА в рамках реализации терапевтического плана должен подвергаться регулярной оценке активности заболевания, а в случаях неадекватного ответа на лечение, наличие нежелательных явлений должно быть проведено изменение режима применения DMARD с его заменой или включением дополнительных ЛС.
В клинической практике проводится регулярная оценка общего физического состояния, данных лабораторных исследований и рентгенограмм, а с целью более строгого контроля исходов терапии/заболевания используются методы количественного оценки состояния пациента с учетом критериев ACR 1988 г. (чаще всего), шкал DAS28, краткая форма опросника по оценке качества жизни (Short Form 36, SF-36), ВАШ, опросника HAQ, определения индекса активности заболевания (Simplified Disease Activity Index, SDAI) и клинической активности заболевания (the Clinical Disease Activity Index, CDAI) (Greene R.J., Harris N.D., 2008).
Автор материала: Булгакова Яна Сергеевна , кандидат биологических наук , ООО Сайнсфайлз

- Лечим ревматоидный артрит без НПВС
- Снятие боли уже через 2-3 сеанса!
- Полный курс лечения 7-12 процедур
Дата публикации: 13.05.2014
Дата обновления: 24.04.2020
Все врачи клиники
Особенности развития болезни
Это хроническое воспалительное заболевание суставов аутоиммунного характера с системными проявлениями и поражением сердца, печени и других органов. Основной причиной его считается наследственная предрасположенность, но болезнь может и не проявиться в течение жизни, если не будет наличия предрасполагающих факторов в виде перенесенных инфекций, стрессов, травм, гормональных нарушений и т.д.
Механизм развития заболевания и его проявления связаны с образованием антител, оказывающих разрушающее воздействие на клетки органов и тканей собственного организма (ревматоидного фактора – РФ), а также резкого увеличения провоспалительных цитокинов – информационных молекул, поддерживающих воспалительный процесс. Заболевание обычно начинается после 40 – 45 лет, чаще у женщин.
Современный подход к лечению болезни
Клинические рекомендации по лечению ревматоидного артрита (РА) включают в себя совместную работу терапевта и больного. Врачу следует своевременно назначать необходимое лечение, а пациенту скрупулезно выполнять назначения. Только в этом случае можно будет добиться результата: ремиссии или снижения активности заболевания. Клинические рекомендации:
- Главная цель лечения – подавление воспаления и разрушения суставов. Это приводит к стойкой ремиссии или, если это невозможно из-за большой продолжительности воспаления, - к снижению активности патологического процесса.
- Пока главная цель не достигнута, раз в три месяца должна проводиться оценка активности процесса (полная диагностика с проверкой состояния суставов) и пересматриваться назначенный курс лечения.
- Пациента следует ознакомить со стратегией лечения ревматоидного артрита для активного участия в лечебном процессе.

Лечение
Перед началом лечебных мероприятий необходимо провести диагностику и уточнить диагноз больного. Терапия должна быть комплексной и включать в себя:
- режим;
- диету;
- медикаментозную терапию;
- физиолечение, лечебную физкультуру, массаж;
- народные средства;
- ортопедические и хирургические методы.
Курс может занимать длительное время, продолжаясь несколько лет.
Пациент должен соблюдать постельный режим только при активном воспалении. Как только активность хронического патологического процесса снижается, объем движений может увеличиваться за счет упражнений лечебной физкультуры (ЛФК). Необходимо также устранить все стрессы, высыпаться, чаще гулять на свежем воздухе.
Диета является составной частью комплексного лечения. Организм больного ревматоидным артритом теряет много белка и кальция, поэтому в рационе больного должны присутствовать блюда, богатые этими ингредиентами. Организмом лучше усваивается белок животного происхождения, поэтому можно употреблять молоко, йогурт, сыр, творожные, мясные, рыбные блюда. Необходимы отварные и свежие овощи, несладкие фрукты. Готовить можно на пару, отваривать и запекать продукты.

Лечение ревматоидного артрита медикаментозными средствами – основной вид помощи. Правильно подобранные лекарства позволяют подавить воспалительную реакцию, приостановить разрушение суставов и нарушение работы внутренних органов.
Медикаментозная терапия ревматоидного артрита должна подбираться индивидуально для каждого больного. По результатам обследования назначают следующие группы препаратов для лечения ревматоидного артрита:
- Нестероидные противовоспалительные средства (НПВС) – Диклофенак, Найз, Кетопрофен . Лекарства этой группы значительно уменьшают отек и боль, их используют в начале лечения. Это чисто симптоматическое воздействие, задачей которого является облегчение состояния больного. НПВС применяют в виде инъекций и ректальных свечей (например, Диклофенак), таблеток (Найз, Целекоксиб), гелей и мазей для местного применения (Диклофенак, Кетопрофен). Но как только боль стихают, их отменяют, так как при длительном применении начинают проявляться побочные эффекты: изменения со стороны желудочно-кишечного тракта (ЖКТ) и свертываемости крови.
- Глюкокортикостероидные гормоны (ГКС – Гидрокортизон, Дексаметазон, Бетаметазон) – применяются наряду с НПВС для устранения отека и болевого синдрома короткими курсами, так как они имеют множество побочных эффектов, а при длительном применении требуют постоянного наращивания дозировок. ГКС сразу же купируют болевой синдром, поэтому при острых состояниях делают уколы внутрь суставов.
- Базисные противовоспалительные препараты (БПВП - Метотрексат, Сульфасалазин, Циклоспорин А, Азатиоприн, Лефлуномид,). Базисные препараты, оказывающие воздействие на механизм развития болезни (патогенез), являются главным средством лечения РА. Механизм действия и формы выпуска БПВП:
- Метотрексат - лечение ревматоидного артрита этим лекарством имеет давние традиции; он подавляет повышенную активность иммунной системы; назначают уколы, таблетки для приема внутрь; действие Метотрексата проверено временем; но длительное применение Метотрексата приводит к нарушению содержания фолиевой кислоты и осложнениям со стороны ЖКТ, в виде облысения и др.; поэтому клинические рекомендации по применению Метотрексата включают также назначение фолиевой кислоты на протяжении всего курса;
- Сульфасалазин – оказывает противовоспалительное действие; лечение ревматоидного артрита этим средством проводится давно и успешно;
- Лефлуномид – современный таблетированный препарат для базисной терапии, подавляющий иммунные реакции, образование и разрастание внутрисуставной соединительной ткани, оказывающий противовоспалительное действие.
- Генно-инженерные биологические препараты (ГИБП) - созданные искусственно молекулы и антитела, механизм действия которых направлен на подавление определенных этапов иммунитета и воспаления.Недостатком этих средств является значительное подавление иммунитета и опасность развития инфекций:
- Инфликсимаб – один из первых лекарств этой группы; это антитела к цитокину ФНО-альфа, поддерживающему воспаление и аутоиммунные реакции; показан при острых и хронических болях; вводится в виде внутривенных капельных инъекций по схеме; аналогичным механизмом действия обладают Адалимумаб, Этанерцепт, Цертолизумаба пэгол, Голимумаб;
- Ритуксимаб – подавляет аутоиммунные воспалительные процессы за счет уничтожения В-лимфоцитов; уколы лекарства делают по схеме; лечебный курс продолжается в течение нескольких месяцев; хорошо подавляет признаки заболевания; недостатком являются достаточно частые аллергические реакции;
- Тоцилизумаб – подавляет действие цитокина интерлейкина-6, подавляет системные нарушения и прогрессирование патологического процесса; вводится внутривенно по схеме;
- Абатацепт – подавляет аутоиммунные реакции за счет блокировки активности Т-лимфоцитов; вводится внутривенно капельно один раз в месяц; хорошо переносится больными, снимает утреннюю скованность.
- Избирательно действующие (селективные) иммунодепрессанты (Тофацитиниб) – относятся к таргетным лекарствам, оказывающим целенаправленное действие на определенные механизмы воспаления и звенья иммунной системы. Так, действие Тофацитиниба связано с подавлением активности ферментов, участвующих в передаче сигналов, активизирующих воспалительный процесс.
Боль в суставах в состоянии покоя
Хондропротекторы что это как выбрать, насколько они эффективны
Так как большинство препаратов для лечения ревматоидного артрита имеет побочные действия, на фоне медикаментозного лечения раз в 3 месяца обязательно проводится контрольное обследование пациента. Иногда такой контроль по решению лечащего врача проводится чаще для того, чтобы проверить качество лечения и изменить комбинацию назначенных лекарств.
![]()
Упражнения лечебной гимнастики назначают с самого начала лечения ревматоидного артрита, когда у больных людей еще есть все симптомы болезни. Применять ЛФК противопоказано при:
- сильных суставных болях;
- симптомах тяжелых системных внесуставных проявлений ревматоидного артрита с поражением внутренних органов;
- тяжелых формах сопутствующих заболеваний.
Назначает упражнения при ревматоидном артрите только врач, а первые тренировки проходят под контролем инструктора по лечебной физкультуре. Вначале используют строго определенное количество упражнений с дозированной нагрузкой для улучшения кровообращения и предупреждения атрофии мышц.
По мере улучшения состояния нагрузки увеличиваются, постепенно вводятся кардиотренировки (тренируются не только мышцы, но и сердечно-сосудистая система) и силовые упражнения. Нагрузки строго дозируются – это очень важно. Нельзя делать упражнения самостоятельно, ориентируясь на видео в интернете: так можно нанести организму непоправимый вред.
![]()
Инструктор ЛФК часто вводит в программу тренировок также упражнения, повторяющие движения, необходимые для самообслуживания и некоторых видов трудовой деятельности – это позволяет пациенту развивать мелкую моторику и в дальнейшем без туда заниматься домашними делами или продолжать прерванную трудовую деятельность. Применяемые методики:
- при ревматоидном артрите колена, голеностопа - должны включать в себя изометрические (на растяжением мышц) и динамические упражнения; такое сочетание позволит сохранить достаточный объем суставных движений; очень полезно проводить такие упражнения в воде;
- при ревматоидном артрите рук, кистей, пальцев; это самые частые поражения, которые сопровождаются деформацией пальцев и кисти; упражнения корректируют положение кисти, подавляют ее наклон в сторону мизинца, уменьшают нагрузку на подушечки пальцев, снижают риск дальнейшего прогрессирования деформации;
- при ревматоидном артрите плечевых, тазобедренных суставов; назначаются изометрические и динамические упражнения, их можно проводить, как без снарядов, так и со снарядами; есть аппараты, позволяющие дозировать нагрузки и регулировать объем движений, увеличивая или снижая их в зависимости от состояния больного.
Курсы лечебного массажа усиливают эффект ЛФК за счет активизации кровообращения и восстановления мышечной силы. Проводится щадящий массаж, не касаясь тканей над пораженными суставами.
Лечение ревматоидного артрита народными средствами проводится только по назначению врача. Специалист так встраивает их в состав комплексной терапии, что они частично заменят некоторые лекарства и уменьшают медикаментозную нагрузку на больного. Для снятия болевого синдрома:
- лавровый лист – из него готовят отвар из расчета 20 г сырья на 500 мл воды; доводят до кипения, держат на медленном огне 5 минут и затем выпивают в течение дня; курс лечения – неделя.
- мазь из тополиных почек; сухие почки растолочь в порошок, смешать с равным количеством сливочного масла и втирать в кожу при поражении суставов; отличное обезболивающее средство;
- согревающие компрессы из коры ивы; отвар готовится из расчета 15 г коры на 500 мл воды; его нужно выдержать на водяной бане 30 минут; наибольший обезболивающий и противовоспалительный эффект при наложении компресса на ночь.
Гомеопатические средства также хороши только в руках лечащего врача. Самостоятельно для лечения ревматоидного артрита эти препараты не применяются, но вместе с другими лекарствами усиливают положительный эффект. Прием препаратов поможет уменьшить болевой синдром, подавить разрастание соединительной ткани и прогрессирование болезни:
- Бриония – гомеопатическое средство из корня брионии; выпускается в гранулах для рассасывания и виде мази; способствует устранению отека и боли в теле;
- Цель Т – многокомпонентный гомеопатический препарат, выпускается в виде таблеток для рассасывания и мази; уменьшает неприятные симптомы;
- Ледум – мазь на основе багульника болотного; снижает болевые ощущения.
![]()
В состав комплексного лечения ревматоидного артрита обязательно должны входить физиотерапевтические процедуры. На разных стадиях РА назначаются следующие курсы:
- электрофорез или фонофорез с Гидрокортизоном – для устранения боли в суставах, а также для предупреждения разрастания соединительной ткани и прогрессирования суставных деформаций;
- лазеротерапия, магнитотерапия, синусоидальные модулированные токи – для устранения длительно протекающего воспалительного процесса и утренней скованности;
- электростимуляция мышц – позволяет вылечить мышечную атрофию, приводит к увеличению диапазона движений;
- бальнео- и грязелечение – назначают в состоянии ремиссии для предупреждения рецидивов заболевания и прогрессирования суставных деформаций.
Для предупреждения и коррекции деформации конечностей больным ревматоидным артритом проводится ортопедическое лечение, С этой целью назначают прерывистое ношение ортезов – специальных приспособлений, поддерживающих правильное положение конечности. Постоянно носить ортез нельзя – это приведет к атрофии мышц, а при прерывистом ношении наблюдается восстановление правильного положения конечности.
Когда встает вопрос, как лечить ревматоидный артрит с тяжелой степенью утраты функции конечности, на помощь приходит хирургическое лечение: проводится операция эндопротезирования – замены полностью изношенного сустава на искусственный. Это позволяет вылечить пациента, вернуть ему достойное качество жизни. Иногда для предупреждения прогрессирования деформации достаточно провести операцию иссечения суставной оболочки.
Отличительные особенности лечения в нашей клинике – это:
- обязательное проведение диагностики перед назначением лечения;
- применение индивидуально подобранного для каждого пациента сочетания передовых эффективных европейских методик для лечения ревматоидного артрита с традиционными восточными методами лечения этого заболевания, столетиями с успехом применяемыми китайскими и тибетскими врачами.
Наши врачи для лечения ревматоидного артрита с успехом применяют:
- медикаментозную терапию и новейшие лекарственные препараты по разработанным учеными международным схемам; регулярно каждому больному проводится контрольное обследование и, при необходимости, – корректировка лечебных схем и назначенных препаратов в зависимости от стадии заболевания и состояния пациента;
- фитотерапию, гомеопатию, народные средства – выбирается все, что пойдет на пользу больному, поможет облегчить его состояние и снизить лекарственную нагрузку;
- физиотерапию, ЛФК, кинезитерапию, лечебный массаж – применяются самые передовые западные и восточные методики;
- PRP-терапию – самый современный метод лечения, позволяющий восстанавливать функции пораженных суставов; метод основан на введении пациенту особым способом обработанных собственных тромбоцитов;
- методы рефлексотерапии (РТ) - воздействия на особые точки (акупунктурные точки, АТ) на теле человека, рефлекторно связанные с различными органами и тканями; уникальные методики лечения позволяют полностью устранить симптомы ревматоидного артрита при минимальном использовании лекарственной терапии;
- фармакотерапия – введение в АТ растворов новейших лекарственных препаратов, что значительно увеличивает эффективность лечения.
Видео - лечение заболеваний суставов
Видеоотзыв о лечении артрита
Читайте также:





