Ревматоидный артрит интерферон гамма
У 80 больных ревматоидным артритом исследовано относительное и абсолютное содержание лимфоцитарных рецепторов CD3+, CD4+, CD8+, CD19+ крови, используя иммуноцитохимический субпопуляционный анализ лимфоцитов и уровень интерферона гамма сыворотки крови методом твердофазного иммунноферментного анализа. Проанализированы взаимосвязи между Т-,В-лимфоцитами и уровнем интерферона гамма крови. Определено состояние лимфоцитарных рецепторов и интерферона гамма крови в зависимости от степени активности ревматоидного артрита.
Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р 0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
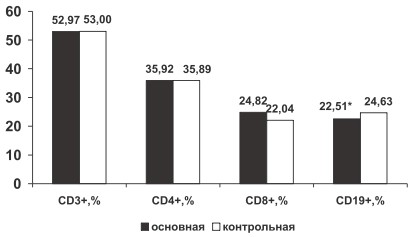
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р 0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р 0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
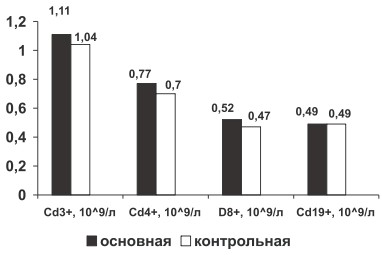
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Р.М. Балабанова, О.Н. Егорова
Благодаря достижениям молекулярной биологии уточняются наши представления о патогенетических механизмах ревматических заболеваний (РЗ). При лечении РЗ используются так называемые препараты, воздействующие на болезнь, которые в той или иной мере влияют и на иммунные процессы.
Однако развитие достаточно серьезных побочных реакций при использовании этих препаратов ограничивает возможность их применения при РЗ.
Сейчас наметилось несколько подходов к решению этой проблемы: создание моноклональных антител (МКАТ) к рецепторам Т-, В-лимфоцитов, антигенпрезентирующих клеток, МКАТ к СД18 и СД54, МКАТ к цитокинам; поиск естественных ингибиторов цитокинов; использование цитокинов, в том числе рекомбинантных интерферонов (ИФН).
К настоящему моменту получены обнадеживающие результаты клинического использования ИФН при РЗ. Наш опыт применения рекомбинантных форм a- и g -ИФН при РЗ согласуется с этими данными.
Advances in molecular biology form a true notion of the pathogenetic mechanisms of rheumatic diseases (RD). To treat the latter, the drugs which affect the disease itself, as well as immune processes in some way or another are used.
However, many serious side effects due to the use of these agents restrict their application in RD. Nowadays there are several evident approaches to solving this problem: the advent of monoclonal antibodies (MAb) to the receptors of T and B Iymphocytes, antigen-presenting cells, MAb to CD18 and CD54 and those to cytokines; search for natural cytokine inhibitors, the use of cytokines, including recombinant interferons (IFN).
The encouraging results of clinical use of IFN in RD have been obtained to date. The authors’ findings while using the recombinant forms of a - and g - interferons in RD are in agreement with these data.
В лекарственной терапии ревматических заболеваний (РЗ) за последние годы достигнуты определенные успехи за счет расширения арсенала лекарственных препаратов и рационализации схем терапии, однако данные относительно роли цитокинов в процессах иммунного и неиммунного воспаления диктуют необходимость поиска новых путей патогенетической терапии РЗ.
Система интерферона и цитокинов при РЗ
Несмотря на очевидное клиническое своеобразие РЗ, имеются общие закономерности развития патологического процесса, в котором ведущая роль отводится цитокинам иммунных и неиммунных клеток: Т- и В-лимфоцитов, нейтрофилов, мононуклеарных фагоцитов, вызывающих деструкцию ткани [1]. Повреждение ткани идет либо прямым путем посредством цитотоксических реакций, либо косвенным - через активацию аутореактивных и воспалительных клеток, индуцирующих продукцию воспалительных цитокинов, протеаз и других компонентов, участвующих в реакции воспаления [1]. Так, при ревматоидном артрите (РА) тканевая деструкция изначально появляется в участке, где Т-лимфоциты тесно контактируют с моноцитами и фибробластподобными синовиальными клетками, что предполагает прямой контакт клеток. В то же время активированные Т-лимфоциты, получившие сигнал от антигенпрезентирующих клеток, начинают секретировать цитокины, действие которых проявляется как in situ, так и через систему микроциркуляции.
Известно более 80 цитокинов, в том числе интерлейкины (ИЛ), фактор некроза опухоли (ФНО), колониестимулирующий фактор, интерфероны (ИФН) и др.
В поддержании гомеостаза макроорганизма наряду с иммунной большая роль отводится системе ИНФ, которая помимо специфического (противовирусного) оказывает и иммуномодулирующее воздействие, проявляющееся регуляцией экспрессии генов главной системы гистосовместимости, модуляцией клеточной дифференцировки и созревания, подавлением пролиферации клеток, а также влияющее на эндокринную систему [2].
Имеются данные, указывающие на взаимодействие системы иммунитета и ИФН. Так, ФНО и g -ИНФ потенцируют действие друг друга в отношении стимуляции миграции нейтрофилов и секреции кислородных радикалов [3]. b -ИЛ-1 и ФНО индуцируют синтез 26 кД белка, который является b -ИФН, он же – ИЛ-6 [4]. Предобработка макрофагов a -, b -, g -ИФН способствует гиперпродукции ИЛ-1 этими клетками, что может объяснить лихорадочную реакцию организма в ответ не введение ИФН [5].
Существует прямая и обратная связь между синтезом ИЛ-2 и g -ИФН, в то же время g -ИФН индуцирует секрецию ИЛ-2 активированными Т-клетками [6]. ИФН способен ингибировать дифференцировку В-клеток, в то же время стимулируя их пролиферативный ответ [2].
Интересны данные о том, что g -ИФН наряду с ИЛ-4 подавляет цитокинстимулированную резорбцию костной ткани, оказывая кальцитонинподобное ингибиторное действие на зрелые остеокласты [1].
Исследование особенностей системы ИФН при РЗ позволило нам выявить сходные изменения ИФН-статуса при РА, системной красной волчанке (СКВ) и болезни Бехчета (ББ): гипопродукцию лейкоцитами in vitro a -ИФН у 89% больных РА И СКВ и у 60% пациентов с ББ, выраженное угнетение выработки g -ИФН у 96% больных РА и СКВ и у 80% больных ББ, гиперпродукцию сывороточного ИФН при РА и СКВ, тестируемого как a -кислотолабильный ИФН – a -КЛИ (О.Н.Щегловитова и А.Н. Кулиева, 1989). Аналогичные результаты получены Hooks и соавт. (1979), обнаружившими в сыворотке больных СКВ, РА и пациентов синдромом Шегрена повышенный уровень сывороточного ИФН, представленного высоким содержанием a -КЛИ, на фоне гипопродукции a - и g -ИФН (J. Barnier и соавт., 1984; Y. Kim и соавт., 1987).
Исследователи расходятся в оценке способности лейкоцитов к продукции ИНФ в ответ на специфическую индукцию.
Так, Т. Stolzenburg и соавт. (1988) при исследовании сыворотки больных РА, СКВ, системной склеродермией (ССД), болезнью Рейтера (БР) и остеоартрозом (ОА) выявили дефект продукции g - ИФН у пациентов с СКВ, РА, ССД, а при БР и ОА уровень исследуемого ИФН не был изменен. Другие, напротив, отмечают снижение продукции a -ИФН у пациентов с СКВ и РА (A. Renter и соавт., 1989; M. Seitz, 1987).
Вышеизложенное свидетельствует о том, что в комплексную терапию РЗ необходимо включать препараты, способные модулировать иммунный ответ пациента и восстановить нормальное функционирование системы ИНФ.
Препараты ИНФ в лечении РЗ
Существующие и широко используемые в клинической практике медицинские препараты ИФН делятся по типу активного компонента на a, b и g, а также по технологии получения и времени создания – на природные (ИФН I поколения) и рекомбинантные (ИФН II поколения).
Человеческий лейкоцитарный ИФН (ИФН I поколения) впервые был использован при СКВ; ряд исследователей (В.А. Галенок, 1971; О.В. Синяченко, 1975; З.С. Алекберова и соавт., 1980) показали положительное влияние этого препарата на течение кожного васкулита, люпус-нефрита.
Схема острой фазы воспаления при ревматическом поражении сустава.
Ранее была предпринята попытка лечения человеческим лейкоцитарным ИФН больных РА, что способствовало уменьшению длительности утренней скованности, числа воспалительных суставов и некоторому снижению активности процесса по данным лабораторных исследований (Р.М. Балабанова и соавт., 1988; M. Peddinani и соавт., 1986).
Однако невозможность полной технической очистки и связанные с этим выраженные побочные явления, опасность ВИЧ-инфекции, а также дефицит сырья - лейкоцитов донорской крови ограничивали применение ИНФ I поколения.
Разработан способ продукции, выделения и очистки генно-инженерными методами различных препаратов ИФН:
a 2а-ИФН - реаферон, виферон, роферон-А;
a 2в-ИФН - интрон-А, инрек, реальдирон;
a 2с-ИФН - берофор;
b -ИФН – ферон;
g -ИФН - инфлаген, полиферон, имукин.
К настоящему времени проведено большое число открытых, плацебо-контролированных и пролонгированных (12 мес) испытаний, свидетельствующих об эффективности препаратов ИФН.
Исследователи использовали различные способы (подкожный, внутримышечный, ректальный) и схемы (ежедневно, прерывистыми курсами и др.) введения, а также разные дозы препаратов - от 40 000 до 9000000 МЕ.
G. Firestein и соавт. (1987) при использовании рекомбинантного g -ИФН в дозе 1 800 000 МЕ/сут у 12 больных РА наблюдали улучшение лишь у двух. У 6 пациентов имела место выраженная лихорадочная реакция. Е. Lemmel и соавт. (1988) предприняли попытку лечения больных РА рекомбинантным g -ИФН в сравнительно низких дозах (40 000 МЕ 1 раз в неделю), что позволило получить положительный эффект у половины больных и избежать побочных реакций, однако выраженного иммунологического эффекта не отмечалось. В Германии в 1996 г. было проведено многоцентровое испытание g -ИФН (полиферона) при подкожном введении 2 000 000 МЕ по 7 инъекций в течение 3 нед, в последующие 4 нед по 3 инъекции в неделю (через день) и еще 5 нед по 2 инъекции в неделю. В результате проведенной терапии отмечено снижение утренней скованности, уменьшение числа воспалительных суставов, снижение иммунологической активности.
При ювенильном РА a -ИФН (реаферон), который применяли ректально не более 2 000 000 МЕ/сут в сочетании с антиоксидантами первые 10 дней каждые 12 ч, далее 3 раза в неделю однократно в течение 6 мес, способствовал уменьшению системных проявлений, положительной динамике суставного и ИНФ-статуса, нормализации лабораторных показателей (Н.Н. Кузьмина и М.К. Щербакова, 1991).
В последнее время в литературе появились сообщения о применении рекомбинантных форм ИНФ при ББ. Так, G. Fierlback и соавт. (1989) выявили обратную корреляцию между активностью ББ и уровнем эндогенного ИФН, что дало основание применять g -ИФН для лечения этого заболевания; препарат назначали в дозе 100 мкг подкожно ежедневно в течение 2 нед 10 больным, затем в той же дозе раз в неделю. В результате терапии исчезли афты у 4 из 8 больных, папулезные высыпания или узловатая эритема у 4 из 7, полиартралгии у 3 из 4 больных. Наиболее устойчивыми к лечению оказались глазные проявления, не исчезнувшие ни у одного из 4 больных. Vedat Hamuryudan и соавт. (1994) также использовали для лечения 20 пациентов с ББ a 2в-ИФН в дозе 5 000 000 МЕ 3 раза в неделю в течение 6 нед, затем в той же дозе 1 раз в неделю в течение 10 нед. Отмечено выраженное влияние на суставной синдром и слабое - на течение язвенного васкулита.
J. Sanchez-Roman и соавт. (1995) применяли a 2в-ИФН у 2 больных с кишечной формой ББ в дозе 5 000 000 МЕ/день в течение 12 дней, затем в той же дозе еженедельно. На фоне лечения нормализовался абдоминальный симптом, что подтверждено колоноскопией, уменьшились или исчезли генитальные афты.
С середины 80-х годов мы проводим открытое неконтролированное лечение больных РА и СКВ рекомбинантными формами ИФН: g -ИФН (реафероном, реальдироном) и g -ИФН (инфлагеном) производства фирмы “Biofa”, Литва, в комбинации как с нестероидными противовoспалительными препаратами, так и со средствами, воздействующими на заболевание, преимущественно с цитостатическими иммунодепрессантами и кортикостероидами (при СКВ), используя различные схемы и дозы введения:
- внутримышечное введение 1 000 000 МЕ a - или g -ИФН через день 1 мес, в последующие 2 мес - 1 раз в неделю;
- внутримышечно по 3 000 000 МЕ a - или g -ИФН по вышеописанной схеме;
- 3 000 000 МЕ внутривенно через день 10 инъекций, а затем в качестве поддерживающей терапии 1 раз в неделю внутримышечно;
- 3 000 000 МЕ внутривенно 3 дня подряд (по типу пульс-терапии) с интервалом 1 мес.
- 3 000 000 МЕ внутривенно 3 дня подряд, затем в течение 1 мес та же доза 1 раз в неделю внутримышечно, курсы повторяются.
Включение рекомбинантных форм ИФН в комплексную терапию РА и СКВ в первую очередь способствовало нормализации ИФН-статуса и за счет этого препятствовало обострению и развитию хронических интеркуррентных инфекций. Нами отмечено уменьшение частоты побочных реакций, особенно при использовании цитостатических иммунодепрессантов.
Эффект проводимой терапии выразился в уменьшении системных проявлений и положительной динамике суставного статуса при РА и регрессии периферического васкулита, люпус-нефрита при СКВ.
Оценивая отдаленные результаты терапии ИФН у больных РА и СКВ, мы отметили недостаточность однократного курса лечения этими препаратами: у 53% больных возобновились респираторно-вирусные и другие инфекции, у 20% развились осложнения терапии иммунодепрессантами, у 55% заболевание приняло типичное течение. У 87,8% больных, получавших повторные курсы препаратов ИФН (22 с РА и 12 с СКВ), удалось стабилизировать активность процесса.
К настоящему моменту нами получены обнадеживающие результаты применения реальдирона или инфлагена при ББ, ССД и синдроме Шегрена, однако для окончательной оценки роли ИФН-терапии при этих заболеваниях необходимо дальнейшее накопление клинического материала.
При введении ИФН, как и при использовании других биологических препаратов, наблюдаются в основном гриппоподобные побочные реакции.
К настоящему времени еще не сформировалось единое мнение о целесообразности использования ИФН в комплексной терапии РА, что объясняется малой доступностью этих препаратов для широкого круга практикующих ревматологов. Однако исследования в этом направлении необходимы, так как становится возможным использование селективных иммуномодулирующих препаратов, биологических иммуномодуляторов.
1. Dayer IM, Burger D. Rheumat in Europe 1995;12:24-6.
2. Ф.Е. Ершов. Система интерферона в норме и при патологии. – М. Медицина, 1996;11-120.
3. Old LJ. Science 1985;230:630.
4 . Van Damme J., Opdenakker G., Simpson RJ. et al. Exp Med 1987;165:515-21.
5. Dinarello Ch. A. Horizon in cytokine research. The 3d Internat. Mochida memor. symp. - Tokyo, 1993;49.
6. Staeheli P, Horisberger MA, Haller O. Virology 1984;132:456-68.
Фармдействие
Интерферон гамма является рекомбинантным интерфероном гамма человека. Лекарственный препарат представляет собой гликопротеин и состоит из 144 аминокислотных остатков и лишен первых трех аминокислотных остатков Cys — Tyr — Cys (Цистеин — Тирозин — Цистеин), которые заменены на Met (Метионин). Молекулярная масса интерферона гамма составляет 16,9 — 25 кДа (килоДальтон). Лекарственный препарат получен в результате микробиологического синтеза в рекомбинантном штамме Escherichia coli, в дальнейшем интерферон гамма очищен колоночной хроматографией. Интерферон гамма также может быть получен из стимулированных T-лимфоцитов человека. Удельная противовирусная активность интерферона гамма на клетках (фибробласты человека), которые инфицированы вирусом везикулярного стоматита, составляет 2 х 10^7 ЕД на мг белка. Интерферон гамма известен как иммунный интерферон. Известно два типа интерферона гамма: интерферон гамма 1a и интерферон гамма 2a, которые различаются последовательностью аминокислот в своей цепочке в 1 и 139 положении. Интерферон гамма обладает ярко выраженной иммуномодулирующей активностью. Интерферон гамма является важнейшим провоспалительным цитокином, который в организме человека вырабатывается естественными киллерными клетками, CD8 цитотоксическими супрессорными клетками и CD4 Th1 клетками. Нейтрофилы, макрофаги, цитотоксические T-лимфоциты, естественные киллерные клетки имеют рецепторы к интерферону гамма. Интерферон гамма активирует эффекторные функции нейтрофилов, макрофагов, цитотоксических T-лимфоцитов, естественных киллерных клеток, в частности их цитотоксичность, способность уничтожать микроорганизмы (микробоцидностъ), продукцию цитокинов, нитрооксидных радикалов, супероксидных радикалов, что приводит к гибели внутриклеточных паразитов. Интерферон гамма угнетает интерлейкин-4, B-клеточный ответ, подавляет экспрессию CD23-антигена и продукцию иммуноглобулина E. Интерферон гамма является индуктором апоптоза дифференцированных B-клеток, которые дают начало аутореактивным клонам. Интерферон гамма стимулирует рост и дифференцировку B-клеток. Интерферон гамма отменяет генерацию активированных лимфокином киллеров и супрессивное действие интерлейкина-4 на интерлейкин-2-зависимую пролиферацию. Интерферон гамма потенцирует экспрессию генов C2 и C4 компонентов системы комплемента. Интерферон гамма активирует синтез белков острой фазы воспаления. Интерферон гамма, в отличие от других интерферонов, увеличивает экспрессию антигенов главного комплекса гистосовместимости как первого, так и второго классов на разных клетках, причем интерферон гамма индуцирует экспрессию данных молекул даже на тех клетках, которые конститутивно их не экспрессируют. Что приводит к возрастанию эффективности презентации антигенов и способности распознавания антигенов T-лимфоцитами. Интерферон гамма блокирует репликацию рибонуклеиновой кислоты и дезоксирибонуклеиновой кислоты вируса, продукцию белков вируса, образование зрелых вирусных частиц. Интерферон гамма блокирует продукцию белка бета-TGF (трансформирующий ростовой фактор бета), который контролирует пролиферацию, клеточную дифференцировку и другие функции во многих клетках, принимает участие в иммунном ответе, сердечно-сосудистых заболеваниях, раке, сахарном диабете, синдроме Лойеса-Дитса, болезни Паркинсона, синдроме Марфана, синдроме приобретенного иммунодефицита, отвечает за развитие фиброза печени и легких. Интерферон гамма оказывает цитотоксическое действие на инфицированные вирусом клетки.
Показания
Для внутримышечного и подкожного введения: в составе комплексного лечения хронического вирусного гепатита B; в составе комплексного лечения хронического вирусного гепатита C; в составе комплексного лечения вируса иммунодефицита человека; в составе комплексного лечения синдрома приобретенного иммунодефицита; в составе комплексного лечения туберкулеза легких; в качестве иммуномодулятора в составе комплексного лечения онкологических заболеваний, в том числе совместно с химиотерапией; в составе комплексного лечения хронического простатита; в составе комплексного лечения урогенитального хламидиоза; профилактика инфекционных осложнений у пациентов с хронической гранулематозной болезнью; монотерапия генитальной герпесвирусной инфекции; монотерапия опоясывающего лишая (herpes zoster); лечение аногенитальных бородавок (вирус папилломы человека) и профилактика рецидива заболевания; поддерживающее лечения кожного и висцерального лейшманиоза; псориаз; лепра; альтернативное лечение ревматоидного артрита; микобактериальная инфекция у пациентов без вируса иммунодефицита человека при неэффективности консервативного лечения; экзема и атопический дерматит, в особенности при высоком уровне иммуноглобулина E.
Для интраназального введения: профилактика и терапия (в составе комплексного лечения) гриппа; профилактика и терапия (в составе комплексного лечения) гриппа H1N1 и H5N1.
Противопоказания
Гиперчувствительность (в том числе к вспомогательным компонентам лекарственного препарата), аутоиммунные заболевания, сахарный диабет, период грудного вскармливания, беременность, детский возраст (в зависимости от используемой лекарственной формы).
Дозирование
Интерферон гамма вводится внутримышечно, подкожно, применяется интраназально. После интраназального введения интерферона гамма рекомендуется в течение нескольких минут помассировать пальцами крылья носа для того, чтобы лекарственный препарат равномерного распределился в полости носа. Дозу препарата устанавливают индивидуально в зависимости от показаний и переносимости лечения.
Хронический вирусный гепатит B, хронический вирусный гепатит C, вирус иммунодефицита человека, синдром приобретенного иммунодефицита, туберкулез легких: для взрослых средняя суточная доза составляет 500000 МЕ; препарат вводится внутримышечно или подкожно один раз в сутки, каждый день или через день; курс терапии составляет 1 — 3 месяца, при необходимости через 1 — 2 месяца курс терапии можно повторить.
Профилактика инфекционных осложнений у пациентов с хронической гранулематозной болезнью: для взрослых средняя суточная доза составляет 500000 МЕ; препарат вводится внутримышечно или подкожно один раз в сутки, каждый день или через день; курс лечения составляет 5 — 15 инъекций, при необходимости курс повторяют через 10 — 14 дней или продлевают.
Онкологические заболевания: для взрослых средняя суточная доза составляет 500000 МЕ; препарат вводится внутримышечно или подкожно один раз в сутки через день.
Генитальная герпесвирусная инфекция, опоясывающий лишай (herpes zoster), урогенитальный хламидиоз: для взрослых средняя суточная доза составляет 500000 МЕ; препарат вводится подкожно один раз в сутки через день; курс лечения составляет 5 инъекций.
Хронический простатит: для взрослых суточная доза составляет 100000 МЕ; препарат вводится подкожно один раз в сутки через день; курс лечения составляет 10 инъекций.
Аногенитальные бородавки: для взрослых суточная доза составляет 100000 МЕ; препарат вводится подкожно один раз в сутки, после проведенной криодеструкции, через день; курс лечения составляет 5 инъекций.
Грипп, острые респираторные вирусные инфекции: при первых признаках заболевания препарат вводят интраназально после туалета носовых ходов по 2 капли в каждый носовой ход 5 раз в день в течение 5 — 7 дней.
Профилактика острых респираторных вирусных инфекций и гриппа при контакте с больным или/и переохлаждении: 2 — 3 капли препарата вводят в каждый носовой ход через день за полчаса до завтрака в течение 10 дней; при необходимости профилактические курсы повторяют; в случае однократного контакта достаточно одного закапывания препарата.
При применении интерферона гамма в виде лиофилизата для приготовления раствора содержимое флакона растворяют в 2 мл (для внутримышечного и подкожного введения) или 5 мл (для интраназального введения) воды для инъекций.
При применении интерферона гамма в дозах более 1000000 МЕ возможно развитие гриппоподобного синдрома, который проявляется слабостью, головной болью, болями в суставах, увеличением температуры тела. При слабо выраженных симптомах нет необходимости в фармакологической коррекции. При выраженных явлениях необходимо купирование симптом с помощью парацетамола, глюкокортикостероидов. При резко выраженных местных и общих реакциях применение интерферона гамма необходимо прекратить.
Нет данных, о влиянии интерферона гамма на способность выполнять потенциально опасные виды деятельности, которые требуют повышенной концентрации внимания и быстроты психомоторных реакций (включая управление транспортными средствами, механизмами).
Побочные эффекты
Реакции в месте введения: гиперемия в месте введения, локальная болезненность в месте введения (в виде слабой боли ломящего характера (подобно перетренированной мышце)).
Прочие: в особенности при применении доз свыше 1000000 МЕ возможно развитие гриппоподобного синдрома (слабость, головная боль, боли в суставах, повышение температуры тела); выраженная лихорадка, миалгии, озноб, утомляемость, слабость, тошнота, сонливость, похудание, повышение активности трансаминаз, нейтропения, тромбоцитопения, алопеция, полиморфная сыпь, кожный зуд.
Особые указания
Применение при беременности и кормлении грудью
Нет данных о применении интерферона гамма во время беременности. Использование интерферона гамма противопоказано у женщин во время беременности. Нет данных о применении интерферона гамма во время грудного вскармливания. На время применения интерферона гамма необходимо прекратить грудное вскармливание.
Читайте также:


