Вазопрессоры при спинальной анестезии
Со времени первоначального описания в 1899 году Августом Биром спинномозговая анестезия (СА) испытала и периоды популярности, и забвения. Популярность связана с несомненными достоинствами метода: простотой и доступностью, способностью надежно блокировать болевую импульсацию, обеспечением релаксации, предотвращением развития многих нейровегетативных реакций, сохраненным сознанием больного.
Учитывая вышеперечисленное, широкое применение находит СА как местноанестезирующими препаратами (МА), так и в сочетании с наркотическими анальгетиками (НА). Однако оба варианта не лишены недостатков: в первом случае - это короткий период анестезии, во втором - возможные осложнения и побочные реакции (Ф.Ф. Белоусов, 1977; А.В. Максимов, В.Х. Хейфед, Schuring, 1993). Осложнения и побочные эффекты при СА лидокаином, тримекаином, либо лидокаином в сочетании с НА морфинового ряда имеют место у 36,7% больных, причем у пятой части пациентов отмечается 2-3 осложнения одновременно на различных этапах лечения (А.А. Семенихин, В.Б. Шуматов, 1991). Поэтому повышение эффективности и безопасности СА является одной из основных проблем регионарного обезболивания.
Цель и задачи исследования
1. Изучить характер и течение СА, осложнения и побочные эффекты при использовании спинальных форм бупивакаина (Маркаин спинал и Маркаин спинал хэви).
2. Провести сравнительный анализ течения СА при использовании Маркаина с другими препаратами и их комбинациями при сходных методах проведения обезболивания.
Материалы и методы
Контрольную группу составили 68 больных урологического профиля, которым проводили СА:
- 1 подгруппа - 5% р-р тримекаина (100-120 мг);
- 2 подгруппа - 5% р-р тримекаина (100 мг) + Морадол 0,005 мкг/кг;
- 3 подгруппа - 5% р-р тримекаина (100 мг) + промедол 0,15 мг/кг;
- 4 подгруппа - 5% р-р тримекаина (100 мг) + фентанил 0,7 мкг/кг;
- 5 подгруппа - 5% тримекаин (100 мг) + морфин 10-14 мкг/кг;
- 6 подгруппа - 2% р-р лидокаина (100 мг).
Исследуемую группу составили 42 больных в возрасте от 18 до 77 лет (средний возраст в группе урологических больных составил 69,2+/-4,1 лет, в группах гинекологических и хирургических больных - 49,6+/-4,2 лет). Урологические и проктологические операции произведены у 26,4%; гинекологические (ампутация и экстирпация матки, пластические операции) - у 23,8% больных; хирургические операции (венэктомии, ампутации, операции на костях и суставах) составили 49,8%. В этой группе СА проводилась спинальными формами бупивакаина - Маркаином спинал и Маркаином спинал хэви, производимыми фирмой "Astra-Zeneca" (0,5% изобарическим раствором у 10 больных, 0,5% гипербарическим раствором - у 32 больных).
Условия подготовки больных, техника и обеспечение СА были идентичными во всех группах. Накануне производилась стандартная премедикация с использованием атарактиков и антигистаминпых препаратов. За 30 мин до операции осуществлялось введение седуксена (0,07-0,15 мг/кг). В операционной начиналась инфузия кристаллоидных препаратов 10-15 мл/кг (до начала введения анестетика инфузия составляла 700-1000 мл). За 15-20 мин до пункции в/м вводилось 0,5 мг атропина. В положении на правом боку пунктировалось субарахноидальное пространство на уровне L2-3-4-5 при помощи "стандартной" иглы типа Квинке-Бебкока G 20-22 длиной 80 мм срединным доступом по общим правилам. При поступлении ликвора в павильон иглы производилось ее вращение на 360° для подтверждения правильного местонахождения. Если ликвор не поступал из всех квадрантов, то это расценивалось как нахождение иглы рядом с дуральной муфтой и от введения анестетика отказывались, во избежание травмы и неадекватной блокады. Маркаин вводили в течение 1-2 мин, не смешивая с ликвором, в дозе 10-15 мг при операциях на нижних конечностях и 15-20 мг при полостных операциях. При использовании гипербарических растворов больному придавалось положение Фовлера под контролем уровня блока. После введения изобарического раствора больной находился в горизонтальном положении. Блок оценивали, исходя из правила дифференциальной блокады: уровень симпатической блокады находится выше уровня сенсорной, которая в свою очередь выше уровня моторной (разница приблизительно 2 сегмента). Сенсорный блок оценивали тестом с помощью иглы, моторный - по шкале Бромэджа. Мониторинг особенно тщательно осуществляли каждые 3 мин в течении первых 20 мин, учитывая факт постепенной фиксации МА структурами спинного мозга (Duthie, 1987; B.G. Covino, 1989). Производилось измерение АД, пульса и SpO2 (пульсоксиметр "ЭЛОКС 01С") выборочно-математический анализ ритма сердца с оценкой активности элементов вегетативной нервной системы на ритмкардиомониторе "ЭЛОН-001" (P.M. Баевский, Л.И. Калакутский, Э.С. Манелис; 1998).
Рис. 1. Число случаев (в %) недостаточной силы блока
Рис. 2. Длительность блока
Pис. 3. Подключение вазопрессоров (% случаев)
Результаты и их обсуждение
В исследуемой группе в большинстве случаев блок развивался за 3-5 мин (в единичных наблюдениях 10-15 мин). В контрольной группе блок наступал за 5-7 мин.
Уровень блока при использовании Маркаина в дозе до 15 мг чаще находился на уровне пупка, либо на середине расстояния между пупком и лонным сочленением. При дозе выше 15 мг сенсорный блок развивался до уровня линии, соединяющей соски и выше на 1-3 см. В контрольной же группе при использовании тримекаина блок развивался до уровня реберной дуги, при СА другими комбинациями препаратов - до V ребра, при комбинации с морфином - до III ребра. Уровень сенсорного блока не имел четкой зависимости от уровня пункции. При СА Маркаином отмечался центральный седативный эффект примерно в 50% наблюдений.
Моторный блок в исследуемой группе оценивался как адекватный в 97,6% (++++), за исключением одного больного (2,4%). Сенсорный блок считался недостаточным когда по уровню не соответствовал ожидаемому, либо когда возникала необходимость в/в введения НА, кетамина и др. Сравнительные данные по группам приведены на рис. 1.
Эффективность блока в исследуемой группе подтвердили результаты математического анализа ритма сердца: ИНБ = 11+/-2,3; СИМ = 2+/-0,9; ПАР = 2,4+/-2,3; МО = 780+/-8,6; АМО = 11+/-1,1; АХ = 352+/-4,3 (все показатели достоверно не отличались от контрольных величин).
Длительность блока (рис. 2.) при СА Маркаином составила 3,5-4 ч, тримекаином - 50-55 мин, лидокаином -1,5 ч, в комбинациях тримекаин + промедол или Морадол - 85 мин, тримекаин + фентанил - 80 мин, тримекаин + морфин - 2,5-3 ч соответственно.
В контрольной группе чаще имели место эпизоды нестабильной гемодинамики: снижение АД на 50-60 мм рт.ст. и урежение ЧСС могло произойти на любом этапе операции и ближайшего послеоперационного периода. Особенно это отмечено в группах с применением опиоидов (АД снижалось на 60-70 мм рт.ст).
В связи с этим больным контрольной группы проводилась инфузия коллоидов, а приблизительно половине - коррекция выраженной брадикардии атропином.
В исследуемой группе изменения гемодинамики носили более мягкий и управляемый характер: АД снижалось в первые 20 мин, после чего относительно стабилизировалось, а введение атропина потребовалось не более чем в 20% случаев. Анестезия Маркаином характеризовалась мягкостью и предсказуемостью: коллоиды применялись в 2 случаях по поводу кровотечения, вазопрессоры - всего в 1 случае (рис. 3.).
В контрольной группе отмечено 3 случая депрессии дыхания (при введении морфина), в то время как в исследуемой группе нарушения дыхания не отмечено.
К осложнениям мы отнесли выраженную гипотонию до 60 мм рт.ст и ниже (в контрольной группе 20,6%, в исследуемой - 2,4%). Некоторые осложнения наблюдали только у больных контрольной группы: раннюю и позднюю респираторную депрессию (2,9% больных), позднюю гипотонию (2,9%), дезориентацию и нарушение сознания (5,9%). К побочным эффектам были отнесены постпункционные головные боли (ПГБ), тошнота, рвота, транзиторные расстройства мочеиспускания, кожный зуд. Побочные эффекты тоже были более выражены в контрольной группе. В исследуемой группе (Маркаин) не отмечались ПГБ, наблюдался один случай мышечной дрожи (купировался введением сульфата магния), один случай непроизвольного мочеиспускания у женщины через 12 ч после ампутации матки, не потребовавший терапии.
Выводы
1. Маркаин (спинальные формы - Маркаин спинал и Маркаин спинал хэви) показал себя как адекватный и безопасный анестетик для эффективной длительной моноанестезии.
2. При использрвании у перечисленных нозологических единиц он не требует дополнительной пролонгации, комбинации с анальгетиками и уменьшения дозы в связи с токсичностью.
3. Данные приведенного клинического исследования обосновывают необходимость более широкого применения спинальных форм Маркаина и замены ими ранее применявшихся препаратов для спинальной анестезии.
В Великобритании число пациентов с поражениями спинного мозга составляет приблизительно 40 000. Большинство из них — молодые люди, которым могут потребоваться самые разные оперативные вмешательствам. Детородность у женщин с такими проблемами почти не отличается от таковой у здоровых, и им часто требуется акушерская помощь.
Спинальный шок может быть четко разделен на три фазы
- Первичная фаза: очень короткий (минуты) период интенсивного нейронального выброса, обусловленного прямой стимуляцией спинного мозга. Это приводит к критической гипертензии и аритмиям, с риском левожелудочковой СН, ИМ и отека легких. Раннее применение стероидов в этой фазе может улучшить неврологический исход.
- Спинальный шок: наступает сразу после первичной фазы, характеризуется гипотензией и брадикардией вследствие утраты симпатического тонуса, равно как и вероятной дисфункцией миокарда. Это наиболее типично при высоких повреждениях (выше Тh7). Сопровождается потерей мышечного тонуса и рефлексов ниже уровня поражения. Парасимпатический тонус вагуса теряет конкурента, что проявляется тенденцией к глубокой брадикардии и даже асистолии при отсасывании из трахеи или интубации. Эта фаза может длиться от 3 дней до 8 недель. Для этой фазы типичен паралитический илеус.
- Рефлекторная фаза: по мере того как восстанавливается нейрональное проведение дистальнее места поражения спинного мозга, возвращается эфферентный симпатический разряд, одновременно с мышечным тонусом и рефлексами.
Характеризуется массивным беспорядочным ответом на стимуляцию ниже уровня повреждения спинного мозга. При поражении ниже уровня Th7 проявляется редко. Частота случаев нарастает с уровнем поражения и наиболее характерна при поражении на шейном уровне. Может развиться в течение 3 недель после травмы, но не позднее 9 месяцев.
Полагают, что дисрефлексия и ее эффекты возникают вследствие потери нисходящего ингибирующего контроля за регенирирующими пресинаптическими волокнами и интернейронами, что ведет к хаотичному рефлекторному действию и массивному выбросу катехоламинов, особенно норадреналина.
Гипертензия — наиболее типичная черта этого рефлекторного расстройства, впрочем, не универсальная. К типичным чертам относятся также головная боль, приливы, бледность (может появляться выше уровня поражения), тошнота, тревожность, потливость, брадикардия и эрекция. Менее типичны изменения зрачков или симптом Горнера. Вегетативная дисрефлексия может осложниться судорогами, отеком легких, комой или привести к смерти, поэтому ее необходимо лечить как неотложное состояние.
Стимулы, способные инициировать состояние, могут быть различны, но наиболее типичные:
- урология — растяжение мочевого пузыря, инфекции мочевого тракта, введение катетера и т.д.;
- акушерство — роды, расширение шейки матки, и т. д.;
- кишечная непроходимость/каловый завал,
- острый живот;
- переломы;
- редко — незначительная травма кожи, кожные инфекции (пролежни).
Ведение пациента
- По возможности уточняют и лечат первопричину.
- Если очевидной причины нет, то необходим тщательный поиск скрытой травмы, инфекции или калового завала.
Если для контроля над АГ простые методы оказываются недостаточными, применяют следующие средства:
- Нифедипин 10-20 мг под язык.
- Фентоламин 2-10 мг в/в, при необходимости — повторно.
- Нитроглицерин трансдермально.
- Клонидин (150-200 мкг в/в медленно) полезен при ассоциированных АГ и спастичности.
- Бета-блокаторы показаны только при сопутствующей тахикардии (брадикардия менее типична — см. выше), но необходимо помнить о возможной рефлекторной брадикардии.
- Снижение ОЦК (до 60 мл/кг, приблизительно на 20%).
- Патологическая реакция на пробу Вальсальвы с продолжительным падением АД (без плато) и без его подъема после снятия надавливания.
- Глубокая постуральная гипотензия с постепенным улучшением после первичного повреждения (никогда до нормы).
- Изменения церебральной ауторегуляции снижают ее влияние на церебральный кровоток и уровень сознания у неанестезированных пациентов.
- Поражение выше С3 — апноэ.
- Поражение на уровне C3-5 — возможно сохранение диафрагмального компонента и некоторого объема дыхания. Первичное повреждение может усиливаться шоком и отеком, с восстановлением по мере регресса отека, что может привести к заметному улучшению объема дыхания.
- Ниже C5 — функция диафрагмы сохраняется, межреберный паралич. Для улучшения объема дыхания необходима мобилизация вспомогательных мышц (на это может потребоваться до 6 месяцев).
- Паралич мышц передней брюшной стенки резко снижает способность к форсированному выдоху и, соответственно, способность кашлять.
- Вследствие повышенной экскурсии диафрагмы ФОЕЛ лучше в горизонтальном положении или с опущенным головным концом кровати. Содержимое брюшной полости в этом положении в большей степени давит на диафрагму, что улучшает сократимость мышц (закон Старлинга).
- Немедленно после высокого поражения возможна бронхиальная гиперсекреция, которая проходит через несколько недель.
- Недостаточная терморегуляция развивается вследствие разобщения регуляторных центров и информационных путей, невозможности использовать мышцы для генерации тепла и измененный периферический кровоток. Чаще всего это ведет к гипотермии, но иногда, в условиях жаркого климата, к гипертермии.
- Мышечные спазмы и спастичность происходят из-за интактности рефлексов ниже уровня поражения. Они провоцируются даже минимальными стимулами, такими как легкое прикосновение. Они могут быть достаточно насильственными для того, чтобы навредить пациенту, и достаточно тяжелыми для того, чтобы мешать операции или физиотерапии. Могут быть необходимы баклофен и диазепам, последний все чаще применяют в виде эпидуральной инфузии.
- Снижение плотности костей повышает риск переломов. До 20% пациентов страдает от гетеротопической кальцификации вокруг суставов.
- Снижение периферической перфузии ведет к развитию пролежней и затруднению установки венозного доступа.
- Анемия, обычно умеренно выраженная, если нет хронических проблем, таких как трофические язвы или пролежни.
- Есть наклонность к тромбозам и, таким образом, к тромбоэмболии легочной артерии (ТЭЛА). В некоторых центрах варфарин в течение 5 дней после первичного поражения назначают больным с двусторонним параличом.
- У этой группы пациентов эвакуация содержимое желудкам замедлена почти в пять раз.
- После денервации верхнего моторного нейрона моторная концевая пластинка эффективно распространяется, покрывая мембрану мышечных клеток полностью. При введении суксаметония деполяризация происходит по всей зоне распространения этой концевой пластинки, что ведет к массивному вбросу калия и, потенциально, к остановке сердца.
- Рекомендации меняются в зависимости от периода потенциального риска этого феномена. Было бы разумно избегать суксаметония начиная с 72 ч после первичной травмы. Нет сообщений о клинически значимой гиперкалиемии на введение суксаметония спустя 9 месяцев после травмы.
- Если быстрая последовательная индукция жизненно необходима в период фазы высокого риска, вброс калия может быть уменьшен прекураризацией (например, 5-10 мг атракуриума) и все, необходимое для лечения гиперкалиемии, должно быть наготове (кальций, бикарбонат, инсулин/глюкоза).
Проведение анестезии
Операции во время этой фазы обычно выполняются в комплексе ведения жизнеугрожающих состояний или сопутствующей травмы. Это следует учитывать при выполнении анестезии.
- Интубация может осложниться тяжелой брадикардией или даже асистолией. Для профилактики перед интубацией назначают атропин (300 мкг в/в) или гликопирролат (200 мкг в/в).
- Меры чрезвычайной осторожности должны быть предприняты, если есть подозрение на повреждение шейного отдела спинного мозга.
- Жидкостная преднагрузка (500-1000 мл кристаллоидов) смягчит гипотензию во время индукции.
- Катетеризация центральной вены может быть необходимой для управления жидкостным балансом и подбора необходимой инотропной терапии.
Очень важна информация о предшествовавших анестезиях — многие операции у этих пациентов многоэтапны или повторны. Пристальное внимание следует уделить следующим вопросам:
- Есть ли уровень чувствительности и насколько она сохранена? (Риск вегетативной дисрефлексии)
- Была ли инструментальная фиксация позвоночника? (Потенциальные проблемы с эпидуральной/спинальной анестезией)
- Шейный отдел позвоночника стабилен/фиксирован? (Потенциально трудная интубация)
- Есть постуральная гипотензия? (Вероятность ухудшения в связи с анестезией)
- Нет ли в анамнезе автономной дисрефлексии (пароксизмальная потливость и/или головная боль), и если да, то что ее провоцирует?
- При шейном поражении какова степень необходимой респираторной поддержки?
- Есть ли контрактуры и пролежни? (Осторожность при укладке в отношении зон сдавления)
Исследования
- Общий анализ крови — потенциальная анемия.
- Мочевина и электролиты — потенциальное поражение почек.
- Функция печени — возможно повреждение при хроническом сепсисе.
- Легочные функциональные тесты (ФВД) — обязательны при шейных поражениях в связи с потенциальной ДН.
В принципе, если при планировании операции требовалась бы анестезия у нормального пациента, она требовалась бы и пациенту с поражением спинного мозга.
- Небольшие периферические вмешательства ниже уровня полностью сохранной чувствительности, скорее всего, безопасны без анестезии.
- Даже при небольших периферических вмешательствах минимальная стимуляция может провоцировать мышечный спазм, который может потребовать подключения анестезии Инфильтрация местного анестетика может предотвратить ее возникновение.
- Особая осторожность необходима у пациентов с высоким (Тh5 и выше) поражением, при урологических операциях или с автономной дисрефлексией в анамнезе.
- Если принято решение оперировать без анестезии, обязательно устанавливают венозный доступ, мониторируют ЭКГ, АД неинвазивно, насыщение крови кислородом.
- При таких операциях должен присутствовать анестезиолог, готовый включиться в процедуру
Общая анестезия
- Мониторирование должно быть начато до индукции, а АД необходимо измерять перед и после каждого изменения положения пациента. Показания к инвазивному мониторингу те же, что и у пациентов без поражения спинного мозга.
- Несмотря на теоретический риск гастроэзофагеального рефлюкса, риск аспирации повышенным не выглядит. Если для планируемой операции необходима интубация, то рекомендуется антихолинэргическая премедикация.
- Пациентам с поражением шейного отдела позвоночника при общей анестезии, вероятно, потребуется респираторная поддержка. При проведении ИВЛ пациентам с тетраплегией, возможно нарастающее падение АД. В этом случае могут потребоваться жидкостная преднагрузка и вазопрессоры (эфедрин).
- За исключением миоплегии для улучшения интубации, нейромышечный блок вряд ли будет необходим при выполнении операции ниже уровня сохранения чувствительности, если нет мешающей мышечной спастичности.
- Должны быть предприняты меры по сохранению температуры тела (одеяла обычные или с поддувом теплого воздуха). Укладка с учетом зон сдавления.
- Инфузионная терапия может быть затруднена, так как объем крови снижен, и, при высоком поражении спинного мозга, рефлекторный механизм компенсации кровопотери отсутствует. Рекомендуется инфузионная преднагрузка в сочетании с агрессивным замещением кровопотери согретыми жидкостями.
Региональная анестезия
Преимущества
Недостатки
- Может быть трудновыполнима. Спинальная анестезия обычно возможна, но эпидуральная методика с высокой вероятностью не выполнима после спинальных операций и при наличии фиксирующих конструкций вследствие облитерации эпидурального пространства.
- При полном поражении нелегко определить успешность или уровень блокады. При неполном поражении тестирование не отличается от такового у нормального пациента и теоретически возможно тестировать уровень по исчезновению спазмов, провоцируемых нанесением этилхлорида, или наблюдая за расслаблением спастичности.
Послеоперационное ведение
- Тетраплегированных лучше всего вести в положении на спине или со слегка приподнятым головным концом кровати, так как в этом положении вентиляционная функция облегчается.
- Следует внимательно мониторировать температуру и активно корригировать гипотермию.
- Анальгезию обеспечивают традиционными средствами в соответствии с типом и уровнем операции.
- Возможно возникновение дисрефлексии, которое потребует медикаментозного лечения после устранения причинных факторов (таких как боль или задержка мочи).
Акушерская анестезия
Влияние беременности на повреждения спинного мозга
- Усиливается постуральная гипотензия и ухудшается реакция на аортокавальную компрессию.
- Снижается респираторный резерв с повышением риска дыхательной недостаточности и пневмонии. Повышается потребность в кислороде.
- Вследствие гемодилюции ухудшается уже существующая анемия.
- Роды являются потенциальной причиной дисрефлексии у пациенток с поражением выше Th5 (у таких пациенток, дисрефлексии может быть первым признаком родов).
Влияние повреждения спинного мозга на беременность
- Повышается риск инфекции (мочевой и пролежневой).
- Повышается риск преждевременных родов (повышающийся с повышением уровня поражении).
- Повышается риск тромбоэмболических осложнений.
- Боли в родах не будут ощущаться при полном поражении выше Th
- При поражении между Th5 и Тh10 некоторые потуги будут беспокоить пациентку.
- Всех пациенток с поражением спинного мозга необходимо при беременности брать под наблюдение как можно раньше и заранее выработать конкретный план анальгезии, которая, возможно, потребуется. Относительные опасности и трудности с установкой эпидурального катетера следует предусмотреть и обсудить с пациенткой. Подробный план анестезии на случай необходимости в кесаревом сечении должен быть выработан и зафиксирован в истории болезни.
- Эпидуральная анальгезия обычно возможна у пациенток с высоким уровнем поражения, не имеющих фиксирующих конструкций на уровне введения катетера.
- Спинальная анестезия обычно возможна при плановом кесаревом сечении и может быть достижима как одноинъекционной методикой, так и введением микрокатетера независимо от наличия фиксирующих конструкций.
- Общая анестезия может быть выполнена с предосторожностями, изложенными выше.
- Наиболее эффективная профилактическая мера против автономной дисрефлексии — это адекватная эпидуральная анальгезия. Пациенткам с высоким поражением эпидуральный катетер может быть установлен еще до индукции родов.
- После адекватной жидкостной преднагрузки (по крайней мере, литр кристаллоидов или коллоидов) гипотензия обычно проблемой не является. Тем не менее у пациенток с высоким поражением гипотензия любой этиологии должна быть агрессивно корригирована, так как компенсаторные механизмы у них отсутствуют и есть наклонность к прогрессирующей гипотензии.
- По тем же причинам следует тщательно избегать аортокавальной компрессии.
- Есть сообщения о развитии вегетативной дисрефлексии в срок до 48 ч после родов. Если достигнут эффективный блок, то целесообразно оставить катетер на этот период, для возобновления анальгезии при необходимости.
- Неудача с установкой адекватного эпидурального блока может потребовать медикаментозного лечения автономной дисрефлексии.

Кафедра анестезиологии и реаниматологии Владивостокского медицинского института
COMPLICATIONS AND SIDE EFFECTS OF SPINAL ANESTHESIA
A. A. Semenikhin, V. B. Shumatov, V. P. Mazaev, L. A. Rybakova
Complication and side, effects of spinal anesthesia have been studied in 2603 patients. The following complications of spinal anesthesia have been observed: transient and prolonged arterial hypotension; marked respiratory and circulatory depression; neurological consequenses and early and late respiratory depression associated with intrathecal administration of narcotic analgesics. Side effects comprised vomiting, nausea, transitory urination disturbances, and itching. The dependence of the number of complications and side effects on the level of puncture, the patient`s age and concentration of "the anesthetic introduced into subarachnoidal space has been established.
библиографическое описание:
Осложнения и побочные эффекты спинальной анестезии / Семенихин А.А., Шуматов В.Б., Мазаев В.П., Рыбакова Л.А. — 1991.
код для вставки на форум:
В настоящее время спинальная анестезия (СА) вновь получила широкое распространение, что обусловлена ее простотой и доступностью, способностью надежно блокировать болевую импульсацию, вызывать релаксацию, предотвращать развитие многих нейровегетативных реакций во время операций. Вместе с тем, как и любому другому способу анестезии, СА присущи определенные недостатки. Основной целью настоящей работы являются изучение характера, частоты и причин осложнений и побочных эффектов метода, разработка мер их профилактики.
Материал и методы. Всего СА в качестве анестезиологического пособия во время хирургических вмешательств на органах брюшной полости, малого таза и нижних конечностях использована нами у 2603 больных в возрасте от 10 до 83 лет (1390 мужчин и 1213 женщин). Из них 2265 оперировано в плановом порядке, 338 — по экстренным показаниям. Обезболивание проводили при сохраненном самостоятельном дыхании. Для достижения хирургической стадии СА в 2095 случаях интратекально вводили местные анестетики в чистом виде (2—5 % раствор лидокаина или тримекаина в дозе 1 мг/кг), в 580—наркотические аналгетики (морфин 10—14 мкг/кг или фентанил 0,35—0,7 мкг/кг) в сочетании с 2% раствором лидокаина или тримекаина (1 мг/кг). У 2063 больных использовали изобарические, у 540 — гипербарические растворы местных анестетиков. В случаях интратекального введения наркотических аналгетиков последние из предоперационной подготовки исключали. С целью профилактики артериальной гипотонии 106 пациентам в премедикацию включали 0,5—1 мл 5 % раствора эфедрина; остальным больным непосредственно после интратекального введения обезболивающих препаратов осуществляли умеренную гиперволемическую гемодилюцию. Седативный эффект получали внутривенным введением седуксена (0,07—0,15 мг/кг) или оксибутирата натрия (30—40 мг/кг).
Осложнения и побочные эффекты СА фиксировали на всех этапах лечения больных в стационаре. У 54 больных в возрасте от 52 до 78 лет с патологией органов малого таза и нижних конечностей в предоперационном периоде изучали реакцию сердечно-сосудистой системы на проведение ортоклиностатических проб, используя при этом метод математического анализа ритма сердца [1]. Ретроспективно полученные результаты сопоставляли с гемодинамическими эффектами в ответ на интратекальное введение местно-анестезирующих препаратов.
Результаты исследования и их обсуждение. Из 2603 больных, оперированных под СА различных вариантов, у 2425 (93,2 %) обезболивание было вполне адекватным, у 123 (4,7 %) течение анестезии потребовало дополнительного использования наркотических препаратов и нейровегетативной защиты, у 55 (2,1 %) метод оказался несостоятельным. Недостаточная эффективность или несостоятельность СА были обусловлены тактическими просчетами и техническими погрешностями при выполнении метода.
Осложнения и побочные эффекты СА зарегистрированы нами у 955 (36,7 %) больных, из них у 161 отмечены 2—3 осложнения одновременно, иногда на разных этапах лечения. Сведения об осложнениях и побочных эффектах при использовании различных вариантов СА представлены в таблице.
К осложнениям СА мы относим кратковременную или длительную артериальную гипотонию (снижение АД более чем на 40 мм рт. ст.), выраженную депрессию дыхания и кровообращения (высокий спинальный блок), неврологические последствия СА (головная боль, очаговые неврологические нарушения), а также раннюю и позднюю респираторную депрессию, связанную с интратекальным введением наркотических аналгетиков; побочными эффектами считаем тошноту и рвоту, транзиторные расстройства мочеиспускания, кожный зуд. Снижение АД в пределах 20—40 мм рт. ст. Общая характеристика осложнений и побочных эффектов СА мы рассматриваем как естественное проявление физиологического действия СА.
Общая характеристика осложнений и побочных эффектов СА
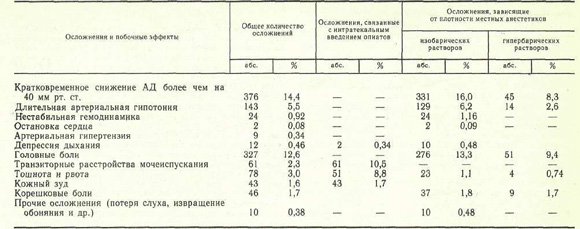
Во время оперативного вмешательства осложнения СА зарегистрированы у 552 (21,2 %) больных, причем при плановых операциях они наблюдались значительно реже (22 % ) , чем при оперативных вмешательствах, выполненных по экстренным показаниям (42 % ) . К наиболее частым интероперационным осложнениям СА следует отнести кратковременную или длительную артериальную гипотонию, причину которой мы склонны видеть в завышении дозы местноанестезирующих препаратов (свыше 1 мг/кг), форсированном их введении в спинномозговой канал, тактических ошибках, связанных с недооценкой анестезиологом плотности местных анестетиков, а также нераспознанной исходной гиповолемией различного происхождения.
Анализируя причины гемодинамических нарушений, мы обнаружили определенную зависимость частоты этого осложнения от уровня люмбальной пункции и возраста больных. Так, при пункции спинномозгового канала на уровне L4 — L5 артериальная гипотония зарегистрирована в 1,7 % случаев, Lз — L4 — в 18,1 %, L2 — L3 — в 44,7 %.
Обращает на себя внимание резкое увеличение количества гемодинамических нарушений (48,9 %) у лиц старше 50 лет, что, на наш взгляд, связано с повышением в этом возрасте числа сопутствующих заболеваний, а также возрастным снижением резервных возможностей организма. Изложенное выше подтверждают дооперационные исследования реакций сердечно-сосудистой системы на проведение классических проб с изменением положения тела. В случаях адекватной реакции с сохранением тонуса сосудов СА не сопровождалась артериальной гипотонией. При исходных неудовлетворительных адаптационных возможностях сердечно-сосудистой системы (скрытая сердечно-сосудистая недостаточность) выраженная и стойкая гипотензия в ответ на интратекальное введение местноанестезирующих препаратов была закономерным явлением и трудно поддавалась коррекции.
Высокий спинальный блок зарегистрирован в 10 (0,38 %) наблюдениях, проявлялся выраженной респираторной депрессией, стойкой и длительной артериальной гипотонией, прогрессирующей брадикардией. У 2 (0,08%) больных он осложнился остановкой кровообращения. Немедленно проведенные реанимационные мероприятия у 9 пациентов позволили восстановить адекватное кровообращение, дыхание, тонус периферических сосудов, а у 1 (0,04 %) больного они не дали эффекта. Причину этого грозного осложнения мы объясняем положением Фоулера на операционном столе после интратекального введения местноанестезирующих препаратов (изобарические растворы), что привело к постепенному распространению анестетика в краниальном направлении с последующей блокадой межреберных нервов, а также соответствующим симпатическим блоком.
Согласно нашим наблюдениям, сроки развития выраженных гемодинамических эффектов были различны. В 47 % случаев артериальная гипотония развивалась через 5—10 мин после интратекального введения местноанестезирующих препаратов, в 48,1 % —через 20—30 мин и только в 0,9 % — в более поздние сроки. Развитие артериальной гипотензии через 20—30 мин и в более поздние сроки можно объяснить фактом окончательной фиксации местноанестезирующих препаратов соответствующими структурами спинного мозга в течение 20 мин [3, 5]. Иначе говоря, местные анестетики, введенные в спинномозговой канал, при определенных условиях (соответствующий угол наклона операционного стола) способны еще в течение довольно длительного времени после развития хирургической стадии СА на нужном сегментарном уровне распространяться в краниальном направлении, блокируя все новые и новые спинальные сегменты. Поэтому для профилактики высокого спинального блока следует рекомендовать тщательный контроль (через каждые 1—2 мин) за уровнем АД, частотой пульса, уровнем блокады болевой чувствительности в течение первых 20—30 мин. Обращает на себя внимание значительное уменьшение числа случаев артериальной гипотензии при использовании гипербарических растворов (см. таблицу). Согласно нашим наблюдениям, СА гипербарическими и особенно вязкими растворами (на 8—10 % растворе глюкозы) в положении с умеренно, опущенным ножным концом стола на период фиксации анестезирующих препаратов позволяет блокировать строго ограниченное количество спинальных сегментов, а следовательно, и симпатических нервных стволов и сплетений.
Наиболее эффективным мероприятием по предупреждению артериальной гипотонии мы считаем переливание в течение 10—15 мин после интратекального введения обезболивающих препаратов коллоидно-кристаллоидных растворов в объеме 10—15 мл/кг с последующей инфузионно-трансфузионной терапией в умеренном темпе. Включение в премедикацию эфедрина и других вазопрессоров, на наш взгляд, не всегда оправдывает себя, а в ряде наблюдений провоцирует артериальную гипертензию, особенно у больных с сопутствующей артериальной гипертонией. Так, стойкая артериальная гипертензия зарегистрирована нами у 9 из 106 пациентов, получивших в премедикации эфедрин, что составило 8,5 %. Полагаем, что использование вазопрессоров оправдано только при резком снижении АД и неэффективности инфузионной терапии 1 .
Осложнение, связанное с интратекальным введением наркотических аналгетиков, зарегистрировано только у одного больного. Это была респираторная депрессия, связанная с ошибочным введением в спинномозговой канал 2 мл 0,005 % фентанила в сочетании с 2 % раствором лидокаина (1 мг/кг). Осложнение развилось через 10 мин, устранено вспомогательной ИВЛ в течение 20 мин. Исход благоприятный.
В ближайшем послеоперационном периоде осложнения и побочные эффекты СА отмечены у 451 (17,7 %) больного. К наиболее частым осложнениям следует отнести головные боли — у 327 (12,6%) больных: У 225 (78 %) пациентов они были умеренными и продолжались не более 1—2 дней. В 72 (22 %) наблюдениях зафиксированы стойкие и длительные головные боли (продолжительностью 3—5 дней и более). Как правило, это осложнение развивалось у лиц молодого и среднего возраста и значительно реже у пожилых людей и стариков (25,9 % ). Считают [3, 6], что патофизиологической основой головных болей являются прокол твердой мозговой оболочки и связанная с ним ликворея. Следуя этой точке зрения, легко объяснить вышеизложенный факт ранним активным поведением людей молодого возраста (переход в вертикальное положение), провоцирующим увеличение ликворного давления в спинномозговом канале, а следовательно, и большую потерю спинномозговой жидкости. Профилактические мероприятия — строгий постельный режим в течение 24 ч, положение на животе, внутривенное введение изотонических солевых растворов — позволили значительно снизить частоту постпункционных головных болей.
Другие неврологические осложнения в виде корешковых болей, явлений межостистого лигаментоза, преходящих нарушений обоняния и слуха были зарегистрированы у 56 (2,1 %) больных.
Поздняя респираторная депрессия отмечена у одного больного через 8 ч после интратекального введения 3 мг морфина (37 мкг/кг) в сочетании с 2 % раствором лидокаина (80 мг). Операция иссечения геморроидальных узлов и анестезия прошли без осложнений. В удовлетворительном состоянии со стабильными показателями гемодинамики и функции внешнего дыхания больной переведен в палату. Респираторная депрессия развилась внезапно, без каких-либо предвестников на фоне относительного благополучия и полного отсутствия боли. Осложнение проявилось в урежении дыхания до 4—5 в минуту, диффузном цианозе и потребовало ИВЛ в течение 8 ч. Исход благоприятный. Причину поздней респираторной депрессии мы склонны объяснить длительной задержкой наркотического аналгетика и его метаболитов в спинномозговой жидкости и мозговой ткани с последующим депрессивным воздействием на дыхательный центр. Превышение стандартной дозы морфина более чем в 3 раза способствовало развитию данного осложнения.
Побочные эффекты СА в виде тошноты и рвоты, транзиторной задержки мочеиспускания, кожного зуда в преобладающем большинстве случаев сопровождали интратекальное введение наркотических аналгетиков, чаще морфина (см. таблицу). Тошнота и рвота возникли у 78 (3 %) больных в ближайшие 2 ч после операции, преимущественно у женщин и ослабленных больных, а также в случаях завышения стандартных доз опиатов, введенных интратекально. Транзиторные расстройства мочеиспускания зарегистрированы у 61 (2,3%) больного и не требовали специального лечения. Кожный зуд отмечен у 43 (1,7 %) пациентов, исчезал самостоятельно или после введения антигистаминных препаратов. Механизмы развития перечисленных выше побочных эффектов подробно описаны в литературе [2—4].
- При проведении СА следует неукоснительно соблюдать все существующие правила ее выполнения с обязательным учетом плотности вводимых интратекально препаратов.
- СА наиболее безопасна при операциях на органах малого таза и нижних конечностях. Использование СА при оперативных вмешательствах
на органах верхней части брюшной полости представляет реальную опасность из-за резкой артериальной гипотонии и респираторных
нарушений. - Оптимальная доза лидокаина (тримекаина) для интратекального введения составляет 1 мг/кг, морфина — 10 мкг/кг, фентанила — 0,35 мкг/кг.
- У лиц, относящихся к группе повышенного риска, от СА следует отказаться в пользу другого метода обезболивания.
- Рифтин А. Д., Гельцер Б. И., Григоренко Г. Ф. Распознавание функциональных состояний организма на основе кибернетического анализа сердечного ритма: Метод, разработка. — Владивосток, 1986.
- Хапий X. X., Давыдов С. Б. Современные методы регионарной анестезии: Осложнения, их профилактика и лечение: Обзор, инофрм.— М., 1988.
- Covino В. G. I/ Int. Anesth. Clin.— 1989.—Vol. 27, N 1.— P. 8—12.
- Duthie D. J., Nitnmo N. S. // Brit. J. Anaesth,— 1987.— Vol. 59, N 1.—P. 61—77.
- Francois Q., Cara M., Deleuze R., Poisvert M. Medecine L'urgence Anesthesia Reanimation Pares.— 1981.— Vol. 8.— P. 136—143.
- Lambert D. H. // Int. Anesth. Clin,—1989.—Vol. 27, N 1. P. 51—55.
Основные причины ятрогенного оставления инородных тел в брюшной полости / Ярема И.В., Казарян В.М., Нахаев В.И., Новикова О.М. // Медицинская экспертиза и право. — 2010. — №6. — С. 27-30.
Читайте также:


