Спейсер тазобедренного сустава отзывы
И еще: хотя это уже и не имеет значения, но "асептическая" нестабильность безцементного имплантата через 1,5 года - это редкое
явление. Скорее всего, у больного имела место именно септическая нестабильность (low grade infection),которая и привела к формированию
свища после ревизии.
С уважением,
А. В. Вакуленко
Донецкий НИИ травматологии и ортопедии, Украина
Волошин Виктор Парфентьевич 11 Июль 2006, 01:33
ВВП, МОНИКИ
- Тобрамицин;
- Гентамицин;
- Ванкомицин;
- Ванкомицин + антибиотик из группы аминогликозидов.
- возможность ранней мобилизации пациента;
- длительное поддержание высокой концентрации антибиотиков в инфекционном очаге;
- сохранение мобильности сустава;
- меньший риск реинфекции по сравнению с одномоментным ревизионным эндопротезированием;
- сохранение объема и структуры околосуставных тканей;
- сокращение времени пребывания в стационаре.
- базовому материалу;
- антибактериальному препарату;
- технологии производства;
- количеству компонентов;
- сохранению функции сустава (артикуляции).
- Преформированные имплантаты. Производятся в заводских условиях. Такие спейсеры отличаются высокой однородностью базового материала и равномерным распределением антибиотика по всему его объему. В них соблюдается точная пропорция компонентов. К недостаткам преформированных имплантатов относится их высокая стоимость и невозможность индивидуального подбора антибиотиков (или их комбинаций).
- Динамические спейсеры. Изготавливаются из костного цемента непосредственно во время операции. Сегодня выпускаются промышленные наборы для их изготовления, состоящие из специальной формы, дозы костного цемента и растворителя. Применение динамических эндопротезов позволяет хирургу добавлять в цемент нужное количество антибиотика, который соответствует характеру и чувствительности возбудителя.
- Неартикулирующие (статические). Не восстанавливают подвижность сустава и требуют постоянной иммобилизации конечности после установки. Их использование сопряжено с риском формирования контрактур и дистрофических изменений мышц. Поэтому от применения статических спейсеров стараются отказываться. Сегодня их устанавливают лишь по особым показаниям: при рецидивирующем инфекционном процессе, больших костных дефектах, повреждениях связочного аппарата, которые сопровождаются нестабильностью в суставе.
- Артикулирующие (мобильные). Состоят из нескольких компонентов, что позволяет сохранить мобильность сустава и анатомо-функциональные взаимоотношения в конечности. После установки артикулирующего спейсера пациент может свободно передвигаться. Это снижает риск формирования контрактур и мышечных дистрофий, улучшая прогноз окончательной ревизии. Отметим, что уставнока артикулирующих имплантатов возможна только при сохранности связочного аппарата сустава.
- наличие абиогенного компонента, способного адсорбировать на своей поверхности бактерии;
- развитие необычной формы бактериальной колонизации абиогенной поверхности с формированием биопленочной формы существования бактерий в составе бактериальных биопленок [2].
- ограниченный выбор размеров имплантируемых деталей и доз антибиотиков;
- возможность применения только одного антибиотика, к которому у возбудителей инфекции может развиваться устойчивость [12].
- Женщины с широкой тазобедренной фигурой
- Защемление нерва в тазобедренном суставе у кошки
- Лечение артрита тазобедренного сустава 4 степени
- После лапароскопии боли в правом бедре
- Однажды в россии операция на бедра
| Re: Повторная ревизия тазобедренного сустава? Отправитель: Anton Vakulenko 11 Июль 2006, 20:45 |
| Вряд-ли такая тактика у 56-летнего пациента со свищем в зоне протеза может называться "активной" :). Это скорее пассивная выжидательная тактика, которая, как показывает не только наш скромный, но и мировой опыт, в большинстве случаев обречена на провал. Даже если свищ под влиянием санации, "иммунокорректоров" или а/б закроется (свищам вообще свойственно периодически открываться и закрываться), то не факт, что больной будет доволен исходом и не будет жаловаться на боль и интоксикацию. С уважением, |
| [ Ответить ] |
| Re: Повторная ревизия тазобедренного сустава? Отправитель: Виктор Парфентьевич Волошин 13 Июль 2006, 02:53 |
| Признаков нестабильности эндопротеза нет, при санации возможны интраоперационные "находки" (увы бывает, что и тогда нужно выдалбливать прочный цемент?). По сравнению со ВСЕМ ЧЕЛОВЕЧЕСТВОМ наш опыт тоже достаточно скромен (56 инфицированных эндопротезов), но за длительный срок, когда разные были подходы и разное отношение к иммунитету, антибиотикам и к самому понятию санация. И одномоментно при инфицированной нестабильности доводилось заменять и спейсеры использовать (кстати из 18 больных со спейсерами у одного более года так и не удается перейти ко второму этапу, несмотря на повторные аналогичные вмешательства). Есть убедительные основания считаться с предложенной тактикой, хотя гарантировать однозначно благоприятный исход нельзя, она скорее не пассивно-выжидательная, а разумно активная :-) ВВП, МОНИКИ |
| [ Ответить ] |
| Re: Повторная ревизия тазобедренного сустава? Отправитель: Anton Vakulenko 13 Июль 2006, 20:20 |
| > Признаков нестабильности эндопротеза нет,
На мой взгляд удаление протеза показано не из-за нестабильности, а из-за трудностей санации инфицированных мягких тканей при наличии рядом с ними отличного "укрытия" для микрофлоры (эндопротеза). > при санации возможны интраоперационные "находки" (увы, бывает, что и Наш опыт еще более скромен (около 20) ;) > длительный срок, когда разные были подходы и разное отношение к Абсолютно согласен, что гарантировать в подобной ситуации нельзя ничего вне зависимости от выбранной тактики лечения :( В любом случае, по данному конкретному случаю сложно что-то советовать, так как коллега Кузнецов предоставил слишком мало исходной информации, качество снимков также неважное. С уважением, |
| [ Ответить ] |
| Re: Повторная ревизия тазобедренного сустава? Отправитель: Кузнецов Ю. 13 Июль 2006, 20:37 |
| Уважаемый Антон Вакуленко! Какая именно информация необходима дополнительно? Постараюсь предоставить, насколько это возможно (в условиях районной больницы). Качество снимков это вопрос оцифровки, если нужно их можно переснять.Просто хотелось бы уточнить, что еще кроме ориентации компонентов эндопротеза, признаков нестабильности, степени распространения контраста там можно разглядеть? С уважением, Кузнецов Ю. |
| [ Ответить ] |
| Re: Повторная ревизия тазобедренного сустава? Отправитель: Anton Vakulenko 13 Июль 2006, 23:08 |
| Уважаемый коллега, прежде всего, интересно узнать жалобы пациента, его функциональный статус, профессию, а также пожелания по поводу улучшения своего теперешнего состояния. Какой возбудитель обнаружен в отделяемом свища, к чему он чувствителен? -- Эндопротезирование колена и ТБС — это сложное хирургическое вмешательство, позволяющие восстановить подвижность сустава и избавиться от хронических болей. Оно является спасением для многих пациентов, поскольку позволяет им вернуться к привычному образу жизни. Но операция сопряжена с некоторыми рисками. Главным ее недостатком является высокий процент послеоперационных осложнений, которые требуют повторного (ревизионного) вмешательства.
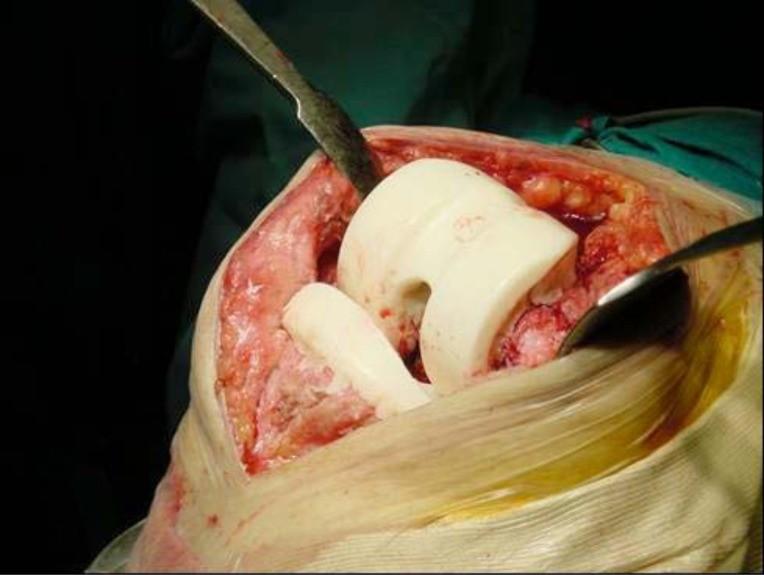
Процесс установки спейсера коленного сустава. Среди всех осложнений инфекционные занимают первое место по тяжести, сложности в лечении и угрозе для здоровья пациента. По разным данным, глубокая перипротезная инфекция развивается у 1-8,5% больных, которым было выполнено эндопротезирование. Ее лечение представляет собой большую проблему и не всегда дает удовлетворительные результаты. Риск реинфекции после ревизионной операции достаточно высок, а пациент рискует снова, уже в третий раз, попасть на операционный стол. Ранее самой эффективной санирующей операцией была резекционная артропластика с созданием неоартроза. Она предусматривала удаление фрагментов пораженного сустава с частичным сохранением опороспособности конечности. Из-за плохих функциональных результатов от операции начали отказываться. Хирурги стали искать более совершенные и менее травматичные методы санации. Оно более эффективно, чем одномоментное реэндопротезирование. И, в отличие от резекционной артропластики, позволяет сохранить не только опороспособность, но и подвижность конечности. Двухэтапная ревизионная операция считается самым успешным методом эрадикации возбудителя инфекции. По данным клинических исследований, она позволяет контролировать инфекцию более чем в 90% случаев.
Спейсеры коленного сустава. Что такое спейсерСпейсеры — это временные эндопротезы коленного и тазобедренного суставов, сделанные из биосовместимых материалов (костного цемента, полиэтилена, металлов) с включением в состав антибиотика. Их устанавливают пациентам с перипротезной инфекцией сразу после удаления инфицированного эндопротеза. Установка временного имплантата выполняется на первом этапе ревизионного эндопротезирования и обязательно комбинируется с системной антибиотикотерапией.
Спейсеры тазобедренных суставов. В состав временных эндопротезов включают такие антибиотики: Количество антибиотика в составе спейсера может достигать 20 грамм на 40 грамм базового материала. При сопутствующей грибковой инфекции вместе с антибактериальными препаратами в базовый материал добавляют амфотерицин В в количестве 100-150 мг на каждые 40 грамм. Установка имплантата, содержащего антибиотик, сокращает длительность системной антибиотикотерапии и тем самым уменьшает токсическое действие антибактериальных препаратов на организм. А ранняя мобилизация пациента, которая становится возможной благодаря имплантации спейсера, помогает избежать контрактур и мышечных дистрофий.
Спейсеры и цемент с антибиотиками. На первом этапе реэндопротезирования врачи выполняют радикальную хирургическую обработку гнойного очага, удаляют компоненты имплантата и костный цемент. После этого хирурги берут как минимум пять образцов тканей для бактериологического и гистологического исследования. В дальнейшем это позволит им идентифицировать возбудителей инфекции, определить их чувствительность к антибиотикам и подобрать адекватную схему антибиотикотерапии. Временный эндопротез устанавливают после санации гнойного очага, удаления старого протеза и забора материала для исследования. После этого в течение 7-10 дней рану промывают через дренажные трубки. Получив результаты бактериологического исследования, врачи назначают больному системную антибиотикотерапию. Лечение антибиотиками обычно продолжается 4-6 недель.
Показания к установкеДвухэтапное эндопротезирование с установкой спейсера показано при перипротезной инфекции и септической нестабильности коленного или тазобедренного суставов.
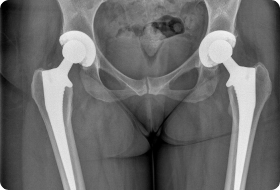
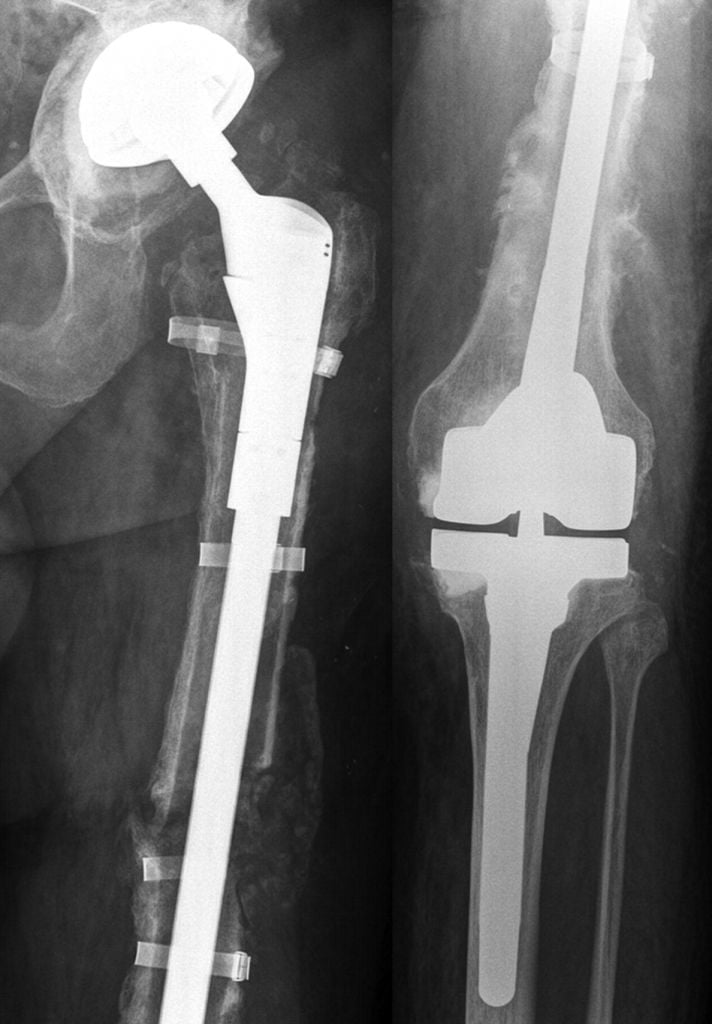
Ревизионные постоянные протезы на рентгене. Преимущества установки временного эндопротеза: В случае реинфекции возможна повторная установка спейсера, выполнение резекционной артропластики или артродезирования. При выборе метода хирургического лечения учитывают возраст пациента, состояние его здоровья, сохранность анатомических структур сустава, характер инфекционного процесса. По возможности предпочтение отдают именно реимплантации.
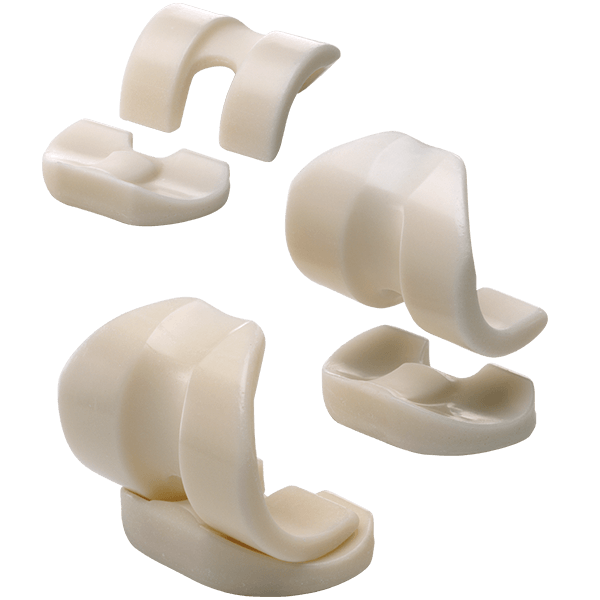
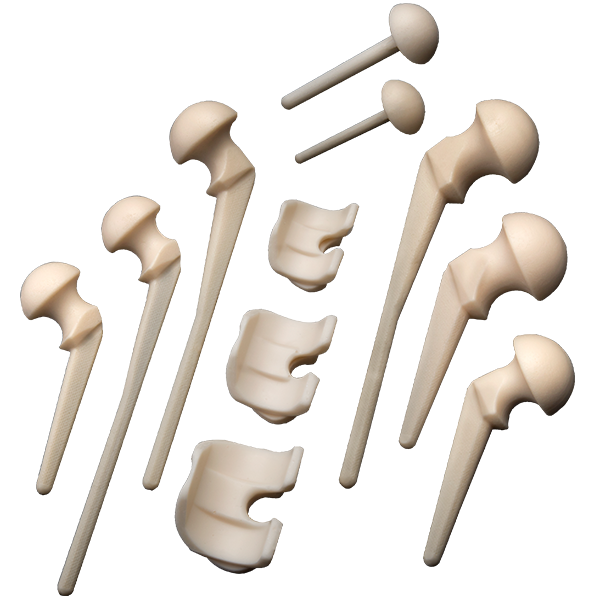
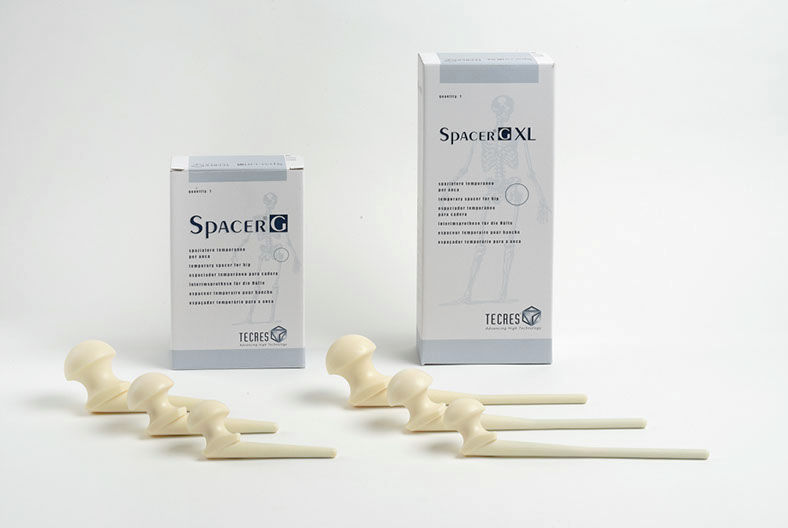
Виды спейсеров, бренды, ценыВременные эндопротезы классифицируют по нескольким критериям: Мы уже выяснили, что для изготовления спейсеров могут использовать разные типы материалов (костный цемент, полиэтилен, металл) и несколько различных антибиотиков. Сегодня предпринимаются попытки внедрить в их состав антисептики и металлы с антимикробной активностью (серебро, медь, цинк), однако таких научных работ пока что немного. В зависимости от технологии производства выделяют:
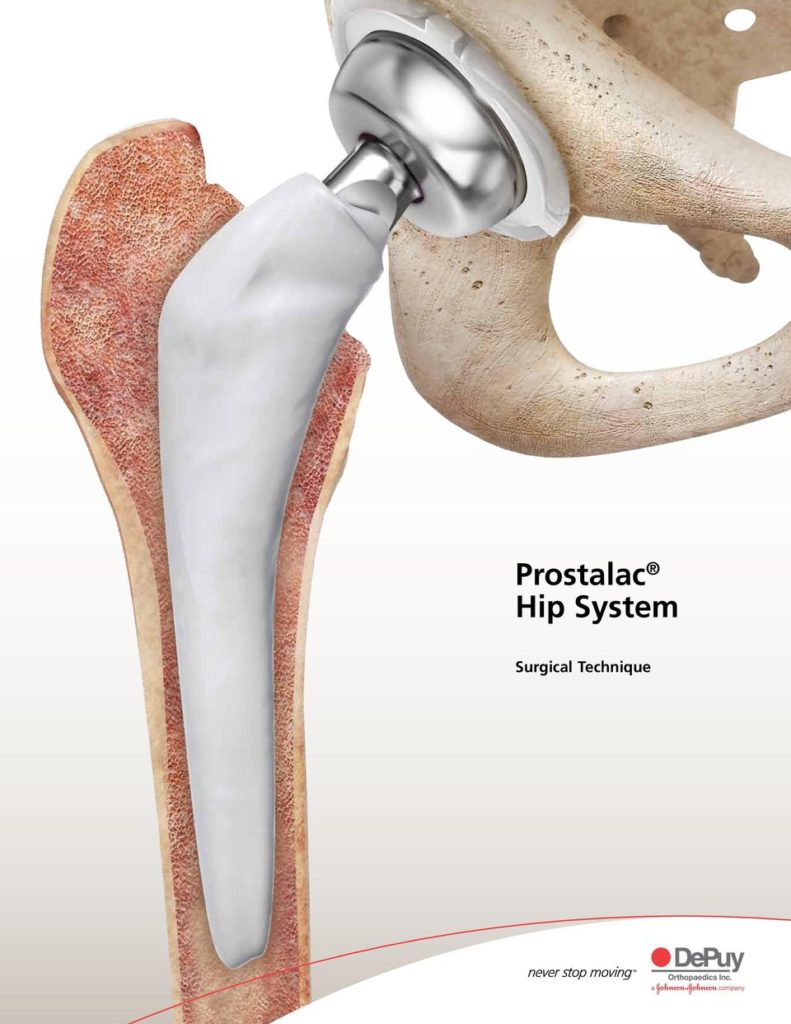
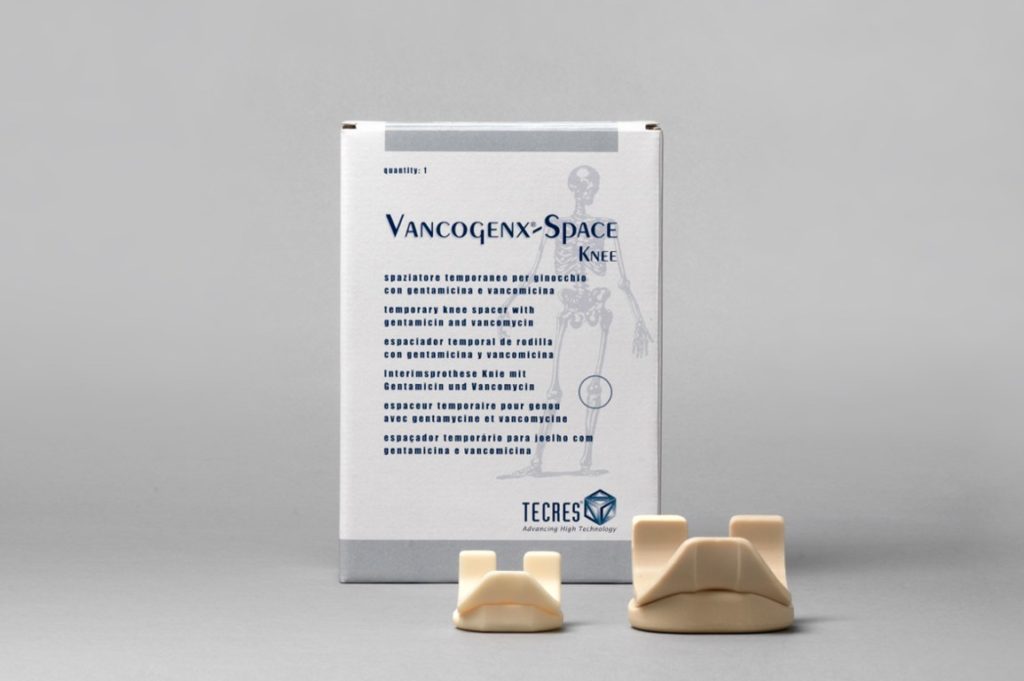
Prostalac® Hip System (DePuy) К преформированным имплантатам относятся Prostalac® Hip System (DePuy), а также артикулирующие спейсеры коленного и тазобедренного сустава Vancogenx (TECRES®). Они имеют более высокую стоимость, чем промышленные наборы для изготовления динамических имплантатов, такие как VANCOGENX-SPACER KNEE и Spacer-K (TECRES®).
VANCOGENX-SPACER KNEE и Spacer-K (TECRES®) Динамические имплантаты являются более эффективным решением для ревизионного эндопротезирования. Они предусматривают использование оптимального антибактериального средства. Однако их изготовление и установка требуют особых навыков и профессионализма оперирующего хирурга и всего персонала учреждения. Виды временных эндопротезов по уровню артикуляции: Сегодня в клинической практике начинают использоваться артикулирующие спейсеры, изготовленные по индивидуальным параметрам (с применением 3D-моделирования). По сравнению с преформированными, они лучше заполняют костные дефекты, обеспечивают лучшую опорную и двигательную функции конечности. Их стоимость в несколько раз ниже, чем у заводских спейсеров, а эффективность использования — выше. Однако применение индивидуальных артикулирующих имплантатов пока что не приобрело больших масштабов из-за сложностей в изготовлении. Как долго ходить со спейсеромУдаление временного имплантата обычно выполняют спустя 3-6 месяцев. Прежде чем планировать второй этап реэндопротезирования, врачи исследуют маркеры воспаления в крови (С-реактивный белок, СОЭ) и аспирационную жидкость, полученную из очага инфекции не менее чем через четыре недели после прекращения антибактериальной терапии. При отсутствии признаков инфекции и воспалительного процесса временный имплантат удаляют, а на его место устанавливают постоянный ревизионный эндопротез. Если на втором этапе врачи выявляют клинические проявления инфекции, больному выполняют повторную хирургическую обработку инфекционного очага. В таком случае еще раз проводят микробиологическое исследование и назначают системную антибиотикотерапию. Возможные варианты дальнейшего лечения врачи согласовывают с пациентов. Больному могут либо повторно установить спейсер, либо сделать операцию, направленную на сохранение опорной функции конечности.
Ограничения из-за временности спейсераНеартикулирующие имплантаты создают ряд ограничений для пациентов, ведь после их установки требуется постоянная иммобилизация нижней конечности. Это приводит к дистрофическим изменениям в мышцах и связках, развитию контрактур. В итоге после второго этапа эндопротезирования возможен неудовлетворительный результат. Что касается артикулирующих спейсеров, они лишены этого недостатка. Но даже они не могут в полной мере восстановить функции пораженного сустава. Поэтому в период между первым и вторым этапами реэндопротезирования человеку приходится сталкиваться с рядом ограничений. Во-первых, он не может пройти полноценную реабилитацию, поскольку в этом нет смысла. Во-вторых, ему запрещается вести активный образ жизни, заниматься спортом, посещать бани и сауны и т.д.
ИтогиИспользование временных эндопротезов снижает риск реинфекции при ревизионных операциях на крупных суставах (коленном, тазобедренном). Выполнение двухэтапной операции с установкой временного имплантата гораздо предпочтительнее, чем одномоментное реэндопротезирование. Динамические спейсеры, изготовленные во время операции, имеют преимущества перед заводскими. Их стоимость гораздо ниже, а эффективность использования — выше. При их изготовлении врачи могут подобрать комбинацию антибиотиков с учетом характера и чувствительности микрофлоры. Это позволяет в разы эффективнее воздействовать на инфекционные агенты. Полезная модель относится к медицине, конкретно - к травматологии-ортопедии. Используется на этапе лечения осложнений тотального эндопротезирования тазобедренного сустава, при гнойно-воспалительных заболеваниях. Сущность полезной модели заключается в совокупности существенных признаков, достаточной для достижения искомого технического результата, состоящего в восстановлении опороспособности нижней конечности при дефектах дна вертлужной впадины, с возможностью коррекции длины конечности во время операции, при сохранении длины отводящих мышц бедра. Полезная модель относится к медицине, конкретно - к травматологии-ортопедии. Используется на этапе лечения осложнений тотального эндопротезирования тазобедренного сустава, при гнойно-воспалительных заболеваниях. При тяжелых формах патологии тазобедренного сустава эндопротезирование позволяет восстановить движения в суставе, значительно снизить болевой синдром, что существенно повышает качество жизни пациента, но, после проведения этой сложной хирургической операции возможны осложнения. Одно из них - гнойные поражения в области тазобедренного сустава - требует удаления компонентов эндопротеза. При фиксации эндопротеза костным цементом его изъятие может приводить к сколам костного вещества и дефектам в структуре дна. Кроме того, из-за болевого синдрома, пациенты не нагружают пораженную нижнюю конечность, вследствие чего развивается локальный остеопороз, увеличивающий риск протрузии. Прототипом предложенной полезной модели является спейсер тазобедренного сустава, который описан в способе создания цементного спейсера тазобедренного сустава [1]. Его создание осуществляют по этапам. Во время операции производят фистулнекрэктомию мягких тканей и удаляют эндопротез тазобедренного сустава. I этап создания спейсера - полость вертлужной впадины плотно заполняют костным цементом с антибиотиком. Методом ручной лепки создают шейку спейсера одинаковой длины, но несколько большего диаметра (на 3-4 мм) шейки удаленного бедренного компонента эндопротеза. В центр шейки спейсера вводят несколько фрагментов (2-4) спиц Киршнера диаметром 2 мм и длинной 4-5 см так, чтобы одна их половина (2-2,5 см) была погружена в костный цемент, а другая половина выступала над торцом шейки спейсера. II этап создания спейсера - в момент затвердевания костного цемента, когда он перестает прилипать к перчаткам, его вводят на глубину 5-7 см в костно-мозговой канал проксимального отдела бедренной кости. Придают нижней конечности функционально выгодное положение - отведение 15°, сгибание 170° в тазобедренном суставе. Соединяют две части спейсера (вертлужную и бедренную) с помощью выступающих половинок фрагментов спиц Киршнера в вертлужной части. После полного затвердевания второй порции костного цемента происходит плотное соединение двух частей спейсера. Недостатком прототипа является небольшой объем движений, невозможность коррекции длины оперированной конечности во время операции, усиление болевого синдрома после установки спейсера из-за повышенного трения поверхности спейсера о дно вертлужной впадины. Сущность полезной модели заключается в совокупности существенных признаков, достаточной для достижения искомого технического результата, состоящего в восстановлении опороспособности нижней конечности при дефектах дна вертлужной впадины, с возможностью коррекции длины конечности во время операции, при сохранении длины отводящих мышц бедра. Выполнение первого элемента в виде шара, диаметр которого соответствует наружному диаметру демонтированной чашки эндопротеза, устанавливаемой в вертлужную впадину, позволяет закрыть ее дефекты, что препятствует протрузии спейсера при физической нагрузке, и даже позволяет несколько увеличить эту нагрузку. Третий элемент спейсера, выполненный в виде полусферической шайбы, расположенный между первыми двумя элементами, позволяет производить индивидуальную интраоперационную коррекцию длины конечности за счет изменения его толщины, и сохранить длину отводящих мышц бедра. Выполнение устройства из трех частей позволяет увеличить объем движений в тазобедренном суставе за счет возможности разнонаправленных движений составляющих частей устройства. При этом конструктивное решение устройства позволяет снизить риск вывиха спейсера из вертлужной впадины. Устройство спейсера поясняется приведенными иллюстрациями: на фиг.1 показан фронтальный вид спейсера, установленного на место удаленного эндопротеза; на фиг.2 - боковая проекция установленного устройства. Предлагаемая полезная модель может быть использована следующим образом. У больного А., 55 лет, оперированного в октябре 2008 г.по поводу правостороннего коксартроза 3-й степени, произошло расшатывание чашки эндопротеза вследствие вялотекущей хронической инфекции. Через 3 года после операции появились периодические боли в оперированном суставе, открылся свищ. Прием антибиотиков и нестероидных противовоспалительных препаратов купировал болевой синдром лишь на некоторое время. Периимплантная инфекция у пациентов с эндопротезированием тазобедренного сустава выявляется в 1-2 % случаев [1, 46]. При этом после ревизионного эндопротезирования частота инфекционных осложнений колеблется от 4,7 % (при использовании цемента с антибиотиками) до 28 % (без использования цемента с антибиотиками). При сохраняющейся динамике к 2030 году доля ревизионных эндопротезирований составит 22-25 % от числа первичных [5, 7]. При инфекционных осложнениях используются открытый дебридмент, длительное промывание полости сустава антисептиками, массивная патогенетически оправданная антибактериальная терапия, одноэтапное реэндопротезирование, хотя эффективность их применения отмечается только у 27-30 % больных [3, 4, 19]. Оптимальным на современном этапе считается сочетание антимикробной терапии, радикальной хирургической обработки гнойного очага с обязательным удалением имплантов и костного цемента, продолжительного по времени дренирования, адекватного дезинтоксикационного лечения и установки цементного спейсера с антибиотиками [3]. Факторы, влияющие на выбор тактики лечения инфекции в области тазобедренного сустава после его тотального эндопротезирования. При эндопротезировании крупных суставов ситуация осложняется возникновением имплантат-ассоциированной инфекции, главными особенностями которой являются: Большинство используемых в настоящее время подходов к лечению инфекционных осложнений заключается в применении традиционной антибактериальной терапии, при этом протоколы лечения периимплантной инфекции тазобедренного сустава после тотального эндопротезирования базируются на результатах микробиологических исследований, выполняемых периоперационно. Безусловно, ряд возбудителей могут быть элиминированы с помощью системной антибиотикотерапии, однако при развитии инфекций, связанных с ортопедическими имплантами, специалисты сталкиваются с фенотипически иными формами бактерий [15, 38, 40]. Было показано, что при использовании рутинных культуральных методов выявляется лишь относительно небольшая доля широкого спектра патогенных микроорганизмов. Установлено, что в этиологии периимплантной инфекции существенное значение имеют антибиотико-резистентные возбудители внутрибольничных инфекций и разнообразные оппортунистические микробы-сапрофиты [7, 19, 40]. Особенностью инфекции при эндопротезировании является и факт адгезии микроорганизмов на поверхности эндопротеза. Микроорганизмы аккумулируются на ней в большом количестве, образуя биопленку, персистируя и становясь устойчивыми к антибиотикам [2]. Известно, что микроколониальные варианты стафилококков и других бактерий могут выживать и размножаться внутриклеточно: в остеобластах, эндотелиальных клетках и даже в полиморфноядерных лейкоцитах и макрофагах [43]. Такие внутриклеточные формы микроорганизмов часто не выявляются традиционно используемым культуральным методом. Применение современных высокочувствительных методов выявления микроорганизмов подтвердило, что полимикробная колонизация после длительно существующей инфекции после тотального эндопротезирования тазобедренного сустава представляет скорее правило, чем исключение [28]. Эти результаты позволили большинству исследователей прийти к выводу, что возможность наличия инфекции протеза тазобедренного сустава после тотального эндопротезирования, как правило, существенно недооценивается, поскольку применение культуральных методов нередко не позволяет выявить возбудителей [14]. Большинство видов бактерий, обнаруживаемых на ортопедических имплантах, демонстрируют низкую чувствительность к антибиотикам [47]. Показано, что полная элиминация микроколониальных форм бактерий требует примерно в сто раз более высоких, чем обычно, концентраций антибиотиков. В то же время эти формы возбудителей, как правило, успешно поддаются лечению препаратами системного действия, обладающими внутриклеточной активностью [41]. При этом микроорганизмы, находящиеся в составе биопленки, требуют для элиминации в 10 3 раз более высоких концентраций антибактериальных препаратов [44]. В большинстве случаев эти возбудители устойчивы как к системной антибактериальной терапии, так и действию антибиотиков, высвобождающихся из импрегнированного полиметилметакрилата [22]. Срок выполнения второго этапа лечения варьирует, при этом решение о возможности реимплантации обязательно основывается на клинических, лабораторных данных и результатах визуализации, свидетельствующих о разрешении инфекции, при этом отмечается нормализация уровней СОЭ и C-реактивного белка. Радикальная санация очага инфекции является необходимым условием успешного лечения любой ортопедической инфекции, однако инфицированное операционное поле не может быть стерилизовано только с помощью хирургической обработки без применения других методов. При этом хирургическая санация устраняет большую часть биологического загрязнения, но не может предупредить замещение остаточного количества бактериальных колоний в санированной области другими микроорганизмами. Концентрации антибиотиков, которые могут быть достигнуты системным введением антибактериальных препаратов или применением локальной антибиотикотерапии доступными препаратами, позволяют осуществить эрадикацию планктонных форм возбудителей, но не являются эффективными в отношении микрокластеров, оставшихся после удаления биопленок микроорганизмов. Вследствие этого возможно повторное развитие инфекции в течение любого промежутка времени. При этом исследователи считают, что отдельные фрагменты биопленок более чувствительны к антибактериальной химиотерапии, чем интактные биопленки [12, 25], тем не менее их элиминация требует использования высоких доз антибактериальных средств, которых невозможно достичь путем применения системной или местной антибиотикотерапии с помощью традиционных средств. Для элиминации остаточных фрагментов биопленок необходимы новые подходы к антимикробной терапии, обеспечивающие достаточно высокие концентрации антибактериальных средств в области инфицированного импланта в течение длительного периода времени [45]. В связи с тем, что концентрации антибиотиков в контаминированной области, обеспечиваемые применением антибактериальных препаратов системного действия и обычно используемых систем доставки антибиотиков, недостаточны для элиминации бактериальных биопленок, стала очевидной необходимость разработки новых подходов к доставке антибиотиков к месту назначения. В любом случае высокие концентрации препарата, необходимые для элиминации бактерий, достигаются только путем местного введения. Невозможность вылечить антибиотиками инфекцию, связанную с установленным протезом, обусловлена не столько слабым проникновением препаратов внутрь биопленки, сколько отсроченным антимикробным действием на микроорганизмы при её наличии [16]. Было выявлено несколько антибактериальных средств, удовлетворяющих данным критериям. Наиболее широко применяемое среди них - ванкомицин, препарат, обладающий внутриклеточным бактерицидным действием и, вследствие этого, эффективный в отношении микроколониальных форм стафилококков [9, 13, 32]. Для ванкомицина характерно быстрое проникновение через гликокаликс [32]. После внедрения в биопленку ванкомицин демонстрирует внутри нее дозозависимую бактерицидную активность в концентрациях, превышающих ингибирующие концентрации для планктонных бактерий в 8-128 раз [32]. Ванкомицин показывает высокую по сравнению с другими препаратами активность в отношении стафилококков в состоянии биопленки, особенно в случаях наличия метициллин-резистентного золотистого стафилококка [45]. Ванкомицин демонстрирует и минимальный цитотоксический эффект по сравнению со всеми используемыми в настоящее время антибиотиками, а также не вызывает системные побочные эффекты после локального введения [13]. Для этого препарата характерно слабое проникновение в окружающие ткани [27], что является недостатком при его внутривенном введении [18], но, напротив, становится преимуществом при локальном применении препарата. Таким образом, локальное использование препаратов с характеристиками, сходными с таковыми у ванкомицина, может наряду с применением соответствующих систем доставки антибиотика явиться высокоэффективным методом лечения инфекционных осложнений при установке ортопедических имплантов. Система доставки препарата должна содержать высокие начальные уровни вещества для обеспечения быстрого проникновения его через гликокаликс, а затем поддерживать концентрацию препарата на необходимом уровне (который, в случае ванкомицина, соответствует 200-500 мг/л) в течение как минимум 72 ч. Независимо от срока с момента удаления предыдущего импланта при установке нового протеза в недавно инфицированную область хирург должен учитывать повышенный риск неблагоприятного исхода операции как при одно-, так и при двухэтапном ревизионном эндопротезировании. Возможное последующее удаление протеза должно быть легко осуществимым и сопряженным с низким риском дополнительных повреждений костных структур. При использовании таких спейсеров становится возможной профилактика усиления биологического загрязнения в области сустава и снижение риска развития контрактуры мягких тканей [15, 31]. Недавние исследования позволяют предположить, что использование цемента, импрегнированного антибиотиком, избавляет от необходимости использования системной антибактериальной терапии, что способствует значительному снижению расходов на их лечение [8, 24, 42]. Полагают, что при смешении цемента с антибактериальным средством важно создать как можно более пористый материал для улучшения высвобождения гентамицина, а также использовать цемент на поздних стадиях полимеризации для предупреждения его врастания в костные структуры, что может значительно усложнить удаление цемента на втором этапе ревизионного эндопротезирования [10]. Смешивание цемента с антибиотиком в вакууме обеспечивает увеличение его механической прочности, однако при этом снижается пористость, вследствие чего может снижаться высвобождение антибиотика [17]. Лекарственные средства для изготовления цемента, импрегнированного антибиотиком, подбирают на основании результатов оценки чувствительности к ним инфекционных агентов. Эти препараты должны соответствовать критериям, разработанным W.R. Murray (1984), которые включают: безопасность, термостабильность, гипоаллергенность, водорастворимость, адекватный спектр бактерицидной активности, возможность получения препарата в форме стерильного порошка [39]. Механические свойства цемента, импрегнированного антибиотиком, зависят от их соотношения в смеси. Установлено, что масса антибактериального средства не должна превышать 10 % массы цемента для того, чтобы предупредить возможный перелом цементного спейсера [7, 20]. Добавление к цементу антибактериального препарата в форме раствора ухудшает механические свойства цемента, импрегнированного антибиотиком, вследствие чего увеличивается риск перелома спейсера. Однако P.H. Hsieh et al. (2009) в исследовании на 42 пациентах, подвергшихся ревизионному эндопротезированию по поводу инфекционных осложнений эндопротезирования тазобедренного сустава, показали, что использование для спейсеров костного цемента с гентамицином в форме раствора обеспечивает эффективную доставку антибактериального средства в область сустава в отсутствие системных побочных эффектов [30]. К наиболее часто используемым в составе костного цемента антибиотикам относятся тобрамицин, гентамицин и ванкомицин [39, 44]. Комбинация ванкомицина и препарата из группы аминогликозидов обеспечивает широкий спектр антибактериальной активности, в том числе против бактерий, которые чаще всего являются возбудителями глубокой инфекции протеза тазобедренного сустава, при этом не наблюдается образование устойчивых штаммов [7]. При использовании временных спейсеров дозировка антибиотиков может достигать 20 г на 40 г костного цемента при отсутствии системных побочных эффектов. При наличии грибковой инфекции наряду с антибактериальными препаратами добавляют от 100 до 150 мг амфотерицина B на каждые 40 г костного цемента [17]. Было показано, что имплантация спейсера из цемента, импрегнированного антибиотиком, сокращает необходимую длительность системной антибиотикотерапии, что позволяет снизить системную токсичность антибактериальных средств и частоту появления устойчивых штаммов [24, 42]. Кроме того, благодаря ранней мобилизации при их применении снижается частота развития осложнений, связанных с длительным лежачим положением пациентов [19]. Спейсеры разделяют на статические (неартикулирующие), интрамедуллярные штифты и шарнирные (артикулирующие, мобильные) спейсеры. Несмотря на удовлетворительные характеристики выделения антибиотика цементными бусами [7], в настоящее время они используются редко вследствие сопряженного с их применением укорочения конечности, которое сопровождается увеличением затрат энергии при ходьбе, потерей ткани, контрактурой мягких тканей и рубцовым процессом, что, в свою очередь, вызывает сложности при последующем обнаружении и удалении бус на втором этапе лечения инфекции [41]. Статические или простые блоковидные спейсеры обеспечивают высокие местные концентрации антибактериальных средств, реализуя при этом функцию сохранения суставного пространства для выполнения последующей операции ревизионного эндопротезирования. Такие конструкции облегчают хирургический доступ во время реимплантации протеза и позволяют доставить в область сустава антибиотики, подобранные в соответствии с результатами оценки чувствительности микроорганизмов [12, 29]. Недостатком статического спейсера является то, что его использование не обеспечивает физиологические движения в суставе, вызывая образование рубцов вокруг импланта и развитие мышечных контрактур и, как следствие, снижение частоты успешных исходов и ухудшение качества жизни пациентов в течение длительного периода лечения. Другим недостатком статического спейсера является повреждение костных структур, связанное с миграцией импланта. В то же время применение таких устройств более эффективно в отношении профилактики развития остаточной микрофлоры по сравнению с использованием мобильных спейсеров [12, 29]. Основным общим недостатком при использовании артикулирующих спейсеров является их нестабильность при исходной дисплазии, деструкции вертлужной впадины или пострезекционных дефектах проксимального отдела бедренной кости. Отсутствие большого (свыше 40 %) фрагмента площади крыши или дна вертлужной впадины наряду с утратой мест прикрепления ротаторов бедренной кости может приводить к послеоперационному вывиху спейсера, снижению его антибактериальных свойств и в полной потере опороспособности конечности [15, 10, 31]. Основной целью использования шарнирных (мобильных, артикулирующих) устройств является сохранение функции сустава и мягких тканей в течение периода ожидания реимплантации для того, чтобы облегчить проведение операции на втором этапе лечения. Было показано, что применение шарнирных спейсеров уменьшает степень повреждения костных структур в процессе лечения по сравнению с применением статических спейсеров [31]. C.P. Duncan, C.A. Beauchamp (1993) впервые описали успешное использование данного вида устройств для двухэтапного ревизионного эндопротезирования при лечении инфекционных осложнений после тотального эндопротезирования тазобедренного сустава [21]. Исследователи отмечают, что контакт между головкой бедренной кости, выполненной из цемента, и костной поверхностью вертлужной впадины может вызывать развитие эрозий кости и дискомфорт. Поэтому было предложено использование цементного компонента и для поверхности вертлужной впадины с целью предупреждения повреждения седалищной кости [34]. Использование такой тактики дает возможность увеличения местных концентраций антибиотиков вследствие наличия большей площади поверхности цемента, высвобождающей антибактериальный препарат, а также длительного взаимодействия цементных компонентов между собой. В то же время артикуляция цементных компонентов снижает объем движений в суставе, что способствует ощущению дискомфорта у пациентов [48]. Следует отметить, что у шарнирных спейсеров имеется и ряд недостатков, к которым относят: Шарнирные спейсеры собирают непосредственно в операционной, что позволяет регулировать дозировку антибиотиков. Однако еще одним недостатком является дополнительное время, необходимое на сборку импланта в ходе операции. Кроме того, повышается риск перелома импланта вследствие гетерогенности цемента, существует вероятность токсического действия антибиотиков, поскольку они добавляются к цементу в больших количествах [12]. В настоящее время используются различные варианты шарнирных спейсеров, в частности при реимплантации удаленного протеза после интраоперационной стерилизации. Используется специально разработанный силикон для многократного применения, могут применяться также металлические формы для импланта на металлическом эндоскелете, в качестве которого могут выступать интрамедуллярные штифты или спицы Киршнера [19, 35]. После радикальной хирургической обработки очага инфекции, удаления всех компонентов импланта и отбора, как минимум, пяти образцов ткани для бактериологического и гистологического исследования устанавливают вертлужный цементный компонент без фиксации [24, 29]. Для бедренного компонента применяют бесцементную или цементную фиксацию в проксимальном отделе, вследствие чего возможно легкое удаление обоих компонентов на втором этапе без повреждения костных структур. В послеоперационном периоде пациентам рекомендуется ходьба на костылях с небольшой нагрузкой на ногу, после чего они могут быть выписаны из стационара. Антибактериальная терапия подбирается путем исследования чувствительности к антибиотикам культур, полученных из интраоперационно отобранных образцов, и осуществляется в течение 4-6 недель. Решение об имплантации нового протеза тазобедренного сустава принимают в том случае, если культуральное исследование жидкости, полученной при аспирации из очага инфекции через четыре недели после прекращения антибактериальной терапии, отрицательно, а исследование маркеров воспаления позволяет предположить разрешение инфекции - при уровнях C-реактивного белка Читайте также:  Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
|