Синдром имплантации костного цемента это
Цель исследования: изучить изменения костной ткани, легких, печени и лимфатических узлов при имплантации костного цемента в бедренную кость в эксперименте.
Костная ткань. При введении метилметакрилата сумма деструктивных изменений костной ткани превышала показатели в контрольной группе при всех сроках эксперимента с наибольшей объемной плотностью некрозов через 3 и 7 суток (рис.1). Фрагментация и гемолиз эритроцитов, тромбоз сосудов наблюдались через 1 и 7 суток. Регенерация костной ткани отсутствовала до конца эксперимента.
Легкие. В контроле через 1 час после операции легкие неравномерно полнокровны, наблюдаются единичные точечные кровоизлияния под висцеральной плеврой, повсеместно венозный застой (макроскопические изменения).
На 1-3-и сутки эксперимента – легкие неравномерно полнокровны, увеличивается число точечных кровоизлияний на плевре, умеренный отек. К концу 7-х суток – легкие неравномерной плотности, с мелкими, местами сливающимися кровоизлияниями под висцеральной плеврой.
К 30-м суткам – легкие неравномерно полнокровны, наблюдается умеренный отек, кровоизлияния отсутствуют. При гистологическом исследовании: в легких через 1 час – гемолиз и деформация эритроцитов в сосудах микроциркуляторного русла, некроз эндотелиальных клеток и единичные мелкие тромбы и кровоизлияния.
На 1-е сутки нарастающий венозный застой, кровоизлияния, стаз и мелкие тромбы в сосудах, гемолиз эритроцитов и некроз эндотелия во всех полях зрения (рис. 2). На 3-е сутки сохраняются расстройства кровообращения. Гемолиз эритроцитов и некроз эндотелиоцитов определяются не во всех полях зрения, но в каждом третьем поле зрения микроскопа имеется перибронхиальная и периваскулярная лимфоидная инфильтрация.
К концу 7-х суток – умеренный венозный застой, отек, умеренный стаз эритроцитов в сосудах, определяются гиалиновые тромбы в единичных сосудах, но значительное расширение площади лимфоидных инфильтратов с формированием 1- 3 аттенуированных фолликулов.
На 30-е сутки снижается отек, нет деформированных эритроцитов, гемолиза и тромбов в мелких сосудах, исчезает периваскулярная, но остается перибронхиальная лимфоидно-макрофагальная инфильтрация с единичными лимфоидными фолликулами (рис.3).
Динамика изменений в лимфатическом узле легкого: через 1 час эксперимента уменьшение площади лимфатического узла на 10%. На 3-и сутки увеличивается площадь лимфатического узла на 30% с увеличением отношения ЛУ2/ЛУ1 на 15%, свидетельствующих об активной антигенной стимуляции. К концу эксперимента показатели наибольшие: отношение ЛУ2/ЛУ1 – 5,11±0.02, что свидетельствует о присоединении иммунного компонента воспаления в легком и его хронизации.
Динамика гистологических изменений в печени: в контрольной группе отмечается острое венозное полнокровие в центре долек, умеренно выраженный отек, гидропическая дистрофия единичных клеток на периферии долек печени. Процент альтерации гепатоцитов в дольке составляет 2,3±0,77.
В эксперименте: через 1 час после операции: балочное строение печени сохранено, имеется стаз в центральных венах и умеренный отек. Количество дистрофически измененных с бледными ядрами гепатоцитов в центре и на периферии дольки приблизительно равно и не превышает 6,15 ± 1,43%.
К концу 1-х суток в центральных венах и межбалочных капиллярах сохраняется стаз, незначительно нарастает альтерация – до некроза единичных гепатоцитов.
Процент поврежденных клеток в центре и на периферии дольки увеличивается до 11,5%.
На 30-е сутки в печени наблюдается стаз, гидропическая дистрофия вплоть до баллонной. В отдельных гепатоцитах в центре долек слабый стаз в портальных трактах. На месте погибших гепатоцитов определяются диссеминированные мелкие очаги из лимфоцитов, макрофагов. Процент альтерации в центральной и периферической части дольки не превышает соответственно 6±0,5% – 9±0,75% и становится ниже, чем в 1-е сутки.
Таким образом, на 3-и сутки эксперимента определяется токсическое повреждение гепатоцитов с максимальным нарастанием повреждения печени на 7-е сутки. К 30 суткам эксперимента по гистологическим и морфометрическим данным не определяется токсического повреждения печени, однако имеются очаги продуктивного гепатита.
Синхронно с регионарными лимфатическими узлами легких идет активная реакция регионарных лимфатических узлов печени, но начиная с 3-х суток эксперимента: ЛУ2 / ЛУ1 – повышается на 15%, на 7-е сутки – на 23%, на 30-е сутки – превышает контрольные показатели на 10%, что связано с сохраняющемся продуктивным воспалением на месте очагов токсического гепатита.
Результаты исследований показали, что имеется сопряженная реакция легких, печени и иммунных органов – лимфатических узлов на токсическое повреждение мономером метилметакрилата. В легких через час после введения метилметакрилата первично повреждаются сосуды микроциркуляторного русла с максимальной выраженностью к концу первых суток, что может привести к массивным кровоизлияниям в легких, способствует тромбозу и объясняет интраоперационную летальность больных. Некроз эндотелиоцитов, гемолиз эритроцитов менее выражен на 3-и сутки, но появляются периваскулярные и перибронхиальные лимфоидные инфильтраты, которые особенно проявляются на 7-е сутки эксперимента, а появление лимфоидных узелков указывает на присоединившийся иммунный компонент воспаления. На 30-е сутки заканчивается токсическое повреждающее действие мономера метилметатриксата, на что указывает отсутствие периваскулярных инфильтратов, деформации и гемолиза эритроцитов в сосудах, но сохраняется, хотя и менее выраженный, иммунный компонент воспаления, что необходимо учитывать при профилактике легочных осложнений. Токсическое повреждение гепатоцитов определяется на 3-и сутки эксперимента, максимальное повреждение печени выявлено на 7-е сутки. К 30 суткам – по гистологическим и морфометрическим данным токсическое повреждение печени не выражено, однако имеются очаги продуктивного гепатита.
Морфология активной антигенной стимуляции в регионарных лимфатических узлах в конце эксперимента отражает присоединение иммунного компонента воспаления и представляет угрозу его хронизации в поврежденных органах.
В легких максимальные показатели объемной плотности некроза эндотелия отмечены через 1 и 7 суток. Деструкция эпителия, фрагментация эритроцитов и тромбоз сосудов были максимальными через 7 суток. Воспалительные инфильтраты с лимфоидными узелками сохранялись до конца эксперимента. Бедренный лимфатический узел перестраивался из фрагментированного в компактный тип с 3-х по 7-е сутки. Наибольшая антигенная стимуляция отмечена через 1 и 7 суток; резкое снижение относительной площади тимус-зависимой зоны – с 7 суток до окончания эксперимента. Синхронно изменялись и аналогичные показатели в лимфатическом узле корня легкого.
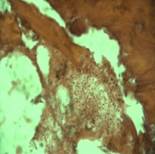
Рис. 1. Через 1 сутки костная ткань, соприкасающаяся с цементом, некротизирована и фрагментирована, костный мозг представлен некротическими тканями. Окраска гематоксилином и эозином. Х200
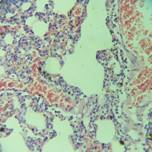
Рис. 2. В легких отек, стаз деформация эритроцитов в сосудах, деструкция эндотелия (12 час. эксперимента). Окраска гематоксилином и эозином. Х200
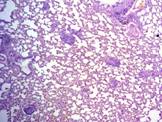
Рис. 3. 30-е сутки эксперимента. Перибронхиальные, периваскулярные воспалительные инфильтраты, формирование гранулем . Окраска гематоксилином и эозином. Х100
Таким образом, токсическое повреждение сосудов исследуемых органов может быть источником тромбоэмболии, прогрессирующего тромбоза в легком через 1 и на 7 сутки. Повреждение печени выражено на 1-е сутки с усилением к концу первой недели. Нарушение транспортной и иммунной функций лимфатических узлов является фактором хронизации воспаления в органах. Мономер метилметакрилата резко замедляет регенерацию кости
Рецензенты:
Бауэр И.В., д.м.н., зав. отделением травматологии и ортопедии Новосибирской государственной областной клинической больницы, г. Новосибирск;


Цементные и бесцементные компоненты эндопротеза тазобедренного сустава отличаются. Цементные ножки эндопротеза гладкие, а бесцементные – шероховатые. Цементные чашки изготавливаются из высокомолекулярного поперечно-связанного медицинского полиэтилена, а бесцементные делают из металлических сплавов с шероховатой наружной частью. Подробнее о том, какие бывают компонентны эндопротеза тазобедренного сустава вы можете прочитать в отдельной статье на нашем сайте (щелкните мышкой, чтобы перейти к этой статье).
Есть два компонента эндопротеза тазобедренного сустава, которые фиксируются к кости – ножка и чашка. Оба эти компонента могут быть цементными или бесцементными. Если один из них цементный, а другой – бесцементный, то такой эндопротез называют гибридным или реверс-гибридным.
Костный цемент используется в медицине уже более 50 лет, и он находит себе применение не только в эндопротезировании для фиксации компонентов эндопротеза к кости, но и в других специальностях (для пластики тел позвонков, в стоматологии и т.д.). Костный цемент заполняет пространство между эндопротезом и костью и формирует эластичную зону, которая работает не только как амортизатор, поглощающий удары, но и равномерно распределяет нагрузку по всей кости, окружающей эндопротез. Равномерное распределение нагрузки от эндопротеза к кости особенно важно для ножки эндопротеза тазобедренного сустава, которая, как правило, имеет неидеальную адаптацию своей формы к форме канала бедренной кости, что приводит к появлению зон повышенной и сниженной нагрузки (неравномерное распределение сил).
Костный цемент по своей химической сути является плексигласом, или, точнее, полиметилметакрилатом. Иногда костный цемент называют акриловым цементом. Впервые полиметилметакрилат в медицине применили в 1940-х годах для заполнения дефекта костей лицевого черепа. Оказалось, что полиметилметакрилат прекрасно уживается с тканями человека (тканевая совместимость), другими словами, ученые наконец-то нашли материал, который можно успешно использовать в костной хирургии, а ведь попытки найти такой материал велись еще в конце 19 века.
В настоящее время в мире ежегодно выполняется несколько миллионов цементных эндопротезирований суставов и такой способ фиксации эндопротеза очень надежен, а сама конструкция – долговечна.
Костный цемент, который используется для эндопротезирования тазобедренного сустава, поставляется в коробке, внутри которой есть пакетик с порошком (преполимеризованный полиметилметакрилат в смеси с аморфным порошком-инициатором) и ампула с жидкостью (метилметакрилат мономер, стабилизатор, ингибитор).

Две дозы костного цемента: ампулы с жидкостью (метилметакрилат мономер, стабилизатор, ингибитор) и порошок, высыпанный из двух пакетов (преполимеризованный полиметилметакрилат в смеси с аморфным порошком-инициатором)
На операции жидкость из ампулы выливают в порошок и перемешивают, после чего начинается процесс полимеризации – цемент сначала становится жидким, как тесто, а через 5-8 минут он твердеет. На ощупь затвердевший цемент напоминает камень, но в опытах с большой нагрузкой он ведет себя как твердая резина, т.е. обладает свойствами эластичности, амортизируя нагрузки.
Костные цементы различаются по вязкости (низкая, средняя и высокая).
Во время полимеризации костный цемент разогревается, причем чем толще слой цемента, тем выше эта температура. В эксперименте температура полимеризации достигает 120-140 градусов, но в теле человека она обычно повышается до 70-80 градусов за счет того, что толщина цементной мантии редко превышает 5 мм и, кроме того, цемент охлаждает кровь.
Важной особенностью костного цемента является то, что в него до полимеризации можно добавить порошок антибиотика, который в некоторых случаях снижает вероятность развития инфекционных осложнений.
Костный цемент выпускают те же фирмы, что и эндопротезы тазобедренного сустава (Zimmer, DePuy, Stryker, Smith&Nephew, Biomet, Aesculap и др.).
Крайне редко в процессе полимеризации цемента в организме может возникнуть грозное осложнение – синдром имплантации костного цемента, который проявляется в резком падении артериального давления, аритмии. К счастью, вероятность этого осложнения очень мала и по научным данным составляет 0,06-0,1%. Подробнее об этой проблеме интересующиеся могут почитать в статье Британского Журнала Анестезии.
Сейчас, к сожалению даже от многих хирургов можно услышать, что цементный эндопротез это плохо, а бесцементный – хорошо. На самом деле это не так. Цементные и бесцементные эндопротезы тазобедренного сустава неодинаковы, и каждый из ниж имеет свои плюсы и минусы. И если хирург говорит о том, что цементный эндопротез это плохо, то он либо лукавит, либо вообще не разбирается в эндопртезах. Во-первых, цементное и бесцементное эндопротезирование тазобедренного сустава зарождалось, формировалось и совершенстовалось практически обособленно друг от друга, цементное эндопротезирование преобладает в Европе (особенно Швеция, Норвегия, Великобритания), а бесцементное преобладает в США. В последние 10-15 лет эти шкаолы эндопротезирования смешиваются и в в Европе стали активнее использовать бесцементное эндопротезирование, а в США – цементное.
Например, в Швеции в 2005 году более 90% всех эндопротезирований тазобедренного сустава выполняется с использованием костного цемента, а в 2009 – более 80%. В Великобритании сейчас около 70% устанавливаемых эндопротезов являются цементными, и только 30% - бесцементными.
Согласитесь, что если в Великобритании и в Швеции цементное эндопротезирование используется так часто, то, скорее всего, оно не так уж и плохо, и не стоит так ругать цементные эндопротезы и думать что они плохие.

Данные шведского регистра эндопротезирования, который ведется с 1967 года. Используются цементные, бесцементные эндопротезы, гибридные (цементная ножка и бесцементная чашка), реверс-гибридные (цементная чашки и бесцементная ножка) и поверхностное (замена только части головки бедренной кости с сохранением шейки бедренной кости).
Еще раз повторимся, что у цементных и бесцементных эндопротезов есть свои сильные и слабые стороны, свои плюсы и минусы, и выбирать цементный или бесцементный эндопротез стоит индивидуально.
Возраст. Чем старше пациент, тем более предпочтительно цементное эндопротезирование. С возрастом прочность кости постепенно снижается (появляется остеопороз), и в таком случае лучше цементная фиксация.Четких границ, которые бы говорили о том, что, например, всем старше 60 лет нужно цементное эндопротезирование, не существует. В некоторых случаях цементный эндопротез будет оптимальным и у 40-летнего, а в другом случае и в возрасте 80 лет может подойти бесцементный эндопротез.
Пол. Прочность кости сильнее снижается у женщин из-за послеменопаузального остеопороза, поэтому цементный эндопротез предпочтителен женщинам после менопаузы. С другой стороны, если эндопротезирование выполняется на фоне артроза, то как правило, плоность кости в таком случае наоборот повышена.
Форма канала бедренной кости. Чем шире канал и чем тоньше стенки бедренной кости, тем более предпочтительно цементное эндопротезирование.
Чаще цементное эндопротезирование выполняется при переломах шейки бедра у пожилых, еще более оно актуально при несросшихся переломах шейки бедренной кости, незаменимо цементное эндопротезирование и в том случае, если оно выполняется на фоне инфекционных процессов, например, после остеомиелита (гнойного поражения кости), так как в цемент можно добавить антибиотик.

Конечно же, определять предпочтительный способ фиксации (цементный или бесцементный) в каждом индивидуальном случае должен врач.
Плюсы
Минусы
Цементный
эндопротез
Бесцементный
эндопротез
Автор статьи – кандидат медицинских наук Середа Андрей Петрович
Примечание 1: В месте самостоятельного отверждения может быть источником выпущенных реагентов ,
которые могут вызвать локальную и / или системную токсичность , как и в случае
мономера , высвобождаемого из methacrylics на основе костного цемента , используемого в
ортопедической хирургии.
Примечание 2: В стоматологии, на полимерной основе цементы также используются в качестве наполнителей
полостей. Они , как правило , отверждают фотохимически с помощью УФ - излучение ,
в отличие от костных цементов.
Костные цементы были использованы очень успешно для закрепления искусственных суставов ( тазобедренных суставов , коленных суставов , плечевые и локтевые суставы ) в течение более полувека. Искусственные суставы (называемые протезы) закрепляются костным цементом. Костный цемент заполняет свободное пространство между протезом и костью , и играет важную роль упругой зоны. Это необходимо потому , что человеческое бедро действует на примерно 10-12 раз больше веса тела и , следовательно , костный цемент должен поглотить силы , действующие на бедрах , чтобы гарантировать , что искусственный имплантат остается на месте в течение длительного времени.
Костный цемент химически не более , чем плексиглас (т.е. полиметилметакрилат или ПММА). PMMA клинически используется в первый раз в 1940 - х годах в пластической хирургии , чтобы закрыть пробелы в черепе. Всесторонние клинические испытания совместимости костных цементов с телом были проведены до их использования в хирургии . Совместимость отличная ткань ПММА позволило костных цементов , которые будут использоваться для закрепления головки протезов в 1950 - х годах.
Сегодня несколько миллионов процедур этого типа проводится каждый год во всем мире , и более половины из них обычно используют костные цементы - и эта доля растет. Костный цемент считается надежным анкером материалом с простотой использования в клинической практике , и в частности , из - за свою проверенную долгосрочную выживаемость с склеенными-в протезах. Хип и коленные регистры для искусственных суставов , таких как те , в Швеции и Норвегии наглядно демонстрируют преимущества металлокерамического в Анкоридже. Аналогичный регистр для эндопротеза был введен в Германии в 2010 году.
содержание
- 1 Композиция
- 2 Важная информация для использования костного цемента
- 3 Ревизии
- 4 Смотрите также
- 5 Ссылки
- 6 Внешние ссылки
Состав
Костные цементы представлены в виде двухкомпонентных материалов. Кость цементы состоят из порошка (т.е. предварительно полимеризованного ПММА и или ПММА или ММА совместно полимерных гранул и порошка или аморфного, радио-opacifer, инициатора) и жидкости (ММА мономера, стабилизатор, ингибитор). Два компонента смешивают и свободный радикальной полимеризации происходит из мономера , когда инициатор смешивают с ускорителем. В костном цементе вязкость изменяется с течением времени из жидкой жидкости в тесто , как состояние , которое может быть безопасно применяться , а затем окончательно затвердевает в твердый затвердевший материал. Установленное время может быть адаптировано , чтобы помочь врачу безопасно применять костный цемент в костном ложе либо якорные металлического или пластикового протез в кости или использоваться отдельно в позвоночнике для лечения остеопоротических компрессионных переломов.
В ходе экзотермической свободно-радикального процесса полимеризации, цемент нагревается. Это тепло полимеризации достигает температуры около 82-86 & deg ; С в организме. Эта температура выше , чем критический уровень для белковой денатурации в организме. Причина низкой температуры полимеризации в организме является относительно тонким цементным слоем, который не должен превышать 5 мм, а также рассеивание температуры с помощью большого протеза поверхности и поток крови.
Отдельные компоненты костного цемента также известны в области стоматологических материалов наполнителя. Акрилатная -А пластмасса также используется в этих приложениях. В то время как отдельные компоненты не всегда совершенно безопасны в качестве фармацевтических добавок и активных веществ , которые сами по себе, как костный цемент индивидуальные вещества либо преобразованы или полностью заключены в цементной матрице во время фазы полимеризации от увеличения вязкости до отверждения. Из современных знаний, вылечить костный цемент теперь могут быть классифицированы как безопасные, как это первоначально было продемонстрировано в ходе ранних исследований по совместимости с телом , проведенного в 1950 - х годах.
Совсем недавно костный цемент был использовать в позвоночнике в любой вертебропластике или Кифопластике процедур. Состав этих типов цемента, в основном , на основе фосфата кальция и более недавно фосфат магния. Разработан новый биоразлагаемый, не-экзотермической, самостоятельной установки ортопедической цемента композиция на основе аморфного фосфата магния (AMP). Возникновение нежелательных экзотермических реакций удалось избежать за счет использования AMP в качестве твердого предшественника
Важная информация для использования костного цемента
То , что упоминается как синдром имплантации костного цемента (BCIS) описан в литературе. В течение долгого времени считалось , что не полностью преобразованный мономером освобожден из костного цемента была причиной реакций кровообращения и эмболии . Однако, теперь известно , что этот мономер (остаточный мономер) является метаболизируется в дыхательной цепи и разбит на диоксид углерода и воду и выводится из организма. Эмболии всегда могут произойти во время закрепления искусственных суставов , когда материал вставляются в предварительно очищенном бедренный канал. Результатом является увеличение интрамедуллярная давление, потенциально вождения жир в кровообращение.
Если пациент, как известно, есть какая-либо аллергия на составляющие костный цемент, в соответствии с текущим костным цементом знания не должно использоваться, чтобы закрепить протез. Anchorage без цемента - имплантация бесцементной - это альтернатива.
Новые кости цементные составы требуют характеристики в соответствии с ASTM F451. Этот стандарт описывает методы испытаний для оценки скорости отверждения, остаточный мономер, механическую прочность, концентрацию перекиси бензоила, и выделения тепла во время отверждения.
Ревизии
Пересмотр является замена протеза. Это означает, что протез ранее имплантирован в тело удаляется и заменяется новым протезом. По сравнению с первоначальными версиями работы часто являются более сложными и более трудным, потому что каждая ревизия включает в себя потерю здоровой костной ткани. Ревизионные операции также являются более дорогими для получения удовлетворительного результата. Поэтому наиболее важной задачей является, чтобы избежать ревизии с помощью хорошей хирургической процедуры и использовать продукты с хорошими (в долгосрочной перспективе) результатов.
К сожалению, это не всегда возможно, чтобы избежать изменений. Там также могут быть разные причины для пересмотра и есть различие между септический или асептический пересмотра. Если необходимо заменить имплантат без подтверждения инфекции, например, асептический-цемент не обязательно удаляется полностью. Однако, если имплантат ослабла по септическим причинам, цемент должен быть полностью удален, чтобы очистить инфекцию. В текущем состоянии знаний это легче удалить, чем цемент, чтобы выпустить хорошо закрепленный Бесцементный протез с сайта кости. В конечном счете это важно для стабильности пересмотренного протеза для обнаружения возможного ослабления первоначального имплантат рано, чтобы быть в состоянии сохранить столько здоровой кость, насколько это возможно.
Протез фиксируется костным цемент обеспечивает очень высокую первичную стабильность в сочетании с быстрой ремобилизацией пациентов. Металлокерамический в протезе может быть полностью загружены очень скоро после операции, так как ПММА получает большую часть своей силы в течение 24 часов. Необходимая реабилитация сравнительно просто для пациентов, у которых был цементируется в протезом имплантировали. Швы могут быть загружены снова очень скоро после операции, но использование костылей еще требуется в течение разумного периода по соображениям безопасности.
Костный цемент оказалось особенно полезным, поскольку конкретные активные вещества, например, антибиотики, могут быть добавлены к компоненту порошка. Активные вещества высвобождаются локально после установки имплантата нового сустава, то есть в непосредственной близости от нового протеза и были подтверждены, чтобы уменьшить опасность инфекции. Антибиотики действуют против бактерий именно в том месте, где они необходимы в открытой ране, не подвергая организм в целом излишне высоких уровней антибиотиков. Это делает костный цемент современной системы доставки лекарственных средств, который обеспечивает необходимые лекарства непосредственно в место операции. Важным фактором является не то, сколько активное вещество находится в цементной матрице, но сколько активного вещества на самом деле выпущен локально. Слишком большое количество активного вещества в костном цементе будет на самом деле быть вредным, так как механическая стабильность фиксированного протеза ослаблена высокой долей активного вещества в цементе. Местные активные уровни вещества промышленного изготовления костных цементов, которые образуются за счет использования костных цементов, которые содержат активные вещества являются приблизительными (при условии, что не существует никакой несовместимости) и значительно ниже клинических доз для обычных системных единичных инъекций.
Распространено мнение, что цементные протезы хуже бесцементых, а их установка чаще вызывает осложнения. На самом деле это не так. Каждый из них имеет определенные достоинства и недостатки.
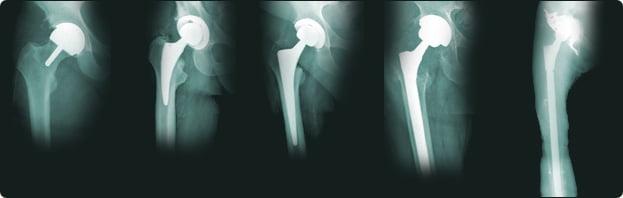
Цементные и бесцементные эндопротезы отличаются не качеством, а способом фиксации. Выбор варианта зависит от плотности кости, строения бедренной кости и возраста пациента.
Разница между цементным и бесцементным эндопротезирование
Основные отличия заключается в методе закрепеления импланта в кости. Сами импланты отличаются по материалу, покрытию и внешнему виду. Кроме цементных и бесцементных существуют еще реверс-гибридные эндопротезы.
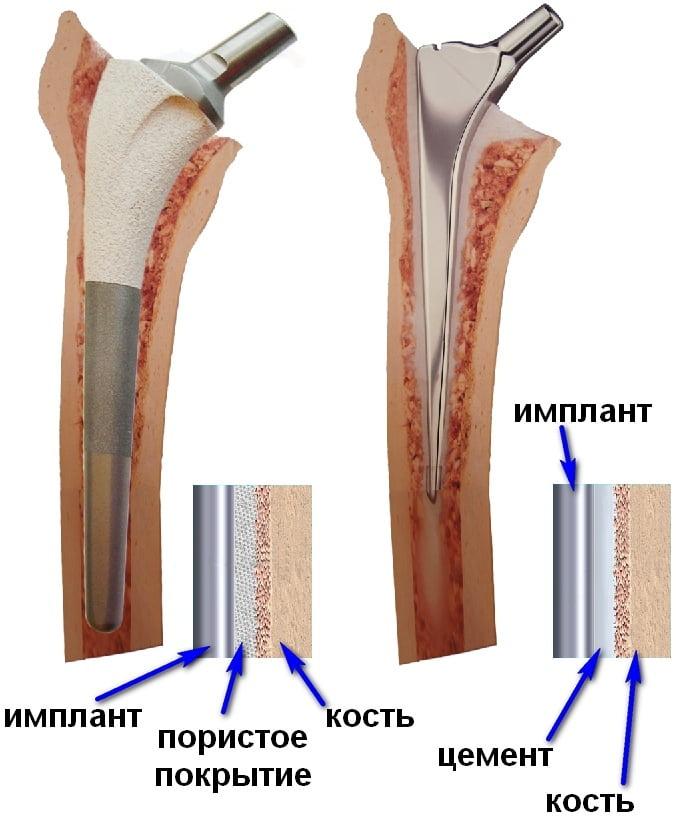
Виды имплантов по способу фиксации:
Таблица 1. Основные различия между цементными и бесцементными протезами.
| Характеристики | Цементный | Бесцементный | Гибридный |
| Способ фиксации | Посадка на фиксирующую субстанцию – полимерный цемент. | Вколачивание в костный канал по методу press fit после его обработки рашпилем. | Бесцементная установка бедренных компонентов и цементная фиксация остальных. |
| Материал | Ножки цементной фиксации делают из хром-кобальтового или кобальт-хром-молибденового сплава. Чашки производят из медицинского полиэтилена. | Эндопротезы из сплавов на основе титана (титан-алюминий-ванадиевый или титан-алюминий-ниобиевый). Примечательно, что в таких имплантах можно выбрать пару трения. | Отдельные фрагменты протезов могут изготавливать с разнообразных материалов. |
| Покрытие | Не имеют напыления. Поверхность таких имплантов обычно санируют или полируют. | Пористое или гидроксиапатитовое покрытие, облегчающее врастание. | Методика обработки поверхностей зависит от того, каким образом планируется устанавливать компоненты протеза. |
| Внешний вид | Имеют гладкую, полированную поверхность. | Обычно выглядят шероховатыми. | Могут иметь различный внешний вид. |
Как выбирают способ фиксации протеза
Успех эндопротезирования тазобедренного сустава в наибольшей степени зависит от мастерства хирурга и правильного подбора протеза. Логично, что хирург сам выберет имплант и способ фиксации.
Самый дорогой, качественный имплант могут установить неправильно, что в итоге приведет к неудовлетворительным результатам операции. А качественно имплантированный дешевый протез может служить десять лет.
Факторы, которые учитывают при выборе эндопротеза:
- Пол и возраст пациента. Пациентам моложе 55 лет лучше ставить бесцементные протезы. В имплантах с цементной фиксацией больше всего нуждаются женщины, из-за высокой частотой развития остеопороза в постменопаузальном периоде.
- Ширина канала бедренной кости. При узком канале врачи предпочитают эндопротезы с бесцементной фиксацией. Если кости тонкие и довольно широкий костный канал – ему ставят цементный протез.
- Плотность костной ткани. Для нормального врастания бесцементного импланта требуется хороший остеогенный потенциал. Если же у пациента низкая плотность костной ткани или имеется остеопороз – протез лучше зафиксировать цементом.
- Наличие переломов. Врачи считают, что при переломах лучше всего ставить цементный протез. Однако ведутся клинические исследования, в которых активно изучается эффективность установки имплантов с бесцементным типом фиксации.
Преимущества и недостатки методов фиксации
Несомненно, оба вида эндопротезирования имеют как преимущества, так и недостатки. Однако в целом исход операции зависит не только от стоимости и характеристик импланта. Как мы уже говорили: все в руках хирурга!
Таблица 2. Плюсы и минусы разных видов эндопротезирования.
Читайте также:


