Синдром двойной мышечной массы
В данной статье речь пойдет о миостатине, относительно недавно обнаруженном биологически активном веществе, которое оказывает существенное влияние на мышечный рост. Тема, касающаяся миостатина, очень актуальна в настоящее, и Рунeт буквально пестрит статьями о миостатине, но, к сожалению, они носят чаще всего фантастический характер. Постараюсь освятить ситуацию с миостатином через призму современных научных статей и исследовательских работ, а не популярных журналов и газет.
Вместе с многоядерными волокнами, в скелетных мышцах присутствует небольшое число одноядерных клеток, в числе которых имеются клетки, дифференцированные по мышечному типу. Эти клетки обычно называют сателлитными. Сателлитные клетки расцениваются как стволовые клетки, поскольку основное время своей жизни они находятся в покоящемся состоянии, но активируются и вступают в клеточный цикл после повреждения мышечной ткани. Установлено, что делящиеся потомки сателлитарных клеток способны участвовать в формировании новых мышечных волокон и образовывать клеточные культуры при выращивании их in vitro. Такие одноядерные мышечные клетки чаще всего обозначают термином миобласты.
Недавно полученные результаты свидетельствуют о том, что в мышцах взрослых особей существует, как минимум, две популяции стволовых клеток, одна из которых представлена типичными клетками сателлитами, а другую составляют так называемые мультипотентные стволовые клетки. И те и другие обуславливают мышечную гиперплазию.
Установлено, что и само возникновение поперечно полосатых мышц на ранних стадиях онтогенеза, и их дальнейшее развитие являются следствием многих молекулярных процессов, протекающих не только в самих мышечных клетках, но и в других тканях и органах организма. Эти процессы обеспечиваются рядом особых гормонов и ростовых факторов.
Большое число ученых, спортсменов и бодибилдеров любителей и просто людей, желающих иметь более совершенную фигуру, крайне заинтересованы в использовании подобных ростовых факторов. С их помощью можно добиться практически любых размерных, силовых и скоростных показателей за короткие сроки.
Надо заметить, что в течение последних десятилетий поиски средств восстановления и увеличения мышечной массы велись не только с применением низкомолекулярных анаболических и антикатаболических препаратов, а также биологически активных пищевых добавок, но и на уровне поиска генов ответственных за гомеостаз мышечной ткани.
Открытие миостатина стало логическим следствием бурного развития молекулярно-генетических методов и фактически совпало с началом формирования нового фронта исследований – функциональной геномики. Во второй половине 90 х был начат поиск в геноме мыши новых генов, которые способны кодировать белки, относящиеся к одному из наиболее важных семейств ростовых факторов, так называемых transforming growth factor ß family (TGFß).
Для этой цели были использованы полимеразная цепная реакция с праймерами, которыми стали олигонуклеотиды, комплементарные определенным консервативным участкам в последовательностях известных ростовых факторов данного семейства, а также ряд других молекулярно генетических методов. Далее продукты амплификации (длиной около 280 нуклеотидов) были использованы как зонды для скрининга кДНК библиотеки мышечной ткани мыши.
Переломным моментом в этих поисках стал 1997 год, когда под руководством Se-Jin Lee в Johns Hopkins University School of Medicine, Baltimore удалось выявить ДНК клон, содержащий открытую рамку считывания для последовательности в 376 аминокислот.
Анализ обнаруженной последовательности показал, что она обладает рядом особенностей, характерных для семейства TGFß. Таким образом, авторы вполне обоснованно стали рассматривать обнаруженную ими кДНК последовательность, как продукт гена, кодирующего новый белок из TGFß семейства, и назвали предсказанный продукт фактором TGF 8 (Growth and Differentiation Factor 8 или, в переводе, - фактор роста и дифференцировки N8), а позднее миостатин.
Однако наибольший интерес и внимание вызвали результаты экспериментов, направленных на выяснение функциональной роли TGF 8. Сначала конструирование мышей мутантов по гену миостатина показало, что такие животные по сравнению с обычными достигают существенно большего веса тела (135%).

При этом увеличение веса обеспечивалось практически за счет мышечной массы, и вес некоторых мышц у гомозигот более чем в 2 раза превышал вес аналогичных мышц у контрольных животных. Поперечное сечение миофибрилл у мышей нуль мутантов оказалось значительно большим, чем у мышей дикого типа (С57Bl), что указывало на развитие мышечной гипертрофии. В итоге авторы пришли к заключению о том, что миостатин (TGF 8) каким-то образом подавляет рост скелетных мышц, и именно поэтому предложили назвать этот фактор миостатином.


При анализе гена миостатина у Belgian Blue была обнаружена делеция в экзоне 3, охватывающая 11 нуклеотидов (позиции 937–947) и вызывающая сдвиг рамки считывания в функционально важной области, кодирующей зрелый миостатин. Грубо говоря, была выявлена мутация гена миостатина. Более того, у этих коров делеция оказалась в гомозиготном состоянии, то есть они являлись фактически нуль мутациями по гену миостатина, не способными к синтезу миостатина.
Имеются косвенные указания на то, что посттрансляционный процессинг промиостатина обеспечивает металлопротеиназа, действие которой блокируют специфические ингибиторы.
Установлено также, что "зрелый" миостатин секретируется в межклеточную среду и затем оказывается в плазме крови, где тестируется как myostatin immunoreactive protein. По имеющимся данным, основная часть циркулирующего в крови миостатина входит в состав особого белкового олигомерного комплекса, где кроме зрелого миостатина, присутствуют пропептид из 243 аминокислотных остатков (продукт процессинга промиостатина), фоллистатин и фоллистатин родственные белки, о которых речь пойдет позднее.
Как отмечалось ранее, особый интерес к миостатину возник в связи с тем, что уже в самых первых публикациях, посвященных этому фактору, был сделан вывод о том, что миостатин каким-то способом подавляет развитие скелетной мускулатуры, поскольку в его отсутствие наблюдается увеличение мышечной массы за счет гипертрофии и гиперплазии мышечных волокон. В последующем ученые отметили, что при определенных условиях блокирование действия миостатина приводит только к гипертрофии, но не вызывает гиперплазию мышц, тогда как другие авторы сообщили о миссенс мутации в гене миостатина, сопровождающейся гиперплазией мышц мыши при отсутствии признаков гипертрофии. По всей вероятности, эти материалы не столько противоречат друг другу, сколько указывают на сложность и многообразие механизмов, обеспечивающих влияние миостатина на скелетную мускулатуру.

Важно отметить, что по имеющимся данным при блокировании действия миостатина наблюдается не только увеличение мышечной массы, но и повышение силовых характеристик скелетных мышц. С другой стороны, при изучении биологических эффектов миостатина была выявлена корреляция между его высокой продукцией и дистрофическими изменениями скелетной мускулатуры (вплоть до кахексии). Эти результаты вполне соответствовали данным, полученным в опытах на моделях, в частности, на клеточных культурах, где удалось продемонстрировать ингибирование пролиферативной активности миобластов после внесения миостатина в культуральную среду.
Более того, было установлено (и для человека, и для многих высших млекопитающих), что миостатин тормозит синтез сократительных и других мышечных белков, в результате чего замедляется формирование скелетных мышц или возникает истощение (кахексия). Вследствие этого появилась гипотеза о том, что по принципу обратной связи миостатин, продуцируемый мышцами, играет роль специфичного физиологического регулятора их роста. Иными словами, миостатин был охарактеризован как один из важных факторов в поддержании равновесия сложных биохимических процессов, которые обеспечивают белковый обмен и связанные с ним процессы формообразования скелетных мышц (гипертрофия и гиперплазия в онтогенезе).
Возможно, у вас возникнет вопрос, а зачем вообще нужны эндогенные подавители мышечного роста, если как раз его многим и недостает? Резонный вопрос, и он уже даже ближе не к физиологии, а к философии, потому что напрямую касается основного закона диалектики "о борьбе и единстве противоположностей".
Дело в том, что физиология человека практически полностью подчиняется этому закону, все системы имеют две противоположности, они обеспечивают как высокую реактивность, так и постоянство внутренней среды организма. Особенно это актуально для гуморальной системы, где любой эффект обеспечивается двумя группами гормонов: первая группа обладает положительным действием, а вторая отрицательным. Казалось бы, что может быть достаточно одной группы, допустим, положительных. В случае с мышечной тканью в эту группу будут входить гормон роста, анаболические стероиды, инсулин и прочие гормональные субстанции с анаболическим эффектом. Однако практика показывает, что для того, чтобы система была максимально стабильной и в тоже время реактивной в адекватных пределах нужен диалектический противовес, и его роль исполняет миостатин, кортизол, минералокортикоиды (в какой-то степени) и другие, еще не открытые по мнению ученых гормоны, подобные миостатину.
Гормоны с отрицательным эффектом нужны для того, чтобы сдерживать потенциал, который может внезапно потребоваться в момент перемены условий внешней среды. В противном случае, анаболические гормоны будут приводить к постоянному росту мускулатуры, как бы мало их не было, а это с позиций эволюции и физиологии не всегда полезно для выживания.
Вернемся к механизму действия миостатина. С учетом особенностей структуры миостатина и его гена, которые предопределили включение данного фактора в семейство TGFß, появились предположения о том, что некоторые рецепторы, обеспечивающие работу других TGF факторов, могут передавать внутрь клетки и миостатиновый сигнал.
Позднее было показано, что функционирование многих членов семейства TGFß включает связывание с трансмембранными рецепторами, которые обладают серин/треонин протеинкиназной активностью и вызывают фосфорилирование так называемых Smad белков.
Для проверки предположения о существовании подобного механизма для миостатина и с целью выявления рецепторов, способных узнавать данный фактор и обеспечивать передачу его сигнала внутрь клетки, была проведена большая работа с использованием самых различных подходов – от создания трансгенных животных с нарушениями в функционировании определенных молекул мишеней, до прямого анализа связывания миостатина с предполагаемым рецептором в условиях конкуренции с другими факторами – антагонистами миостатина.
Первым этапом в этих поисках стали эксперименты с культивируемыми клетками, которые трансфецировали векторами, несущими полноразмерные последовательности, кодирующие различные рецепторы для факторов семейства TGFß, а точнее: TFGßRII, BMPßRII (для факторов BMP – Bone Morphogenetic Proteins), ActRIIA и ActRIIB. Оказалось, что только клетки, экспрессирующие ActRIIB, способны эффективно и специфически связывать рекомбинантный меченый миостатин. При этом заметно меньшее сродство данного лиганда наблюдалось к рецептору ActRIIA, а с остальными рецепторами связывания не регистрировалось. Соответственно, дальнейшие исследования сконцентрировались наизучении ActRIIB и ActRIIA
ActRIIB и ActRIIA ранее были охарактеризованы как рецепторы, работающие с особой группой факторов, относящихся к суперсемейству TGFß, – активинами и ингибинами, близкими по структуре белками, участвующими в различных видах клеточной дифференцировки.
Активины были открыты в конце 80 х годов по их способности активировать секрецию фолликулостимулирующего гормона, что и стало основанием для нескольких вариантов их названия.
Выполненные в последние годы многочисленные исследования структурных и функциональных свойств активинов убедительно показали, что эти регуляторные факторы участвуют в обеспечении различных молекулярных процессов у позвоночных, хотя ряд вопросов еще далеко не ясен.
Наряду с активинами, интенсивно изучаются очень близкие к ним по структуре факторы ингибины (димеры с молекулярной массой около 32 кДа), которые способны подавлять секрецию фолликулостимулирующего гормона.
В целом ряде работ было показано, что взаимодействие активина с рецепторами ActRIIB и ActRIIA может ингибироваться одноцепочечным белком, получившим название фоллистатин, который вначале был описан как фактор, способный блокировать действие фолликулостимулирующего гормона.

В дальнейшем было обнаружено еще несколько белковых факторов, родственных фоллистатину по строению и функциям, которые взаимодействуют с активинами. Таким образом, в настоящее время имеются достаточно веские основания рассматривать активины, ингибины, фоллистатины, родственные им белки и соответствующие рецепторы как одну из важнейших регуляторных систем в организме позвоночных, которая контролирует не только репродуктивную функцию (через фолликулостимулирующий гормон), но и многие другие процессы, в частности фоллистатин вызывает мышечный рост.
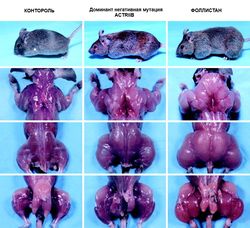
По этому поводу были проведены отдельные исследования, в ходе трансгенные животные, которым ввели генетическую конструкцию, продуцирующую фоллистатин, продемонстрировали впечатляющие развитие мышечной системы. У таких животных поперечное сечение мышечных волокон в среднем увеличивалось на 28% по сравнению с контролем (гипертрофия), а рост количества миофибрилл (гиперплазия) составил 66%.
Таким образом, удалось продемонстрировать, что избыточная продукция фоллистатина, по видимому, снижает активность миостатина и, в целом, ведет к тем же биологическим эффектам в мышечных тканях, которые достигаются при блокировании рецепторов ActRIIB. Эти данные вполне коррелируют с наблюдениями за мышами, которые имели нокаут мутации в гене фоллистатина. Эти животные характеризовались заметным снижением мышечной массы при рождении, множественными дефектами развития и быстрой гибелью в перинатальном периоде, что, возможно, отчасти связано с действием миостатина, полностью освобожденного от ингибирующего эффекта фоллистатина.
Знаменитая фотография "накачанной" борзой.

И Richard Sandrak у которого врожденная мутация гена миостатина, будучи еще ребенком имеет степень развития мускулатуры выше, чем у многих взрослых.

Flex Wheeler - известный бодибилдер.


Миостатин (также известный как фактор роста и дифференцировки 8) — белок, который подавляет рост и дифференцировку мышечной ткани. Образуется в мышцах, затем выделяется в кровь, оказывая свое действие на мышцы за счет связывания с рецепторами ACVR2B (activin type II receptor). Миостатин активен в мышцах, используемых для движения (скелетные мышцы) до и после рождения. Это обычно ограничивает рост мышц, гарантируя, что мышцы не становятся слишком большими. Миостатин оказывает влияние как на величину, так и на структуру мышечных волокон. Исследования на животных показывают, что блокирование действия миостатина приводит к значительному увеличению сухой мышечной массы с практически полным отсутствием жировой ткани.
Генетика
Ген, кодирующий миостатин, был обнаружен в 1997 генетиками Александрой Макпэрроной и Си-Джин Лином. Получив чистую линию мышей с неработающим геном миостатина, они доказали, что отсутствие гена миостатина вызывает значительное повышение мышечной массы. Аналогичные генетические аномалии встречаются у некоторых мясных пород коров, а также известны у уиппета и человека.
MSTN нанесен на карту 37 хромосомы собаки (CFA37) и состоит из трех экзонов. Он высококонсервативен среди видов и у человека расположен во второй хромосоме. Этот ген относится к семейству трансформирующих факторов роста β и кодирует протеин миостатин. Изучение MSTN у мышей демонстрирует, что этот ген является негативным регулятором скелетной мышечной массы. MSTN контролирует общее количество мышечных волокон, регулируя распространение миобласта. Недостаток протеина приводит к образованию большего количества мышечных волокон.
Мутация в гене миостатина (MTSN), который отвечает за мышечный белок, приводит к увеличению мышечной массы и улучшению скоростных показателей уиппетов. Как и люди, собаки имеют по 2 копии каждого гена: один наследуется от матери, второй – от отца. Доктор Ostrander и ее коллеги обнаружили, что уиппеты с одной мутированной копией миостатина и одной его нормальной копией более выносливы, чем обычные уиппеты и относятся к числу самых резвых собак в породе. Однако, их исследование также показало, что уиппеты с двумя мутированными копиями миостатина имеют чрезмерно большую мышечную массу и редко попадают в ряды конкурентноспособных бегунов.
Породы
Широкая распространенность мутации MTSN среди уиппетов является относительно недавним феноменом в эволюции собак, все это результат отбора при разведении. Для изучения возможного влияния данной мутации на мышечную массу и скорость у других пород исследователи взяли образцы ДНК собак 14 различных пород (бульмастиф, ротвейлер, бульдог, канарский дог, карликовый бультерьер, американский стаффордширский терьер и стаффордширский бультерьер), включая и грейхаундов. Полученные данные не выявили возникновения такой мутации среди других пород.
Грейхаунды и уиппеты имеют общий пул анцестральный (родовых) генов и как результат породы очень тяжело разделить при проведении генетического кластерного анализа. На ряду с тем фактом, что обе породы являются исключительными бегунами, предполагалось, что мутации будут обнаружены и у грейхаундов. Однако, ни один из исследованных грейхаундов не нес генной мутации. Есть три возможных объяснения такого результата. Во-первых, если предположить, что такая мутация встречается у грейхаундов очень редко, то мы взяли недостаточное количество примеров ДНК. Во-вторых, мутация может идти только по определенным линиям грейхаундов, которые не попали в данное исследование. И наконец, мутация вообще может и не происходить у грейхаундов, что говорит об относительно новой мутации в популяции породистых собак. Также может быть подобная мутация не приводит к преимуществам у беговых грейхаундов. А наоборот, может лишь быть недостатком собаки. Изучение строения мышц у мышей с поврежденным Mstn показало пропорционально больший объем волокон быстрого типа II и гликолитических волокон к объему волокон низкого типа I и окислительных волокон по сравнению с мышами дикого типа. Если такое изменение в структуре мышц может быть выгодно для уиппетов, которые обычно совершают забеги на короткие дистанции 200-300м, то грейхаундам, чьи забеги обычно составляют до 900м, такое изменение может стать недостатком, так как им больше нужна выносливость. К тому же, у коров породы Belgian Blue с гомозиготностью в MSTN мутации, было обнаружено уменьшение некоторых органов, включая и легкие. Если гетерозиготной собаке даже немного уменьшить объем легких, то возможно мутация в MSTN будет большим недостатком для бегунов на длинные дистанции, каковым и есть грейхаунд. И в конце, необходимо напомнить, что с данной мутацией могут быть связаны и другие еще не изученные проблемы со здоровьем.
Симптомы


Собаки с избыточной мышечной массой, называемые заводчиками булли-уиппет, имеют широкие челюсти, необычайно развитую мускулатуру ног и шеи. Владельцы таких собак утверждают, что у них нет других аномалий со здоровьем, кроме как судорог в плечах и бедрах. Однако, таких собак зачастую усыпляют еще в раннем возрасте, т.к. они не соответствуют стандарту. К тому же около 50% булли-уиппетов имеют характерный перекус.
mh/+ генотип были обнаружен у самых быстрых собак, что подтверждают их беговые показатели, полученные в течении беговой карьеры собаки. Это демонстрирует, что гетерозиготность приводит к увеличению выносливости. Собаки-носители одной мутации mh/+ замечательно показали себя в соревнованиях, однако эти собаки получили низкие балы на выставке.
Содержание
- 1 Миостатин (GDF-8)
- 2 Блокаторы миостатина
- 2.1 Блокатор миостатина MYO-029 (Stamulumab)
- 2.2 Элементы рецепторов ACVR2B как блокаторы миостатина
- 2.3 ACE-031
- 2.4 Модифицированные пропептиды миостатина
- 3 Выводы для спортсменов
- 4 Блокаторы миостатина в спортивном питании
- 4.1 Эффективные блокаторы миостатина
- 4.2 Никотин - активатор миостатина
- 5 Читайте также
- 6 Предупреждение
- 7 Примечания
Миостатин (GDF-8) [ править | править код ]
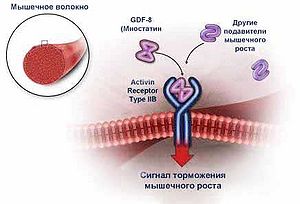
Миостатин (также известен как фактор дифференциации роста 8 или GDF-8) - синтезируемый внутри организма пептид, который подавляет рост и дифференцировку мышечной ткани. Миостатин образуется в мышцах и затем выделяется в кровь, оказывая свое действие на мышцы за счет связывания с рецепторами ACVR2B (activin type II receptor). [1] У человека миостатин закодирован в гене MSTN. [2]
Исследования на животных показывают, что блокирование действия миостатина приводит к значительному увеличению сухой мышечной массы с практически полным отсутствием жировой прослойки. [3]

Бельгийская голубая - порода с мутацией гена миостатина

Борзая с мутацией гена миостатина

Знаменитый бодибилдер Flex Wheeler с врожденной мутацией гена миостатина

Мальчик 12 лет, как утверждалось с мутацией гена миостатина

Слева Ричард Сандрак в 12 лет, справа в 24 года: мышцы исчезли, когда он перестал тренироваться
Блокаторы миостатина [ править | править код ]
В настоящее время ведется разработка целого ряда блокаторов действия миостатина, 
однако на настоящий момент нет ни одного препарата одобренного к применению на людях.
Wyeth Pharmaceuticals в 2002 году начала разработку препарата MYO-029 (Stamulumab) - рекомбинантные антитела, которые связываются с миостатином и блокируют его эффекты.
В начале 2005 года Wyeth Pharmaceuticals при дополнительном финансировании MDA начала фазу 1-2 клинических исследований безопасности и переносимости MYO-029 (Stamulumab) на 116 испытуемых. Данные клинических испытаний были опубликованы только в январе 2008 года.
Препарат показал себя безопасным и хорошо переносимым в трех различных дозировках, о чем сообщено в отчете, опубликованном Kathryn Wagner с коллегами из Johns Hopkins University School of Medicine в Baltimore в журнале Annals of Neurology [4]
Однако в марте 2008 года, после окончания клинических испытаний компания объявила о приостановке развития проекта MYO-029 (Stamulumab), так как ни у кого из участвующих в исследовании не было статистически значимого улучшения силы или роста мышц.
Большой потенциал имеет новый препарат ACVR2B, который представляет собой раствор элементов рецепторов к миостатину. Молекулярные элементы ACVR2B имеют участок, схожий с активным центром рецептора и связываются со свободным миостатином, блокируя его способность активировать рецепторы. Данный препарат был создан в 2005 году, под руководством все того же доктора Se-Jin Lee, Johns Hopkins University School of Medicine в Baltimore. Se-Jin Lee надеется, что ACVR2B может использоваться в ближайшем будущем и на людях, тогда как по состоянию на 2005 год он уже доказал высокую эффективность на лабораторных мышах. Команда доктора Se-Jin Lee апробировала различные дозы ACVR2B на 49 мышах и зафиксировала мышечный прирост после четырех недель применения препарата. Максимальные показатели мышечного прироста были достигнуты при двух инъекциях в неделю, в дозировке 50 мкг на килограмм массы тела. Мышечная масса этих мышей увеличилась на 61% по сравнению с исходной. [5]
ACE-031 еще один перспективный препарат класса блокаторов миостатина, он представляет собой раствор экстрацеллюлярных частей рецепторов ActRIIB соединенных с Fc фрагментом иммуноглобулина G. Путем блокирования сигнала через рецептор ActRIIB, препарат увеличивает мышечную массу и силу. Предварительные испытания ACE-031 продемонстрировали высокую эффективность на экспериментальных моделях с животными.
Клинические испытания ACE-031 для лечения миодистрофии были прекращены в мае 2013 года в связи с развитием побочных эффектов (дилатация сосудов кожи, кровотечения из носа и десен). [6] В продаже доступны кустарные препараты от китайского производителя.
В качестве еще одного блокатора миостатина предложены модифицированные пропептиды миостатина , в частности мутированный пропептид миостатина D76A. Механизм действия препаратов весьма интересен. До тех пор, пока незрелый миостатин (предшественник миостатина) не подвергнется модификации под влиянием металлопротеиназы, он не будет оказывать свое действие. Применяя мутированные пропептиды миостатина, типа D76A происходит необратимое или частично-необратимое связывание с металлопротеиназой, после чего посттрансляционный процессинг промиостатина прекращается, а проще говоря, не образуется зрелый миостатин.
Пробы проводились только на животных, и данных о применении препаратов данной группы на людях пока нет.
Выводы для спортсменов [ править | править код ]

В настоящее время нет возможности полноценного применения препаратов или добавок действующих, как антагонисты миостатина поскольку:
1. Недостаточная доказательная база. Многие исследования дают диаметрально противоположные выводы, поэтому пока достоверных данных в этой области очень мало.
2. Побочные эффекты. Сейчас еще рано судить о безопасности выключения действия миостатина. Возможно, это может приводить к отсроченным осложнениям различного рода, к примеру, гипертрофия миокарда. Так же последние работы показали, что интенсивный мышечный рост приводит к увеличению частоты травм связочного аппарата, который остается на таком же уровне развития и рассчитан на относительно меньшие нагрузки.
3. Низкая селективность. Как уже было замечено, миостатин является частью очень обширной метаболической системы, где многие элементы имеют схожее строение и дублируют функцию других. Применяя препараты, ингибирующие действие миостатина, можно получить сбой в работе других элементов метаболической системы. Иными словами, учитывая довольно широкий диапазон компетенции данной метаболической системы, помимо мышечного роста существует вероятность многочисленных серьезных побочных эффектов со стороны всех систем органов и тканей.
Блокаторы миостатина в спортивном питании [ править | править код ]

В то время, как в научном мире идут ярые споры и активно ведутся испытательные работы, мир спортивной индустрии активно производит абсолютно безопасные и "эффективные" блокаторы миостатина.
Myo-Blast, по заявлению производителя, содержит самую высокую дозу наиболее мощного средства миостатин-нейтрализующего средства, известного как — Myozap CSP3.
Выдержка из описания:
Myozap CSP3 - торговое название патентованной состава для нейтрализации миостатин-белка. Этот экстракт получен из экзотического морского растения (Cystoseira canariensis) и был сначала обнаружен в течение научных исследований, проводимых исследователями биохимии в Las Palmas Университет в Испании. Как только Вы начинаете нейтрализовать миостатин, начинается рост новых мышечных клеток. С помощью этого спортивного питания, новые клетки мышцы увеличиваются в размере и образуют новые волокна мышечной ткани. Каждое новое волокно, фактически представляет потенциал для дополнительной новой мышцы, сверх тех, что Вы уже имеете. И эти многие новые мышечные волокна в конечном счете формируются в вашем теле, давая Вам возможность преодолеть генетический порог, заданный миостатином.
Myostat, Myo-T12 и пр. имеют похожее описание и то же самое действующее вещество - Cystoseira canariensis.

Несмотря на эти громкие слова, данные добавки абсолютно неэффективны. В настоящее время нет ни одной добавки, которая бы влияла на обмен миостатина.
1. Исследования, проведенные Джорджеи Ниффисом, профессором из Института Национального Здоровья (США, штат Огайо), выявили, что все качества, приписываемые спортивному питанию на основе Cystoseira canariensis - не более, чем рекламный ход. В процессе эксперимента выяснилось, что даже в количестве в 50 раз больше рекомендуемого эти добавки не оказали никакого существенного влияния на рост мышечной массы.
2. Все современные антагонисты миостатина белковой природы, поэтому они не принимаются внутрь, так как в этом случае активное вещество было бы неминуемо разрушено пищеварительными ферментами.
В 2009 году было опубликовано исследование, проведенное иранскими учеными. Они выявили, что миостатин в значительной степени подавляется при дополнительном приеме креатина. [7]
Hulmi JJ и Tannerstedt J доказали, что протеин блокирует синтез миостатина при систематическом употреблении тренирующимися людьми. [8]

Исследованием, проведенном учеными Ноттингемского университета, установлено, что активность синтеза мышечных белков у курильщиков оказалась значительно ниже, чем у некурящих. Кроме того, в организме любителей никотина гораздо выше уровень белка миостатина и фермента MAFbx. Первый из них просто задерживает мышечный рост, а второй – расщепляет белки мышц. [9]
Читайте также [ править | править код ]
- Гормон роста
- Фоллистатин
- Анаболические стероиды
- Силодрол (Silodrol)
Предупреждение [ править код ]

Анаболические препараты могут применяться только по назначению врача и противопоказаны детям. Представленная информация не призывает к применению или распространению сильнодействующих веществ и нацелена исключительно на снижение риска осложнений и побочных эффектов.
Читайте также:


