Что нового в лечении системной красной волчанки

В последние годы настоящей сенсацией стало сообщение о регистрации FDA нового биологического препарата для лечения системной красной волчанки – белимумаба.
Белимумаб – первый генно-инженерный биологический препарат (ГИБП), специально созданный для лечения волчанки, что явилось одним из наиболее крупных достижений ревматологии за последние 50 лет.
Механизм действия Белимумуба очень сложный. Если кратко и упрощенно, то особый интерес исследователей вызывал В-лимфоцитарный стимулятор (B-lymphocyte stimulator – BLyS). В клинических исследованиях показано, что у пациентов с системной красной волчанкой наблюдается увеличение концентрации BLyS в сыворотке, коррелирующей с концентрацией антител к двуспиральной ДНК и динамикой активности заболевания. Эти данные и послужили теоретическим обоснованием для разработки анти-BLyS-препаратов, в первую очередь белимумаба, для лечения СКВ.
Официальные показания для назначения белимумаба при системной красной волчанки:
- умеренная или высокая активность заболевания,
- наличие выраженных иммунологических нарушений (положительные результаты определения антинуклеарного фактора и/или антител к ДНК),
- недостаточная эффективность стандартной терапии.
Белимумаб обычно хорошо переносится, наиболее частыми нежелательными явлениями являются инфекционные осложнения, боль в суставах, головная боль, диарея, тошнота. Очень редко отмечаются тяжелые инфекции и депрессия.
На основании широкомасштабного исследования эффективности белимумаба в реальной клинической практике, результаты которого были доложены на X Международной конференции по системной красной волчанке (Буэнос-Айрес, Аргентина, 18–19 апреля 2013 г.), показана высокая эффективность белимумаба у 501 больного СКВ. Применение белимумаба в течение 6 месяцев приводило к улучшению у 57–65% больных с высокой и средней активностью болезни. У 77% больных, получавших белимумаб, удалось значительно снизить дозу гормонов, а у 9% полностью отменить их. Терапия белимумабом приводила к уменьшению частоты обострений, госпитализаций, снижению показателей активности системной красной волчанки. Первые признаки улучшения, как правило, наблюдаются на 8-й неделе терапии: уменьшение чувства усталости, снижение индексов активности системной красной волчанки. Более выраженное улучшение наблюдается к 12–16-й неделе.

Показания для назначения белимумаба при СКВ в клинической практике:
- Недостаточная эффективность предшествующей терапии в течение по крайней мере 3 месяцев.
- Высокая или средняя активность СКВ.
- Необходимость назначения гормональных препаратов или их комбинация с цитостатиками для поддержания ремиссии.
- Противопоказания для назначения одного из цитостатиков или необходимость назначения цитостатиков в дозе, превышающей рекомендованную.
- Высокий уровень антител к ДНК, низкий уровень комплемента.
- Поражение кожи, суставов, мышц, слизистых оболочек, тромбоцитопения, прогрессирующие на фоне стандартной терапии.
- Нефрит с низкой степенью клинической и морфологической активности.
Основные цели терапии:
- снижение активности заболевания;
- предотвращение рецидивов появления активности;
- снижение суточной дозы гормональных препаратов;
- снижение риска развития необратимых повреждений органов;
- улучшение качества жизни.
Вот такие сегодня новости. А реальный дневник пациентки на Белимумабе можно почитать здесь. К сведению, разработка новых и эффективных препаратов продолжается. Будем внимательно следить 🙂
- 19174
- 14,9
- 4
- 4
![]()
Ольга Георгинова
![]()
Антон Чугунов![]()
Андрей Панов
- Аутоиммунитет
- Иммунология
- Фармакология
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
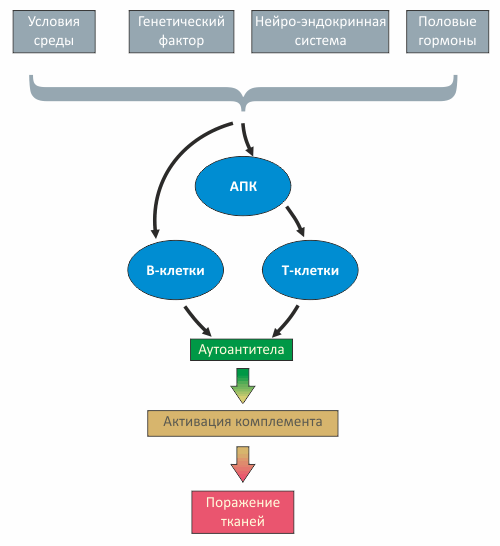
Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Для лечения СКВ применяют также препарат моноклональных антител, селективно действующий на CD20 + В-лимфоциты, — ритуксимаб, зарегистрированный FDA для лечения неходжкинской лимфомы. Впрочем, высокая цена этого препарата не позволила ему получить широкого применения при лечении СКВ в нашей стране.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Профессор М. М. Иванова (Институт ревматологии РАМН)
Несмотря на то, что прогноз системной красной волчанки (СКВ) в последние годы значительно улучшился, лечение этого заболевания остается весьма трудной задачей. Это обусловлено большой вариабельностью течения болезни, необходимостью подбирать адекватное активности болезни лечение в соответствии с органной патологией, разрабатывать так называемую поддерживающую терапию, чтобы избежать обострений и прогрессирования болезни.
Оценка результатов
Выживаемость больных СКВ значительно изменилась в течение последних 4 десятилетий: в 1959 г. 5-летняя выживаемость составляла менее 50 %, а к 90-м годам она достигла более 90 %. К 1998 г. 20-летняя выживаемость больных СКВ составляет 70 %. Основные причины улучшения прогноза больных СКВ — ранняя диагностика и разработка методов лечения с умелым применением ГКС, иммунодепрессантов, а также совершенствование терапевтических программ, включающих экстракорпоральные методы лечения, современные препараты, подавляющие отдельные симптомы болезни (гипотензивные, антитромботические, антибиотики и др.).
Методы терапии
Оптимальные методы терапии разрабатывались на протяжении многих лет. Уже в первые годы работы Института ревматологии под руководством В.А.Насоновой были разработаны адекватные методы лечения СКВ глюкокортикостероидами (ГКС), когда удалось значительно увеличить продолжительность жизни больных, ранее обреченных [Насонова В.А. и др., 1968]. В последующие годы программа лечения ГКС неуклонно совершенствовалась, однако глюкокортикостероиды по сей день составляют основу лечения СКВ.
Лекарственные формы ГКС совершенствовались на протяжении многих лет. Наиболее удобным при СКВ остается преднизолон, особенно 6-метилпреднизолон (урбазон, медрол, солюмедрол), минимально влияющий на водно-минеральный обмен. Введение фтора в молекулу преднизолона позволило создать новые ГКС (триамсинолон, дексаметазон, бетаметазон), которые используют при плохой переносимости преднизолона или его неэффективности в острой фазе СКВ. Однако для длительного применения они оказались малопригодными из-за быстрого развития ожирения, артериальной гипертонии (дексаметазон), миопатии (триамцинолон).
Дозировка
Дозировки ГКС на протяжении многих лет подбирались эмпирически. В большинстве случаев при высокой активности СКВ адекватной оказывается суточная доза преднизолона, составляющая 1 мг/кг массы тела. При гломерулонефрите и острых церебральных нарушениях, гематологическом кризе суточная доза может быть и выше (до 80—100 мг). Практически всем больным ГКС назначаются внутрь, так как они быстро и почти полностью всасываются в желудочно-кишечном тракте.
Пероральный прием является наиболее эффективным путем введения ГКС. Укрепилось мнение о том, что ГКС следует давать больным СКВ в течение многих лет, в основном пожизненно, переходя с высоких доз в фазе активности к поддерживающим (7,5—5 мг) и сохраняя эту дозу даже в период клинической ремиссии. Лишь в редких случаях ГКС приходится вводить внутримышечно, увеличивая при этом дозу в 3—4 раза по сравнению с пероральной.
Новую эру в лечении СКВ открыла пульс-терапия — внутривенное введение метилпреднизолона по 1000 мг в день в течение 3 дней. Метод оказался весьма эффективным у некурабельных ранее больных СКВ и успешно применяется в Институте ревматологии РАМН на протяжении последних 15 лет. Пульс-терапию проводят при активном люпус-нефрите, гематологическом кризе, острых нейропсихических расстройствах. Если в таких случаях диагноз СКВ не вызывает сомнений, не следует ждать, пока другая терапия окажется неэффективной. Поначалу показания к пульс-терапии были очень строгими. Так, например, считалось, что у больных с активным люпус-нефритом можно применять метилпреднизолон в сверхвысоких дозах лишь при наличии клеточной пролиферации в биоптате почки, подобной таковой при кризе отторжения.
По мере накопления опыта изменилась и методика проведения пульс-терапии. Классическая пульс-терапия (по 1 г внутривенно в течение 3 дней) не всегда бывает достаточной. При активном люпус-нефрите мы проводили повторные курсы пульс-терапии метилпреднизолоном по 1000 мг (иногда 2000 мг) ежемесячно в течение 6—12 мес. Тактика ведения больных с активным люпус-нефритом очень сложна. Возможность быстрого снижения пероральной дозы преднизолона после пульс-терапии не подтвердилась в связи с ухудшением состояния у некоторых больных, прогрессированием почечного синдрома (в том числе быстрым снижением скорости клубочковой фильтрации).
Вскоре после освоения метода пульс-терапии и оценки ее первых результатов мы изменили тактику лечения после завершения внутривенного введения метилпреднизолона. В последующие 4 нед продолжается лечение ГКС в достаточно высокой дозе внутрь (40— 50 мг преднизолона в сутки). У части больных-при недостаточной эффективности трехдневной пульс-терапии мы вводили метилпреднизолон внутривенно по 250 мг/сут еще 2—3 нед, что значительно повышало эффективность применения сверхвысоких доз ГКС при люпус-нефрите.
Фармакокинетические исследования показали, что концентрация метилпреднизолона в плазме уже через 1 ч достигает максимума, а затем быстро снижается в течение 6—7 ч. Через 4 дня в периферической крови обнаруживают только следовые количества метилпреднизолона, чего явно недостаточно для достижения стойкого эффекта. О пересмотре механизма действия сверхвысоких доз метилпреднизолона сообщают Е.Л.Насонов и соавт.
Пульс-терапия не только значительно снижает содержание активаторов воспаления, высвобождение вазоактивных веществ и их повреждающее действие на ткань почки, но и улучшает функцию почек за счет влияния на физиологические факторы (улучшение почечного кровотока, снижение общего периферического сосудистого сопротивления). Стимулируя почечный кровоток, метилпреднизолон в ударных дозах предотвращает сладж-феномен в капиллярах клубочков, характерный для активного люпус-нефрита. Наши наблюдения подтвердили, что внутривенное введение метилпреднизолона может несколько улучшить функциональную способность почек и при хронической почечной недостаточности, если имеются признаки активности нефрита, что можно объяснить уменьшением воспалительного процесса и активацией компенсаторных вазодилатационных механизмов.
Пульс-терапию метилпреднизолоном следует индивидуализировать, учитывая возраст, особенности висцеральной патологии: у больных старшего возраста при давней болезни, артериальной гипертонии, поражении миокарда целесообразно изменить дозировку препарата (250—500 мг/сут в течение 8—10 дней). Многолетнее наблюдение показало, что в день проведения пульс-терапии следует в вечерние часы сохранять прием 1/4 суточной дозы преднизолона per os.
Таким образом, тактика применения ГКС при СКВ за прошедшие десятилетия претерпела значительные изменения. Наиболее оправданным является применение препаратов метилпреднизолона, которые даже при длительном лечении реже вызывают побочные реакции.

Возможно, что на одну неизлечимую болезнь станет меньше
Как вылечить волчанку?
Результаты международного крупного исследования, которое длилось на протяжении 3 лет, и в котором участвовало более 360 человек в возрасте от 18 до 70 лет с системной красной волчанкой, показало, что болезнь все же может поддаваться лечению. Многолетняя работа международной группы ученых, о которой пишут в издании EurekAlert, должна изменить ситуацию для миллионов пациентов. Финальная фаза исследований показала, что лекарственное средство анифролумаб (anifrolumab) является эффективным для лечения волчанки у людей.
Анифролумаб представляет собой человеческие антитела, которые чувствительны к белку интерферону первого типа, провоцирующему воспаление в организме при волчанке. Лечение анифролумабом блокирует рецепторы этого интерферона во всех клетках организма, снижая активность заболевания. — говорят авторы исследования.
Клинические испытания были поделены на два этапа — TULIP 1 и TULIP 2, которые проводились в период с 2015 по 2018 годы. Результаты первого этапа, представленные в прошлом году, не показали статистической значимости в снижении активности заболевания у людей при приеме анифролумаба по сравнению с пациентами из группы плацебо. И тогда исследователи уже почти отчаялись. Но все же решились на вторую фазу испытаний. И их ждал неожиданный результат. Если вам интересна данная тема, то подписывайтесь на наш канал в Телеграм.
Во время второй фазы, TULIP 2, участникам внутривенно вливали 300 миллиграммов анифролумаба каждые четыре недели в течение 48 недель. Через 52 недели после начала лечения у большинства участников было зафиксировано общее снижение активности заболевания во всех органах, улучшение состояния кожи. Более того, пациентам также потребовалсь принимать меньше стероидных препаратов (показанных при волчанке), а с течением времени врачи наблюдали у участников опыта снижение годового темпа вспышек заболевания, которые включали лихорадку, болезненность и опухание суставов, усталость, сыпь и язвы во рту или в носу.
Теперь команда планирует получить разрешительную документацию, после чего нужно будет дождаться проверки препарата организациями по контролю вроде той же FDA (Food and Drug Administration). Если все эти этапы пройдут успешно, то лекарство появится в широкой продаже. О стоимости препарата, кончено же, ничего не известно, но хочется надеяться, что оно будет доступным для простых людей. Ведь согласно данным Всемирной организации здравоохранения, во всем мире более 5 миллионов человек (среди которых 90% — это женщины) страдают от этой болезни, для которой нет никакого лечения.

Человеческий организм — сложнейшая система, которая преподносит совершенно неожиданные и порой очень пугающие сюрпризы. Недавно офтальмологи из индийского города Нью-Дели рассказали о 14-летней девочке, у которой из глаз неожиданно начала литься кровь. По словам ее матери, имя которой держится в секрете, красные полосы крови стекают по щекам ребенка на протяжении нескольких минут по 2-3 раза […]


Бактерии, вирусы и различные паразиты беспокоили человечество на протяжении всей его истории. За примерами далеко ходить не надо, вспышка коронавируса в 2020 году — яркое тому подтверждение. Но микроорганизмы также изменили жизнь (при этом не всегда в худшую сторону) и повлияли на нашу эволюцию. Например, паразиты помогли нашей иммунной системе обрести необходимый стимул и стать […]
Войти через uID
Системная красная волчанка (СКВ) — аутоиммунное ревматическое заболевание, в основе патогенеза которого лежат дефекты иммунорегуляции, приводящие к неконтролируемой гиперпродукции антинуклеарных аутоантител к компонентам ядер и цитоплазмы клеток собственных тканей и развитию хронического воспаления, затрагивающего многие органы и системы.
СКВ — хроническое полисиндромное заболевание преимущественно молодых женщин и девушек.
По МКБ-10 — М32 Системная красная волчанка.
Название болезнь получила из-за своего характерного признака — сыпи на переносице и щеках (поражённый участок по форме напоминает бабочку), которая, как считали в Средневековье, напоминает волчьи укусы.
Эпидемиология. Точных сведений о распространенности СКВ в нашей стране нет. В США она составляет 48 случаев на 100000 жителей.
Этиология. Конкретный этиологический фактор при СКВ не установлен. Наиболее признана роль вирусной инфекции.
Основания: в крови больных обнаружено повышение титров AT к ряду РНК-содержащих вирусов (кори, краснухи, парагриппа и др.), а также к ДНК-содержащим герпетическим вирусам, таким, как ВЭБ, вирус простого герпеса; в эндотелии тканей пораженных органов находят вирусоподобные включения.
Обнаружена семейная предрасположенность к СКВ, конкордантность в заболеваемости СКВ у 50% гомозиготных близнецов, а наличие антиядерных AT выявляют у 2/3 близнецов.
При СКВ чаще, чем в контроле, встречаются антигены HLA A11, В7, имеется повышение содержания антигенов HLA групп DR2 и DR3, а они связаны с функцией иммунного ответа.
В последние годы находят все больше подтверждений генетической природы СКВ.
Так исследователи из Колорадо обнаружили ген Ifi202, который ответствен за развитие СКВ, более слабый вклад в развитие этого заболевания вносят также другие гены.
Например, определенные варианты гена маннозо-связывающего лектина — сывороточного белка, участвующего в иммунном ответе организма, увеличивают риск артериального тромбоза (и инфаркта миокарда, в частности) у пациентов с СКВ.
Патогенез. СКВ — иммунокомплексное заболевание, для которого характерна неконтролируемая продукция AT. Центральное звено — утрата толерантности к аутоантигенам. АутоАТ принимают участие в образовании ИК, которые, в свою очередь, обусловливают появление и развитие различных признаков болезни, особенно поражение почек и ЦНС. Циркуляция множества AT связана с гиперреактивностью В-клеток, продуцирующих эти AT.
В крови и костном мозге возрастает число клеток, секретирующих различные Ig. Неконтролируемая продукция AT происходит как из-за спонтанной гиперреактивности В-клеток, так и вследствие гиперфункции Т-хелперов (С04-лимфоциты) на фоне дисфункции CDS-лимфоцитов.
При СКВ обнаруживают значительное количество противотканевых AT, а также ИК, обладающих противоорганными детерминантами к различным органам. В частности, обнаружены противосердечные, противокардиолипидные, противопочечные и другие AT, а также AT, направленные против отдельных элементов крови, т. е. антилейкоцитарные, антитромбоцитарные и антиэритроцитарные.
Клиническая картина. Болеют преимущественно женщины в молодом возрасте. Заболевание может развиваться остро (у 1/3 больных), но чаще начинается постепенно.
Клиническая картина характеризуется полиморфизмом симптомов и прогрессированием.
На первом месте по частоте стоит поражение суставов.
Страдают преимущественно мелкие суставы кистей, голеностопные суставы.
Суставной синдром может проявляться как артралгиями, так и полиартритом. Последний обычно течет без деформаций.
Кожные поражения.
Наиболее типичный симптом — высыпания в форме бабочки, которые занимают переносицу, крылья носа и область носогубной складки.
Эритематозные высыпания могут появляться по всему телу.
Следующим по частоте симптомом является разнообразная лихорадка. Важнейшим клиническим признаком СКВ служит полисерозит, наиболее часто — плеврит, однако может быть и перикардит.
Лимфоаденопатия. Довольно часто наблюдается увеличение лимфатических узлов. Они мягкие, без воспалительных изменений.
Висцеральные поражения. Поражается ССС в виде очагового или диффузного миокардита — особый вид эндокардита без выраженной клеточной реакции (эндокардит Либмана—Сакса).
В легких может развиваться своеобразный люпус-пневмонит, очень редко — фиброзирующий альвеолит (синдром Хаммена—Рича).
Одним из наиболее тяжелых поражений при СКВ является волчаночная нефропатия (люпус-нефрит), которая может протекать в различных формах — от изменений, выявляющихся только при электронной микроскопии, до картины мембранозной нефропатии.
Редко встречаются волчаночные гепатиты, примерно в 1/4 случаев выявляется спленомегалия.
Прогностически наиболее тяжелым проявлением СКВ является волчаночный нефрит, представляющий собой иммуннокомплексное гломеруляриое заболевание с очень сложным патогенезом,
В его основе лежит зависимый от Т-клеточного иммунитета аутоиммунный ответ на аутоантигены.
При этом в качестве аутоантигенов выступают ДНК или нуклеосомы. Стимулируемое последними образование индивидуальных аутоантител с разной реактивностью по отношению к гломерулярным антигенам ведет к различным повреждениям, что и определяет отдельные разновидности болезни. Аутоантитела, образуемые В-клетками, вызывают активацию аутореактивных Т-клеток, которые инфильтрируют почки и вызывают васкулит и интерстициальный нефрит.
Выделяются 6 классов, соответствующих определенным фазам заболевания:
класс I — морфологически почки интактны;
класс II — пролиферация мезангиальных клеток;
класс III — очаговая пролиферация или очаговый некроз;
класс IV — диффузная пролиферация с (или без) очаговым некрозом;
класс V — мембранозный вариант и класс VI — терминальная стадия.
Диагностика. Лабораторные исследования: примерно у половины больных наблюдаются гипо- или нормохромная анемия и лейкопения, специальными исследованиями можно обнаружить LE-клетки (нейтрофилы, в цитоплазме которых находятся круглые или овальные включения, состоящие из деполимеризованной ДНК).
Весьма существенны изменения СОЭ и белковых фракций.
Особенно значимо повышение b-глобулинов.
Считается, что при наличии 4 и более признаков диагноз СКВ достоверен.
В последние годы большое значение в диагностике СКВ стали придавать иммунологическим исследованиям, в частности, определению титра антинуклеарного фактора (АНФ — антитела к внутриядерным структурам). Выявление АНФ осуществляется методом непрямой иммунофлуоресценции.
Имеет значение как тип антител, так и характер свечения при иммунофлуоресценции.
Варианты АНФ:
— AT к двуспиральной ДНК (коррелируют с активностью СКВ и развитием волчаночного нефрита, дают гомогенное и периферическое свечение);
— AT к гистонам (гомогенное свечение);
— AT к малым ядерным рибонуклеопротеинам (крапчатое свечение).
Из инструментальных методов диагностики следует отметить биопсию почек, которая позволяет определить наличие и тип волчаночного нефрита, рентгенографию — при вовлечении в патологический процесс легких и эхокардиографию — для выявления характера поражения сердца.
КТ и ЯМР помогают диагностировать степень вовлечения в процесс ЦНС.
Классификация. СКВ классифицируется по клиническому течению.
Острое течение: острое начало в ближайшие 3—6 мес, выраженная полисиндромность — люпус-нефрит или поражение ЦНС.
Подострое течение: болезнь начинается постепенно с общих симптомов, артралгий, разнообразных, обычно неспецифических поражений кожи.
В течение 2-3 лет развивается характерная полисиндромность.
Хроническое течение: заболевание длительное время проявляется рецидивами тех или иных синдромов — полиартрита, реже полисерозита, синдрома дискоидной волчанки, синдрома Рейно.
На 5-10-м году присоединяются другие органные поражения (нефрит, пневмонит); на 10—15-м году могут развиться явления деформирующего полиартрита.
По клинико-лабораторным данным различают три степени активности:
1-я степень активности: нормальная температура тела, незначительное похудание, дискоидные очаги поражения кожи, адгезивный плеврит и перикардит, кардиосклероз; поражение почек ограничивается мочевым синдромом, НЬ 120 и более г/л, у-глобулины в пределах 20-23%, LE-клетки — единичные (на 1000 лейкоцитов) или отсутствуют, титр АНФ — 32 и гомогенный тип свечения AT при иммунофлуоресценции;
Лечение. Для контроля над болезнью в настоящее время используется практически весь арсенал существующих в медицине противовоспалительных и цитотоксических препаратов, применение которых позволило существенно улучшить прогноз жизни больных.
Если до 1970г. продолжительность жизни только 40% больных СКВ превышала 5 лет, то в настоящее время 5-летняя выживаемость составляет 90% и более.
В этом плане трудно переоценить значение глюкокортикостероидов (ГКС), эффект которых наступает практически сразу после назначения.
ГКС были и остаются препаратами выбора при остром течении заболевания с висцеральными проявлениями.
Новым этапом в использовании ГКС при СКВ стало внедрение метода в/в введения сверхвысоких доз — пульс-терапии, который оказался весьма эффективным у некурабельных ранее больных.
Имеющиеся данные свидетельствуют о значительном иммуносупрессивном действии вводимых в/в высоких доз ГКС уже в первые сутки.
Ударные дозы ГКС (в первую очередь метилпреднизолона) приостанавливают образование иммунных комплексов, в большей степени депонируются в воспаленных тканях, блокируют повреждающее действие лимфотоксинов.
Выделена определенная категория больных (молодой возраст, быстропрогрессирующий люпус-нефрит, высокая иммунологическая активность, тяжелый цереброваскулит, системный васкулит), у которых данный способ должен использоваться в дебюте заболевания или незамедлительно — при любом обострении.
Схема лечения: ежедневно в/в в течение трех последовательных дней вводится метилпреднизолон из расчета 15-20 мг на кг веса больного в 100 мл изотонического раствора натрия хлорида одномоментно или по 500 мг в два приема.
В инфузируемую жидкость добавляют гепарин (5000 ЕД) и супрастин.
С целью повышения эффективности ударные дозы метилпреднизолона назначаются с интервалами в несколько недель в течение нескольких месяцев.
Для усиления воздействия на иммунопатологические процессы программное назначение пульс-терапии метилпреднизолоном может быть усилено добавлением циклофосфамида (в/в в течение 5-10 дней).
В случаях резистентности к названным препаратам, а также при наличии нескольких прогностически неблагоприятных факторов перспективно проведение синхронной интенсивной терапии, в основе которой лежит комбинация пульс-терапии и экстракорпоральных методов лечения (плазмафереза).
Если не удается достигнуть стойкой ремиссии, то необходимо назначение других средств — цитостатических иммунодепрессантов, которые используют в комбинации со средними дозами преднизолона.
Показания к назначению цитостатиков: высокая активность и быстро прогрессирующее течение; активные нефротический и нефритический синдромы; недостаточная эффективность лечения ГКС; необходимость быстро уменьшить подавляющую дозу преднизолона; необходимость уменьшить поддерживающую дозу преднизолона, если она превышает 15-20 мг; кортикостероидная зависимость.
Наиболее часто применяют азатиаприн (имуран) и циклофосфамид в дозе 100—200 мг/сут (1-3 мг/кг массы тела), лучше в сочетании с 30 мг преднизолона. Курс лечения 2—2,5 мес.
Затем переходят на поддерживающую дозу, которая составляет обычно 50-100 мг/сут и назначается на многие месяцы.
Возможные осложнения: лейкопения, тромбоцитопения, агранулоцитоз, диспепсические явления, инфекционные осложнения, геморрагический цистит. Возможно назначение аминохинолиновых препаратов в сочетании с ГКС — делагила, плаквенила (по 0,25 г 1—2 раза в день), особенно при наличии поражений кожи.
В случае системного увеличения лимфоузлов предложено их облучение.
НПВП назначают в терапевтических дозах при лечении лихорадки, суставного синдрома и серозита.
Большой интерес в последние годы вызывает циклоспорин А, который рассматривается как одно из наиболее эффективных лекарственных средств с селективной иммуносупрессивной активностью.
Он все шире используется в клинической практике для лечения многих иммуновоспалительных заболеваний внутренних органов, в том числе и СКВ. Конкретные механизмы, определяющие эффективность циклоспорина А (ЦсА) при СКВ, до конца не ясны.
Очевидно, что по характеру воздействия на синтез цитокинов ЦсА весьма близок к ГКС.
Нельзя исключить, что один из важных механизмов действия ЦсА при СКВ связан с ингибицией синтеза интерферона-у.
Представляет интерес способность ЦсА подавлять экспрессию лиганда CD40 на мембране Т-лимфоцитов.
Высокие дозы ЦсА: 10 мг/кг/сут в течение 7 нед.
Лечение ЦсА положительно влияет на активность заболевания, воздействуя на тяжелую органную патологию, а использование невысоких доз и тщательный мониторинг терапии позволяет избежать развития тяжелых побочных явлений.
ЦсА можно считать альтернативным препаратом второго ряда при непереносимости и неэффективности ГКС и цитостатиков.
Кроме того, несомненными положительными сторонами включения ЦсА в схему лечения СКВ следует считать меньшую частоту развития сопутствующей инфекции и возможность назначения при беременности.
Обнадеживающие результаты получены и при использовании у больных СКВ еше одного селективного иммуносупрессанта — мофетила микофенолата.
Мофетила микофенолат (селлсепт) представляет собой синтетический морфолиноэтиловый эфир микофенольной кислоты и является ее предшественником.
После приема мофетила микофенолата внутрь печеночные эстеразы полностью превращают его в активное соединение — микофенольную кислоту, которая является неконкурентным ингибитором инозинмонофосфатдегидрогеназы, фермента, лимитирующего скорость синтеза гуанозиновых нуклеотидов.
Терапия мофетила микофенолатом в дозах 1,5—2 г/сут приводит к снижению протеинурии, стабилизации уровня сывороточного креатинина, нормализации уровней С3-компонента комплемента и антител к ДНК, снижению показателей активности СКВ.
Другим направлением терапии СКВ в последние года становится использование некоторых иммуномодуляторов, таких как талидомид, биндарит, нуклеозидные аналоги (флударабин 25—30 мг/мУсут в/в в течение 30 мин, мизорибин, лефлюномид).
Использование этих препаратов у экспериментальных моделей волчаночноподобного заболевания приводило к уменьшению протеинурии и увеличению выживаемости мышей.
В настоящее время накоплен некоторый опыт и по применению этих препаратов у больных СКВ.
Клинические испытания талидомида в основном проводились у больных с тяжелым поражением кожи, резистентным к антималярийным препаратам и ГКС.
У подавляющего большинства больных удавалось добиться хорошего эффекта и снижения дозы ГКС, при этом отмена препарата не приводила к обострению симптоматики.
Главным ограничением при использовании талидомида является его тератогенность.
Кроме того, описано развитие необратимой периферической нейропатии, зависящей от дозы и длительности лечения.
В этом отношении большие возможности представляет применение антиидиотипических моноклональных AT, в/в иммуноглобулина.
Имеются немногочисленные данные об эффективности у экспериментальных моделей люпуса рекомбинантной ДНК-азы, ДНК-расщепляющего фермента.
Самым агрессивным методом лечения СКВ в настоящее время следует признать аутологичную трансплантацию стволовых клеток (АТСК).
Предварительные позитивные результата, безусловно, нуждаются в дальнейшем подтверждении.
Необходимо длительное наблюдение за больными, имея в виду возможность индукции на фоне лечения развития злокачественных опухолей.
Несмотря на создавшееся впечатление об эффективности данного вида терапии в случаях рефрактерного и тяжелого течения СКВ, АТСК можно рекомендовать только в наиболее тяжелых, безнадежных случаях вследствие сопровождающей его высокой летальности.
В последние годы внедрен новый метод — высокодозная иммуносупрессивная терапия с трансплантацией периферических стволовых кроветворных клеток.
Важным направлением фармакотерапии СКВ является предотвращение развития или лечение сопутствующей (часто лекарственно индуцированной) патологии, в первую очередь раннего атеросклероза, остеопороза, инфекционных осложнений, которые оказывают не менее негативное влияние на жизненный прогноз, чем само заболевание.
Это определяет необходимость более широкого внедрения современных гипотензивных, гиполипидемических, антиостеопоретических и антимикробных препаратов. Поскольку некоторые из них, например статины, антибиотики и, возможно, бифосфонаты, обладают противовоспалительной и иммуномодулирующей активностью, их применение потенциально может повысить эффективность лечения воспалительных ревматических болезней.
Профилактика заключается прежде всего в предупреждении обострений. Главное — это длительный прием поддерживающих доз ГКС, исключение вредных влияний внешней среды (инсоляция), своевременное лечение интеркуррентных заболеваний.
Читайте также:





