Ритуксимаб при системной красной волчанке
С.К. Соловьев
ГУ Институт ревматологии РАМН, Москва
Системная красная волчанка (СКВ) - классическое аутоиммунное ревматичес кое заболевание, в основе патогенеза которого лежат дефекты иммунорегуляции, приводящие к неконтролируемой гиперпродукции В лимфоцитами аутоантител к компонентам собственных тканей и развитию хронического вос паления, затрагивающего многие органы и системы. Прогрессирующее поражение жизненно важных органов определяет жизненный и социальный прогноз больных СКВ, при "катастрофическом" течении летальность достигает 40% в год, в связи с чем принципиальное значение имеет разработка новых методов патогенети ческой терапии этого заболевания.
В последние десятилетия сформиро ваны основные принципы терапии СКВ, в основе которых лежит применение раз личных режимов глюкокортикоидной (ГК) терапии и цитотоксических препаратов. Современные терапевтические схемы с использованием пульс-терапии метилпреднизолоном и циклофосфаном (ЦФ) значительно улучшили отдаленную выжи ваемость и высокоэффективны при развитии угрожающих состояний у больных СКВ. Наиболее ярким примером повыше ния качества лечения СКВ является более чем пятикратное увеличение 5-и летней выживаемости у больных с волчаночным нефритом. Однако, отдаленный жизненный прогноз у этой категории больных остается неблагоприятным. Так, 20-и летняя выжи ваемость при развитии люпус-нефрита, даже при использовании современных терапевтических программ, не превышает 20%. Значительно отягощает кратко срочный и отдаленный жизненный прогноз у больных СКВ развитие таких угрожающих состояний как цитопенических криз, поражение центральной и периферической системы, пневмонит, катастрофическое течение АФС и генерализованный (криоглобулинемический) васкулит. Основными факторами, влияющими на развитие неблагоприятного исхода при СКВ, является резистентность к высоким дозам ГК и циклофосфана и торпидное, прогрес сирующее течение болезни. В тоже время применение высоких доз ГК и ЦФ ассоциируется с повышением риска воз никновения тяжелых вирусных и бакте риальных инфекций, что в значительной степени лимитирует их назначение.
Безусловно, "сверхзадачей" терапии СКВ и других аутоиммунных заболеваний, является создание препаратов селективно влияющих на ключевые звенья патогенеза. В этой связи перспективным направ лением фармакотерапии СКВ являются препараты, блокирующие пролиферацию В - клеток, среди которых одним из наиболее изученных, безусловно является Ритуксимаб (Rituxumab, MabTHera, Roch,), который представляет собой рекомби-нантные химерные (мышь-человек) моноклональные антитела к поверхностным рецепторам В-лимфоцитов - CD20. Пред полагаемый механизм действия ритуксимаба, направленный на подавление активности В клеток, может реализовываться за счет антитело-зависимой клеточной цитотоксичности, комплемент-зависимой цитотоксичности, ингибиции клеточной пролиферации и индукции апоптоза В лимфоцитов. Молекулярные взаимодействия связывания CD20 могут приводить к перестройке мембранных липидов, активации ферментов и регу ляции синтеза интерлейкина 10. Основной мишенью ритуксимаба являются клетки предшественники, незрелые, зрелые и "наивные" В-лимфоциты. На плазмати ческие клетки препарат не оказывает влияния, из-за отсутствия их на мембране CD20.
Впервые ритуксимаб был применен для лечения больных злокачественной В-клеточной лимфомой в 1997 г. Моно терапия ритуксимабом В-клеточных лимфом эффективна у 50% больных и в 10% случаев наблюдается клиническая ремис сия, в тоже время при комбинации его с химиотерапией эффективность лечения возрастает до 81-97%, а частота ремиссий достигает 74%.
Первое сообщение о применении ритуксимаба при СКВ относится к 2001 г когда F.Petschner et al. с успехом исполь зовали его для лечения "катастро фической" СКВ по жизненным показаниям.
В настоящее время, по данным литературы, ритуксимаб применялся в лечении более чем 200 больных СКВ. Назначение препарата в дозах от 1000 до 2000 мг (обычно РМ назначается по 375 мг/м 2 еженедельно в течение 4 недель) оказалось высокоэффективным у больных с поражением суставов, кожи, слизистых оболочек, полисерозитом, лихорадкой и гематологическими нарушениями. Особо го внимания заслуживает тот факт, что высокая эффективность ритуксимаба (око ло 80%) отмечалась при развитии прогрессирующего волчаночного нефрита, тяжелом поражении ЦНС, гематоло гическом кризе, пневмоните и катастро фическом течении АФС - при неэффек тивности пульс-терапии ГК, ударных доз циклофосфана, иммуносорбции, плазмафереза, мофетила микофенолата и цик лоспорина.
В настоящее время проведено нес колько открытых пилотных испытаний эффективности ритуксимаба у больных с волчаночным нефритом. Так, в одном из них (P. Sfikakis et al.) препарат был назначен 10 больным с активным пролиферативным люпус-нефритом (III-IV класс по класси фикации ВОЗ), без признаков почечной недостаточности. До включения в ис следование все пациенты получали вы сокие дозы глюкокортикоидов (ГК), пульс-терапию циклофосфаном (ЦФ) или мофетила-микофенолат (МФ) без существен ного эффекта. Инфузии РМ по 375 мг/м - проводились еженедельно в течение 4-х недель. В результате проведенного лечения частичная ремиссия (улучшение на 50% клинико-лабораторных параметров нефрита) зафиксирована у 8 больных через 1-4 месяца. В последующем полная ремиссия (протеинурия В большинстве исследований пока зано, что эффект терапии этим препаратом при волчаночном нефрите развивается не сразу, как правило значимое уменьшение протеинурии, повышение клубочковой фи льтрации, увеличение содержания альбу мина в сыворотке крови, наблюдается на 2-3 месяце от начала лечения и достигает своего максимума к 5-6 месяцу. Одно временно наблюдается уменьшение ин дексов активности СКВ (BILAG, SLEDAI), антител к ДНК, повышение комплемента. Напротив, применение Ритуксимаба у больных с высокой активностью, обус ловленной внепочечными проявлениями СКВ - цитопенией, полиартритом, серозитом, пневмонитом и АФС, может при вести к развитию положительной динамики уже через несколько дней.
Отчетливый быстрый эффект ритукси маба отмечен у больных с критическим течением СКВ, обусловленным пораже нием ЦНС. Поражение ЦНС (нейролюпус), сопровождающееся развитием состояния угрожающего жизни у больных СКВ, наблюдается достаточно редко, в 2-4% случаев. Терапия таких тяжелых прояв лений волчаночного поражения ЦНС, как судорожный синдром, демиелинизирующая нейропатия, поперечный миелит, психоз - представляет большие трудности, стандартных терапевтических алгоритмов не существует, а летальность превышает 50%. В этой связи особый интерес вызывает публикация Tokunaga, в которой сообщается о применении ритуксимаба у 10 больных СКВ по жизненным пока заниям. У всех описываемых больных наблюдались различные проявления пора жения ЦНС: потеря сознания, судороги, дезориентация, атаксия, сенсорная ней ропатия, психоз. Во всех случаях наз начение ритуксимаба привело к быстрому улучшению, развившемуся в течение нес кольких дней от начала лечения. Авторы отмечают быстрый выход из коматозного состояния, уменьшение и исчезновение двигательных и чувствительных наруше ний, купирование судорожного синдрома, психоза и депрессии. Нарастание поло жительной динамики, переходящее в стабильное улучшение наблюдалось в течение 6-7 месяцев, у всех больных за этот период удалось существенно снизить дозу преднизолона и отменить иммунодепрессанты. Полученные данные свидетельствуют о высокой эффективности инфузий ритуксимаба при СКВ с развитием критических состояний, непосредственно угрожающих жизни пациентов. Особенно важным представляется то, что высокая эффективность терапии наблюдалась у больных с тяжелым, прогрессирующим поражением ЦНС с неэффективностью интенсивной терапии, включающей ударные дозы ГК, ЦФ в комбинации с плазмаферезом и иммуносорбцией.
Применение ритуксимаба у больных СКВ не только индуцирует развитие клинического улучшения, продолжитель ностью от нескольких месяцев до 1 года, но и приводит к появлению различных иммунологических феноменов. Практи чески все исследователи отмечают развитие лимфопении, подавление В-лимфоцитов, наблюдаемое практически сразу после проведения курса лечения ритуксимабом. Leandro, Anolik сообщают о значительном подавлении В лимфоцитов, продолжающееся в среднем около 4 месяцев от начала терапии и корре лирующее с развитием клинического эффекта, нормализацией гемоглобина, СОЭ, комплемента. По мнению авторов, появление на фоне терапии антихиме рических антител может провоцировать развитие аллергических реакций. Те же авторы не выявили достоверного снижения антител к ДНК. Оценивая влияние ритуксимаба на активность люпус-нефрита Stifakis et al. так же обращают внимание на подавление 99% В лимфоцитов у 8 из 10 больных, наблюдаемое от 1 до 7 месяцев. Продолжительность угнетения В клеток соответствовала длительности ремиссии и, напротив, их регенерация предшество вала развитию обострения.
Большинство исследователей отме чают достаточно хорошую переносимость препарата. Подавляющее большинство побочных реакций возникающих во время или после проведения инфузий, так или иначе могут быть связаны с "биоло гической", белковой основой препарата. Как правило, наблюдаются такие явления как озноб, лихорадка, гипотензия, одышка. Обычно такие побочные реакции устра няются более медленной скоростью введения, дробным введением. Для профилактики может использоваться пара цетамол, антигистаминовые препараты или ГК в небольших дозах. Сложившимся правилом, позволяющим практически пол ностью устранять "инфузионные" реакции, является использование инфузомата и внутривенное введение 100-250 мг метипреда непосредственно перед инфузией.
В большинстве исследований посвя щенных применению ритуксимаба как в онкологии, так и при аутоиммунных заболеваниях, не находит свое под тверждение концепция об увеличении риска развития оппортунистических инфекций. Вероятно это связано с тем, что несмотря на значительное снижение циркулирующих В лимфоцитов после инфузии РМ, не наблюдается сколь либо существенного снижения продукции иммуноглобулинов, что в свою очередь можно объяснить наличием значительного количества долгоживущих плазматических клеток.
Российский регистр больных СКВ получающий терапию ритуксимабом
Прогностически неблагоприятные варианты течения СКВ и состояния угрожающие жизни
| • Прогрессирующий нефрит (III-IV класс по ВОЗ) • Поражение ЦНС (поперечный миелит, судороги, кома, психоз) • Геморрагический альвеолит • Гематологический криз • КАФС (тромбозы, мультиорганное поражение) • Генерализованный (fulminant) некротизирующий васкулит | • "Стандартные" методы терапии • Пульс-терапия метилпреднизолоном и циклофосфаном • Внутривенный иммуноглобулин • Плазмаферез • Антикоагулянты • Реанимационные мероприятия Смертельные исходы в течение 1-го года до 40% |
Изменение 5-и летней выживаемости у больных С IV классом ВН (J.Cameron 1998)
| Годы | Выживаемость % |
| 1953-1969 отсутствие патогенетической терапии | 17% |
| 1970-1979 средние и большие дозы ГКС, пульс-терапия | 55 (в 3 раза!) |
| 1980-1983 + циклофосфан | 80 |
| 1990-1995 + мофетила микофенолат, циклоспорин, комбинированная ПТ | 82 |
| XXI век: МабТера, А-BLyS, Октембра . | ? |
20-летняя выживаемость больных СКВ
Анти-В клеточная терапия Ритуксимаб (МабТера, ROCHE)
Показания для назначения Ритуксимаба при СКВ
Неконтролируемая активность болезни
Влияние ритуксимаба на показатели активности СКВ
Эффективность РМ у больных с волчаночным нефритом
- 2002 - 2007 гг. РМ использован для лечения 72 б-ных с рефрактерным к стандартной терапии прогрессирующим ВН ( у 25 в комбинации с ЦС)
- Клинический и лабораторный эффект достигнут у 77%
- Полная или частичная ремиссия достигалась через 6-8-12 недель, продолжительность эффекта от 3 месяцев до 1,5 лет
- Через 1 год значительное уменьшение морфологической активности при повторной биопсии
Показатели активности волчаночного нефрита после терапии Ритуксимабом
Изменение морфологической активности нефрита через год после терапии Ритуксимабом
 | До лечения Индекс активности 10 |
 | Через год Индекс активности 1-2 |
Эффективность Ритуксимаба при неиролюпусе
М. Тikunаgа et al. 2006
| Клинические проявления | Результат и скорость достижения эффекта | Длительность эффекта |
| 6 больных Кома, судороги, каталепсия, психоз, нейропатия, галлюцинации, головные боли | Выздоровление 2- 5 дней | 4-29 месяцев |
| 4 больных Депрессия, психоз, нейропатия | Улучшение 1-4 недели | 7-14 месяцев |
Побочные эффекты и осложнения ритуксимаба
- Инфузионные реакции (озноб, гипотония, отеки, высыпания, зуд, лихорадка) могут наблюдаться у 10-20% больных. Возможно обусловлены образованием антихимерных антител (антител против РМ). Вероятность развития при повторных инфузиях уменьшается. Профилактика - метилпреднизолон 100 мг в/в до инфузии.
- Тяжелые, требуюшие антимикробной терапии инфекции редки. Чаще наблюдаются ОРВИ, герпетичекая инфекция.
ЛИТЕРАТУРА
1. Lipsky PE. Systemic lupus erythe matosus: an autoimmune disease of B cell hyperactivity. Nat Immunol. 2001;2:764-766.
2. Silverman GJ. Anti-CD20 therapy in systemic lupus erythematosus: a step closer to the clinic. Arthritis Rheum. 2005;52:371-377
3. Vasoo S, Hughes GRV Perspectives on the changing face of lupus mortality. Autoimmun Rev. 2004;3:415-417.
4. Pryor BD, Bologna SG, Kahl LE. Risk factors for serious infection during treatment with cyclophosphamide and high-dose corti costeroids for systemic lupus erythemato sus. Arthritis Rheum. 1996;39:1475-1482.
5. Chambers SA, Isenberg DA Anti - B cell therapy (Rituximab) in the treatment of autoimmune disease. Lupus. 2005;14:210-214.
6. John Looney, Jennifer H. Anolik, Debbie Campbell, Raymond E. Felgar et al. B Cell Depletion as a Novel Treatment for Systemic Lupus Erythematosus A Phase I/II Dose-Escalation Trial of Rituximab Arthritis Rheum. 2004;Aug;8:2580-2589.
7. Sfikakis PP, Boletis JN, Lionaki S., Vigklis V., Fragiadaki KG, Iniotaki A., and Moutsopoulos HM Remission of Proliferative Lupus Nephritis Following B Cell Depletion Therapy Is Preceded by Down-Regulation of the T Cell Costimulatory Molecule CD40 Ligand An Open-Label Trial. Arthritis Rheum. 2005;52(2):501-513.
8. Mikiko Tokunaga et al. Efficacy of rit uximab (Anti-CD20) for refractory systemic lupus erythematosus involving the central nervous system. 15 Nov 2006; Ann Rheum Dis
9. С.К. Соловьев, Е.Л. Насонов, М.А.Котовская. Ритуксимаб в лечении системной красной волчанки. Русский Медицинский журнал, 2005, 26, 1731-1736.
10. Е.Л. Насонов, С.К. Соловьев. Перспективы применения моноклональных антител к В-лимфоцитам (ритуксимаб) при воспалительных ревматических заболеваниях. Научно-практическая ревматология 1, 2007, 4-8.
Подход к лечению проявлений и симптоматики системной красной волчанки зависит от особенностей заболевания и степени его тяжести.
Для всех больных СКВ подходят общие рекомендации:
- защита от солнечных лучей,
- правильное питание,
- физические упражнения,
- прекращение или ограничение курения,
- коррекция режима иммунизации,
- лечение сопутствующих заболеваний.
При легкой и средней тяжести СКВ обычно используются:
- неспецифические противовоспалительные препараты (NSAIDs),
- противомалярийные,
- кортикостероиды.
При развитии заболевания и выраженности клинических манифестаций дозировки кортикостероидов становятся больше и добавляются препараты, подавляющие иммунные реакции.
Неспецифические противовоспалительные препараты (NSAIDs)
Используются для облегчения мышечных и суставных болей, при наличии припухлостей и отечности. Эта группа препаратов обладает болеутоляющими, противовоспалительными и противосвертывающими свойствами, что благоприятно сказывается на общей симптоматике системной красной волчанки, но при их назначении надо учитывать возможность нежелательных проявлений действия лекарств.
Блокада синтеза простагландинов посредством ингибирования энзимов циклооксигеназ (COX, COX2), вследствие чего развивается противовоспалительный, анальгезирующий и жаропонижающий эффекты.
- раздражение желудочно-кишечного тракта,
- кровотечения,
- нефротоксичность,
- гепатотоксичность,
- гипертензия.
- возможность появления:
- тошноты и рвоты,
- боли в животе,
- темного (до дегтеобразного) стула.
- общий развернутый анализ крови,
- креатитнин сыворотки крови,
- функциональные пробы печени,
- общий анализ мочи.
Противомалярийные препараты
Некоторые антималярийные лекарства доказали свою эффективность при лечении различных проявлений СКВ и ее обострений. Хотя механизм их действия точно не выяснен, предполагается, что противомалярийные средства могут мешать активации Т-лимфоцитов, ингибировать активность цитокинов, внутриклеточные toll-рецепторы, распознающие и связывающие чужеродные элементы . Наиболее часто применяется гидроксихлорохин (Плаквенил) внутрь по в сутки.
- патология желтого пятна,
- мышечная слабость.
глазное дно и поля зрения перед лечением и затем каждые
Кортикостероидные гормоны
Кортикостероидные препараты подменяют естественные гормоны коры надпочечников и помогают контролировать кровяное давление и функции иммунитета (например, блокада активации цитокинов и ингибирование интерлейкинов, γ-интерферона и фактора некроза опухолей-α). Кортикостероиды уменьшают выраженность боли и отечности, связанных с воспалением, которое возникает при обострениях заболевания. Ввиду серьезности побочных эффектов при длительном применении, кортикостероиды надо использовать в настолько малых дозах, насколько это возможно, и только тогда, когда надо купировать активное обострение СКВ.
Обычные дозировки — преднизон внутрь При обострениях — метилпреднизолон внутривенно в сутки в течение дней в зависимости от клиники.
- увеличение веса тела,
- гипертензия,
- гипергликемия,
- остеопороз,
- катаракта,
- отеки,
- гипокалиемия,
- мышечная слабость,
- замедление роста у детей,
- снижение иммунитета к инфекционным заболеваниям,
- глаукома.
- артериальное давление,
- плотность костной ткани (минимум ежегодно),
- уровень глюкозы крови (минимум раз в
- уровень калия крови,
- липидный профиль (минимум ежегодно).
Иммуносупрессоры (лекарства, подавляющие иммунные реакции)
Оказывают комплексное угнетающее действие на иммунитет (например, понижение пролиферации Т- и В-лимфоцитов, разрывы цепочек нуклеиновых кислот). Обычно используются в тяжелых случаях, когда высокие дозы кортикостероидов или антималярийные препараты не помогают. Кроме этого, они применяются тогда, когда надо добиться и поддерживать ремиссию.
Иммуносупрессоры можно давать вместе с высокими дозами глюкокортикоидов при лечении обострений, для снижения дозировок каждого применяемого препарата, для снижения частоты проявлений побочных эффектов. Обычно используются:
циклофосфамид (cyclophosphamide, Cytoxan) внутрь1-3 мГ/кГ/сутки или внутривенно вместе или без кортикостероидов. азатиоприн (azathioprine, Azasan, Imuran) внутрь микофенолат (CellCept) для проблем, связанных с поражением почек при СКВ) — внутрь
- угнетение кроветворения,
- гепатотоксичность,
- нарушение функции почек,
- бесплодие,
- повышение риска инфекционного и/или онкозаболевания.
- общий анализ крови,
- число тромбоцитов,
- креатинин сыворотки,
- печеночные пробы,
- общий анализ мочи.
Моноклональные антитела
Белимумаб (belimumab, Benlysta, ранее известный как LymphoStat-B) разрешен FDA в марте 2011 г. как первый препарат моноклональных антител, предназначенный для лечения системной красной волчанки. По сути, это первый препарат за 50 лет, специально предназначенный для этого.
Белимумаб ингибирует активацию В-лимфоцитов посредством воздействия на белок, необходимый для активных В-лимфоцитов — BLyS.
Белимумаб рекомендован больным с активной СКВ, получающих неспецифические противовоспалительные, антималярийные, глюкокортикоиды и/или препараты, угнетающие иммунитет.
Препарат назначается внутривенно в количестве 10 мГ/кГ; введение осуществляется медленно в течение 1 часа и более. Первые 3 введения — с интервалом 2 недели между введениями, далее интервал между введениями увеличивается до 4 недель.
- тошнота,
- жидкий стул,
- лихорадочные реакции,
- назофарингит,
- бессонница,
- боли в конечностях,
- депрессия,
- мигрень,
- гастроэнтерит,
- инфекции:
- бронхит,
- пневмония,
- целлюлит,
- инфекции мочевыводящих путей.
- деятельность желудочно-кишечного тракта,
- инфекционную симптоматику,
- изменения настроения и поведения,
- реакции на введение препарата.
Ритуксимаб (rituximab, Rituxan) — продукт генной инженерии, химерическое моноклональное антитело к антигену CD20, обнаружившее и определенный потенциал для лечения СКВ.
Предполагается, что В-лимфоциты, отвечающие за синтез патологических аутоантител и других иммуноактивные вещества, имеющие отношение к патогенезу системной красной волчанки, разрушаются ритуксимабом.
В течение последних лет как обнадеживающие, так и неоднозначные данные относительно применения ритуксимаба, назначавшегося вместе с кортикостероидами и иммуносупрессорами при СКВ у детей и взрослых, были получены в нескольких клинических испытаниях.
Польза ритуксимаба была замечена и при волчаночном нефрите, артралгии, артрите, кожном васкулите, воспалении слизистой, высыпаниях, слабости и неврологической симптоматике . Побочные эффекты препарата как правило выражены несильно, хотя зафиксированы и описаны как незначительные, так и более выраженные реакции на введение препарата.
В исследовании Terrier et al. положительное действие ритуксимаба описано у 71% пациентов, причем значительный эффект наблюдался при рефрактерном течении заболевания, а так же были отмечены улучшения со стороны кожи, суставов, почек, крови при приемлемой переносимости препарата. В другом исследовании с участием 188 больных СКВ были получены еще более впечатляющие результаты (значительное улучшение состояния 91% больных, особенно при люпусном нефрите, при том, что побочное действие и инфекции были отмечены у 23% пациентов).
Тем не менее, 2 дополнительных рандомизированных исследования, проводившихся начиная с 2010 г., не продемонстрировали значительных клинических улучшений у пациентов, принимавших ритуксимаб вместе с кортикостероидами.
Таким образом, обоснованность применения ритуксимаба при системной красной волчанке нуждается в дополнительных исследованиях.
Дополнительные возможности лечения СКВ
Исследователи интересуются возможностью трансплантации стволовых клеток как способ внедрения в организм здорового клеточного материала с целью перестройки иммунной системы больного.
Некоторые полагают, что комбинация DHEA (дегидроэпиандростерона), регулирующего половые гормоны, и ритуксимаба особенно хороша для больных, которые не реагируют на традиционные иммуносупрессоры.
(создана: 2013-04-23 16:59:35, дополнена: 2014-04-09 22:36:30)
Белимумаб при системной красной волчанке - клиническая эффективность и обоснование лечения, патофизиология, побочное действие, рекомендации.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Wallace D.J. Management of Nonrenal Systemic Lupus erythematosus. In: M.H. Weisman, M.E. Weinblatt, J.S. Louie, R.F. van Vollenhoven (eds). Targeted Treatment of the Rheumatic Diseases. 1st ed. Philadelphia, PA: Saunders Elsevier, 2010;9:91-105
Ishimori M., Weisman M.H., Setooden K., Wallace D.J. Principles of Therapy, Local Measures, and Nonsteroidal Medications. In: D.J. Wallace, Hannahs Hahn (eds). Dubois’ Lupus Erythematosus and Related Syndromes. 8th ed. Philadelphia, PA: Saunders Elsevier, 2012;47:582-90
Touma Z., Gladman D.G., Urowits M.B. Clinical Measures, Metrics, and Indices. In: D.J. Wallace, Hannahs Hahn (eds). Dubois’ Lupus Erythematosus and Related Syndromes. 8th ed. Philadelphia, PA: Saunders Elsevier, 2012;46:563-9.
Navarra S.V., Naidas O.D. Management of Systemic Lupus Erythematosus Renal Disease. In: M.H. Weisman, M.E.Weinblatt, J.S. Louie, R.F. van Vollenhoven (eds). Targeted Treatment of the Rheumatic Diseases. 1th ed. Philadelphia, PA: Saunders Elsevier, 2010;10:108-20.
Appel G.B., Contreras G., Dooley M.A. et al. Mycophenolate mofetil versus cyclophoaphamide for induction treatment of lupus nephritis. J Am Soc Nephrol 2009;20:1103-12.
Pepper R., Griffith M., Kirwan C. Rituximab is an effective treatment for lupus nephritis and allows a reduction in maintenance steroids. Nephrol Dial Transplant 2009;1-7.
Chan T.M., Li F.K., Tang C.S.O. et al. Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis. N Engl J Med 2000;343:1156-62.
Dooley M.A., Jayne D., Ginzler E.M. et al. Mycophenolate versus azathioprine (as maintenance therapy of lupus nephritis). N Engl J Med 2011;365:1886-95.
Houssiau F.A., Cruz D.D., Sangle S. et al. Azathioprine versus mycophenolate mofetil for long-term immunosuppression in lupus nephritis: results from MAINTAIN Nephritis trial. Ann Rheum Dis 2010;69:2083-9.
Van Vollenhoven R.F. Novel Therapies for SLE: Biological Agents Available in PracticeToday. In: D.J. Wallace, Hannahs Hahn B. (eds). Dubois’ Lupus Erythematosis and Related Syndromes. 8th ed. Philadelphia, PA: Saunders Elsevier, 2012;53:642-5.
Van Vollenhoven R.F. Rituximab Shadow, illusion or light? Autoim Rev 2012;11:563-7.
Badin F., Hayslip J. Rituximab in the treatment of B-cell non-Hodgkin lymphoma, focus on outcomes and comparative effectiveness. Clin Econom Out Res 2010;2:37-45.
Cohen S.B., Emery P., Greenwald M.W. et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthr Rheum 2006;54:2793-806.
Jayne D. Rituximab Treatment for Vasculitis. J Am Soc Nephrol 2010;5:1359-62.
Gorman C., Leandro M., Isenberg D. Does B-cell depletion have a role to play in the treatment of systemic lupus erythematosus? Lupus 2004;13:312-6.
Ramos-Casals M., Soto M.J., Cuadrado M.J., Khamashta M.A. Rituximab in systemic lupus erythematosus: A systematic review of off-label use in 188 cases. Lupus 2009;18:767-76.
Smith M.R. Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance. Oncogene 2003;22:7359-68.
Rovin B.H., Furie R., Latinis K. et al. Efficacy and safety of rituximab in with Rituximab study. Arthr Rheum 2012;64:1215-36.
Jonsdottir T., Gunnarsson I., Lisselada A. et al. Treatment of refractory SLE with rituximab plus cyclophosphamide: clinical effects, serological changes, and predictors of response. Ann Rheum Dis 2008;67:330-4.
Leandro M.J., Edwards J.C.W., Cambridge G., Ehrenstein M.R. B-cell repopulation occurs mainly from naive B-cells in patients with rheumatoid arthritis and systemic lupus erythematosus treated with rituximab. Arthr Rheum 2003;48(Suppl):464.
Gunnarsson I., Sundelin B., Jonsdottir T. et al. Histopathologic and clinical proliferative lupus nephritis. Arthr Rheum 2007;56:1263-72.
Jonsdottir T., Zickert A., Sundelin B. et al. Long-term follow-up in lupus nephritis patients treated with rituximab clinical and histopathological response. Rheumatology (Oxford) 2013 [Epub ahead of print]; PubMed PMID: 23287364.
Merrill J.T., Neuwelt C.M., Wallace D.J. et al. Efficacy and safety of rituximab in moderate-to-severely active systemic lupus erythematosus: the randomized, double-blind, phase II/III systemic lupus erythematosus evaluation of rituximab trial. Arthr Rheum 2010;62:222-33.
Li E.K., Tam L.S., Zhu T.Y. et al. Is combination rituximab with cyclophosphamide better than rituximab alone in the treatment of lupus nephritis? Rheumatology 2009;48:892-8.
Hahn B. The Pathogenesis of SLE. In: D.J. Wallace, Hannah Hahn B. (eds). Dubois’ Lupus Erythematosus and Related Syndromes. 8th ed. Philadelphia, PA: Saunders Elsevier, 2012;3:29-32.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.












Перспективы анти-В-клеточной терапии системной красной волчанки
Системная красная волчанка (СКВ) остается заболеванием с высоким уровнем смертности, значительными органными повреждениями и низким качеством жизни, несмотря на имеющийся арсенал глюкокортикоидных гормонов и цитостатических препаратов. Появившиеся генно-инженерные биологические препараты, способные блокировать функцию В-лимфоцитов, дают ревматологам новые возможности в ведении пациентов с СКВ: купировать жизнеугрожающие ситуации (ритуксимаб), уменьшать развитие побочных эффектов от традиционной терапии (белимумаб и эпратузумаб). За этими препаратами будущее – улучшение качества жизни пациентов с СКВ.
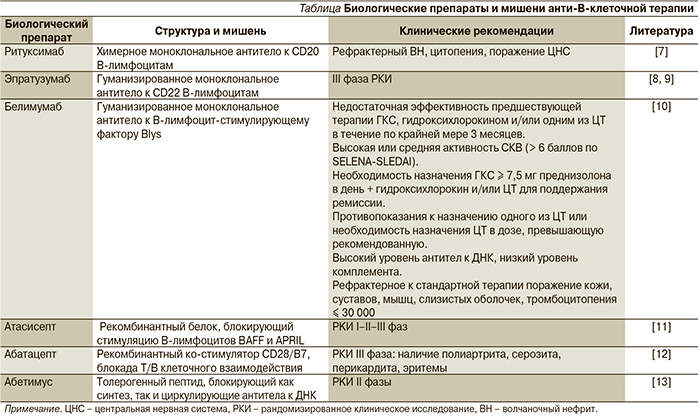
Системная красная волчанка (СКВ) является прототипом хронического аутоиммунного заболевания, при котором наблюдаются гиперпродукция аутоантител, образование иммунных комплексов, фиксирующихся на клеточных мембранах различных тканей в присутствии комплемента, развитие воспалительных реакций и тканевого повреждения [1]. Этиология СКВ неизвестна, определенную роль в развитии заболевания играют экологические триггеры: вирус Эпштейна–Барр, воздействие ультрафиолетового света, эстрогенсодержащие препараты, кварцевая пыль и курение [2, 3]. СКВ остается заболеванием, потенциально угрожающим жизни пациента даже при использовании высоких доз глюкокортикостероидных гормонов (ГКС) и цитостатиков (ЦТ), характеризуется высоким уровнем заболеваемости, смертности, значительными повреждениями органов и низким качеством жизни [4]. Распространенность составляет от 20 до 70 случаев на 100 тыс. женщин и варьируется в зависимости от расовой и этнической принадлежности [5, 6]. На рубеже ХХ–XXI столетий с появлением генно-инженерных биологических препаратов (ГИБП) сформировались новые стратегические подходы к терапии СКВ. Хорошо известно, что при СКВ отличительной чертой патогенеза является гиперпродукция аутоантител, в связи с чем неудивительно, что наибольший интерес представляют ГИБП, способные блокировать функцию В-лимфоцитов. Характеристика наиболее известных анти-В-клеточных препаратов представлена в таблице.
Ритуксимаб (РТМ) является химерным (человек/мышь) антителом, представляющим собой моноклон иммуноглобулина G1 (IgG1) каппа, направленный против антигена CD20, который находится на поверхности В-лимфоцитов и отсутствует на стволовых, про-В-лимфоцитах и плазматических клетках. Механизм действия РТМ до конца не изучен, деплеция (исчезновение из циркуляции) В-лимфоцитов может быть реализована антител-зависимой цитотоксичностью, комплемент-зависимой цитотоксичностью и прямым апоптозом [14]. РТМ с 1997 г. включен в стандарт лечения неходжскинских лимфом.
В связи с тем что в патогенезе СКВ ключевую роль играют активированные В-лимфоциты, гиперфункция которых приводит к продукции аутоантител, применение РТМ при этом заболевании представляется перспективным.
В 2002 г. появилась первая публикация об успешном применении РТМ в группе больных СКВ с умеренно тяжелым и рефрактерным к стандартной терапии течением болезни [15]. Несмотря на отсутствие официально зарегистрированных показаний за последующее десятилетие, в многочисленных неконтролируемых проспективных исследованиях была продемонстрирована высокая эффективность РТМ (80–90 %) у больных СКВ с поражением кожи, суставов, серозных оболочек, а также в случаях критической тромбоцитопении, гемолитической анемии и тяжелым поражением центральной нервной системы – ЦНС [16–21]. Высокая эффективность РТМ при гематологических проявлениях СКВ может быть связана с подавлением антиэритроцитарных и антитромбоцитарных аутоантител. В то же время эффективность РТМ при других внепочечных проявлениях СКВ, появление которых не связано с синтезом специфических аутоантител, очень высока и колеблется в пределах 89–100 % [22].
Несмотря на эффективность терапии РТМ, продемонстрированной в открытых испытаниях, два проведенных рандомизированных клинических исследования (РКИ) не подтвердили его эффективности по сравнению с плацебо у больных ВН (LUNAR) [30] и при СКВ без поражения почек (EXPLORER) [31]. В то же время при более детальном анализе данных установлено, что по сравнению с группой плацебо RTX оказывал значительно больший эффект на пациентов с достигнутой деплецией, высоким уровнем а-ДНК и низким комплементом [22, 25]. К возможным объяснениям неудач РКИ можно отнести слишком короткий срок наблюдения, высокие дозы ГКС и применение мофетила микофенолата (ММФ) в группе плацебо.
Таким образом, РТМ:
- приводит к деплеции В-лимфоцитов, снижению анти-ДНК, повышению С3-, С4-комплемента;
- применение оправданно при рефрактерном ВН с сохранной функцией почек, тромбоцитопении, анемии, поражении ЦНС.
Среди нескольких ГИБП, имеющих своей мишенью В-лимфоциты, особо следует отметить эпратузумаб (ЭПМ), в первую очередь потому, что он, как и РТМ, представляет собой моноклональные антитела к рецепторам В-лимфоцита (анти-CD22). CD22 является трансмембранным лектиноподобным рецептором, который присутствует на поверхности зрелых, наивных и переходных клеток, но отсутствует на клетках памяти и плазматических клетках, играет важную роль в регуляции функции В-клеток [35]. ЭПМ скорее модулирует функцию В-лимфоцитов, вызывая их умеренное истощение, в отличие от РТМ не вызывает апоптоза и не приводит к полной деплеции В-лимфоцитов. Его основной мишенью являются наивные, зрелые и переходные В-лимфоциты, содержание которых сокращается на 40 % после применения ЭПМ [36].
Было показано, что уже к 6-й неделе исследования общий счет BILAG уменьшился у 77 % больных на 50 %. Отмечено снижение циркулирующих В-лимфоцитов на 35 % к 18-й неделе, их уровень оставался сниженным и на 6-м месяце от начала терапии. В то же время отмечен непродолжительный эффект терапии ЭПМ, уже к 32-й неделе число пациентов с более чем 50 %-ным улучшением составляло всего 15 % [38]. До настоящего времени остаются неизученными возможность и целесообразность комбинации различных генно-инженерных препаратов, в т.ч. и анти-В-клеточных при СКВ. В связи с этим большой интерес представляет исследование J. Carnahan и соавт. (2007) [39]. Было показано, что in vivo комбинация РТМ и ЭПМ оказывает более значимое воздействие на пролиферацию и апоптоз В-лимфоцитов, что может увеличивать клиническую эффективность терапии. По всей вероятности, основным показанием к назначению ЭПМ будут среднетяжелое течение СКВ, необходимость снижения дозы ГКС, предотвращение обострений и достижение стойкой ремиссии.
В основные РКИ (BLISS-52 и BLISS-76) вошли 1693 пациента из 31 страны (223 клинических центра), открытая фаза этих исследований продолжается (более 6 лет). В настоящее время завершено два РКИ фазы III, BLISS-52 и BLISS-76 [45, 46], результаты которых послужили основанием регистрации препарата. Создание белимумаба ознаменовало новую эру в лечении СКВ, связанную с началом широкого применением ГИБП и созданием нового класса лекарственных препаратов – ингибиторов BLyS, которые могут иметь важный терапевтический потенциал не только при СКВ, но и при широком круге аутоиммунных заболеваний человека.
Показания к назначению белимумаба при СКВ (адаптировано из (RamosCasals M. и соавт.) [47]:
- Недостаточная эффективность предшествующей терапии ГКС, гидроксихлорокином и/или одним из ЦТ в течение по крайней мере 3 месяцев.
- Высокая или средняя активность СКВ (> 6 баллов по SELENA-SLEDAI).
- Необходимость назначения ГКС ≥ 7,5 мг преднизолона в сутки + гидроксихлорокин и/или ЦТ для поддержания ремиссии.
- Противопоказания к назначению одного из ЦТ или необходимость назначения ЦТ в дозе, превышающей рекомендованную.
- Высокий уровень антител к ДНК, низкий уровень комплемента.
- Рефрактерное к стандартной терапии поражение кожи, суставов, мышц, слизистых оболочек, тромбоцитопения ≤ 30 тыс.
- Полиорганная рефрактерность к стандартной терапии.
Противопоказаниями к назначению белимумаба служат критическое течение СКВ, активный ВН, поражение ЦНС.
Авторы выражают благодарность профессору С.К. Соловьеву за помощь в подготовке данной статьи.
Читайте также:


