Полнослойный дефект суставного хряща медиального мыщелка





Владельцы патента RU 2351020:
Изобретение относится к области экспериментальной медицины и может быть применимо для моделирования лечения полнослойных дефектов хряща коленного сустава. Моделируют стенки и дно дефекта. Производят забор фрагмента ткани жирового тела для последующего выделения и культивирования аутологичных мезенхимальных стволовых клеток. Вводят куьтивированные клетки пункционно трехкратно в полость коленного сустава. Способ позволяет замедлить прогрессирование дегенеративно-дистрофических изменений, оптимизировать формирование регенерата в области дефекта. 4 ил.
Изобретение относится к области медицины, а именно к ортопедии и травматологии, и может быть использовано для лечения полнослойных дефектов хряща коленного сустава.
Более перспективным методом хирургического лечения локальных глубоких повреждений хряща коленного сустава, позволяющим более оптимально восстановить гиалиновый хрящ по данным гистологического исследования, представляется пересадка культуры аутохондроцитов с периостальным лоскутом (Minas, Peterson, 1997). Этапами данного метода являются артроскопический забор хрящевой ткани из медиального или латерального мыщелков бедренной кости, ее культивирование в течение 3-4 недель для выращивания 10-12 миллионов жизнеспособных хондроцитов, имплантация культуры хондроцитов в область повреждения под периостальный лоскут, взятый из медиального мыщелка бедренной кости. Субпериостальная имплантация культуры аутогенных хондроцитов позволяет добиться хороших отдаленных результатов более чем у 85% пациентов в сроки до 12 лет после операции (Gillogly, 2002). Основными недостатками данного метода являются дополнительное повреждение хряща при заборе ткани, трудоемкость и высокая стоимость культивирования хондроцитов, двухэтапность хирургического лечения и соответственно необходимость повторной госпитализации пациента для выполнения второго этапа.
Разработанный нами, экспериментально подтвержденный способ лечения глубоких повреждений хряща коленного сустава позволяет оптимизировать формирование полноценного регенерата в области дефекта суставной поверхности, существенно замедлить развитие и прогрессирование дегенеративно-дистрофических изменений в суставе и избежать необходимости повторного оперативного вмешательства.
Результат изобретения достигается за счет того, что во время хирургического вмешательства после моделирования стенок и дна дефекта из ткани жирового тела коленного сустава выделяются и культивируются аутологичные мезенхимальные стволовые клетки, которые затем пункционно трехкратно вводятся в пораженный коленный сустав.
На фигурах изображено следующее.
Фиг.1. Макроскопический препарат правого коленного сустава (основная группа) через год после операции, сохраняются контуры сформированного дефекта хряща, отсутствуют признаки гонартроза.
Фиг.2. Микроскопия дефекта хряща коленного сустава (основная группа), дно дефекта представлено базальным слоем суставного хряща, вне зоны дефекта хрящ обычного строения.
Фиг.3. Макроскопический препарат левого коленного сустава (контрольная группа) через год после операции, сохраняются контуры сформированного дефекта хряща, выраженные признаки гонартроза.
Фиг.4. Микроскопия дефекта хряща коленного сустава (контрольная группа), дно дефекта представлено склерозированной костной тканью - костными шлифами, в субхондральной костной пластинке костные кисты.
Способ осуществляется следующим образом. Для создания однотипных условий проведения эксперимента у всех животных использовали оригинальную методику формирования полнослойного локального дефекта круглой формы в нагружаемой зоне мыщелка бедренной кости только на толщину гиалинового хряща без повреждения подлежащей субхондральной кости. Под общим наркозом, после обработки и драпировки операционного поля, выполняли передневнутреннюю артротомию правого коленного сустава, надколенник вывихивали кнаружи, мобилизировали жировое тело, коленный сустав сгибали до острого угла для доступа к наиболее нагружаемым отделам мыщелков бедренной кости, после чего в одном из них полой фрезой диаметром 5 мм с ограничителем строго перпендикулярно суставной поверхности производили аккуратное удаление хряща на всю его толщину. Ограничитель, располагающийся внутри фрезы, препятствовал повреждению субхондральной кости. Резецировали 3-5 мм 3 жирового тела коленного сустава и помещали его в пробирку с питательной средой. Затем рану промывали раствором антисептика, выполняли контроль гемостаза и далее послойный шов раны. Аналогичным способом формировали дефект суставной поверхности внутреннего мыщелка бедренной кости левого коленного сустава (контрольная группа). В послеоперационном периоде иммобилизацию суставов не применяли, дополнительных назначений медикаментов не требовалось, животные находились в клетках вивария.
Аутологичные мезенхимальные клетки из жирового тела получали путем измельчения ткани в диссоциирующем растворе, осаждения клеток центрифугированием, отмывки раствором DPBS без ионов Са 2+ и Mg 2+ и посева во флаконы в среде DMEM с 10% сыворотки эмбрионов коров. Клетки выращивали в течение 10-14 дней, после чего одну их часть вводили животным, а другую замораживали в жидком азоте для повторных введений собакам.
Через 4, 12 и 26 недель после операции под внутривенным наркозом с соблюдением асептики выполняли пункцию правого коленного сустава и внутрисуставно вводили взвесь аутологичных мезенхимальных стволовых клеток в количестве 5×10 6 клеток в 1 мл 0,9% раствора хлорида натрия. В левый коленный сустав внутрисуставно вводили 1 мл 0,9% раствора хлорида натрия.
Через год собак выводили из эксперимента. Осуществляли забор и препаровку макропрепаратов коленных суставов, визуально оценивали наличие признаков их дегенеративно-дистрофического поражения: цвет, толщина, плотность и равномерность хрящевого покрытия мыщелков бедренной и большеберцовой костей, наличие краевых костно-хрящевых разрастаний, состояние синовиальной оболочки.
После соответствующей обработки выполняли микроскопию срезов внутренних мыщелков бедренной кости в области сформированных ранее дефектов суставной поверхности.
У беспородной половозрелой собаки №1 в операционной под внутривенным наркозом из передневнутреннего доступа выполнили артротомию правого коленного сустава. В нагружаемой зоне внутреннего мыщелка бедренной кости полой фрезой диаметром 5 мм сформировали полнослойный дефект хряща до субхондральной кости без ее пенетрации. Резецировали часть жирового тела и поместили его в стерильную пробирку с питательной средой. Рану послойно ушили. Аналогичным способом после артротомии сформировали дефект суставной поверхности внутреннего мыщелка бедренной кости левого коленного сустава. В послеоперационном периоде иммобилизацию суставов не применяли, раны зажили первичным натяжением.
Аутологичные мезенхимальные клетки из жирового тела получали путем измельчения тела в диссоциирующем растворе, осаждения клеток центрифугированием, отмывки раствором DPBS без ионов Са 2+ и Mg 2+ и посева во флаконы в среде DMEM с 10% сыворотки эмбрионов коров. Клетки выращивали в течение 10-14 дней, после чего одну их часть вводили животным, а другую замораживали в жидком азоте для повторных введений собакам.
Через 4, 12 и 26 недель в операционной под внутривенным наркозом выполнили пункцию правого коленного сустава и внутрисуставно ввели взвесь аутологичных мезенхимальных стволовых клеток в количестве 5×10 6 клеток в 1 мл 0,9% раствора хлорида натрия.
Через год собаку вывели из эксперимента и осуществили забор и препаровку коленных суставов.
При визуальной оценке наличия и степени выраженности признаков дегенеративно-дистрофического поражения правого и левого коленных суставов отмечена существенная разница.
Хрящ правого коленного сустава имел нормальную окраску и плотность, сохранялись очертания дефекта суставной поверхности, однако он был неглубоким, заполненным тканью, напоминающей хрящевую, но более мягкую при пальпации. Костно-хрящевых разрастаний по краю суставной поверхности мыщелков бедренной и большеберцовой костей не было, в синовиальной оболочке отсутствовали признаки острого или хронического воспаления (фиг.1). При микроскопическом исследовании дефект сохранял округлую форму, дно его было представлено базальным слоем суставного хряща, покрытым тонкой прослойкой фиброзной ткани и фибрина. В подлежащей кости наблюдались явления склерозирования. Хрящ вне зоны дефекта имел обычное строение (фиг.2).
Хрящ левого коленного сустава был тусклым, размягченным, с очаговыми истончениями в наиболее нагружаемых отделах. Сохранялись четкие границы глубокого дефекта суставной поверхности внутреннего мыщелка бедра, дном которого была субхондральная кость. По краю суставной поверхности мыщелков бедренной и большеберцовой костей сформировались выраженные костно-хрящевые разрастания, в синовиальной оболочке отмечались умеренные признаки хронического воспаления (застойная гиперемия, гипертрофия ворсин, незначительный отек и уплотнение) (фиг.3). При микроскопическом исследовании дно дефекта было представлено склерозированной костной тканью - костными шлифами, по краям которых определялись костно-хрящевые разрастания. В субхондральной костной пластинке формировались кисты (фиг.4).
1. Gillogly S.D. Cartisel: indications, technique and results // Surgical treatment of complex knee ligament, patellofemoral and articular cartilage disorders. - Rosemont, 2002. - P.201-204.
2. Minas Т., Peterson L. Chondrocyte transplantation // Operative Techniques in Orthopaedics. - 1997. - V.7. - P.323-333.
3. Ogilvie-Harris D.J., Jackson R.W. The arthroscopic treatment of chondromalacia patellae // J. Bone Jt. Surgery. - 1984. - V.66-B, №5. - P.660-665.
4. Steadman J.R., Rodkey W.G., Rodrigo J.J. Microfracture: surgical technique and rehabilitation to treat chondral defects // Clin. Orthop. - 2001. - №391. - P.362-369.
Способ моделирования лечения полнослойных дефектов хряща коленного сустава, отличающийся тем, что после моделирования стенок и дна дефекта производят забор фрагмента ткани жирового тела для последующего выделения и культивирования аутологичных мезенхимальных стволовых клеток, которые затем пункционно трехкратно вводят в полость коленного сустава.
Повреждения хряща могут возникать как в обычных бытовых условиях, так и во время занятий спортом при резких ротационных движениях в коленном суставе.
При остром повреждении клиническая оценка крайне сложна. Клиническая картина может варьировать от полного отсутствия жалоб до острой интенсивной боли. В ряде случаев на первое место могут выступать симптомы повреждения передней крестообразной связки и разрывов мениска.
Определенного алгоритма клинического осмотра при травматическом повреждении хряща не существует. Диагноз позволяет предположить анализ анамнеза и механизм травмы. Необходимо исключить повреждение крестообразных связок и менисков.
Изолированное повреждение хряща на обычных рентгенограммах не выявляется, только при повреждении субхондральной кости или если с момента травмы прошло более месяца, можно увидеть повышение плотности или неровность суставной поверхности (в случае вдавленного перелома, перелома медиальной поверхности латерального мыщелка бедренной кости).
Данные МРТ очень важны для постановки правильного диагноза при повреждении хряща, однако полученные изображения должны быть достаточно высокого качества.
Артроскопия является наиболее ценным и точным методом диагностики повреждений хряща, так как позволяет достоверно определить распространенность и глубину травматического повреждения и посттравматических изменений.
Травматические и посттравматические изменения хряща имеют множество различных проявлений, поэтому единую классификацию повреждений создать очень сложно. Bauer и Jackson предложили классификацию хондральных повреждений, включающую 6 категорий и основанную на выраженности изменений, затрагивающих внутрисуставной хрящ.
- Тип 1 (трещина) – повреждение хряща представлено изолированной трещиной, которая может доходить до субхондральной кости.
- Тип 2 (звездчатый дефект) – несколько разнонаправленных линий переломов, часто с центральным дефектом. Линии переломов могут достигать субхондральной кости.
- Тип 3 (лоскутный дефект) – поврежденный лоскут прикреплен к предлежащему интактному хрящу. Глубина повреждения может достигать субхондральной кости.
- Тип 4 (кратер) – отделение полнослойного фрагмента хряща с обнажением субхондральной кости.
- Тип 5 (фибрилляция) – при этом типе повреждения имеется зона поверхностной фибрилляции без отделения хряща на большом протяжении. Этот тип повреждения очень сложно отличить от дегенеративного повреждения.
- Тип 6 (деградация) – разрушение и отделение хряща с обнажением субхондральной кости. Этот тип также сложно, а часто невозможно отличить от дегенеративных поражений хряща. Локализация зоны повреждения может указывать на причину повреждения.
Во время диагностики и лечения повреждений хряща необходимо обращать особое внимание на целостность передней и задней крестообразных связок. Острая и хроническая нестабильность коленного сустава, связанная с повреждением этих связок, очень часто приводит к повреждению суставного хряща.
- Медиальный мыщелок бедра.
Зона повреждения практически всегда находится на латеральной поверхности медиального мыщелка бедра (в области межмыщелкового возвышения). В данной зоне могут встречаться любые виды травматических повреждений хряща.
- Латеральный мыщелок бедра.
Типы повреждений латерального мыщелка бедренной кости сходны с типами повреждений медиального мыщелка. Повреждения, возникающие в этой области, ограничены боковой трещиной, образующейся вследствие винтообразного механизма перелома и большего размера латерального мениска. Такие повреждения также могут распространяться и на латеральную порцию латерального мыщелка бедра. Поперечные линейные трещины (щелеобразные переломы) в некоторых случаях достигают медиальной стороны.
Чаще всего причиной остеохондральных переломов являются прямая травма, вывих надколенника и разрыв ПКС. Вывих надколенника нередко приводит к смещению костно-хрящевого фрагмента с медиальной стороны надколенника и с латерального края латерального мыщелка бедренной кости.
Лечение
Лечение травматических повреждений хряща зависит от их глубины и распространенности, клинической картины и сопутствующих повреждений.
Травматические повреждения хряща (исключение – субхондральная гематома), включающие в себя разрушение суставной поверхности, нестабильные фрагменты хряща и вовлечение в процесс субхондральной кости определяют выбор метода лечения.
Применяются различные подходы:
- Невмешательство.
Если выявлены небольшие поперечные трещины хряща, лучше оставить их нетронутыми, так как чрезмерная механическая обработка может привести к еще более выраженным повреждениям.
- Удаление нестабильных хрящевых фрагментов.
Лоскутные повреждения хряща, выраженные фибрилляции и нестабильные участки должны быть устранены.
- Стимуляция регенерации фиброзного хряща.
Индукция образования волокнистого хряща зависит от различных факторов, наиболее благоприятными из которых являются следующие:
- Молодой возраст пациента,
- Стабильный хрящ, окружающий дефект;
- Отсутствие нестабильности, связанной с повреждением капсульно-связочного аппарата;
- Отсутствие угловой деформации нижней конечности,
- Небольшой размер дефекта (менее 15 мм),
- Неповрежденные мениски.
К неблагоприятным факторам, которые следует учитывать, прибегая к методам индукции формирования фиброхрящевой ткани, относятся:
- Большой размер дефекта (более 15 мм),
- Нестабильные края,
- Наличие угловой деформации нижней конечности,
- Нестабильность связочного аппарата,
- Пожилой возраст,
- Ожирение,
- Локализация дефекта в области бедренно-надколенникового сочленения.
Существует множество различных методик стимуляции репарации хрящевой ткани:
- Рассверливание по Pridie,
- Субхондральная абразивная хондропластика,
- Микрофрактурирование.
- Пересадка хряща.
Доступны следующие методики трансплантации хряща и костно-хрящевых блоков:

Внутри коленного сустава есть хрящи. Они покрывают суставные поверхности костей: бедренной и большеберцовой. Хрящи смягчают трение. Они обеспечивают сохранность внутрисуставных структур даже на фоне интенсивных физических нагрузок. К сожалению, в силу различных заболеваний возможно истончение или механическое повреждение хрящей. В этом случае пациенту требуется лечение.

Принципы лечения
Подходы к лечению зависят от того, по какой именно причине истончился хрящ. Это может произойти в результате:
- воспалительных заболеваний;
- дегенеративных процессов;
- травм;
- проведенных хирургических операций.
Лечение может быть направлено на устранение симптомов, замедление дегенеративных процессов, купирование воспаления, усиление регенераторных способностей хрящевой ткани. Иногда требуется хирургическое вмешательство. Оно позволяет выполнить замещение дефектов хрящевой поверхности.
Консервативные методы
Если гиалиновый хрящ коленного сустава истончен, лечение начинают консервативными методами. Применяются такие способы терапевтического воздействия:
- Коррекция образа жизни.
- Физиотерапевтическое лечение и массаж.
- Лечебная физкультура.
- Медикаментозная терапия.
Коррекция образа жизни
Изначально необходимо устранить все факторы, которые могут провоцировать истончение хряща коленного сустава. Лечение начинают с того, что пациенту рекомендуют отказаться от тяжелой физической работы, спорта. Потому что при продолжающемся механическом раздражении хряща он будет повреждаться, а полноценное восстановление хрящевой ткани невозможно по причине его слабого кровоснабжения.
Пациенту необходимо:
- снижение массы тела, если ИМТ превышает 25 кг/м2;
- уменьшение нагрузки на больную ногу;
- применение ортопедических приспособлений (ортезов, стелек);
- использование трости или костылей.
Физиотерапия
Физиотерапевтическое лечение применяется с целью уменьшения отека, боли. Оно позволяет улучшить кровообращение в той зоне тела, которая находится в непосредственной близости к поврежденным коленным хрящам. В результате улучшается трофика тканей, уменьшаются явления гипоксии, ускоряются регенераторные процессы.
Применяются такие виды физиолечения:
- электрофорез;
- гальванизация;
- фонофорез;
- электростимуляция;
- магнитотерапия;
- лазеротерапия;
- вибромассаж и другие.
Физиотерапия часто сочетается с медикаментозным лечением. Местные препараты наносятся на кожу. Затем проводится электрофорез или фонофорез для их лучшего проникновения внутрь суставной полости.

Лечебная физкультура
Физические тренировки помогают укрепить мышцы, разгрузить коленный сустав. Они также способствуют восстановлению хряща за счет улучшения кровообращения. При нагрузке к мышце приливает кровь. Расширяются сосуды. Поэтому кровоснабжение суставной капсулы возрастает. Улучшается и кровенаполнение тех частей хряща, которые прилегают к капсуле.
Медикаментозная терапия
Применение препаратов остается одним из главных способов лечения. В данный момент не существует лекарственных средств, которые гарантированно восстанавливают хрящи или хотя бы предотвращают их дальнейшее разрушение. Однако ряд лекарственных средств позволяют добиться неплохих результатов за счет усиления регенераторных процессов, снижения воспаления, защиты хряща от сильных механических воздействий.
Препараты могут использоваться такими способами:
- применяются внутрь;
- вводятся внутримышечно или внутривенно;
- наносятся на кожу над коленным суставом;
- вводятся инъекционно внутрь сустава.
Так как в большинстве случаев происходит постепенное разрушение хряща коленного сустава, лечение проводится таблетированными формами препаратов. Они удобнее в использовании и не требуют постоянного участия медицинского персонала в лечебном процессе.
Часто применяются и внутрисуставные инъекции. Они хороши тем, что позволяют после нескольких введений лекарств получить устойчивый длительный результат. Он сохраняется полгода или год. Применение уколов в колено позволяет снизить потребность в медицинских препаратах, которые применяются перорально. Соответственно, уменьшается медикаментозная нагрузка и риск побочных эффектов.
Кремы и гели – это вспомогательное лечение. Оно исключительно симптоматическое. Используется для уменьшения боли, устранения отека. Нет местных препаратов, которые могли бы восстановить суставные хрящи колена или хотя бы замедлить их дегенерацию.

НПВС. Эти препараты не могут восстановить хрящи. Но они способны в некоторых случаях замедлить их дегенерацию за счет устранения воспалительного процесса. Кроме того, нестероидные противовоспалительные средства принимаются с целью снижения болевого синдрома, который неизбежно развивается в случае истончения хрящей из-за сильного трения суставных поверхностей во время выполнения любых движений в коленном суставе.
Хондропротекторы. Это препараты хондроитина и глюкозамина. Их получают из хрящей животных. Хондропротекторы вводятся внутрь сустава, инъекционно внутримышечно, наносят на кожу или принимают внутрь.
Только последний способ применения имеет смысл с точки зрения доказательной медицины. Нанесение хондропротекторов на кожу в виде геля не имеет доказанной эффективности. Введение в сустав или внутримышечно приносит пользу, но лечение нужно длительное (от 6 месяцев), а при таком способе введения переносимость терапии значительно ухудшается.
Несмотря на то, что врачи очень часто назначают хондропротекторы внутрь в капсулах, нет доказательств, что они восстанавливают суставной хрящ. Исследования лишь показывают, что при артрозе коленного сустава длительное применение хондроитина в комбинации с глюкозамином позволяет уменьшить симптомы заболевания.
Гиалуронат. Вводится внутрь коленного сустава. Подобные препараты также выпускаются в лекарственных формах для наружного использования или для применения внутрь. Однако такие способы лечения не имеют убедительных доказательств эффективности. Поэтому гиалуронат в таблетках в основном продается как биологически-активные добавки, а не препараты.
Введение гиалуроновой кислоты внутрь сустава позволяет повысить её концентрацию в синовиальной жидкости. Уменьшается трение хрящей, предотвращается их дистрофия. Симптомы уменьшаются или уходят на несколько месяцев. После этого инъекцию гиалуроната можно выполнить повторно.
PRP. Этой аббревиатурой обозначают богатую тромбоцитами плазму. Её получают из собственной крови пациента, центрифугируют, а затем вводят в сустав. Это один из самых эффективных способов усиления регенерации хрящей. Тромбоциты выделяют большое количество факторов роста. В результате репарация хрящевой ткани усиливается. Но восстановление хрящей колена возможно только в случае ранней стадии артроза или при незначительном их травматическом повреждении.

Хирургические методы
При значительных дефектах суставной поверхности восстановление хрящевой ткани возможно только хирургическими методами. Для этого используется множество различных методов. Некоторые из них очень дорого стоят и доступны только за границей (Германия, Швейцария, США). Одни способы появились недавно, другие применяются уже более 50 лет.
Наибольшую эффективность хирургические методы восстановления хряща имеют при:
- рассекающем остеохондрите;
- травматическом повреждении колена;
- остеоартрозе до 2 степени.
При других заболеваниях, а также в случае выраженного гонартроза полноценно восстановить хрящевые поверхности часто не удается.
Основные хирургические методы восстановления гиалинового хряща коленного сустава:
Субхондральная туннелизация. Врач просверливает в нескольких местах хрящ и субхондральную костную ткань. Открывается кровотечение. Результатом становится образование на месте искусственно нанесенной травмы волокнистого хряща.
Микрофрактурирование. Усовершенствованная методика, которая постепенно вытесняет туннелизацию. Механизм воздействия аналогичный. Формируются множественные микропереломы субхондральной кости с сохранением её каркаса. Методика более безопасна, потому что исключаются ожоговые повреждения хрящей, неизбежные при сверлении.
Аутотрансплантация хряща. Применяется для закрытия тех дефектов суставной поверхности, которые подвергаются максимальным механическим нагрузкам. Здесь хрящи имеют наибольшую толщину. Для аутотрансплантации берутся хрящи с другого участка тела пациента и подсаживаются в коленный сустав. Недостатками метода является дополнительная травматизация донорских участков и недостаток материала при обширных хрящевых дефектах.
Имплантация аутологичных хондроцитов. Берут маленький фрагмент хряща, затем культивируют. Фактически, для пациента выращивается новый хрящ. Его закрепляют на матрице, придавая нужную форму, и имплантируют в сустав. Метод максимально эффективен у пациентов до 55 лет, при дефекте хрящевой поверхности до 10 квадратных сантиметров. Недостатки: высокая стоимость и необходимость проведения двух операций (для забора хряща, а затем для его имплантации в колено).
При появлении признаков повреждения суставных хрящей человек должен обращаться к врачу как можно быстрее. Есть немало способов восстановления суставных поверхностей колена, однако большинство из них становятся малоэффективными в запущенных клинических случаях.
Коленные суставы – это место приложения постоянных физических нагрузок и частых травм. Вследствие этого страдают не только кости сочленения, но и его хрящи. Нередко возникает хондромаляция коленного сустава.
Что такое хондромаляция?
Разрушение хряща в коленном суставе называют хондромаляцией. Само сочленение при этом может оставаться неповрежденным. Иногда хондромаляция протекает параллельно с суставными заболеваниями — остеоартрозами и артритами. Заболевание это известно с начала XX века.
Для того чтобы оценить, насколько тяжело повреждается хрящ при этом заболевании, травматологами было разработано более пяти классификаций. Наиболее удобной оказалась классификация по степени разрушения хряща. Она чаще всего используется в практической медицине. В повреждении хряща были выделены 4 степени:
- Первая степень — хрящ начинает размягчаться и отекать.
- Вторая степень — он делится на части, растрескивается, хрящевая поверхность расслаивается на отдельные волокна. При второй степени повреждается лишь небольшой участок хряща, диаметром не более 12,5 мм.
- Третья степень повреждения представляет собой дальнейшее разрушение хряща. Он растрескивается, делится на волокна в нескольких слоях. Диаметр площади повреждения более 12,5 мм.
- Четвертая степень — разрушение достигает кости, возникает значительный дефект хряща.
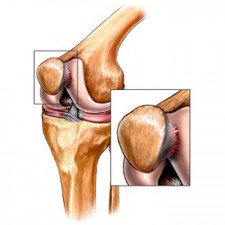
Хондромаляция коленного сочленения может проявлять себя по-разному. Чаще всего отмечаются такие симптомы:
- Боль. Она может быть ноющей или острой, похожей на спазм. Иногда сустав болит только спереди, если затронут надколенник, а иногда весь — независимо от места повреждения.
- Ощущение хруста в колене. Особенно часто оно появляется при подъеме или спуске по лестнице.
- Блокады сустава. Заклинивание сочленения не совсем характерно для хондромаляции, но иногда происходит. Такие блокады называют мягкими из-за стертых симптомов.
- Умеренное ограничение движений. Чаще движения в коленных суставах сохраняются в полном объеме, но при третьей — четвёртой степени могут несколько ограничиваться.
- Отек, припухлость колена. Может появляться при развитии воспаления.
- Неустойчивость в сочленении. Иногда это ощущение описывают как соскальзывание. Встречается в 30% случаев.
Диагностика
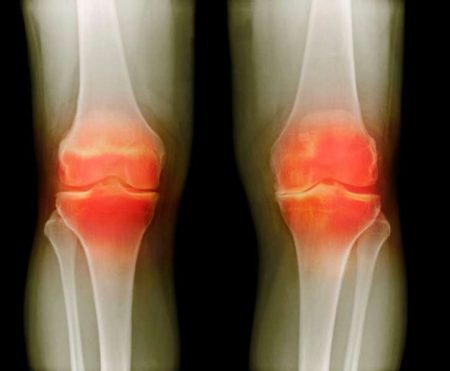
Методами подтверждения диагноза служат артроскопия — осмотр суставной полости при помощи эндоскопа и магнитно-резонансная томография. Предварительный диагноз выставляется по рентгеновскому снимку.
Лечение
Несмотря на невыразительность жалоб лечить это заболевание нужно обязательно. Вслед за четвертой степенью разрушения хряща начинает повреждаться кость — развивается деформирующий остеоартроз коленного сустава.
Часто присоединяется воспаление внутренней суставной оболочки — синовит.
В полости сочленения может накапливаться жидкость. Это приводит к ухудшению состояния и появлению новых жалоб. Для лечения хондромаляции используют консервативные и хирургические методы.
Это вид лечения может помочь лишь в начале заболевания — при первой и второй степени повреждения хряща. В консервативной терапии с успехом применяют как физиотерапевтические процедуры, так и лекарственные средства.

В процессе лечения желательно ограничить нагрузки не только на область колена, но и на весь организм. При занятиях лечебной физкультурой следует отдавать предпочтение упражнениям по укреплению четырехглавой мышцы бедра. Для этого в течение дня нужно многократно повторять разгибания коленных сочленений.
Отличным методом укрепления мышц во всем теле и восстановления суставов является плавание в бассейне.
Из физиотерапевтических процедур при хондромаляции используют магнитотерапию, ультразвуковое воздействие, лазеротерапию.

Основными лекарствами при хондромоляции являются нестероидные противовоспалительные средства. Чаще всего это диклофенак натрия в различных формах и его аналоги. Эти препараты снимают воспаление в области коленных суставов и убирают боль.
Могут назначаться длительным курсом на несколько недель или коротким — для быстрого избавления от симптомов.
Длительное применение противовоспалительных средств чревато развитием кровотечений и образованием язв и эрозий в желудке и кишечнике. Также при их использовании необходимо регулярно проверять состояние свертывающей системы крови.
Для лечения этого заболевания используют и хондропротекторы — хондроитин, глюкозамин. Однако убедительных доказательств их эффективности в лечении хондромаляции пока еще не получено. Иногда медикаментозную терапию дополняют лечением гиалуроновой кислотой и ее аналогами. Вводятся такие препараты внутрь сустава, обычно длительным курсом.
При третьей и четвертой стадии разрушения хрящевой ткани обычно прибегают к оперативному лечению.
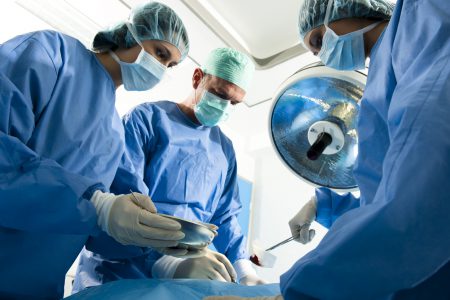
Прежде чем провести операцию, травматологи должны оценить степень повреждения. Это возможно при проведении диагностической артроскопии. Эндоскопический осмотр сустава изнутри позволяет не только определиться с хирургической тактикой, но и сразу провести оперативное вмешательство.
Благодаря артроскопу можно контролировать ход операции не рассекая сустава.Обычно используется местное обезболивание в сочетании с внутривенным наркозом. Объем оперативного вмешательства зависит от тяжести процесса:
- При выявленной первой степени повреждения можно ограничиться промыванием суставной полости. Для этого используется физиологический раствор, в объеме около двух литров.
- Вторая и третья стадии разрушения хряща требуют его частичного удаления — резекции. Для удаления выбираются нестабильные, поврежденные участки. Хрящ резецируется до здорового слоя при помощи специальных ножниц. Оперативное вмешательство, как и при первой стадии разрушения, завершается промыванием полости сочленения физиологическим раствором.
- Четвертая степень повреждения — наиболее сложное для оперативного лечения состояние. В этом случае хрящ разрушен на значительных промежутках, и обычная резекция не спасет положение. Часто требуется проведение костно-хрящевой пластики, пересадка хрящевых или стволовых клеток. На этом этапе хирургическому воздействию подвергается и подхрящевая кость. Специальным шилом или спицей в ней проделывается множество отверстий. Процесс этот называется туннелизация или создание микропереломов. Разрушение кости заставляет организм ее восстанавливать. На месте отверстий образуется соединительная ткань, которая, разрастаясь, закрывает дефекты хряща.
Длительность послеоперационного лечения зависит от вида оперативного вмешательства. В случае эндоскопической операции стационарное лечение занимает не больше недели, затем продолжается амбулаторно. Полноценные физические нагрузки разрешаются с третьей — четвёртой недели. Иммобилизации (обездвиживания) конечности не требуется.
Если проводилось полное рассечение сустава — артротомия, то послеоперационный период затягивается.
При лечении четвертой степени разрушения хряща с проведением костно-хрящевой пластики на ногу накладывается гипсовая повязка. Срок иммобилизации может достигать одного месяца, а умеренные физические нагрузки разрешаются только через 6 недель.
После любой операции показаны восстановительные процедуры — физиотерапия, лечебная физкультура и плавание в бассейне.
Читайте также:


