Миелопатия при амиотрофическом склерозе
Миелопатия — обобщенное понятие, используемое в неврологии для обозначения различных по своей этиологии поражений спинного мозга, обычно имеющих хроническое течение. Клинически они могут проявляться нарушениями силы и тонуса мышц, различными сенсорными расстройствами, дисфункцией тазовых органов. Задачей диагностического поиска при миелопатии является выявление причинного заболевания. С этой целью проводится рентгенография позвоночника, МРТ, ЭМГ, ЭНГ, ангиография, анализ ликвора, биохимические исследования крови, ПЦР-диагностика и др. Лечебная тактика основана на терапии основного заболевания, симптоматическом лечении и реабилитации при помощи ЛФК, механотерапии, массажа, иглоукалывания и физиотерапии.
- Этиология и патогенез миелопатии
- Классификация миелопатии
- Симптомы миелопатии
- Ишемическая миелопатия
- Посттравматическая миелопатия
- Радиационная миелопатия
- Карциноматозная миелопатия
- Диагностика миелопатии
- Лечение миелопатии
- Прогноз и профилактика миелопатии
- Цены на лечение
Общие сведения
Этиология и патогенез миелопатии
В преобладающем большинстве случаев патологические процессы, приводящие к развитию миелопатии, локализуются вне спинного мозга. В первую очередь это дегенеративные изменения позвоночника (остеохондроз, спондилоартроз, спондилез, инволютивный спондилолистез) и травмы (перелом позвонка, подвывих или вывих позвонков, компрессионный перелом позвоночника). За ними следуют сосудистые заболевания (атеросклероз, тромбоз спинальных сосудов), аномалии развития позвоночника, опухолевые процессы в области позвоночника, метаболические нарушения (при диспротеинемии, сахарном диабете, фенилкетонурии, лизосомальных болезнях накопления), туберкулез и остеомиелит позвоночника. К патологическим изменениям спинного мозга может привести радиоактивное и токсическое воздействие на организм.
Реже встречаются миелопатии, обусловленные непосредственным поражением вещества спинного мозга. Первопричиной их возникновения могут являться: позвоночно-спинномозговая травма, инфекционные поражения и опухоли спинного мозга, гематомиелия, демиелинизация. Последняя может носить наследственный (при синдроме Русси-Леви, болезни Рефсума и пр.) или приобретенный (при рассеянном склерозе) характер. В исключительных случаях миелопатия развивается в качестве осложнения люмбальной пункции.
Среди патогенетических механизмов возникновения миелопатии преобладает компрессионный. Возможна компрессия межпозвоночной грыжей, остеофитами, отломками при переломе, опухолью, посттравматической гематомой, смещенным позвонком. При этом происходит как непосредственное сдавление спинного мозга, так и пережатие спинномозговых сосудов, следствием чего является гипоксия и нарушение питания, а затем дегенерация и гибель нервных клеток пораженного спинномозгового сегмента. Возникновение и развитие патологических изменений реализуется постепенно с увеличением компрессии. Результат — выпадение функции нейронов данного сегмента и блокировка проведения через него импульсов, идущих по проводящим путям спинного мозга.
Классификация миелопатии
В современной неврологии миелопатия традиционно классифицируется по этиологическому принципу.
- Спондилогенная (в т. ч. дискогенная) — связана с различными дегенеративными процессами позвоночного столба.
- Ишемическая (дисциркуляторная, атеросклеротическая, сосудистая) — развивается на фоне хронического нарушения спинномозгового кровообращения.
- Посттравматическая — обусловлена как непосредственной травмой спинного мозга (сотрясение, ушиб), так и с компрессионным воздействием гематомы, смещенных позвонков или их частей при переломе.
- Карциноматозная — является проявлением паранеопластического поражения ЦНС при лейкемии, лимфоме, лимфогранулематозе, раке легкого и др. онкологической патологии.
- Инфекционная — встречается при ВИЧ, сифилисе (нейросифилис), болезни Лайма, энтеровирусной инфекции у детей.
- Токсическая — обусловлена токсическим воздействием на ЦНС. Может наблюдаться при дифтерии.
- Радиационная — зависит от дозы и времени радиоактивного облучения. Радиационная миелопатия может возникать после лучевой терапии злокачественных новообразований.
- Метаболическая — редко встречающееся осложнение эндокринных и метаболических расстройств.
- Демиелинизирующая — результат наследственных или приобретенных демиелинизирующих процессов в ЦНС.
Симптомы миелопатии
Клинически миелопатия проявляется целым рядом неврологических симптомов, которые практически не имеют специфики, отражающей ее этиологию, и всецело зависят от уровня и степени поражения спинного мозга. В целом миелопатический симптомокомплекс включает периферический парез/паралич с мышечной гипотонией и гипорефлексией, развивающийся на уровне пораженных сегментов; центральный парез/паралич с мышечным гипертонусом и гиперрефлексией, распространяющийся ниже уровня локализации патологических изменений; гипестезиею и парестезию как на уровне поражения, так и ниже его; тазовые нарушения (задержка или недержание мочи и кала).
Спинномозговые сосуды гораздо реже подвергаются образованию атеросклеротических бляшек и тромбозу, чем церебральные (сосуды головного мозга). Как правило, это происходит у лиц старше 60 лет. Наиболее чувствительными к ишемии являются мотонейроны, находящиеся в передних рогах спинного мозга. По этой причине в клинической картине сосудистой миелопатии ведущее место занимают двигательные нарушения, что напоминает проявления БАС. Расстройства чувствительной сферы минимальны и выявляются лишь при тщательном неврологическом осмотре.
Представляет собой развивающийся в зависимости от тяжести травмы и течения ближайшего посттравматического периода спинальный синдром. По клиническим проявлениям часто имеет много общего с сирингомиелией, в частности диссоциированный тип чувствительных расстройств: выпадение поверхностной (температурной, болевой и тактильной) чувствительности при сохранности глубокой (мышечно-суставной и вибрационной). Обычно посттравматическая миелопатия носит необратимый характер и составляет основу резидуальных (остаточных) явлений травмы. В отдельных случаях отмечается ее прогредиентное течение с прогрессированием сенсорных нарушений. Зачастую посттравматическая миелопатия осложняется интеркуррентными инфекциями мочевыводящих путей (циститом, уретритом, пиелонефритом); возможен сепсис.
Наиболее часто наблюдается в шейных спинномозговых сегментах у пациентов, прошедших лучевую терапию рака глотки или рака гортани; в грудном отделе — у больных, получавших облучение по поводу опухолей средостения. Развивается в период от 6 мес до 3-х лет после лучевых нагрузок; в среднем спустя 1 год. В таких случаях миелопатия нуждается в дифференциальной диагностике со спинномозговыми метастазами имеющейся опухоли. Типично медленное прогрессирование клиники, обусловленное постепенным некрозом тканей спинного мозга. При неврологическом осмотре может выявляться синдром Броун-Секара. В цереброспинальной жидкости изменения не наблюдаются.
Обусловлена токсическим влиянием опухоли и воздействием синтезируемых ею биологически активных веществ, что в конечном итоге приводит к некротическим изменениям спинномозговых структур. Клинический симптомокомплекс во многом повторяет неврологические нарушения при боковом амиотрофическом склерозе. Поэтому некоторые авторы относят этот вид миелопатии к особой форме БАС. В ликворе может выявляться плеоцитоз и умеренный гиперальбуминоз.
Диагностика миелопатии
Диагностический алгоритм при выявлении признаков миелопатии направлен на исключение другой, сходной по клиническим симптомам, патологии ЦНС и установление этиологического фактора, лежащего в основе дистрофических изменений спинного мозга. Он включает общий и биохимический анализ крови, рентгенографию позвоночника, МРТ позвоночника, электромиографию (ЭМГ), электронейрографию (ЭНГ), исследование вызванных потенциалов, МР- или КТ-ангиографию спинного мозга, люмбальную пункцию.
По показаниям при отсутствии возможности проведения МРТ в отдельных случаях могут быть выполнены миелография и дискография. При подозрении на инфекционную природу миелопатии проводится исследование крови на стерильность, RРR-тест, ПЦР-исследования, посев спинномозговой жидкости.
В ходе диагностического поиска невролог может привлекать к совместному консультированию других специалистов: вертебролога, фтизиатра, онколога, венеролога; при предположении о демиелинизирующей наследственной миелопатии — генетика.
Лечение миелопатии
Тактика лечения миелопатии зависит от ее этиологии и клинической формы. Она включает терапию причинного заболевания и симптоматическое лечение.
При компрессионной миелопатии первоочередным является устранение компрессии. С этой целью может быть показано удаление клина Урбана, дренирование кисты, удаление гематомы и опухоли. При сужении позвоночного канала пациент направляется к нейрохирургу для решения вопроса о возможном проведении декомпрессивной операции: ламинэктомии, фасетэктомии или пункционной декомпрессии диска. Если компрессионная миелопатия обусловлена грыжей межпозвоночного диска, то в зависимости от степени протрузии и состояния диска выполняется микродискэктомия или дискэктомия.
Лечение ишемической миелопатии заключается в устранении факторов компрессии сосудов и проведении сосудистой терапии. Поскольку сосудистый компонент присутствует в патогенезе практически любой миелопатии, подобное лечение входит в комплексную терапию большинства больных. Оно включает спазмолитические и сосудорасширяющие средства (дротаверин, ксантинола никотинат, папаверин, винпоцетин), препараты улучшающие микроциркуляцию и реологические свойства крови (пентоксифиллин).
При токсической миелопатии основу лечения составляет дезинтоксикация, при инфекционной — адекватная этиологии антибактериальная терапия. Большие трудности представляет лечение наследственной демиелинизирующей миелопатии и канцероматозной миелопатии при гемобластозах. Зачастую оно сводится к проведению симптоматической терапии.
Обязательными в лечении миелопатии являются препараты, улучшающие метаболизм нервной ткани и снижающие ее подверженность гипоксии. К ним относятся нейропротекторы, метаболиты и витамины (гидролизат мозга свиньи, пирацетам, гемодериват крови телят, вит В1, вит В6). Многим пациентам показана консультация физиотерапевта для оптимального подбора методов физиотерапевтического воздействия: диатермии, гальванизации, УВЧ, парафинотерапии и пр.
С целью увеличения объема двигательной активности, выработки навыков самообслуживания, предупреждения развития осложнений (мышечных атрофий, контрактур суставов, пролежней, застойной пневмонии) с ранних сроков заболевания больным миелопатией показано проведение ЛФК, массажа и реабилитационной физиотерапии (электростимуляция, электрофорез с неостигмином, рефлексотерапия, СМТ паретичных мышц, водолечение). При глубоких парезах ЛФК состоит в выполнении пассивных упражнений и механотерапии.
Прогноз и профилактика миелопатии
В случае своевременного устранения сдавления компрессионная миелопатия имеет благоприятное течение: при соответствующем лечении ее симптомы могут в значительной степени редуцироваться. Ишемическая миелопатия зачастую имеет прогрессирующее течение; повторные курсы сосудистой терапии могут на время стабилизировать состояние. Посттравматическая миелопатия, как правило, стабильна: ее симптомы не редуцируются и не прогрессируют. Неблагоприятный прогноз и неуклонно прогрессирующее течение имеют радиационная, демиелинизирующая и карциноматозная миелопатия.
Профилактика миелопатии заключается в предупреждении заболеваний, способных привести к ее развитию. Это своевременное выявление и лечение патологии позвоночника и сосудистых заболеваний; стабильная компенсация эндокринных и метаболических расстройств; предупреждение травматизма, инфекционных заболеваний, интоксикаций свинцом, цианидами, гексахлорофеном и др.
Миелопатия — это общий медицинский (неврологический) термин, который обозначает разные по происхождению виды спинномозговых патологий. Их проявлениями являются нарушения мышечной силы и тонуса, функций органов таза.
Основная задача диагностики — определение болезни, ставшей причиной миелопатии. Терапия направлена на лечение основной болезни, устранение симптомов и реабилитацию с помощью лечебной физкультуры, массажа, механотерапии, иглоукалывания, физиотерапевтических методов.
Миелопатия

В это комплексное понятие входят все дистрофии спинного мозга вне зависимости от происхождения. Обычно это дегенеративные патологические процессы, характеризующиеся острым либо подострым течением, которые происходят вследствие нарушения кровообращения в отдельных сегментах спинного мозга и нарушения обмена веществ в них.
Этиология
Практически всегда болезненные процессы, которые вызывают миелопатию, происходят за пределами спинного мозга. Это дегенеративные изменения в структуре позвоночника и позвоночные травмы. Также распространённой причиной являются болезни сосудов, отклонения в развитии позвоночника, нарушения обмена веществ, позвоночный туберкулёз, а также остеомиелит.
В более редких случаях отмечаются миелопатии, причиной которых стало непосредственное поражение спинномозгового вещества. К таким факторам относятся травмы спинного мозга, инфекции, поражающие его, спинномозговые опухоли, демиелинизация наследственного либо приобретённого характера.
Основным механизмом патогенеза миелопатии является компрессия (сдавливание). Причинами сдавливания могут быть межпозвоночная грыжа, остеофиты, обломки при переломе, опухоль, смещённый позвонок. Это сопровождается сдавливанием спинного мозга и его сосудов, вследствие чего возникает гипоксия, нарушается питание, после чего гибнут нервные клетки в поражённом сегменте спинного мозга. Появление болезненных изменений и их развития происходят постепенно при усилении компрессии.
Формы миелопатии
Различают несколько форм миелопатии.
- Спондилогенная — вызываемая патологическими процессами дегенерации столба позвоночника;
- Ишемическая — возникающая вследствие нарушений кровообращения;
- Посттравматическая — вызванная либо спинномозговой травмой, либо сдавливанием из-за гематомы либо смещённых позвонков, либо частей позвонков после перелома;
- Карциноматозная — следствие поражения ЦНС, вызываемого лейкемией, лимфомой, лимфогранулематозом, раком лёгких;
- Токсическая — вызывается токсическим влиянием на ЦНС;
- Радиационная — вызываемая радиоактивным облучением и возникающая, в частности, вследствие лучевой терапии онкологических заболеваний;
- Метаболическая — возникающая вследствие осложнения патологий, связанных с обменом веществ;
- Демиелинизирующая — является следствием наследственной либо приобретённой демиелинизирующей патологии ЦНС.

Симптомы
При миелопатии отмечается большое количество различных симптомов неврологического характера. Все они являются неспецифичными, отражают причину миелопатии и полностью определяются степенью спинномозгового поражения.
К ним относятся периферический парез либо паралич, гипотония мышц, гипорефлексия на уровне позвоночных сегментов, поражённых миелопатией; центральный парез либо паралич, повышенный тонус мышц, гиперрефлексия, распространяющиеся под уровнем патологических изменений; парестезия и гипестезия и на уровне поражённого участка, и под ним; расстройства функций органов таза.

Сосуды спинного мозга намного реже подвержены формированию в них тромбов и бляшек по сравнению с сосудами мозга головы. Обычно такие процессы происходят в возрасте от 60.
Самые уязвимые в отношении ишемии — те моторные нейроны, которые расположены в передней части спинного мозга. Поэтому главным симптомом данной формы миелопатии являются нарушения подвижности. По симптоматике ишемическая миелопатия сходна с боковым амиотрофическим склерозом.

Её развитие в каждом конкретном случае может иметь определённые особенности. Симптомы посттравматической миелопатии нередко во многом сходятся с симптомами сирингомиелии. К таким сходствам относится прежде всего диссоциированное нарушение чувствительности, которое заключается в потере поверхностной чувствительности с одновременным сохранением глубокой чувствительности (вибрационной и мышечной).
Как правило, эта форма миелопатии является необратимой. Относится к остаточным травматическим явлениям. Редко имеет прогрессирующее течение, при этом отмечается развитие сенсорных расстройств. Нередко наступают осложнения в виде интеркуррентных инфекций.
Чаще обнаруживается у больных, которые прошли радиотерапию рака гортани. Также может возникать в грудном позвоночном отделе у пациентов, проходивших лучевое лечение опухолей, локализированных в средостении. Время развития варьируется от шести месяцев до трёх лет с момента окончания лучевой терапии.
Радиационная форма миелопатии требует дифференциального подхода при диагностировании — её необходимо дифференцировать с метастазами уже имеющейся в другом месте организма опухоли в спинной мозг.
Характерно медленное развитие симптомов, причиной чего является медленный процесс некроза спинномозговых тканей.
Её причиной является токсическое воздействие самой опухоли, а также некоторых вырабатываемых ею веществ. Симптомы в значительной мере сходны с проявлениями неврологических расстройств в случае БАС. Потому ряд авторов считают данную форму миелопатии специфической формой бокового амиотрофического склероза. При анализе ликвора иногда обнаруживается повышенная концентрация альбумина.
Диагностика
Диагностика миелопатии основана прежде всего на дифференциации её с другими патологиями, которые имеют сходные проявления, и определении причины дистрофических процессов в спинном мозге. Используются анализы крови, позвоночная рентгенография, томография, электромиография, спинномозговая ангиография и пункция позвоночника.
При наличии показаний, если отсутствует возможность провести томографию, назначается дискография. При диагностике невролог иногда отправляет на консультации к другим профильным специалистам: вертебрологу, генетику.
Лечение
Направлено на причинную болезнь и устранение симптомов.
При компрессионной форме миелопатии главной задачей становится устранение сдавливания. В случае сужения канала позвоночника больного направляют к нейрохирургу, решающему вопрос необходимости в операции, направленной на устранение компрессии. Если причина компрессионной миелопатии — межпозвонковая грыжа, то с учётом степени протрузии осуществляют дискэктомию либо микродискэктомию.
Ишемическая миелопатия лечится путём устранения сдавливания сосудов и осуществления сосудистой терапии. В процессе возникновения почти каждого случая миелопатии так или иначе задействованы сосуды, потому такая терапия является частью комплексного лечения практически всех пациентов и подразумевает применение спазмолитиков и препаратов, которые расширяют сосуды и улучшают местное кровообращение.
В случае токсической формы миелопатии лечение направлено прежде всего на снятие интоксикации, в случае инфекционной формы проводится антибактериальное лечение, соответствующее причине миелопатии.
Для повышения подвижности, способности к самообслуживанию, профилактики осложнений (атрофия мышц, контрактура суставов, застойная пневмония) пациентам с миелопатией назначаются лечебная физкультура, массаж, реабилитационная физиотерапия (в частности, электрофорез, рефлексотерапия, гидротерапия). В случае глубоких парезов лечебная физкультура предусматривает пассивные упражнения.
Прогноз при миелопатии
При условии своевременного устранения компрессии при компрессионной форме миелопатии прогноз благоприятный: правильная терапия приводит к редукции симптомов. При ишемической миелопатии течение нередко является прогредиентным, однако повтор курса сосудистой терапии способен временно стабилизировать состояние.
При посттравматической миелопатии обычно состояние пациента стабильное, её проявления не склонны к прогрессированию или редукции. При радиационной, демиелинизирующей, а также карциноматозной формах миелопатии течение прогрессирующее, прогноз неблагоприятный.

Профилактика
Профилактика миелопатии направлена на исключение болезней, которые могут вызвать её возникновение. Она подразумевает предупреждение болезней позвоночника, стабильную компенсацию нарушений метаболизма, всех инфекционных болезней и различных интоксикаций.
Что такое миелопатия?
Миелопатию, которую еще называют компрессией спинного мозга, считают одной из частых причин боли в шее у людей старше 55 лет во всем мире. Почти у 10% пациентов, имеющих симптомы стеноза позвоночного канала, со временем развивается миелопатия. Миелопатия также является составной частью различных медицинских состояний, вызывающих боль в шее, таких как, например, поперечный миелит, боковой амиотрофический склероз, синдром Броун-Секара и другие. Однако чаще всего миелопатия бывает вызвана проблемами с позвонками, дугоотросчатыми суставами позвоночника и межпозвонковыми дисками, а также проблемами с нервами, мышцами и связками позвоночника.
Причины
Естественное изнашивание структур позвоночника — это самая распространенная причина миелопатии. Когда тело стареет, естественное изнашивание структур позвоночника вызывает процесс дегенерации. Дегенеративные изменения затрагивают дугоотросчатые суставы, межпозвонковые диски и связки.
Когда межпозвонковые диски состариваются, они начинают усыхать и затвердевать, они начинают давить на близлежащие структуры, в том числе на хрящевую поверхность дугоотросчатых суставов. Это добавляет нагрузку на суставы и мешает им правильно работать, что запускает цикл дегенерации. Дегенерация межпозвонкового диска также может привести к появлению межпозвонковой грыжи, которая может сдавить близлежащий корешок спинномозгового нерва или даже спинной мозг, вызывая целый комплекс неприятных симптомов.
Межпозвонковая грыжа образуется в том случае, когда в ослабленной внешней оболочки межпозвонкового диска появляется трещина или разрыв, через который часть гелеобразного содержимого диска (пульпозного ядра) буквально выдавливается в позвоночный канал под действием силы тяжести. Обычно межпозвонковая грыжа бывает не настолько больших размеров и расположена не таким образом, чтобы сдавить спинной мозг. Как правило, при грыже наблюдается только сдавление корешка спинного мозга. Симптомы сдавления корешка спинного мозга тоже могут быть очень неприятными и даже инвалидизирующими, однако потенциально такое состояние гораздо менее опасно и, в превалирующем большинстве случаев, прекрасно лечится консервативными методами. Спинной мозг может сдавить только грыжа больших размеров, находящаяся в определенном положении, нередко на фоне уже имеющегося стеноза позвоночного канала. Симптомы миелопатии, несмотря на частое отсутствие болевого синдрома гораздо более опасны, так как являются проявлениями выпадения функций, котрые контролируют спинной мозг.
Дегенерация структур позвоночника может запустить формирование костных разрастаний (остеофитов), которые также могут сдавливать корешки спинномозговых нервов и иногда спинной мозг. Кроме того, на фоне разрастания костей позвонков возникает сужение (стеноз) позвоночного канала. Поскольку спинной мозг и отходящие от него корешки спинномозговых нервов располагаются как раз в позвоночном канале, вероятность того, что будет задет нерв или спинной мозг, увеличивается.
Другой частотной причиной миелопатии является травма, например, полученная при занятиях спорта, в дорожной аварии или при падении. Такие травмы нередко затрагивают мышцы и связки, которые стабилизируют позвоночника. Также травмы могут вызвать перелом костей и смещение суставов.
Миелопатия может быть также вызвана воспалительным заболеванием, таким как, к примеру, ревматоидный артрит, при котором иммунная система человека атакует суставы позвоночника, как правило, шейного отдела. Менее распространенные причины миелопатии включают опухоли, инфекции и врожденные аномалии позвонков.
Симптомы миелопатии
Самые распространенные симптомы миелопатии включают ощущение скованности в шее, постоянную ноющую боль в шее с одной или с обеих сторон, ноющую боль в руках и плечах, скованность и слабость в ногах и проблемы с хождением. Человек также может чувствовать похрустывание или треск при движении шеей. Пациенты с миелопатией часто испытывают острую боль в руке, локте, запястье, пальцах, тупую боль или онемение в руке. Миелопатия также может вызывать потерю чувства положения конечностей, что, к примеру, может привести к тому, что пациент не может двигать руками, если он на них не смотрит. Кроме того, при миелопатии может наблюдаться недержание мочи и кала за счет нарушения чувствительности. Симптомы миелопатии прогрессируют многие годы и могут быть неочевидными до того момента, пока компрессия спинного мозга не составит 30%.
Диагностика
Если результаты осмотра и полученные во время беседы данные настораживают врача и склоняют его к мысли о возможной миелопатии, он назначает дополнительные обследования, которые могут включать рентгенографию для проверки состояния позвонков, магнитно-резонансную томографию, которая позволит выявить наличие межпозвонковой грыжи и компрессии спинного мозга, а также миелографию, если проведение МРТ по каким-то причинам невозможно. Кроме того, электромиография (ЭМГ) может быть полезной для выявления других состояний и заболеваний, симптомы которых напоминают симптомы миелопатии.
Лечение
Хотя лучшим лечением для большинства пациентов с миелопатией является хирургическая декомпрессия спинного мозга, для той группы пациентов, у которых симптомы миелопатии выражены слабо, более подходящим будет ожидание с постоянным мониторингом состояния. Если симптомы миелопатии выражены незначительно, врач может порекомендовать, комплекс упражнений, чтобы укрепить позвоночник и повысить его гибкость, различные массажные методики, а также медицинские препараты, направленные на снятие болевого синдрома, например, нестероидные противовоспалительные препараты (НПВП). По нашему опыту для лечения миелопатии необходимо уменьшить размер грыжи диска, особенно, в случае стеноза позвоночного канала, так как операции на шее в случае стеноза приводят к более частым осложнениям и часто инвалидизируют пациента. Применение гирудотерапии поможет снять воспаление, отек и уменьшить болевой синдром. Гирудотерапия в отличие от стероидных гормонов не имеет побочных эффектов и более эффективна.
Основной целью хирургического вмешательства при миелопатии, как уже было сказано, является декомпрессия спинного мозга. Врач может выбрать ламинотомию с боковым доступом (через надрез в спине). С помощью такой операции можно убрать часть костной ткани позвонка, которая сдавливает спинной мозг и, таким образом, освободить пространство для спинного мозга. Тем не менее, эта процедура может не подойти всем пациентам, поскольку она может привести к нестабильности позвоночного сегмента и развитию кифоза. Врач также может использовать передний подход при операции на шейном отделе позвоночника, что позволит ему увидеть и удалить остеофит или межпозвонковую грыжу, оказывающие давление на спинной мозг. Во время процедуры врач также может провести спинальную фузию (сращение позвоночного сегмента с помощью костного имплантата), чтобы снизить риск осложнений после хирургического вмешательства.
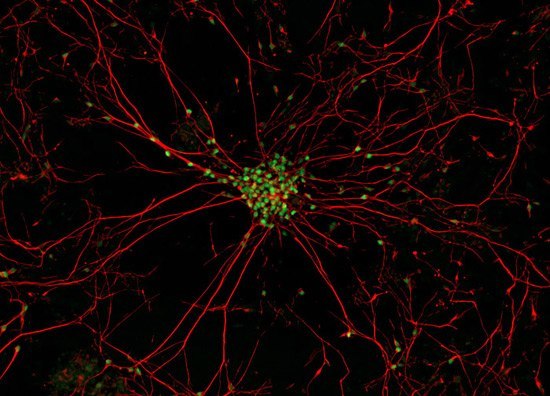
Настоящее фото мотонейрона (двигательного нейрона в передних рогах спинного мозга) - закупорка межсинаптических щелей (зелёные точки) - блокада передачи импульсов через медиаторы (вещества для передачи импульсов) в синапсы (места соединения) отростков нервных клеток.
В центре - тело мотонейрона.
Красные линии -длинные отростки мотонейрона - аксоны и короткие -дендриты.
Причина появления блокады передачи импульсов в межсинаптических щелях учёными мира не найдена. Предположительно - мутация гена,кодирующего фермент передачи этих импульсов через нейромедиаторы - супероксиддисмутазы. (СОД).
Предрасположенность к мутациям гена может иметь наследственный характер по аутосомно-рецессивному типу.
Эндемические (массовые вспышки) случаи этого заболевания зафиксированы у групп военных, живущих в островах на тихом океане. Чаще болеют мужчины от 40 до 60 лет.Следовательно не исключается инфекционная причина развития заболевания.
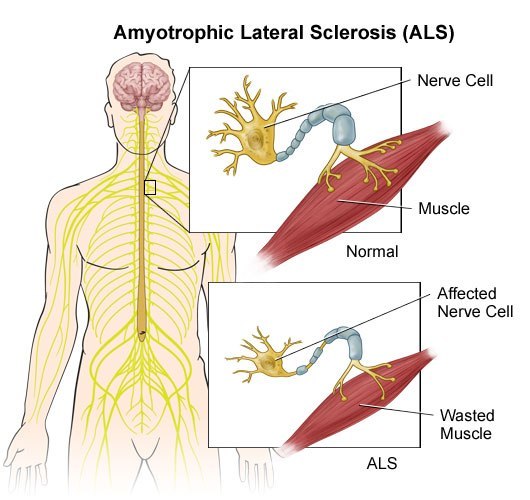
Боковой амиотрофический склероз. (БАС)..
Показано истончение нервных волокон в случае БАС и нарушение иннервации (передачи нервных импульсов) к мышцам. Как следствие - уменьшение работы мышцы и её последующая атрофия. (уменьшение размеров, обратное развитие.)
Блокада передачи нервных импульсов к мышцам (как к поперечно-полосатым которыми мы управляем сами своей волей так и к к гладким, работающим, независимо от нашего сознания, усилий и воли) пищеварительной и дыхательной системы ведёт к смерти из-за невозможности совершать эти жизненно важные моменты работы мускулатуры.
Две статьи из медицинских источников:
1) Теория аксостаза бокового амиотрофического склероза. Аксональная теория бокового амиотрофического склероза
Теория аксостаза основана на анализе патологических процессов, происходящих в аксональном транспорте мотонейронов [Chou S., 1992]. Наибольшими нейронами организма являются двигательные мотонейроны передних рогов спинного мозга и пирамвды Беца. Они должны поддерживать интеграцию дендритов, часто протяженностью более 1 см, и аксон, достигающий 100 см. В аксоне имеются непрерывные потоки, через которые клеточное тело направляет структурные и функциональные белки на периферию и получает обратные сигналы. Ортоградный транспорт бывает 2 видов: а) быстрый — 400 мм в день, идущий в обоих направлениях и транспортирующий связанные с мембраной белки и гликопротеиды, б) медленный — несколько миллиметров в день, транспортирующий сети микрофиламентов, микротрубочек, нейрофиламентов, как компонент "а" (0,1—2 мм в день), а также большой комплекс растворимых белков, как компонент "б" (2—4 мм в день). Ретроградный аксональный транспорт несет эндогенные (аминокислоты, фактор роста нервов) и экзогенные (токсин столбняка, вирус полиомиелита, простого герпеса, бешенства, лектин пероксидазы хрена и др.) субстанции от терминальных аксонов к клеточному телу со скоростью свыше 75 мм в день. Морфологические исследования аксонального транспорта в биоптатах двигательных веточек периферических нервов больных боковым амиотрофическим склерозом выявили уменьшение скорости ретроградного аксонального транспорта и, следовательно, связи терминального аксона с перикарионом [Bieuer A. et al., 1987]. В межреберных нервах больных АБС еще до развития признаков нейрональной дегенерации появляются изменения белков микротрубочек [Binet S. et al., 1988].
Улыраструктурные исследования проксимального аксона и аксонального бугорка мотонейронов переднего рога спинного мозга больных, умерших от бокового амиотрофического склероза [Sasaki S. et al., 1996], показали нарушение быстрого аксонального транспорта. Гладкий эндо-плазматический ретикулум теряет структуру: происходит скопление митохондрий, лизосом, Леви-подобных телец, эозино-фильных и гиалиновых включений, липофусциновых гранул, особенно в аксональном бугорке. Присутствие этих необычных структур является отражением дисфункции аксонального транспорта. Применительно к возможной этиологии АБС еще ранее выдвинута концепция "аксостаза" [Chou S., 1992]. Ней-ротоксические факторы путем ретроградного транспорта избирательно поражают нейрон, создавая феномен "суицидцального транспорта". Ухудшение медленного транспорта в аксоне сопровождается скоплением нейрофиламентов, набуханием проксимального аксона и последующей дистальнои аксональной атрофией, а также вторичной демиелинизацией, характерной для центральной дистальнои аксонопатии или "ретроградного умирания" — "dying back". Определенную значимость в развитии ранних морфологических изменений мотонейронов при АБС имеет теория аутоиммунитета [Smith R. et al., 1996], основанная на появлении антител к зарядам входа кальциевых каналов. Пассивный перенос фракций, содержащих иммуноглобулин, мышам вызывает изменения нервно-мышечных соединений, сходные с таковыми при спорадическом АБС. У животных эти изменения отражают расстройства внутриклеточного Са2+ гомеостаза, и раннее повреждение пластинчатого комплекса в мотонейронах в форме набухания и фрагментации. Иммуноглобулины от больных спорадическим боковым амиотрофическим склерозом вызывают зависимый от Са2+ апоптоз клеток вследствие оксидативных повреждений. Апоптоз, обусловленный иммуноглобулином от указанных больных, регулируется присутствием связанных белков, которые могут модулировать избирательную ранимость нейронов при спорадическом АБС.
2) Боковой амиотрофический склероз
Несмотря на более чем 100-летнее изучение, боковой амиотрофический склероз (БАС) остается фатальным заболеванием центральной нервной системы. Заболевание характеризуется неуклонно прогрессирующим течением с избирательным поражением верхнего и нижнего мотонейронов, что приводит к развитию амиотрофий, параличей и спастичности. До настоящего времени вопросы этиологии и патогенеза остаются невыясненными, в связи с чем не разработаны специфические методы диагностики и лечения этого заболевания. Рядом авторов отмечено повышение частоты встречаемости заболевания среди лиц молодого возраста (до 40 лет).
МКБ-10 G12.2 Болезнь двигательного неврона
ЭПИДЕМИОЛОГИЯ
Боковой амиотрофический склероз дебютирует в возрасте 40 – 60 лет. Средний возраст начала заболевания 56 лет. БАС - болезнь взрослых, и не наблюдается у лиц моложе 16 лет. Несколько чаще заболевают мужчины (отношение мужчины-женщины 1,6-3.0: 1).
БАС является спорадическим заболеванием и встречается с частотой 1,5 – 5 случая на 100 000 населения.
В 90% случаев БАС носит спорадический, а в 10% - семейный или наследственный характер как с аутосомно-доминантным (преимущественно), так и с аутосомно-рецессивным типами наследования. Клинические и патоморфологические характеристики семейного и спорадического БАС практически идентичны.
В настоящее время возраст является основным фактором риска при БАС, что подтверждается нарастанием заболеваемости после 55 лет, и в этой возрастной группе уже не наблюдается различий между мужчинами и женщинами. Несмотря на достоверную связь БАС с возрастом, старение является только одним из предрасполагающих факторов развития патологического процесса. Вариабельность заболевания как в различных возрастных группах, так и среди лиц одного возраста предполагает существование определённых факторов риска: дефицит, или наоборот, наличие определённых нейропротективных факторов, к которым в настоящее время относят: нейростероиды или половые гормоны; нейротрофические факторы; антиоксиданты.
Некоторые исследователи отмечают особо благоприятное течение заболевания у молодых женщин, что подтверждает несомненную роль половых гормонов, в особенности эстрадиола и прогестина, в патогенезе бокового амиотрофического склероза. Подтверждением этому являются: большая частота встречаемости БАС у мужчин до 55 лет (при этом у них отмечается более раннее начало и быстрое прогрессирование заболевания по сравнению с женщинами); с наступлением менопаузы женщины болеют также часто, как и мужчины; единичные случаи заболевания боковым амиотрофическим склерозом во время беременности. К настоящему времени существуют единичные работы по изучению гормонального статуса больных с боковым амиотрофическим склерозом, и ни одной, посвящённой определению концентраций гормонов у молодых пациентов.
Этиология заболевания не ясна. Обсуждается роль вирусов, иммунологических и метаболических нарушений.
В развитии семейной формы БАС показана роль мутации в гене супероксиддисмутазы-1 (Cu/Zn-супероксиддисмутазу, SOD1), 21q22-1 хромосома, выявлен также БАС, связанный с 2q33-q35 хромосомой.
Синдромы, клинически не отличимые от классического БАС, могут возникать в результате:
•опухоли большого затылочного отверстия
•спондилез шейного отдела позвоночника
•артериовенозная аномалия спинного мозга
•бактериальные - столбняк, болезнь Лайма
•вирусные - полиомиелит, опоясывающий лишай
Интоксикации, физические агенты:
•токсины - свинец, алюминий, другие металлы.
Читайте также:


