Методы диагностики нервно мышечных заболеваний
Исследование ферментов в крови. Разработаны методы определения в крови ряда лизосомных ферментов при поражении или дегенерации мышечных волокон. Среди этих ферментов наибольшее диагностическое значение имеет креатинкиназа. Этот фермент обнаружен только в трех органах, в соответствии с локализацией выделяют три типа креатинкиназы: ММ — в скелетных мышцах, MB — в мышце сердца и ВВ — в головном мозге.
Определение креатинкиназы в плазме крови, без сомнения, не может быть единым скрининговым тестом в диагностике всех нервно-мышечных заболеваний, так как многие из них не сопровождаются повышением активности ферментов в плазме крови. Повышенная активность креатинкиназы характерна для некоторых заболеваний, в частности мышечной дистрофии Дюшенна.
Молекулярно-генетическое исследование. В настоящее время разработаны методы исследования многих ДНК-маркеров наследственных миопатии и невропатий в крови. Если клинические проявления позволяют заподозрить какое-то нервно-мышечное заболевание, эти исследования помогают подтвердить диагноз и не подвергать ребенка таким инвазивным процедурам, как мышечная биопсия. Определение других молекулярных маркеров возможно только при биопсии мышц. Генетический анализ крови как одного пациента, так и в серии — дорогостоящая процедура, которая обычно не предусмотрена программой медицинского страхования.
Исследование скорости проведения возбуждения по нервам. Скорость проведения возбуждения по двигательным и чувствительным нервам можно исследовать электрофизиологическим методом с помощью поверхностных электродов. Для различных типов невропатий характерно снижение скорости проведения возбуждения по нервам. Этот метод позволяет определить зоны травматического повреждения нерва. Скорость проведения возбуждения при рождении примерно в 2 раза меньше, чем к 2 годам жизни. Нормальная скорость проведения возбуждения в различном возрасте в период младенчества, в том числе у недоношенных новорожденных, указана в специальных таблицах.
Поскольку это исследование регистрирует только наибольшую скорость проведения возбуждения по волокнам нерва, снижение скорости указывает на поражение не менее 80 % волокон нерва.
Электромиография. Для регистрации ЭМГ требуются введение специальных игл в мышцу и запись электрических потенциалов на различных стадиях сокращения мышцы. Этот метод менее распространен в педиатрической практике, чем при исследовании взрослых пациентов, отчасти в связи с техническими затруднениями, возникающими при записи этих потенциалов у детей раннего возраста, и частично в связи с необходимостью сотрудничества со стороны пациента в процессе исследования для получения наиболее точного результата (необходимо полное расслабление и максимально полное сокращение определенных мышц). Большинство детей слишком напуганы, чтобы выполнять команды врача во время исследования.
Характерный паттерн ЭМГ позволяет отличить денервацию от миопатического процесса. С помощью этого метода обычно невозможно точно определить тип миопатии, однако позволяет диагностировать некоторые специфические миопатические состояния, такие как миотония. После проведения ЭМГ возможно транзиторное повышение активности креатинкиназы в крови.
ЭМГ в сочетании с повторной электрической стимуляцией двигательных нервов вызывает тетаническое сокращение мышцы, что применяется для демонстрации декрементной реакции при миастении. Для этих исследований используются также мелкие мышцы, например отводящая мышца мизинца или мышца в области гипотенара.
Мышечная биопсия. Биопсия мышц — наиболее важный и специфичный метод исследования для диагностики большинства нервно-мышечных заболеваний, применяется в том случае, если точный диагноз наследственного заболевания не установлен на основании молекулярно-генетического исследования крови. Биопсия мышц не только позволяет отличить неврогенный и миопатический процесс, но и определяет тип миопатии и дефицит специфического фермента. Для биопсии наиболее часто используют латеральное брюшко четырехглавой мышцы бедра.
В большей части случаев следует избегать биопсии дельтовидной мышцы, так как в норме 60-80 % волокон этой мышцы составляют волокна I типа, в связи с чем паттерн распределения типа волокон в мышцах установить трудно. Мышечная биопсия — простая процедура, выполняемая в амбулаторных условиях. Она выполняется под местной анестезией без блокады бедренного нерва или в сочетании с ней. Игольчатая биопсия не рекомендуется, так как в этом случае на коже проводится разрез как при открытой биопсии, необходим многократный забор мышечный ткани для получения более точного результата и в целом результаты исследования менее точные, чем при открытой биопсии.
Гистохимическое исследование замороженных срезов мышц необходимо во всех случаях биопсии мышц в детской практике, так как многие виды врожденных и метаболических миопатии не могут быть диагностированы при исследовании парафиновых срезов с помощью традиционных методов окрашивания. В некоторых случаях важную роль играет иммуногистохимический анализ, например для выявления дистрофина при подозрении на мышечную дистрофию Дюшенна или мерозина — при врожденной мышечной дистрофии. Необходимо подготовить часть биопсийного материала для электронной микроскопии. В отдельных случаях исследование ультраструктуры мышц имеет дополнительное диагностическое значение.
Интерпретация данных мышечной биопсии сложна и должна осуществляться опытным патологом. Следует сохранить часть замороженной мышечной ткани, учитывая, что может возникнуть необходимость биохимического анализа (например, для подтверждения митохондриальных нарушений, определения карнитинпальмитилтрансферазы и кислой мальтазы).
Биопсия нерва. Наиболее часто для биопсии берут ткань икроножного нерва; это чисто сенсорный нерв, который иннервирует небольшую область кожи на латеральной поверхности стопы. Для биопсии возможен участок целого нерва или отдельных его волокон. Если участок нерва берут для биопсии позади латеральной лодыжки, регенерация нерва наблюдается более чем в 90 % случаев, стойкие сенсорные нарушения отсутствуют. Икроножный нерв часто поражается при многих видах невропатий, которые клинически проявляются преимущественно как моторные.
В большинстве случаев проводится электронная микроскопия материалов, полученных при биопсии нерва, так как многие морфологические изменения не могут быть выявлены при световой микроскопии. Иногда волокна исследуют после их стимуляции, что помогает выявлению сегментарной демиелинизации, аксональных утолщений и других специфических аномалий, однако эта процедура занимает много времени и не проводится в рутинном порядке. Возможно применение специальных методов окрашивания замороженных или парафиновых срезов биоптатов мышц для демонстрации миелина, аксоплазмы и продуктов метаболизма.
Электрокардиография. Исследование функции сердца имеет важное значение при подозрении на миопатию, так как сердце нередко поражается при мышечных дистрофиях, а также при воспалительных и метаболических миопатиях. ЭКГ часто позволяет выявить ранние признаки кардиомиопатии или нарушения сердечной проводимости, которые не проявляются клинически. В некоторых случаях показано более полное обследование функции сердца, включая ЭхоКГ и консультацию детского кардиолога. При мышечных дистрофиях и других хронических заболеваниях двигательных единиц показано проведение серии функциональных тестов, позволяющих оценить функцию легких.

Касаткина Л.Ф., Гильванова О.В.
М.: Медика, 2010. 416 с.: ил.
В книге приводится краткая характеристика методов исследования периферической нервной системы, дается подробное описание метода игольчатой электромиографии и возможностей ее применения для диагностики различных нервно-мышечных заболеваний - болезней мотонейронов спинного мозга, периферических нервов, нервно-мышечной передачи и мышц. Описаны клинические примеры некоторых нервно-мышечных заболеваний с результатами электромиографических исследований.
Книга предназначена для неврологов, специалистов по функциональной диагностике, врачей других специальностей, где необходима оценка состояния периферического нейромоторного аппарата, а также для студентов медицинских учебных заведений, аспирантов и научных сотрудников, работающих в области изучения периферической нервной системы.
СОДЕРЖАНИЕ
Глава 1. Возможности использования электромиографии в клинической практике
1.1. Основные электромиографические методы исследования
1.1.1. Исследование проводящей функции моторных нервов
1.1.2. Исследование проводящей функции сенсорных нервов
1.1.3. Исследование F-волн
1.1.4. Исследование нервно-мышечной передачи (декремент-тест)
1.1.5. Транскраниальная магнитная стимуляция
1.2. Методики игольчатой электромиографии
1.2.1. Стандартная игольчатая электромиография
1.2.2. Электромиография одиночного мышечного волокна
1.2.3. Использование метода макроэлектромиографии
1.2.4. Использование сканирующей электромиографии
1.3. Выбор ЭМГ методов обследования
Глава 2. Основные принципы игольчатой электромиографии
2.1. Двигательная единица
2.2. Потенциалы двигательных единиц
2.2.1. Длительность потенциалов двигательных единиц в норме
2.2.2. Длительность потенциалов двигательных единиц при патологии
2.2.3. Амплитуда потенциалов двигательных единиц в норме
2.2.4. Амплитуда потенциалов двигательных единиц при патологии
2.2.5. Форма потенциалов двигательных единиц в норме и при патологии
2.3. Спонтанная активность
2.3.1. Потенциалы фибрилляций
2.3.2. Положительные острые волны
2.3.3. Миотонические и псевдомиотонические разряды
2.3.4. Спонтанная активность мышечных волокон, не являющаяся патологией
2.3.5. Спонтанная активность двигательных единиц - потенциалы фасцикуляций
Глава 3. Основные принципы изменения потенциалов двигательных единиц при неврогенных заболеваниях
3.1. Механизмы возникновения компенсаторной иннервации и её электромиографическое проявление
3.2. Максимальный объём и эффективность компенсаторной иннервации
3.3. Электромиографические стадии денервационно-реиннервационного процесса при неврогенных заболеваниях
3.4. Сроки изменения параметров потенциалов двигательных единиц
Глава 4. Электромиографическое обследование больных с поражением мотонейронов спинного мозга
4.1. Диагностическая значимость различных методов исследования при нейрональных заболеваниях
4.2. Игольчатая электромиография у больных с заболеваниями мотонейронов спинного мозга
4.2.1. Потенциалы двигательных единиц при заболеваниях мотонейронов спинного мозга
4.2.2. Спонтанная активность у больных с заболеваниями мотонейронов спинного мозга
4.3. Исследование проводящей функции моторных нервов при заболеваниях мотонейронов спинного мозга
4.4. Изменения F-волн при поражении мотонейронов спинного мозга
4.5. Исследование нервно-мышечной передачи при поражении мотонейронов спинного мозга
4.6. Основные заболевания мотонейронов спинного мозга
4.6.1. Боковой амиотрофический склероз
4.6.2. Спинальные мышечные атрофии
4.6.3. Полиомиелит и постполиомиелитический синдром
4.6.4. Нейрональная форма болезни Шарко-Мари-Тус
4.6.5. Вторичные поражения мотонейронов спинного мозга
Глава 5. Элекгромиографическое обследование больных с поражением аксонов двигательных нервов
5.1. Патофизиологические основы заболеваний периферических нервов
5.1.1. Основные функции аксона
5.1.2. Миелиновая оболочка и её структура
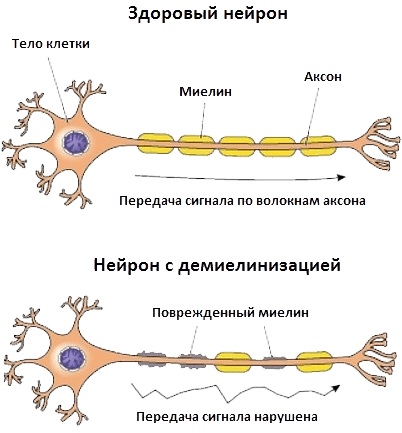
5.1.3. Нарушение проведения возбуждения в демиелинизированных волокнах
5.1.4. Замедление проведения возбуждения и блок
5.1.5. Восстановление проведения возбуждения в демиелинизированных аксонах
5.1.6. Патофизиологические основы современной классификации невропатий
5.1.7. Аксональные невропатии
5.1.8. Демиелинизирующие невропатии
5.2. Игольчатая электромиография при заболеваниях периферических нервов
5.2.1. Характеристика потенциалов двигательных единиц при аксональном процессе
5.2.2. Характеристика потенциалов двигательных единиц при демиелинизирующем процессе
5.2.3. Сравнительный анализ потенциалов двигательных единиц при аксональных и демиелинизирующих полиневропатиях
5.2.4. Спонтанная активность у больных с аксональными и демиелинизирующими невропатиями
5.3. Основные заболевания, связанные с поражением периферических нервов
5.3.1. Мононевропатии
5.3.2. Плекситы, плексопатии
5.3.3. Полиневропатии
5.3.4. Поражение спинальных корешков
Глава 6. Электромиографическое обследование больных с нарушением нервно-мышечной передачи
6 1. Классификация основных синаптических заболеваний
6.2. Диагностика основных синаптических заболеваний
6.2.1. Критерии диагностики миастении
6.2.2. Миастенический синдром Ламберта-Итона
6.2.3. Электромиографическое обследование больных с ботулизмом
Глава 7. Первично-мышечные заболевания
7.1. Классификация первично-мышечных заболеваний
7.2. Игольчатая электромиография при первично-мышечных заболеваниях
7.2.1. Параметры потенциалов двигательных единиц у больных с первично-мышечными заболеваниями
7.2.2. Спонтанная активность у больных с первично-мышечными заболеваниями
7.3. Наследственные первично-мышечные заболевания
7.3.1. Прогрессирующие мышечные дистрофии
7.3.2. Врождённые (конгенитальные) непрогрессирующие формы миопатий
7.3.3. Митохондриальные миопатий
7.4. Заболевания мышц, сопровождающиеся нарушением расслабления и судорогами
7.4.1. Миотонические расстройства
7.4.2. Дистрофическая миотония
7.4.3. Врождённая миотония
7.4.4. Парамиотония Эйленбурга
7.4.5. Нейромиотония
7.4.6. Пароксизмальные миоплегии, периодический паралич
7.4.7. "Крампи"-синдром
7.4.8. Болезнь МакАрдля
7.5. Воспалительные миопатий
7.5.1. Идиопатические воспалительные миопатий
7.5.2. Воспалительные миопатий, сочетающиеся с заболеваниями соединительной ткани
7.5.3. Инфекционные воспалительные миопатий
7.5.4. Гранулёматозные воспалительные миопатий
7.6. Ревматоидный артрит
7.7. Миопатий при эндокринных и метаболических нарушениях
Глава 8. Методические приемы проведения электромиографического исследования с помощью концентрических игольчатых электродов
Заключение
Возможности электронейромиографического комплекса
Научно-медицинской фирмы "МБН"
Нервно-мышечными заболеваниями (НМЗ) является группа патологий, которые передаются на генетическом уровне от родителей детям. Нарушаются мышечные функции, снижается двигательная активность. Появляются характерные клинические симптомы.
Патологические процессы развиваются на фоне нарушений функций нервно-мышечных соединений, при поражении мышц и спинномозговых нейронов, нервов. Правильно подобранная терапия не поможет полностью вылечить человека, но позволит улучшить качество его жизни.
Этиология и неврология
Нервно-мышечные заболевания нарушают нормальную синаптическую передачу импульсов с нервных окончаний к мышечным волокнам. В основе каждого типа патологических изменений лежат аутоиммунные процессы.
Большая группа заболеваний характеризуется не только поражением мышечной ткани, но и периферических нервов, передних рогов спинного мозга. Среди часто диагностируемых патологий выделяют миопатию, миотонию, миастению.
Классификация
Нервно-мышечные заболевания различают по следующим видам:
Описание
Нервно-мышечные заболевания передаются по наследству, чаще появляются у людей, в семье которых были родственники с таким диагнозом.
Приобретенные патологические процессы развиваются в результате гормональных или метаболических нарушений в организме человека. Наблюдается сбой в функционировании иммунной системы. Она вырабатывает клетки, которые атакуют свой организм. Аутоиммунные заболевания приводят к появлению слабости в мышцах.
Нервно-мышечные патологии, сопровождающиеся дистрофическими процессами, поражают следующие области тела человека:
- мышцы;
- нервно-мышечные окончания;
- двигательные нейроны;
- периферические нервы.
При миопатии у человека высоки шансы стать инвалидом в результате утраты подвижности. Все виды нервно-мышечных заболеваний без своевременной терапии влекут за собой последствия. Это может быть не только инвалидность, но и смерть человека.
Стадии и степени
Нервно-мышечные заболевания протекают по стадиям. Определить этап развития патологических процессов поможет врач невролог при помощи медицинской диагностики.
| Название | Описание |
| I стадия | Двигательные нарушения слабо выраженные. |
| II стадия | У больного присутствуют ярко выраженные клинические признаки и наблюдаются серьезные двигательные изменения. |
| III стадия | Пациент не может самостоятельно передвигаться. |
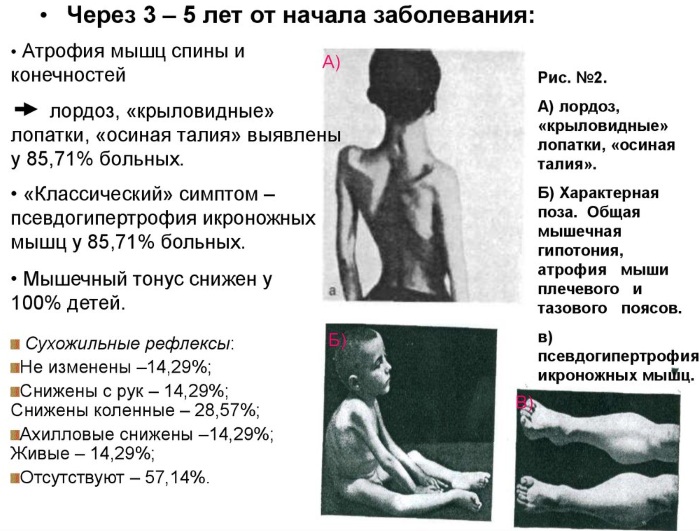
Нервно-мышечные заболевания миопатия Дюшенна на 2 этапе
Клиническая картина зависит от скорости развития патологических процессов и степени тяжести заболевания. Установить точный диагноз поможет врач невролог.
Симптомы
Основной признак нервно-мышечных заболеваний – это слабость мускулатуры. Клиническая картина зависит от области поражения (плечевой пояс, бедра, таз, нижние конечности).
В большинстве случаев у пациентов диагностируют следующие симптомы:
- снижается мышечный объем;
- наблюдаются болезненные спазмы;
- непроизвольно сокращаются мышцы;
- пораженные ткани немеют;
- снижаются сухожильные рефлексы;
- больной ощущает покалывание;
- двоится в глазах (диплопия);
- нарушаются глотательные и дыхательные рефлексы.
При нервно-мышечных заболеваниях опускаются веки, мышечная слабость проявляется симметрично и постепенно прогрессирует. В большинстве случаев при развивающейся мышечной дистрофии слабость возникает в области тазового и плечевого пояса. То же самое касается проксимальных отделов конечностей.
Иногда невральная амиотрофия сопровождается парестезией, нарушением глубокой или поверхностной чувствительности. Клинические признаки нервно-мышечных заболеваний проявляются постепенно. По мере прогрессирования патологических процессов человек теряет способности самостоятельно обслуживать себя. То же самое касается передвижения.
Причины появления
Нервно-мышечные заболевания в большинстве случаев возникают по причине аутоиммунных патологий.
Провоцирующим фактором также являются следующие обстоятельства:
- наследственный фактор;
- поражение периферических нервов и мотонейронов спинного мозга;
- сбои в функционировании нервно-мышечных соединений;
- отравление организма различными веществами;
- врожденный сбой метаболизма;
- патологические изменения в мышцах.
Нервно-мышечные заболевания также развиваются на фоне нарушений работы двигательного нейрона в области ствола головного мозга.
Определить причину и поставить точный диагноз поможет врач невролог. Учитывая состояние пациента, степень развития патологических процессов и индивидуальные особенности человеческого организма, специалист подберет эффективное лечение.
Диагностика
Медицинское обследование позволит врачу установить точный диагноз. Тестирование специалист назначает пациенту, учитывая его жалобы и симптоматику.
Для диагностики нервно-мышечных заболеваний назначаются следующие методы обследования:
Описание

Исследованием состояния сердечной мышцы занимается кардиолог. Специалист назначает не только кардиограмму, но и ультразвуковое исследование (УЗИ) сердца.
Когда необходимо обратиться к врачу
К врачу необходимо обратиться сразу, при появлении первых признаков нарушений в работе мышц. Но если в семье есть родственники с нервно-мышечными заболеваниями, необходимо пройти полное медицинское обследование и понять, насколько высока вероятность появления патологических процессов по наследственной линии.
Диагностикой и лечением занимается врач невролог. Специалист проведет осмотр и подберет максимально информативные методы исследования.
Профилактика
Нервно-мышечные заболевания в большинстве случаев развиваются по причине наследственного фактора. Предупредить патологические изменения невозможно. Женщине во время планирования беременности рекомендуется проходить медицинские обследования, особенно если в семье есть родственники с таким диагнозом.
Диагностические мероприятия также назначаются в период вынашивания малыша на ранних сроках. При высокой вероятности развития нервно-мышечных заболеваний специальная медицинская комиссия советует будущей матери прервать беременность.
Методы лечения
Терапия нервно-мышечных заболеваний осуществляется комплексными методами. Пациентам назначают медицинские препараты, лечебную физкультуру. При отсутствии серьезных противопоказаний, можно использовать рецепты знахарей и целителей. Основная цель терапии – это поддержать мышечные силы и замедлить атрофирующие процессы.
Медикаменты подбирает врач невролог, учитывая результаты медицинской диагностики, степень развития патологических процессов и индивидуальные особенности организма человека.
Самостоятельно не рекомендуется принимать лекарства, поскольку многие препараты вызывают побочные эффекты.
При нервно-мышечных заболеваниях врач назначает следующие медикаменты:
Применение
Лекарства позволяют устранить дефицит энергии и белка, положительно влияют на вещественные обмены в мышечных тканях. Дополнительно назначаются витаминные комплексы.
Нервно-мышечные заболевания можно лечить рецептами знахарей и целителей, но в качестве вспомогательной терапии. Народные средства улучшают качество жизни пациента и общее его состояние. Используемые средства следует обсуждать с лечащим врачом неврологом.
| Название | Рецепт | Применение |
| Овес | Зерна хорошо промыть и залить водой (500 мл). Полученную массу ставят на огонь, доводят до кипения и греют 30 мин. Дальше оставляют на 2 часа, процеживают и принимают по схеме. | Готовое средство рекомендуется принимать внутрь перед едой 4 раза в сутки. Курс терапии продолжается 3 месяца. Затем необходимо сделать перерыв на 30 дней и продолжить терапию. |
| Репчатый лук | Продукт очистить и смешать 200 г с сахаром (200 г), добавить воды (0,5 л). Полученную массу поставить на медленный огонь и греть 1,5 часа. Остудить и добавить 2 ст.л. натурального меда. | Готовое средство рекомендуется принимать по 2 ч.л. 3 раза в сутки. |
| Чеснок | Очистить и измельчить 3 головки чеснока. Добавить 4 лимона, предварительно измельченные. Все компоненты залить медом (1 л) и льняным маслом (200 г). | Полученное средство следует принимать по 1 ч.л. 3 раза в день. |
При нервно-мышечных заболеваниях полезно проводить контрастные ванны для нижних конечностей. После водных процедур ноги рекомендуется укутывать теплым одеялом.
Комплексная терапия нервно-мышечных заболеваний позволяет замедлить их развитие, продлевает период ремиссии и улучшает качество жизни пациента.
Вместе с традиционным и народным лечением больным назначаются следующие методы терапии:

| Название | Описание |
| Физиотерапевтические процедуры | Лечение улучшает проводимость нервных импульсов в мышечных тканях, способствует их питанию. Усиливается кровообращение и вещественный обмен. |
| Массаж | Точечное воздействие помогает повысить тонус мышц. Для достижения лечебного эффекта необходимо провести несколько сеансов на протяжении года. |
| Лечебная физкультура | Гимнастика проводится в специализированном комплексе под наблюдением специалиста. |
Сохранить самостоятельное передвижение пациента позволяют специальные ортопедические приспособления. Лечебная физкультура в виде активных и пассивных движений улучшает состояние больного.
Упражнения следует выполнять регулярно, соблюдая умеренные нагрузки. При нервно-мышечных заболеваниях также рекомендуется плавать. В воде легче выполнять физические упражнения без нагрузки на позвоночник.
Возможные осложнения
Негативные последствия патологических процессов появляются в результате поражения различных внутренних органов и систем организма человека:
Описание
Прогрессирующие патологические процессы также могут спровоцировать искривление позвоночника (кифоз, сколиоз). Больным необходимо носить специальные корсеты. В тяжелых ситуациях или на запущенных стадиях развития нервно-мышечных заболеваний пациенту показано оперативное вмешательство. Решение принимает врач невролог, учитывая состояние человека и индивидуальные особенности его организма.
При нервно-мышечных заболеваниях нарушается двигательная функция, слабеют мышцы. Симптомы постепенно усиливаются на фоне прогрессирующих дистрофических процессов.
Пациенту необходимо пройти полное обследование для постановки диагноза и специально подобранное лечение. Лекарства, средства народной медицины, физиотерапевтические процедуры помогут лишь облегчить жизнь пациенту, но полностью избавить от генетической патологии не смогут.
Оформление статьи: Владимир Великий
Видео о нервно-мышечных заболеваниях
Телесеминар о нервно-мышечных заболеваниях:
Многие нервно-мышечные заболевания сопровождаются поражением миокарда. Среди них наиболее распространенными являются прогрессирующие мышечные дистрофии (ПМД), в частности ПМД Дюшенна. Атрофический процесс при ПМД поражает и скелетные, и сердечную мышцы. Это связано с тем, что в этиологии и патогенезе заболеваний сердечной и скелетной мышц много общего, ведь, несмотря на существующие различия, эти мышцы обладают сходством в молекулярной, анатомической структуре и физиологии [3]. При ПМД Дюшенна 84-96% больных страдают патологией со стороны сердечно-сосудистой системы [1, 2]. Дилатационная кардиомиопатия (ДКМП), желудочковые аритмии, фибрилляция предсердий, нарушения атриовентрикулярной и внутрижелудочковой проводимости, а также внезапная сердечная смерть – хорошо известные проявления мышечной дистрофии Дюшенна.
ПМД Дюшенна – наследственное рецессивное Х-сцепленное заболевание, с распространенностью 1 случай на 3600-6000 мальчиков, рожденных живыми, возникающее в результате мутации в гене дистрофина и характеризующееся поражением проксимальных групп мышц, кардиологическими, ортопедическими и респираторными осложнениями (рис. 1). Другими словами, это наследственное заболевание, которое возникает в результате дефектов гена (делеция, дупликация или точечная мутация гена), кодирующего белок дистрофин. Дистрофин, в свою очередь, локализован в плазматической мембране скелетных мышечных волокон и кардиомиоцитов. ПМД Дюшенна является наиболее тяжелой формой с манифестацией в возрасте 2-5 лет и прогрессирующим злокачественным течением: формированием вялых парезов, параличей и мышечных контрактур, что приводит в будущем к обездвиженности.

Ввиду того что ПМД Дюшенна связана с мутациями в гене, который находится на Х-хромосоме, этим заболеванием страдают только мальчики. Описания данной патологии у девочек крайне редки.
Основным симптомом является мышечная слабость, которая в первую очередь связана с атрофией скелетных мышц.
Облигатным признаком развернутой стадии ПМД Дюшенна является гипертрофическая, или дилатационная, кардиомиопатия, которая сопровождается нарушениями ритма сердца, расширением его границ, явлениями сердечной недостаточности (СН). Кардиомиопатия – наиболее частая причина летального исхода при ПМД Дюшенна [4, 5]. К летальности приводит также дыхательная недостаточность, которая провоцируется интеркуррентными инфекциями или аспирацией. Больные погибают на втором-третьем десятилетии жизни.
При биохимическом анализе крови выявляют повышение активности печеночных ферментов (АлАТ, АсАТ) и значительное – в сотни и тысячи раз – повышение активности креатинфосфокиназы. Это отражает процесс разрушения мышечной ткани.
Основным методом для подтверждения диагноза является ДНК-диагностика, довольно сложная и дорогая. В некоторых странах обсуждается возможность проведения массового скрининга на данное заболевание.
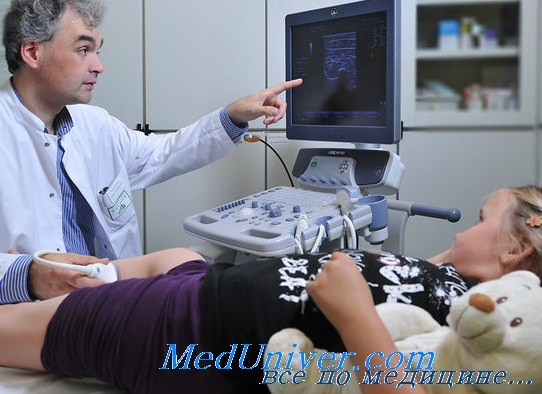
Поэтому при постановке диагноза мы стараемся использовать дополнительные методы. Один из них – электромиография (ЭМГ). Этот метод позволяет подтвердить тот факт, что в основе заболевания лежит первично-мышечный тип изменений, а периферическая нервная система при этом совершенно интактна [6]. ЭМГ-исследование на сегодняшний день является одним из основных методов в оценке структурно-функционального состояния мышц и диагностике нервно-мышечных заболеваний. ЭМГ используют для дифференциальной диагностики между первичными (мышечными) и вторичными (невральными) мышечными дистрофиями.
ЭМГ (стимуляционная) – это комплекс методов оценки функционального состояния нервно-мышечной системы, основанный на регистрации и анализе биоэлектрической активности мышц и периферических нервов. К основным заболеваниям, при которых ЭМГ-диагностика является наиболее информативной и часто используемой, относятся первично-мышечная патология (ПМД, полимиозит, миозит), невральная патология (радикулопатии, плексопатии, невропатии (травматические; компрессионно-ишемические; полиневропатии – воспалительные, наследственные, дисметаболические, токсические), заболевания периферического двигательного мотонейрона (полиомиелит, боковой амиотрофический склероз).
Электронейромиография (ЭНМГ) как диагностический метод включает в себя две основные методики – стимуляционную и игольчатую. В основе стимуляционной ЭНМГ (рис. 2) лежит регистрация сумарного ответа мышцы или нерва в ответ на стимуляцию импульсом электрического тока. Методы стимуляционной ЭНМГ позволяют исследовать проводящую функцию моторных и сенсорных аксонов периферических нервов, а также функциональное состояние нервно-мышечной передачи. Также сюда относят исследование поздних ответов, таких как F-волна (данный метод позволяет выявить поражение нейромоторного аппарата на ранней субклинической стадии заболевания) и Н-рефлекс (является аналогом ахиллового рефлекса, посредством которого можно оценить порог возбудимости мотонейронов поясничного утолщения). С помощью игольчатой ЭМГ (рис. 3) определяют функциональное состояние мышцы, наличие или отсутствие текущего процесса в ней, степень и выраженность денервации, выраженность и эффективность реиннервации. В основе этого метода лежит определение параметров потенциалов двигательных единиц (ПДЕ), которое включает анализ длительности, фазности и амплитуды, а также анализ спонтанной активности ДЕ и мышечных волокон.

В диагностике ПМД Дюшенна стимуляционная ЭНМГ особой роли не играет. При исследовании проводящей функции моторных нервов выявляется снижение амплитуды М-ответа, соответствующее снижению силы мышцы и выраженности атрофии; остальные параметры остаются в норме до поздней стадии заболевания. Более информативной является игольчатая ЭМГ. Она и служит основным методом исследования при подозрении на ПМД. Выполнение данной методики позволяет выявить первично-мышечный тип изменений потенциалов ДЕ (уменьшение длительности и снижение амплитуды ПДЕ) и спонтанную активность мышечных волокон (в виде потенциалов острых волн – ПОВ, потенциалов фибрилляции – ПФ), указывающих на степень активности процесса в каждой конкретной мышце. Спонтанная активность, регистрируемая при ПМД, всегда значительно выражена, что отличает ПМД от других наследственных первично-мышечных заболеваний. Она наблюдается в самых начальных стадиях заболевания, когда наряду с ПФ выявляются ПОВ и разряды высокой частоты [6].
Несмотря на то что проблема вовлечения сердца в патологический процесс при миодистрофии Дюшенна активно изучается с 1980-х гг. [21, 22], до сих пор уровень выявляемости сердечно-сосудистых нарушений и профилактика тяжелых осложнений на ранних стадиях остаются очень низкими. Причиной летального исхода при большинстве форм ПМД является вовлечение в патологический процесс сердечной мышцы [23, 24].
Все это обусловливает необходимость дальнейшей разработки вопросов ранней диагностики кардиологических нарушений при различных формах ПМД с целью определения тактики лечения, профилактики развития тяжелых сердечно-сосудистых нарушений, улучшения качества и продолжительности жизни больных.
Нарушения со стороны сердца проявляются в виде ишемических и метаболических изменений миокарда, перегрузки левого желудочка (ЛЖ), нарушений проводимости и сердечного ритма (в виде внутрисердечных блокад и аритмий), а также развития внезапной сердечной смерти. Структурные изменения сердца с дилатацией ЛЖ или гипертрофией встречаются при миотонической дистрофии приблизительно у 20% больных, систолическая дисфункция ЛЖ отмечается в 14% случаев [7, 8], но клинически очевидная СН встречается редко – всего у 2% больных. Кардиомиопатия у детей с миодистрофией Дюшенна развивается на фоне гипо- и адинамии, поэтому не проявляется СН I и IIA стадии и не провоцирует жизнеугрожающих нарушений ритма и проводимости сердца, что приводит к поздней диагностике.
На основании анализа данных многих исследований можно с уверенностью сказать, что пациенты с миодистрофией Дюшенна должны в обязательном порядке проходить кардиологическое обследование и обследование дыхательной системы на ранних этапах заболевания.
Скрининг для выявления сердечной патологии необходимо проводить всем детям с нервно-мышечными заболеваниями, при которых существует риск вовлечения в патологический процесс сердца. Рекомендации относительно времени и частоты проведения первичного и последующих обследований были разработаны Американской академией педиатров совместно с экспертами в данной предметной области и основываются на времени начала и клиническом течении поражения сердца при отдельных нервно-мышечных заболеваниях. Скрининг должен включать тщательный сбор анамнеза, физикальное обследование на предмет признаков и симптомов СН или аритмии [9]. Иногда установить наличие клинически значимой СН у пациентов с генерализованной мышечной слабостью бывает трудно вследствие присутствия симптомов, которые могут имитировать признаки СН. Необходимо фиксировать такие общие жалобы, как одышка, слабость, утомляемость, нарушение сна, снижение аппетита, потеря массы тела, поскольку они в том числе могут являться и симптомами недостаточности кровообращения. Головокружение или синкопальные состояния, ощущение перебоев в работе сердца, чувство учащенного сердцебиения могут быть признаками нарушения ритма сердца.
При постановке диагноза в скрининг при выявлении патологии со стороны сердца необходимо включать проведение инструментальных и лабораторных исследований.
Электрокардиография (ЭКГ) – важный инструмент скрининга для выявления нарушений ритма и проводимости сердца, гипертрофии или дилатации желудочков [10]. Проведение эхокардиографии считается золотым стандартом диагностики структурно-функциональных нарушений миокарда и способствует выявлению патологии сердца на доклиническом этапе [11].
Очень часто – в зависимости от уровня поражения сердца – требуется выполнение дополнительного обследования. При заболеваниях, сопровождающихся выраженными нарушениями ритма, рекомендуется проведение суточного мониторирования ЭКГ. Кроме того, для оценки степени фиброза миокарда, воспалительных изменений, патологии перикарда у пациентов могут применяться такие неинвазивные методы диагностики, как магнитно-резонансная или компьютерная томография сердца с контрастированием [12, 13].
Лечение больных с нарушениями ритма и проводимости сердца включает антиаритмическую терапию, имплантацию искусственного водителя ритма (электрокардиостимулятора), кардиовертера-дефибриллятора. Больные с ремоделированием миокарда, нарушениями систолической и/или диастолической функции миокарда и хронической СН (ХСН) должны получать лечение в соответствии с рекомендациям по терапии ХСН [14]. В настоящее время рассматривается вопрос о начале превентивной терапии патологии сердечно-сосудистой системы больных с нервно-мышечными болезнями в детском возрасте. Согласно данным Педиатрического реестра кардиомиопатии шестилетняя выживаемость у пациентов с мышечной дистрофией Дюшенна после установления диагноза ДКМП составляет 58%, а уровень выживаемости без трансплантации сердца – 55% [15]. Данные 10-летнего наблюдения указывают на более низкий уровень смертности среди пациентов, которым согласно рандомизированному отбору были изначально назначены ингибиторы ангиотензинпревращающего фермента (ИАПФ) [16]. Увеличение выживаемости по сравнению с данными литературы отмечено в исследованиях у пациентов с ПМД Дюшенна, получавших комбинированную терапию ИАПФ и β-блокаторами. Также у части пациентов выявлена нормализация функции и размеров ЛЖ [17].
На сегодняшний день не существует специфического лечения мышечной дистрофии. Все лечение симптоматическое и направлено на поддержание жизненно важных систем и функций организма. В то же время за рубежом уже зарегистрирован препарат, стимулирующий выработку дистрофина. Также запатентована методика пересадки костного мозга от отца к сыну, что, к сожалению, не восстанавливает утраченные способности мышц, однако предотвращает дальнейшее их разрушение.
Читайте также:


