Мабтера в лечении склеродермии
В настоящее время в клинических исследованиях продемонстрирована высокая эффективность ритуксимаба для лечения ревматоидного артрита (РА), системной красной волчанки (СКВ), синдрома Шегрена (СШ), АНЦА-ассоциированных васкулитов, антифофсолипидного синдрома (АФС) и многих других аутоиммунных и хронических воспалительных заболеваний, относящихся к числу наиболее распространенных и тяжелых форм патологии человека.
В основе аутоиммунитета лежит нарушение толерантности к собственным антигенам, приводящее к развитию иммунного ответа против нормальных тканей, как если бы они были чужеродными для организма. Иммунный ответ, направленный против ограниченного числа аутоантигенов, присутствующих в определенных тканях, приводит к локальному органоспецифическому воспалению, характерному для аутоиммунных эндокринопатий и заболеваний нервной системы. Иммунный ответ против множества аутоантигенов, присутствующих во всех тканях (нуклеиновые кислоты, нуклеопротеиды, белки плазмы), индуцирует генерализованное (системное) воспаление. Аутоиммунные заболевания характеризуются наличием аутореактивных лимфоцитов в пораженных тканях и циркулирующих аутоантител - иммуноглобулинов, направленных против собственных антигенов. Наряду с нарушением иммунорегуляции важную роль в патогенезе аутоиммунных заболеваний играют генетические и внешнесредовые факторы.
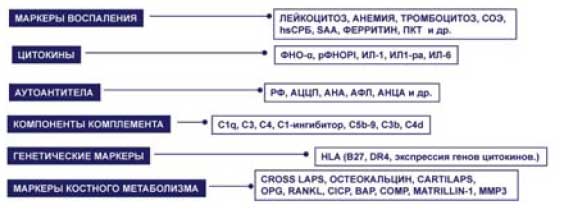
Лабораторная диагностика аутоиммунных и системных воспалительных заболеваний включает определение маркеров воспаления (лейкоцитоз, анемия, тромбоцитопения, СОЭ; белки острой фазы воспаления - С-реактивный белок, сывороточный амлоидный белок А, ферритин, прокальцитонин), аутоантител (ревматоидный фактор - РФ, анттела к циклическому цитрулинированному пептиду -АЦЦП, антинуклеарные антитела - АНА, антитела к фосфолипидам - аФЛ, антинейтрофильные цитоплазматические антитела - АНЦА), компонентов комплемента, провоспалительных цитокинов и их растворимых рецепторов (фактор некроза опухоли - ФНО и рФНОР, интерлейкин - ИЛ-1 и антагонист рецептора ИЛ-1, ИЛ-6), субпопуляций лимфоцитов, генетических маркеров, маркеров костного метаболизма. Эти лабораторные биомаркеры имеют важное значение для диагностики аутоиммунных заболеваний, мониторирования активности патологического процесса, оценки прогноза болезни и эффективности проводимой терапии.
В настоящее время выделяют три группы цитокинзависимых иммуновоспалительных заболеваний с преимущественной гиперпродукцией ФНО, ИЛ-1 или ИЛ-6, патогенез которых обусловлен нарушением Т-клеточной иммунорегуляции. Данная медицинская концепция является основанием для применения генно-инженерных биологических препаратов, блокирующих активность соответствующих цитокинов.
В последние годы установлено, что наряду с Т клетками важную роль в развитии аутоиммунных заболеваний играют аутореактивные В-клетки. В-клетки синтезируют аутоантитела (РФ, АЦЦП и др.), участвуют в презентации антигена Т-клеткам, являются продуцентами провоспалительных цитокинов.
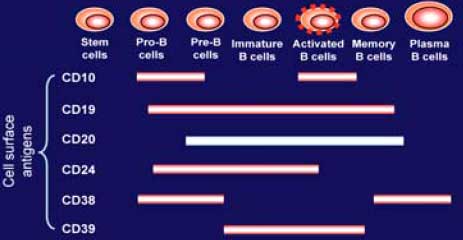
Выбор CD20 антигена в качестве мишени для моноклональных антител связан с особенностями дифференцировки В-клеток, которые в процессе созревания от стволовых клеток в плазматические клетки проходят несколько последовательных стадий, для каждой из которых характерна экпрессия определенных мембранных молекул. Экспрессия CD20 наблюдается на мембране ранних и зрелых В клеток, но не на стволовых, про В-клетках, дендритных клетках и плазматических клетках. Поэтому применение ритуксимаба приводит к истощению зрелых В-клеток, но не отменяет регенерацию пула В-клеток и синтез иммуноглобулинов плазматическими клетками. Для оценки эффективности терапии ритуксимабом в измеряют количество CD19 клеток в периферической крови и синовиальной ткани методом проточной цитофлюорометрии.
Имеются данные о резком снижении числа В-лимфоцитов в крови больных РА в течение 24 недель после введения ритуксимаба при незначительном снижении уровня иммуноглобулинов в сыворотке крови.
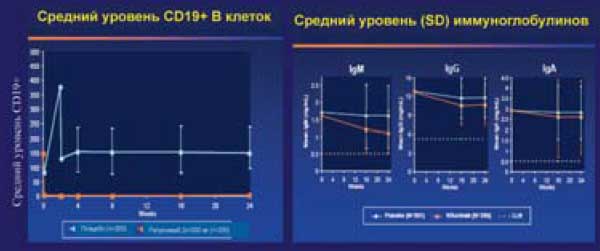
При использовании высокочувствительного метода проточной цитофлюорометрии выявлено неполное удаление В-клеток на 2-ой неделе после введения ритуксимаба и более раннее восстановление их количества (через 9 месяцев) по сравнению с обычным методом цитофлюорометрии.
Восстановление В-клеток начинается через 16 недель после назначения мабтеры и к 24 неделе достигает одинакового уровня как у пациентов с сохранением, так и у пациентов с утратой клинического эффекта, т.е. удаление В-клеток не отменяет эффект ритуксимаба.
Отмечается корреляция между уровнем деплеции В-клеток в периферической крови (на 15 день после введения Мабтеры) и в синовиальной ткани (через 6 месяцев после введения Мабтеры). В большинстве случаев при РА наблюдается снижение числа В клеток в синовиальной мембране через 6 мес. после введения препарата, однако у некоторых больных деплеции синовиальных В-лимфоцитов не наблюдается.
Наиболее часто у больных РА отмечается уменьшение концентрации IgM ниже нормы, которое однако не ассоциируется с нарастанием частоты инфекционных осложнений. При повторных введениях ритуксимаба значительное снижение сывороточного уровня IgM наблюдалось у 12, IgG - у 7, IgA - у 1 из 22 больных РА. Эти данные свидетельствуют о необходимости мониторировать уровень сывороточных иммуноглобулинов при лечении ритуксимабом.
Аутоантитела, как известно, являются основными диагностическими маркерами ревматических аутоиммунных заболеваний. Наиболее важными серологическими маркерами РА являются РФ и АЦЦП. Ревматоидные факторы -IgG, IgM, IgA антитела к Fc фрагменту IgG, определяемые методами латекс-агглютинации, иммуноферментного анализа и нефелометрии. Наибольшее клиническое значение имеет IgМ-РФ (чувствительность 60-80%, специфичность-80-93%). Увеличение титров РФ является диагностическим критерием РА.
АЦЦП - новый высокоспецифичный и чувствительный серологический маркер РА (чувствительность 41-80%, специфичность 93-99%), определяемый методом иммуноферментного анализа. Определение АЦЦП очень полезно для диагностики раннего РА, подтверждения диагноза серонегативного РА и дифференциальной диагностики с другими РЗ, для прогнозирования тяжелого эрозивного поражения суставов.
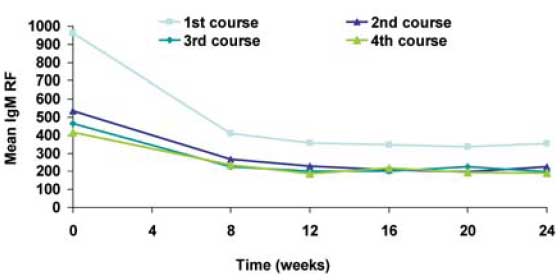
Выраженное и стойкое снижение концентрации РФ наблюдается к 8 неделе после введения ритуксимаба и продолжается в течение 24 недель.
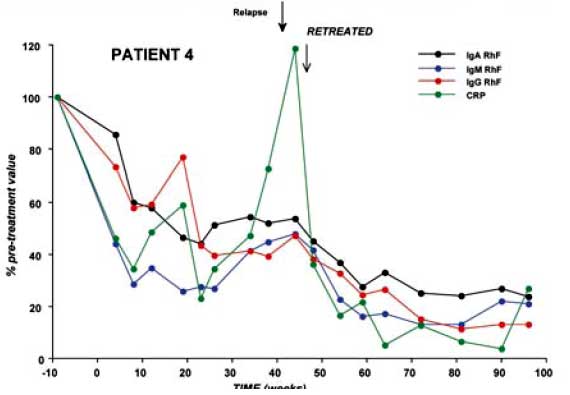
Как показано на слайде, к 30 неделе у пациента произошло нарастание уровня РФ и СРБ, развилось обострение заболевания, что явилось основанием для назначения повторного курса ритуксимаба.
Данные о влиянии ритуксимаба на уровень АЦЦП противоречивы.
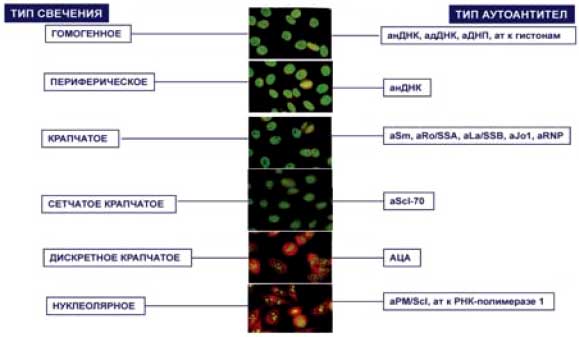
Антинуклеарные антитела - гетерогенная группа антител, реагирующих с различными компонентами ядра. Стандартным скрининговым тестом для определения антинуклеарных антител (в этом случае их обозначают как АНФ) является метод непрямой иммунофлюоресценции с использованием в качестве субстрата криостатных срезов мышиной печени и НЕр-2 клеток человека. Использование НЕр-2 леток предпочтительнее, т.к. позволяет повысить чувствительность метода и выявлять некоторые типы свечения, которые не обнаруживаются на криостатных срезах (антитела к центромере, аRo). Клиническое значение АНФ зависит от титра и типа свечения. Гомогенное свечение характерно для антител к нДНК, ДНП, гистонам; периферическое - для анДНК; крапчатое - для аSm, aRo/La, aRNP, aJo1; сетчатое крапчатое - для aScl 70; дискретное крапчатое - для антител к центромере; нуклеолярное - для аPM/Scl, аРНК-полимеразе 1. С целью подтверждения диагноза у АНФ положительных пациентов рекомендуется определение специфических АНА к отдельным компонентам ядра, используя подтверждающие тесты (иммуноферментный анализ, иммуноблот, двойная иммунодиффузия и др.).
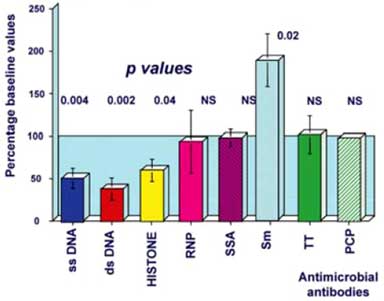
Данные о влиянии ритуксимаба на уровень антител к ДНК противоречивы. Одни исследователи не отмечали достоверного снижения титров аДНК на протяжении 30 недель после деплеции В-лимфоцитов, другими авторами показано уменьшение сывороточной концентрации аДНК у большинства больных СКВ. В частности, через 6 месяцев после деплеции В-клеток ритуксимабом у больных СКВ наблюдалось достоверное снижение уровня антител к ДНК и гистонам, в то время как уровень антимикробных антител (к столбнячному токсину и пневмококковому полисихариду) не изменялся.
В недавнем исследовании показано, что повышение уровня антител к экстрагируемым ядерным антигенам является предиктором обострения СКВ и индикатором необходимости повторного введения препарата.
Получены также интересные данные о снижении уровня криоглобулинов на фоне терапии ритуксимабом.
При СКВ у большинства больных показано увеличение концентрации С3 компонента комплемента после приема препарата. Получены данные о повышении уровня С4 на фоне лечения ритуксимабом. Снижение уровня С3 рассматривается как предиктор обострения СКВ и является основанием для повторного введения препарата.
Среди маркеров воспаления наибольшее клиническое значение для оценки эффективности мабтеры имеют СОЭ и СРБ.
У больных РА установлено выраженное снижение СОЭ на фоне лечения мабтерой. При этом эффект снижения СРБ сохраняется после начала восстановления числа В клеток в периферической крови. Имеются данные, что СРБ остается сниженным на 75% по сравнению с его базальным уровнем в течение 5 циклов лечения ритуксимабом.
Согласно рекомендациям Эдвардса при РА оптимальными лабораторными маркерами для мониторирования терапии ритуксимабом являются CD19+В-клетки, IgG, СРБ и IgM РФ. Определение этих маркеров следует проводить до введения препарата, через 1 месяц после введения, далее 1 раз в 2 месяца. Наилучшим предиктором обострения является РФ
Учитывая потенциальную возможность реактивации гепатита В на фоне лечения ритуксимабом консенсус 2006 года по использованию ритуксимаба у больных РА рекомендует наряду с выполнением рутинных лабораторных тестов (общий и биохимический анализ крови, анализ мочи) и определением уровня иммуноглобулинов обязательное исследование маркеров гепатита В до начала терапии ритуксимабом. Наряду с этим большинством экспертов указывается на неэффективность мониторирования В-клеток в обычной клинической практике.
Таким образом, важнейшими лабораторными биомаркерами для обеспечения регистра больных, получающих ритуксимаб, являются: маркеры воспаления (СОЭ, СРБ), аутоантитела (РФ, АЦЦП, аДНК, аЭЯА, АНЦА), иммуноглобулины, криоглобулины, С3 и С4 -компоненты комплемента,
CD19+В-клетки, тесты на гепатит В, а также прокальцитониновый тест для дифференциальной диагностики бактериальной инфекции и сепсиса от обострения аутоиммунного заболевания.
Лабораторными индикаторами обострения заболевания, которые могут служить основанием для повторного введения ритуксимаба, являются: при РА - восстановление количества В клеток в периферической крови и синовиальной ткани при достаточном уровне IgG, повышение концентрации СРБ более, чем на 50% от исходного уровня непосредственно после предшествующего введения препарата, увеличение титров IgM РФ; при СКВ - наряду с восстановлением числа В-клеток - увеличение концентрации антител к экстрагируемым ядерным антигенам и снижение уровня С3-компонента комплемента.
ЛАБОРАТОРНОЕ ОБЕСПЕЧЕНИЕ РЕГИСТРА ПАЦИЕНТОВ ПОЛУЧАЮЩИХ ПРЕПАРАТ РИТУКСИМАБ (МАБТЕРУ)
Е.Н. Александрова, А.А. Новикова, Е.Л. Насонов
ГУ Институт ревматологии РАМН
Заболевании, при которых продемонстрирована эффективность Ритуксимаба
IgA нефропатия (почки)
Пурпура Шенлейн-Геноха (сосуды)
Атопический дерматит (кожа)
Трансплантационная болезнь (трансплантат)
Астма (лёгкие)
Другие
Рассеяный склероз (ЦНС)
Системная склеродермия (соединительная ткань)
Болезнь Лайма (ЦНС)
Язвенный колит (толстый кишечник)
Болезнь Крона (толстый кишечник)
Интерстициальное заболевание лёгких (лёгкие)
АУТОИММУНИТЕТ
Нарушение толерантности к собственным антигенам, приводящее к развитию иммунного ответа против нормальных тканей, как если бы они были чужеродны для организма.
- Иммунный ответ против небольшого числа аутоантигенов, присутствующих в определенных тканях, приводит к локальному (органоспецифическому) воспалению, особенно характерному для аутоиммунных эндокринопатии и заболевании нервной системы.
- Иммунный ответ против множества аутоанти генов, присут¬ствующих во всех тканях (нуклеиновые кислоты, нуклеопротеиды, белки плазмы и др), приводит к развитию генерали¬зованного (системного) воспаления.
ПАТОГЕНЕЗ АУТОИМУННЫХ ЗАБОЛЕВАНИЙ
Primer: the practical use of biological markers of rheumatic and systemic inflammatory diseases
РОЛЬ В КЛЕТОК В РАЗВИТИИ АУТОИММУННЫХ БОЛЕЗНЕЙ
REFLEX: ДИНАМИКА ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ
HIGH SENSITIVITY FLOW CYTOMETRY REVEALS INCOMPLETE DEPLETION AND EARLIER RETURN OF В CELLS AFTER THERAPY
КЛИНИЧЕСКИЙ ЭФФЕКТ В ЗАВИСИМОСТИ ОТ УРОВНЯ B-КЛЕТОК
Число В-клеток к 24 неделе в зависимости от эффекта (ACR50) терапии
LEVEL OF INITIAL В CELL DEPLETION (DAY 15) IN PB CORRELATES WITH LATER SYNOVIAL В CELL EXPRESSION
SYNOVIAL B CELL SCORES PRE- AND 6 MONTHS POST-TREATMENT WITH RTX
УРОВЕНЬ IgM В СЫВОРОТКАХ БОЛЬНЫХ РА ПРИ ПОВТОРНЫХ ЦИКЛАХ ТЕРАПИИ РИТУКСИМАБОМ (МАБТЕРОЙ)
УРОВЕНЬ IgG В СЫВОРОТКАХ БОЛЬНЫХ РА ПРИ ПОВТОРНЫХ ЦИКЛАХ ТЕРАПИИ РИТУКСИМАБОМ (МАБТЕРОЙ)
ПОВТОРНЫЕ КУРСЫ РИТУКСИМАБА
суммарный анализ безопасности
Число пациентов с низкой концентрацией Ig в период лечения
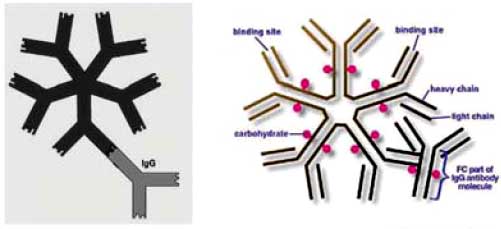
АНТИТЕЛА К ЦИКЛИЧЕСКОМУ ЦИТРУЛЛИНИРОВАННОМУ ПЕПТИДУ (АЦЦП)
| АЦЦП представляют собой аутоантитела, взаимодействующие с синтетическими пептидами, содержащими атипичную (unusual) аминокислоту - цитруллин. |  |
IGM RF LEVELS OVER TIME BY TREATMENT COURSE
INFLAMMATION FOLLOWS AUTOANTIBODIES (NOT В CELL LEVELS)
АНТИНУКЛЕАРНЫЙ ФАКТОР (АНФ) ГЕТЕРОГЕННАЯ ГРУППА АУТОАНТИТЕЛ, РЕАГИРУЮЩИХ С КОМПОНЕНТАМИ ЯДРА
Метод определения: НИФ с использованием криостатных срезов мышиной печени (>1/40) и HEp-2 клеток человека (>1/100)
ДИНАМИКА ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ
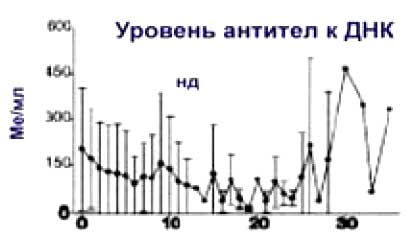
SLE: ANTIBODY LEVELS 6 MONTHS AFTER В CELL DEPLETION
Efficacy and safety of rituximab in type II mixed cryoglobulinemia
В Lymphocyte Depletion Therapy in Children With Refractory Systemic Lupus Erythematosus
Efficacy and safety of rituximab in type II mixed cryoglobulinemia
Baseline serum C3 and time to flare after BCDT
ЛАБОРАТОРНЫЕ ПРЕДИКТОРЫ ОТВЕТА НА ТЕРАПИЮ РУТИКСИМАБОМ (МАБТЕРОЙ)
| CD19+ В клетки |
| IgG |
| hsCPБ |
| IgM РФ |
| ENA |
| СЗс |
Safety and Efficacy of Rituximab in Patients with Rheumatoid Arthritis Refractory to Disease Modifying Antirheumatic Drugs and Anti-Tumor Necrosis Factor-a Treatment
Currently our impression is that monitoring оf CDl9+ В cells, IgG, CRP and IgM RF titre pre-treatment. 1 month post-treatment, then bi-monthly, with clinical state often assessable by telephone or email, is optimal for intelligent re-treatment.
ОБСЛЕДОВАНИЯ ДО НАЗНАЧЕНИЯ ТЕРАПИИ
Consensus statement on the use or rituximab in patients with rheumatoid arthritis
J S Smolen, E C Keystone, P Emery, F C Breedveld, N Betteridge, G R Burmester, M Dougados, G Ferraccioli, U Jaeger, L Klareskog, T K Kvien, E Martin-Mola, K Pavelka The Working Group on the Rituximab Consensus Statement
Annals of the Rheumatic Diseases 2007;66:143-150
Лабораторные тесты
- Рутинные лабораторные тесты
- Уровень иммуноглобулинов (IgG, IgA, IgM)
- Маркеры вируса гепатита В
ИНФЕКЦИЯ ВИРУСАМИ ГЕПАТИТА В, С И ВИЧ
Данные, касающиеся применения ритуксимаба, у пациентов с РА, являющихся носителями гепатита В, С и ВИЧ отсутствуют
В онкологии
- успешное применение у носителей гепатита С без прояилактики (Уровень доказательности IV)
- успешное применение у носителей гепатита В на фоне профилактики ламивудином (Уровень доказательности IV)
- развитие фулминантного гепатита на фоне реактивации инфекции вирусом гепатита В
- не увеличивает риск обострения ВИЧ (Уровень доказательности lib)
ОСНОВНЫЕ ЛАБОРАТОРНЫЕ БИОМАРКЕРЫ ДЛЯ ОБЕСПЕЧЕНИЯ РЕГИСТРА ПАЦИЕНТОВ ПОЛУЧАЮЩИХ ПРЕПАРАТ РИТУКСИМАБ (МАБТЕРА)
Войти через uID
Системная склеродермия (ССД) — системное заболевание соединительной ткани неизвестной этиологии, характеризующееся фиброзом кожи, мелких сосудов и внутренних органов.
Различают два варианта течения заболевания.
Системная склеродермия с диффузным поражением кожи (туловище, лицо, дистальные и проксимальные отделы конечностей) течет тяжело, высок риск почечного склеродермического криза.
Системная склеродермия с очаговым поражением кожи (лицо, дистальные отделы конечностей) течет относительно благоприятно, однако через много лет иногда развивается первичная легочная гипертензия или первичный билиарный цирроз.
К этому же варианту относят синдром CREST (по первым буквам слов: calcinosis— обызвествление, Raynaud's phenomenon — синдром Рейно, esophageal dysmotility — нарушение перистальтики пищевода, sclerodactyly — склеродактилия, telangiectasia — телеангиэктазия).
По МКБ-10 — М34 Системный склероз.
Эпидемиология ССД изучена слабо.
Первичная заболеваемость в США составляет в год 12 случаев на 1 млн населения. Женщины болеют значительно чаще, чем мужчины (в 3—7 раз). Заболевают обычно лица старше 30—40 лет.
Этиология ССД неизвестна.
Предполагается мультифакториальный генез ССД, обусловленный взаимодействием неблагоприятных экзо- и эндогенных факторов с генетической предрасположенностью к заболеванию.
Четко можно выделить во многих случаях провоцирующие факторы развития болезни.
Это вибрация, контакты с химическими веществами, длительное охлаждение, психическое напряжение. Имеется семейно-генетическое предрасположение: в семьях больных ССД у родственников отмечается синдром Рейно, реже — ССД и другие ревматические болезни.
При хроническом течении имеется связь с HLA антигеном DR3, при подострой форме — с DR5.
Патогенез. В патогенезе ССД большое значение имеет нарушение метаболизма коллагена и других компонентов СТ. Нарушена функция фибробластов и гладкомышечных клеток сосудистой стенки, которые ответственны за синтез коллагена.
При ССД повышена функция образования коллагена I и III типа, увеличено образование фибронектина, протеогликанов и гликопротеинов. Недавно был идентифицирован мутантный ген, детерминирующий синтез фибронектина фибробластами пораженной кожи больных ССД, однако роль фибронектина в патологическом процессе неясна.
Важный фактор — нарушение микроциркуляции, которое обусловлено поражением сосудистой стенки и изменением свойств самой крови. Повреждение эндотелия ведет к адгезии и агрегации клеточных элементов крови, стазу, внутрисосудистой коагуляции и микротромбозу.
В развитии ССД имеет значение изменение иммуногенеза.
Это подтверждается общностью клинических проявлений с СКВ, сочетанием с гемолитической анемией иммунного происхождения или таким иммунокомплексным заболеванием, как зоб Хашимото.
Об этом говорит плазмоклеточная инфильтрация в тканях, костном мозге и лимфоузлах, наличие различных аутоантител, LE-клеток (в меньшем количестве, чем при СКВ), РФ и т. п.
Может быть поражение опорно-двигательного аппарата: полиартралгии, полиартрит, периартриты.
Встречается остеолиз ногтевых фаланг и их ампутация, вызванные в основном сосудистыми изменениями. В тканях выявляется отложение кальция, особенно в области пальцев (синдром Тибьержа—Вейссенбаха).
Весьма важным в диагностическом плане и в отношении ощущений больного является поражение пищевода: развивается дисфагия, РЭ, сужение пищевода. Возможно поражение желудка и тонкой кишки.
Вовлечение в процесс сердца различно по глубине и происхождению. Крупные очаги склероза сходны на ЭКГ с изменениями при ИМ.
Диффузные и мелкоочаговые поражения дают клиническую картину, типичную для любого кардиосклероза.
Кроме того, может быть гипертрофия правого желудочка из-за развивающегося диффузного пневмосклероза и гипертрофия левого вследствие АГ, обусловленной склеродермической почкой.
Описывается и картина митральной недостаточности, вызванной склерозированием клапана без воспалительных изменений.
Существенным висцеральным синдромом ССД является поражение легких, в которых развиваются пневмосклероз, кистозное легкое, что ведет к легочной гипертензии и дыхательной недостаточности. Изменения почек могут быть разного вида.
Главное — изменение сосудов (фибриноидный некроз интимы, склероз, гиалиноз, нередко мезангиальная пролиферация).
Клинически это может проявляться мочевым синдромом, реже имеет место картина ГН.
Но особенно тяжело течет так называемая истинная склеродермическая почка. В этом случае на фоне любого предшествующего поражения почек в течение 2—3 нед развиваются ЗАГ, олигурия, ОПН и смерть через 2—3 мес. Возникают и общие проявления, выраженные в разной степени: исхудание, трофические изменения, выпадение волос; лихорадка неинтенсивная.
Диагностика трудна при малой выраженности поражений кожи.
При начальных проявлениях болезни основой диагностики является триада: синдром Рейно, поражения суставов (полиартралгия), плотный отек кожи.
На более поздних стадиях ССД диагноз устанавливается при наличии синдрома Рейно, склеродермических поражений кожи, суставно-мышечного синдрома, синдрома Тибьержа—Вейссенбаха (кальциноз), остеолиза, пневмосклероза, первичного кардиосклероза, поражения пищеварительного тракта, истинной склеродермической почки.
Лабораторные тесты мало специфичны и имеют дополнительное значение. Отмечается ускорение СОЭ, в крови определяется С-реактивный белок, нарастает содержание у-глобулинов, что говорит об активности процесса.
Наиболее доказательным является увеличение выделения с мочой оксипролина (продукта неправильного формирования коллагена).
В сомнительных случаях существенную помощь оказывает морфологическое исследование биоптата кожи.
Для больных ССД специфичны AT к топоизомеразе 1 (SCL-70), но их находят менее чем в трети случаев.
Течение болезни отражено в классификации ССД Н.Г. Гусевой: хроническое (наиболее часто встречается), подострое (относительно быстро наступает поражение внутренних органов), острое течение (наиболее неблагоприятный вариант, появление висцеральных поражений уже в первый год болезни, в том числе нередко развитие склеродермической почки).
Стадии болезни:
1) начальные проявления, преимущественно суставные при подостром течении и вазоспастические — при хроническом;
2) генерализация, когда в полной мере развивается полисиндромность и полисистемность;
3) стадия далеко зашедших изменений (терминальная), когда имеются тяжелые склеродермические, дистрофические и сосудисто-некротические поражения с нарушением функций отдельных органов.
Степени активности:
I степень (минимальная), обычно бывает при хроническом течении заболевания или как результат лечения подострой формы ССД;
II степень (умеренная) — при подостром течении или обострении хронического течения ССД;
III степень (максимальная) свойственна подострому и острому течению.
Примеры клинических диагнозов:
1. Системная склеродермия, острое течение, с распространенным поражением кожи в стадии плотного отека, синдромом Рейно, полиартритом, полимиозитом и висцеральными поражениями (кардит, пневмонит, острая склеродермическая нефропатия со злокачественной артериальной гипертензией и прогрессирующей почечной недостаточностью), активность II степени, III стадия.
2. Системная склеродермия, подострое течение с поражением кожи, суставов, сосудов (синдром Рейно), сердца (кардиосклероз), легких (пневмосклероз), пишевода (эзофагит), почек (умеренная хроническая склеродермическая нефропатия), активность Ш степени, II стадия.
3. Системная склеродермия, хроническое течение с поражением кожи в стадии плотного отека, сосудов (синдром Рейно), суставов (полиартрит), активность I степени, II стадия.
Лечение
Существует 3 группы препаратов, которые воздействуют на основные патогенетические механизмы ССД:
1) антифиброзные;
2) сосудистые;
3) противовоспалительные.
Антифиброзные препараты: D-пеницилламин (купренил, металкаптаза). Основной механизм — торможение синтеза и созревания коллагена. Кроме того, он обладает иммунодепрессивным и гпютивовоспалительным действием. Используется препарат перорально, в капсулах, в дозе 150—300 мг/суг в течение 2 нед; дозу увеличивают каждые 2 нед на 300 мг.
Максимальная доза (900 мг/суг) дается в течение 2 мес, а потом уменьшается до поддерживающей (около 300 мг).
При хорошей переносимости данный препарат принимают годами.
Эффект от применения D-пеницилламина или купренила наступает примерно через 2 мес.
Противопоказания к назначению D-пеницилламина: поражение почек и печени с нарушением функции этих органов; лейкопения и тромбоцитопения, большая наклонность к аллергическим реакциям.
Предлагается D-пенинилламин сочетать с преднизолоном, чтобы уменьшить возможность развития аллергии.
Наиболее серьезное осложнение, которое может дать D-пеницилламин,— нефропатия, она развивается примерно через полгода после начала приема препарата.
Поэтому при его назначении необходим тщательный КОНТроЛЬ анализов мочи (при протеинурии более 1—2 г/сут лекарство отменяется).
Антифиброзным действием обладает препарат мадекассол, который может использоваться при подостром и хроническом течении заболевания по 10 мг 3 раза в сутки per os.
Достаточно эффективным оказался данный препарат в виде мази при лечении язвочек на пальцах рук.
При хроническом течении ССД продолжают использоваться лидаза и ронидаза. Лечение лидазой проводят повторными курсами подкожных или в/м инъекций по 64—128 ЕД (разводится в 1 мл 0,5% раствора новокаина) через день, на курс 12—14 инъекций, а также электрофореза (лидаза или гиалуронидаза) или в виде аппликаций ронидазой на область контрактур и индуративно измененных тканей.
Противопоказанием к назначению данных препаратов является высокая активность процесса.
Определенной возможностью препятствовать фиброзообразованию обладает колхицин (0,6 мг 2 раза в сут), а также рекомбинантный у-интерферон.
В качестве местной терапии используется диметилсульфоксид (ДМСО) в виде аппликаций 50% раствора на кожу.
Он оказывает влияние на проницаемость мембран, деградацию коллагена, тормозит пролиферацию фибробластов.
Кроме того, ДМСО служит проводником через кожу многих других сосудорасширяющих средств, поэтому часто сочетают аппликации ДМСО с никотиновой кислотой, продектином.
Для воздействия на систему микроциркуляции применяют БКК, дезагреганты (курантил), гепарин. При наличии ЗАГ у больных ССД назначают ингибиторы АПФ. Их эффективность связана с тем, что данная АГ протекает с высоким содержанием ренина, а ингибиторы АПФ прерывают цепочку синтеза прессорных соединений. Противовоспалительные иммунодепрессивные средства.
ГКС используются при высокой и умеренной активности, когда имеются поражения суставов, высокая лихорадка, явления миозита, легочного фиброза, ГН, выявляются признаки активности по лабораторным тестам. Наиболее доступен преднизолон.
Он используется при отчетливых нарушениях иммунокомплексного порядка, а именно: обнаружение РФ, антинуклеарного фактора, ЦИК и т. д.
В комплекс лечения входят и аминохинолиновые производные (как и при СКВ). В частности, речь идет о делагиле, применяемом также длительно.
При высокой степени активности могут использоваться и НПВП — вольтарен, индометацин,6руфени др.
При хроническом течении ССД рекомендуется лидаза (гиалуронидаза), под влиянием которой уменьшается скованность и увеличивается подвижность в суставах, преимущественно за счет размягчения кожи и подлежащих тканей.
Лидазу вводят через день по 64 УЕ в 0,5% растворе новокаина п/к (12 инъекций на курс).
Через 1—2 мес курс лечения лидазой можно повторить (всего 4-6 курсов в год).
При выраженном ангиоспастическом компоненте (синдроме Рейно) показаны повторные курсы ангиотрофина (по 1 мл п/к, на курс 30 инъекций), калликреин-депо, андекалин (по 1 мл в/м, на курс 30 инъекций).
Другие виды лечения
При всех вариантах течения болезни рекомендуется активная витаминотерапия, АТФ.
При хроническом течении показаны бальнеотерапия (хвойные, радоновые и сероводородныв ванны), парафиновые и грязевые аппликации, электрофорез гиалуронидазы, аппликации с 30—50% раствором диметилсульфоксида (20—30 сеансов) на пораженные конечности.
В комплексном лечении большое значение имеют санаторно-курортные методы (не в периоды обострения).
При поражении опорно-двигательного аппарата — Евпатория, а при наличии поражения сосудов или внутренних органов — Пятигорск с родоновыми, сероводородными, углекислыми ваннами, грязелечением.
И последнее — больной должен отказаться от курения, так как никотин является мощным сосудосуживающим агентом и может вызывать обострение ССД.
Профилактика разработана недостаточно. Важным является полноценная поддерживающая терапия.
Прогноз заболевания серьезный, зависит от характера течения болезни.
Читайте также:


