Ингибитор фосфодиэстеразы 4 псориатический артрит
Псориатический артрит (ПсА) – хроническое воспалительное заболевание суставов, позвоночника и энтезисов, ассоциированное с псориазом. Патологический процесс локализуется преимущественно в тканях опорно-двигательного аппарата и приводит к развитию эрозивного артрита, внутрисуставного остеолиза. ПсА возникает у 5–7% больных среднетяжелым псориазом. Несмотря на успехи в лечении псориаза и ПсА базисными противовоспалительными препаратами (БПВП) и генно-инженерными биологическими препаратами (ГИБП), до конца не решены проблемы, связанные с иммуногенностью, наличием инфекционных осложнений, вторичной неэффективностью. Эти факторы послужили причиной поиска новых таргетных синтетических препаратов (блокаторы сигнальных путей). К данной группе препаратов относится апремиласт, ингибитор фосфодиэстеразы 4. Полученные к настоящему времени данные контролируемых исследований свидетельствуют о том, что препарат эффективен и безопасен при лечении псориаза и ПсА. Перспективы применения апремиласта при ПсА связаны с возможностью использования его у пациентов с неэффективностью БПВП или ГИБП, способностью поддержания длительной (более 3 лет) ремиссии, уменьшения проявлений энтезита и дактилита.
Псориатический артрит (ПсА) – хроническое воспалительное заболевание суставов, позвоночника и энтезисов, ассоциированное с псориазом. Патологический процесс локализуется преимущественно в тканях опорно-двигательного аппарата и приводит к развитию эрозивного артрита, внутрисуставного остеолиза и спондилоартрита. Псориаз выявляется у 1–3% населения. Мужчины и женщины страдают псориазом одинаково часто. ПсА развивается у 5–7% больных псориазом [1, 2]. Дебют заболевания может наблюдаться в любом возрасте, но чаще приходится на 20–50 лет [1–4].
Этиология и патогенез ПсА до конца не изучены (рис. 1) [5]. Обнаружена связь псориаза с HLA-антигенами В13, В16, В17, В27, В38, В39, DR4, DR7. Установлено, что HLA-B27 ассоциируется с поражением осевого скелета (позвоночника и крестцово-подвздошных сочленений), DR4 – с эрозивным артритом периферических суставов, HLA-Cw6 – с ранним началом заболевания, HLA-B27, B39 и ФНОα 1 -308-аллели – с прогрессированием заболевания, полиморфизм гена рецептора к интерлейкину (ИЛ) 23 (ИЛ23R) – с ПсА [6–12].
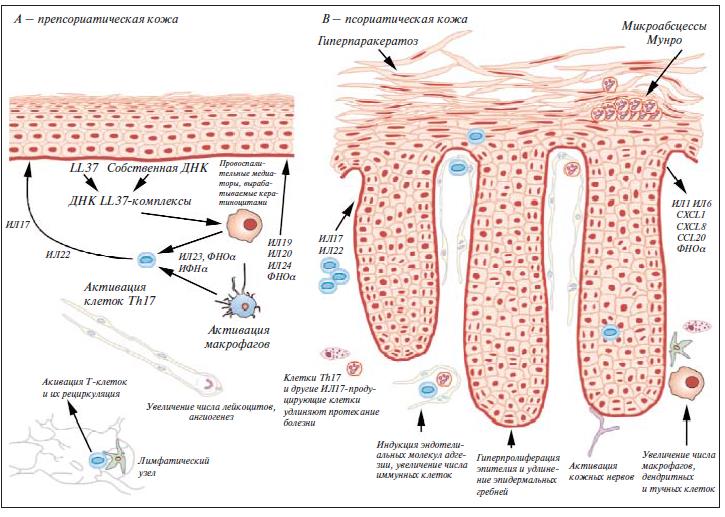
Рис. 1. Схема патогенеза псориатического процесса [5]
Провоцировать появление первых признаков болезни могут инфекционные агенты (стрептококк, стафилококк, грибковая инфекция, ВИЧ и другие ретровирусы), эндокринные факторы (пубертатный период и период менопаузы, беременность), заболевания желудочно-кишечного тракта – ЖКТ (гастрит, холецистит, дисбактериоз кишечника), психоэмоциональный стресс, прием лекарственных средств (препараты лития, бета-адреноблокаторы, аминохинолиновые средства, иногда нестероидные противовоспалительные препараты – НПВП) [1, 10].
Результаты иммуногистохимических исследований кожи больных псориазом показали, что инфильтрация Т-клетками предшествует клиническим проявлениям на коже. В клеточных инфильтратах кожи при этом выявляется повышенное содержание CD4+ и CD8+ лимфоцитов с преобладанием последних [6].
ИЛ12 вырабатывается макрофагами и дендритными клетками и играет важную роль в функционировании врожденной иммунной системы, контролируя дифференцировку CD4+ лимфоцитов в подкласс Т-хелперов 1-го типа (Th1). Th1-клетки продуцируют провоспалительные цитокины: ФНОα и интерферон γ (ИФНγ). ИЛ12 также индуцирует кожные лимфоцитарные антигены, вызывая миграцию Т-клеток в кожу и активирует CD8+ (цитотоксические) Т-клетки и естественные киллеры [1, 6, 9–11].
ФНОα играет одну из ключевых ролей в патогенезе псориаза, стимулируя синтез других провоспалительных цитокинов, значение которых в развитии болезни установлено. Кроме того, он способствует накоплению воспалительных клеток в тканях путем индукции экспрессии молекул внутриклеточной адгезии 1 (ICAM1) и повышает продукцию сосудистого фактора роста (VEGF), что приводит к активации вазопролиферативных процессов. Помимо этого, ФНОα – провоспалительный цитокин, определяющий развитие синовиального воспаления и остеокласт-опосредованной костной деструкции при артритах [1, 6–12].
При ПсА, как и при многих других заболеваниях, сопровождающихся иммунными нарушениями, наблюдается патологическое образование ИЛ12 и ИЛ23. О роли ИЛ12 в патогенезе артрита свидетельствует ряд клинических исследований. Было выявлено, что уровень ИЛ12 коррелирует с уровнями ФНОα, ИЛ8 и ИЛ10. Повышенное содержание ИЛ1, ИЛ2, ИЛ10, ИФНγ и ФНОα обнаружено в синовиальной ткани у пациентов с ПсА. Описаны случаи тяжелого обострения артрита в ответ на введение экзогенного ИЛ12 у пациентов с РА. Недавно опубликованы исследования, указывающие на наличие связи между генетическими вариантами рецептора к ИЛ23 и развитием ПсА. ИЛ12 и ИЛ23 представляют собой гетеродимерные цитокины, состоящие из двух субъединиц гликозилированных протеинов, связанных дисульфидными мостиками и имеющих общую субъединицу р40. При связывании общей субъединицы p40 с субъединицей p35 образуется ИЛ12, при связывании с субъединицей p19 – ИЛ23, каждая из этих субъединиц названа в соответствии со своей молекулярной массой. Эти цитокины продуцируются преимущественно макрофагами и дендритными клетками и оказывают действие путем связывания с двухцепочечными гетеродимерными рецепторными комплексами, экспрессируемыми на поверхности CD4+ T-лимфоцитов и естественных киллеров (NK-клетки). Через общую субъединицу p40 ИЛ12 и ИЛ23 связываются с цепью 1 рецептора к ИЛ12, вызывая первичное взаимодействие цитокина с рецептором. Специфичность сигнала обеспечивается связыванием уникальной субъединицы каждого цитокина с уникальной субъединицей рецепторного комплекса: ИЛ12p35 связывается с рецептором 2 к ИЛ12, а ИЛ23p19 – с рецептором к ИЛ23, запуская внутриклеточную сигнализацию и активируя клетки, несущие рецепторы. ИЛ23 стимулирует клетки Th17, которые начинают продуцировать провоспалительные факторы, включая ИЛ17, которые также стимулируют образование других провоспалительных агентов. Так как ИЛ12 и ИЛ17 играют важную роль в патогенезе псориаза, целевое воздействие на эти цитокины может способствовать нормализации структуры кожи. Это подтверждается данными экспериментов на животных.
Значимость ИЛ12 и ИЛ23 была доказана при проведении генетического анализа, продемонстрировавшего, что предрасположенность к развитию псориаза связана с изменениями гена IL12B (кодирующего рецепторы ИЛ23) [1, 6–9].
Таким образом, патогенетической основой развития псориаза является активация клеточного иммунитета в коже и синовии у лиц с врожденной предрасположенностью под воздействием провоцирующих факторов. Возникающая при этом гиперпродукция провоспалительных цитокинов, хемокинов вызывает дисбаланс ключевых про- и противовоспалительных цитокинов, таких как ФНОα, ИЛ12, ИЛ23, ИЛ17, ИЛ1, ИЛ1β, ИЛ6 и хемокины. Этот дисбаланс приводит к дебюту заболевания или развитию в последующем его рецидивов [1, 6–9].
Системные проявления включают поражение органа зрения в виде конъюнктивита, иридоциклита, реже – эписклерита. Возможно развитие общих проявлений (потеря массы тела, амиотрофия). При тяжелой и злокачественной формах течения ПсА могут наблюдаться поражение сердца по типу миокардита и эндокардита с вовлечением клапанного аппарата (чаще аортального клапана с развитием аортита), поражение почек (нефропатия, вторичный амилоидоз), печени (гепатит), генерализованная лимфаденопатия, синдром Рейно, вовлечение в процесс нервной системы (полиневрит) и др. [1, 2, 12].
Основная цель фармакотерапии ПсА – достижение ремиссии или минимальной активности заболевания (артрита, спондилита, энтезита, дактилита, кожных проявлений псориаза), замедление или предупреждение рентгенологического прогрессирования, увеличение продолжительности и качества жизни пациентов, а также снижение риска возникновения коморбидных заболеваний [12–16].
Для лечения ПсА применяют НПВП, глюкокортикоиды (ГК), главным образом внутрисуставные, базисные противовоспалительные препараты (БПВП), таргетные синтетические БПВП (или блокаторы сигнальных путей) и генно-инженерные биологические препараты (ГИБП). НПВП – препараты первой линии терапии при активном ПсА, их назначают в сочетании с внутрисуставным введением ГК или без него. Эффективность лечения оценивают каждые 3–6 мес [12–16].
В последние десятилетия для лечения ПсА с успехом используются БПВП. Препаратом первой линии является метотрексат (МТ), оказывающий благоприятное влияние на суставной и кожный компоненты заболевания. МТ назначают внутрь в дозе от 7,5 до 15 мг/нед. При увеличении дозы МТ до 20–25 мг/нед используют его внутримышечное или подкожное введение в комбинации с фолиевой кислотой (20 мкг/сут в те дни, когда МТ не применяют). Доказана эффективность лефлуномида для замедления суставных деструкций и уменьшения выраженности кожных проявлений псориаза. Доза лефлуномида – 100 мг/сут в течение первых 3 дней, затем – по 20 мг/сут. Применяют также салазопроизводные (сульфасалазин). Начинают лечение с 500 мг/сут в течение недели, затем дозу повышают на 500 мг/сут каждую неделю до терапевтической (2–3 г/сут); поддерживающая доза – 0,5–1,0 г/сут. Хорошо зарекомендовал себя в лечении кожных проявлений псориаза циклоспорин А. Его суточная доза составляет 2,5–3,0 мг/кг, в процессе лечения необходим контроль уровня креатинина сыворотки крови. При неэффективности БПВП могут быть использованы таргетные синтетические БПВП – апремиласт, ингибитор фосфодиэстеразы 4 (ФДЭ4), зарегистрированный для лечения псориаза и ПсА [12–17].
Несмотря на сложность и многогранность, патогенез воспаления при ПсА имеет ключевые звенья. Одним из этих звеньев является ФДЭ4 – энзим, участвующий в метаболизме циклического аденозинмонофосфата (цАМФ) в иммунных клетках, регулирующих воспаление, а также катализирующий переход цАМФ в его неактивную форму – АМФ. Ингибиторы ФДЭ4 тормозят разрушение цАМФ и способствуют поддержанию его высокого внутриклеточного уровня, что снижает активность провоспалительных функций клеток. Хотя семейство ФДЭ состоит из 11 изоформ, ФДЭ4 является цАМФ-специфической и преобладающей изоформой, которая экспрессируется иммунными клетками воспаления. ФДЭ4 – основной регулятор метаболизма цАМФ практически во всех провоспалительных и структурных клетках, вовлеченных в хроническое воспаление при ПсА [11, 17].
Апремиласт ингибирует внутри клетки ФДЭ4, что ведет к подавлению воспалительной реакции за счет снижения продукции ФНОα, ИЛ12, ИЛ23, ИЛ17, ИЛ22 и других провоспалительных цитокинов, а также изменения уровней некоторых противовоспалительных цитокинов, например ИЛ6, ИЛ10. В клинических исследованиях у больных ПсА апремиласт значительно модулировал, но полностью не ингибировал белки плазмы крови: ИЛ1α, ИЛ6, ИЛ8, моноцитарный хемоаттрактантный белок 1, макрофагальный белок воспаления 1β, матриксную металлопротеиназу 3 и ФНОα [14, 15]. Через 40 нед лечения апремиластом отмечено снижение концентрации ИЛ17 и ИЛ23 и повышение содержания ИЛ10 в плазме крови. У больных псориазом апремиласт уменьшал очаговые эпидермальные утолщения пораженных участков кожи, инфильтрацию клетками воспаления и экспрессию провоспалительных генов, включая гены индуцируемой синтазы оксида азота (iNOS), ИЛ12/ИЛ23p40, ИЛ17A, ИЛ22 и ИЛ8 (рис. 2) [17–18].
Апремиласт – пероральный ингибитор ФДЭ4, представитель нового класса малых молекул (блокаторы сигнальных путей) в лечении псориаза и ПсА. Препарат применяется для терапии бляшечного псориаза средней и тяжелой степени у взрослых при недостаточной эффективности, противопоказаниях к использованию БПВП или их непереносимости, включая циклоспорин, МТ или лекарственные средства, используемые вместе с ультрафиолетовым облучением А, а также при лечении активного ПсА у взрослых в монотерапии или в комбинации с БПВП при недостаточном ответе на предшествующую терапию БПВП или ее непереносимости [13–16]. Также апремиласт может быть назначен в тех случаях, когда терапия ГИБП не показана (инфекции, особенности введения ГИБП) либо неэффективна. Апремиласт может применяться у больных с коморбидными заболеваниями (например, метаболическим синдромом, повышенным риском гепатотоксичности и др.) [13–16].

Рис. 2. Роль ФДЭ4 в патогенезе воспалительных заболеваний 2
Особыми клиническими проявлениями ПсА являются дактилит и энтезит, которые существенно ухудшают качество жизни пациентов и плохо поддаются лечению [1, 12].
Резистентность дактилита и энтезита к терапии объясняется несколькими факторами. Так, некоторые исследователи считают, что она связана с наличием в области воспаления аваскулярных зон (сухожилия, капсулы и др.), в которые затруднена доставка активных действующих веществ лекарственных средств. Более того, дактилит и энтезит ассоциируются с вовлечением в воспаление многих цитокинов, концентрация ряда которых не уменьшается при подавлении воспаления с применением блокаторов других цитокинов. Показано, что уровень ИЛ17A, ИЛ12/23 остается стабильным даже после подавления активности ФНОα [19]. В связи с этим представляется перспективным применение ингибиторов ФДЭ4 (апремиласт), которые одновременно прерывают транскрипцию многих провоспалительных цитокинов и блокируют внутриклеточный механизм ее реализации. Это приводит к подавлению концентрации цитокинов, в том числе в аваскулярных зонах. Такой подход перспективен в лечении дактилита и энтезита, являющихся частыми и тяжелыми проявлениями ПсА [1, 12, 18, 20, 21].
В рандомизированных клинических исследованиях (PALACE 1–3) было доказано, что при ПсА апремиласт эффективен в отношении периферического артрита, псориаза, а также достоверно повышает физическую активность пациентов и улучшает качество жизни. Ответ по ACR20, ACR50 и ACR70 наблюдался у 61,3; 30,7 и 12% пациентов через 1 год терапии и у 66,5; 37,3 и 21% через 2 года [22].
Апремиласт уменьшает выраженность симптомов дактилита и энтезита при ПсА. Эффект доказанно сохраняется в течение 3 лет терапии препаратом. Апремиласт включен в рекомендации EULAR и GRAPPA для лечения активного периферического артрита, дактилита, энтезита, псориаза (в том числе псориаза ногтей) у пациентов с неэффективностью/непереносимостью БПВП или хотя бы одного ГИБП [15, 16, 22–24].
Высокая частота коморбидных состояний при ПсА, в частности хронической обструктивной болезни легких (ХОБЛ) у курильщиков, делает предпочтительным применение у таких больных ингибиторов ФДЭ4, которые положительно влияют как на суставной синдром, так и на поражение легких, т. е. оказывают плейотропный эффект.
Безопасность и эффективность апремиласта изучалась в ходе многоцентровых рандомизированных двойных слепых плацебоконтролируемых регистрационных исследований III фазы ESTEEM, в которых участвовали 1257 пациентов с хроническим вульгарным псориазом умеренной – тяжелой степени. Пациенты были рандомизированы на группы в соотношении 2:1 для получения апремиласта 30 мг дважды в день и плацебо. К 16-й неделе 75% улучшения по шкале Psoriasis Area and Severity Index (PASI-75 – основной критерий эффективности терапии) достигли 33,1% пациентов в исследовании ESTEEM I и 28% в исследовании ESTEEM II, что достоверно выше, чем в группе сравнения (5,3 и 5,8% соответственно; р remains high in patients with ankylosing spondylitis receiving inhibitors of tumor necrosis factor α in the course of the year. Terapevticheskii arkhiv. 2017; 89(4):80-5. (In Russ.)]
Мазуров В.И., Трофимов Е.А., Гайдукова И.З. Место ингибитора фосфодиэстеразы 4-го типа в стратегии лечения псориатического артрита. Современная ревматология. № 1, 2018.
Апремиласт, ингибирующий фосфодиэстеразу 4 типа и подавляющий синтез различных провоспалительных цитокинов, – это низкомолекулярный базисный противовоспалительный препарат таргетного действия, предназначенный для лечения средне-тяжелого и тяжелого бляшечного псориаза и активного псориатического артрита (ПсА). В рандомизированных, плацебо-контролируемых исследованиях 3 фазы, проводившихся в целом у нескольких тысяч больных псориазом (ESTEEM 1, 2) и ПсА (PALACE 1-3, ACTIVE), апремиласт по эффективности достоверно превосходил плацебо. Апремиласт не является белком и, соответственно, не обладает иммуногенностью. В клинических исследованиях апремиласт характеризовался благоприятным профилем безопасности, в частности не вызывал увеличения риска инфекционных осложнений.
Псориаз – это хроническое иммуновоспалительное заболевание кожи, распространенность которого в общей популяции достигает 2% [1]. В настоящее время псориаз рассматривают как системное заболевание, поражающее не только кожу, но и другие ткани, в частности суставы и ногти [2]. Псориатический артрит (ПсА) развивается примерно у каждого третьего больного псориазом и может сопровождаться воспалением энтезисов (энтезит) и сухожилий пальцев кистей и стоп (дактилит, теносиновит), тел позвонков (спондилит) и илиосакральных сочленений (сакроилиит) [3,4]. Для лечения средне-тяжелого и тяжелого бляшечного псориаза и ПсА применяют различные базисные противовоспалительные препараты (БПВП), прежде всего метотрексат, и генно-инженерные биологические препараты (ГИБП), в том числе ингибиторы фактора некроза опухоли-α (ФНО-α), интерлейкинов-12/23 (ИЛ-12/23) и ИЛ-17А, которые оказывают действие на все проявления псориатической болезни [5,6].
Апремиласт – это таблетированный представитель низкомолекулярных БПВП таргетного действия для лечения псориаза и ПсА [7]. Апремиласт оказывает селективное ингибирующее действие на фосфодиэстеразу 4 типа (ФДЭ 4), которая разрушает цикло-аденозинмонофосфат (цАМФ) [8]. Увеличение содержания цАМФ в клетках, экспрессирующих ФДЭ 4, сопровождается подавлением синтеза провоспа лительных цитокинов, в том числе ФНО-α, интерферона-g, интерлейкинов 12, 17, 22, 23, и хемокинов (CXCL9, CXCL10 и CCL4). Таким образом, апремиласт действует на начальном этапе воспалительного каскада и регулирует продукцию многочисленных компонентов воспалительного ответа [9].
В Российской Федерации апремиласт в дозе 30 мг два раза в день зарегистрирован под торговым названием ОТЕСЛА® для лечения активного ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением. Апремиласт был включен в Российские федеральные рекомендации, рекомендации EULAR (European League Against Rheumatism), GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis), NICE (National Institute for Health and Care Excellence) для лечения пациентов с активным ПсА и псориазом 13.
Эффективность апремиласта в лечении псориатического артрита и псориаза
Эффективность и безопасность апремиласта в лечении ПсА изучались в рандомизированных, плацебо-контролируемых клинических исследованиях 3 фазы (программа PALACE), которые проводились по сходным протоколам 14. В целом в эти исследования были включены более 2000 взрослых больных активным ПсА (по крайней мере 3 опухших и болезненных сустава, длительность артрита ≥3 или ≥6 месяцев), которые получали апремиласт в дозах 20 или 30 мг два раза в день или плацебо. В исследования PALACE 1, PALACE 2 и PALACE 3 включали больных, которые ранее принимали стандартные БПВП (72-83% пациентов) или ГИБП (15-28%). Допол ни тель ным критерием включения в исследование PALACE 3 было наличие по крайней мере одной псориатической бляшки размером ≥2 см. Во время исследований допускалась сопутствующая терапия метотрексатом, сульфасалазином, лефлуномидом, глюкокортикостероидами в низких дозах и/или нестероидными противовоспалительными препаратами. Первичной конечной точкой исследований PALACE была частота ответа по критериям Амери канской коллегии ревматологов (АКР 20) через 16 недель, а основной вторичной конечной точкой – изменение индекса нетрудоспособности по вопроснику Health Assessment Questionnaire (HAQ-DI).
По частоте ответа по критерию АКР 20 апремиласт превосходил плацебо как у больных, получавших БПВП (32-41% и 18-19%, соответственно), так и пациентов, которые ранее не принимали БПВП или ГИБП (31% и 16%). К настоящему времени опубликованы результаты долгосрочной терапии апремиластом. Так, через 1 год применения препарата ответ по AКР 20 наблюдался у 61,3% пациентов, через 4 года – у 66,4% [17]. Таким образом, с течением времени отмечалось постепенное стабильное нарастание терапевтического эффекта (рис. 1).
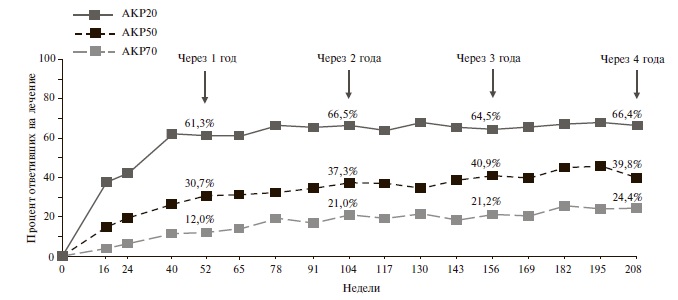
Рис. 1. Частота ответа по критериям АКР при длительном лечении апремиластом у больных ПсА
Эффективность апремиласта была подтверждена и при анализе динамики индекса HAQ-DI, который в большей степени снизился при применении исследуемого препарата. Клинически значимое снижение индекса HAQ-DI по крайней мере на 0,35 через 156 недель было достигнуто у 48% больных в исследованиях PALACE 1, 2 и 3. Стоит также отметить, что по данным мета-анализа исследований PALACE 1, 2 и 3, у больных, завершивших 52- и 104-недельную терапию апремиластом, отмечалось снижение индекса утомляемости (FACIT-F) на 4,8 и 5,6 балла, соответственно, а клинически значимое снижение этого показателя в обеих точ ках было достигнуто примерно у половины пациентов.
Во всех трех исследованиях лечение апремиластом привело также к достоверному уменьшению числа болезненных и припухших суставов, индекса DAS28СРБ, а также к уменьшению проявлений энтезитов и дактилитов. По данным анализа исследований PALACE 1, 2 и 3, через 3 года применения апремиласта симптомы дактилита были полностью устранены у 79,6% пациентов, симптомы энтезита – у 55,0% (рис. 2, 3).
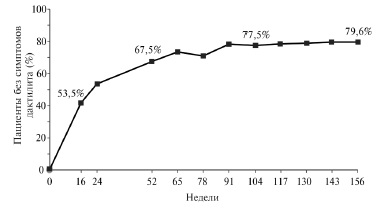
Рис. 2. Динамика процента больных, у которых отсутствовали признаки энтезита, при длительном лечении апремиластом в дозе 30 мг два раза в день
Эффективность апремиласта была подтверждена в рандомизированном, двойном слепом, международном исследовании ACTIVE, в которое были включены 219 пациентов с активным ПсА (по крайней мере три болезненных сустава и по крайней мере три припухших сустава) длительностью ≥3 мес [18]. Больные ранее не получали ГИБП, а стандартные БПВП отменяли перед началом исследования, во время которого допускалась только сопутствующая терапия пероральными глюкокортикостероидами в стабильных низких дозах и/или НПВП. Пациентов рандомизировали на группы апремиласта в дозе 30 мг два раза в день или плацебо. Через 16 недель больных, у которых счет болезненных и при суставов не улучшался по крайней мере на 10%, переводили на апремиласт, а через 24 недели исследуемый препарат назначали всем оставшимся пациентам группы плацебо.
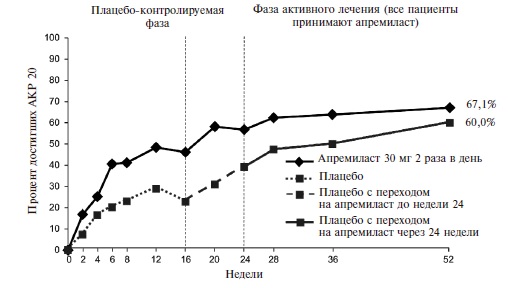
Рис. 3. Динамика процента больных, у которых отсутствовали признаки дактилита, при длительном лечении апремиластом в дозе 30 мг два раза в день.
Действие монотерапии апремиластом проявлялось быстро. Уже через 2 недели частота ответа по критерию АКР 20 в основной группе достоверно превышала таковую в группе плацебо (16,4% и 6,4%, соответственно; p=0,0252) (рис. 4). При продолжении лечения частота ответа постепенно нарастала и через 16 недель (первичная конечная точка) достигла 38,2% против 20,2% в группе плацебо (p 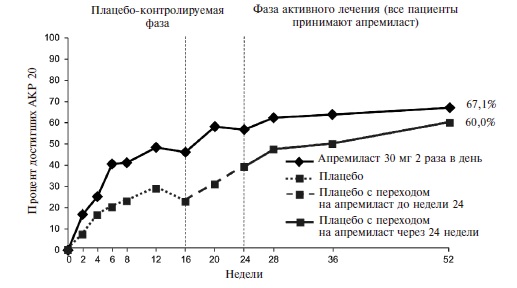
Рис. 4. Частота ответа покритериям АКР20 у больных ПсА в исследовании ACTIVE
Таким образом, результаты двойных слепых, контролируемых исследований 3 фазы показали, что апремиласт в дозе 30 мг два раза в день по эффективности превосходит плацебо у больных ПсА. Действие препарата проявлялось уже в первые 2 недели, а через 16 недель доля пациентов, ответивших на лечение (АКР 20), составляла 30-40% и достоверно превышала таковую в группе плацебо. Через 3-4 года ответ по критерию АКР 20 наблюдался примерно у 2/3 больных ПсА, продолжавших терапию апремиластом.
Эффективность апремиласта у пациентов со среднетяжелым и тяжелым псориазом изучалась в регистрационных, рандомизированных, двойных слепых, плацебо-контролируемых исследованиях 3 фазы ESTEEM [19,20]. В эти исследования были включены взрослые больные средне-тяжелым или тяжелым бляшечным псориазом кожи (индекс PASI≥12), нуждавшиеся в системной терапии или фототерапии.
Первые результаты лечения отмечались уже через 2 недели применения препарата, а через 16 недель исходное значение индекса PASI уменьшилось по крайней мере на 75% (PASI 75) у трети пациентов. Через 52 недели достигнутый ответ на лечение сохранялся у пациентов, продолживших прием апремиласта.
Особый интерес представляют данные субанализа исследований, отражающие терапевтическую эффективность препарата в отношении проявлений псориаза ногтей и волосистой части головы, которые, в целом, хуже поддаются лечению [21]. В исследовании ESTEEM через 16, 32 и 52 недели индекс NAPSI, который используется для оценки тяжести поражения ногтей, уменьшился на 22,5%, 43,6% и 60,2%, соответственно, а в исследовании ESTEEM 2 – на 29,0%, 60,0% и 59,7%. При этом индекс NAPSI в те же сроки уменьшился по крайней мере в два раза у 33,3%, 45,2% и 63,0% больных, соответственно, в первом исследовании и у 44,6%, 55,4% и 68,6% пациентов во втором исследовании.
Эффективность апремиласта была показана и при анализе динамики поражения волосистой части головы. Так, через 52 недели полное или практически полное разрешение псориаза этой локализации быдо достигнуто у 73,0% пациентов в исследовании ESTEEM 1 и у 62,5% больных в исследовании ESTEEM 2.
Профиль безопасности апремиласта у больных ПсА и псориазом
Отличительной особенностью апремиласта являются хорошая переносимость и благоприятный профиль безопасности [22,23]. При длительном лечении апремиластом у больных псориазом и ПсА не было выявлено увеличения риска серьезных инфекций, сердечно-сосудистых исходов или злокачественных опухолей, частота которых оставалась очень низкой [7]. Также не было выявлено ни одного случая реактивации латентного туберкулеза.
Все ГИБП представляют собой белки, которые обладают иммуногенностью и вызывают образование антител, в том числе с нейтрализующей активностью. Появление нейтрализующих антител при введении ГИБП может нивелировать эффект лечения. По данным мета-анализа 68 исследований более чем у 14000 пациентов с различными аутоиммунными заболеваниями, получавших ингибиторы ФНО-α, частота образования антител к препаратам этой группы составила в целом 12,7%, а при применении инфликсимаба достигла 25,3% [24]. Риск формирования антительного ответа был ниже при применении ГИБП, представляющих собой человеческие антитела, таких как секукинумаб или устекинумаб. Апремиласт – это низкомолекулярный непептидный препарат, поэтому он не способен вызывать появление антител.
В клинических исследованиях основными нежелательными эффектами препарата были легкие или умеренно выраженные желудочно-кишечные нарушения, в том числе диарея, тошнота и рвота, которые возникали в течение первых 2 недель и проходили в течение 4 недель [25]. У большинства больных желудочно-кишечные расстройства не требовали прекращения приема апремиласта. Кроме того, при лечении апремиластом встречались инфекции верхних дыхательных путей и головная боль, в том числе напряжения [7]. При более длительном применении апремиласта (до 156 недель в исследованиях ESTEEM и до 208 недель в исследованиях PALACE) частота и тяжесть нежелательных явлений не нарастали, а новых значимых нежелательных реакций выявлено не было [26,27].
В клинических исследованиях у больных псориазом и ПсА частота депрессии при лечении апремиластом была несколько выше, чем при приеме плацебо. У пациентов с псориазом депрессия ни в одном случае не потребовала прекращения лечения, в то время как у больных ПсА частота отмены апремиласта из-за депрессии составила 0,2% (3 из 1945 пациентов). Псориаз сам по себе ассоциируется с депрессией. Соот ветственно, депрессивное состояние не является основанием для отказа от лечения, однако в таких случаях следует соблюдать осторожность.
У пациентов с легким или умеренным нарушением функции почек апремиласт применяют в стандартной дозе, в то время как при тяжелой почечной недостаточности (клиренс креатинина
Заключение
Апремиласт – это таблетированный препарат, который действует на более раннем этапе воспалительного каскада, чем ГИБП, в том числе ингибиторы ФНО-α, ИЛ12/23 и ИЛ-17А, и вызывает подавление продукции различных медиаторов воспаления. Апремиласт применяют в дозе 30 мг два раза в день для лечения ПсА у взрослых в виде монотерапии или в комбинации с БПВП при недостаточном ответе или при непереносимости предшествующей терапии БПВП, а также для лечения средне-тяжелого и тяжелого бляшечного псориаза у взрослых при недостаточном ответе, наличии противопоказаний или непереносимости других БПВП, включая циклоспорин, метотрексат или лекарственные средства, применяемые вместе с ультрафиолетовым-А облучением.
В рандомизированных, двойных слепых клинических исследованиях 3 фазы у больных средне-тяжелым и тяжелым бляшечным псориазом и ПсА апремиласт по эффективности достоверно превосходил плацебо, а достигнутый ответ сохранялся в отдаленном периоде. Терапия апремиластом вызывала уменьшение тяжести псориаза ногтей и волосистой части головы, который в целом хуже поддается лечению, а также улучшала качество жизни пациентов с псориазом.
У пациентов с активным ПсА апремиласт оказывал быстрое действие и уменьшал симптомы артрита, энтезита и дактилита. Судить о сравнительной эффективности апремиласта и ГИБП сложно, учитывая отсутствие прямых сравнительных исследований. Преимуществом апремиласта являются возможность приема внутрь и благоприятный профиль безопасности. Лечение этим препаратом не сопровождается повышением риска инфекционных осложнений, в том числе активации латентного туберкулеза, и образованием антител.
Читайте также:


