Guidelines международные стандарты лечения остеопороза
Остеопороз: стандарты диагностики и лечения
Определение, классификация и клиническое значение.
Выделяют две основные формы остеопороза: первичный и вторичный. В свою очередь первичный остеопороз условно подразделяется на постменопаузальный и сенильный.
Первичный остеопороз может развиваться у мужчин и женщин в любом возрасте, но чаще у женщин в период менопаузы и у мужчин в пожилом возрасте.
Вторичный остеопороз обычно является осложнением различных заболеваний (эндокринных, воспалительных, гематологических, гастроэнтерологических и др.) или лекарственной терапии (например, глюкокортикоидный остеопороз). По некоторым оценкам, вторичный остеопороз составляет 60% от всех случаев остеопороза у мужчин (наиболее часто связан с гипогонадизмом, приемом глюкокортикоидов и алкоголизмом), и примерно половину от всех случаев остеопороза у женщин в перименопаузе (гипоэстрогенемия, применение глюкокортикоидов, тиреоидных гормонов и противосудорожных препаратов).
Клиническое значение остеопороза определяется в первую очередь риском переломов костей скелета. Наиболее частыми и характерными являются возникающие после минимальной травмы (нетравматические) переломы позвоночника, дистального отдела лучевой кости и проксимального отдела бедренной кости (перелом шейки бедра).

А. Тело неизмененного позвонка (приводим в качестве сравнения).
Б. Компрессионный перелом позвонка при остеопорозе.
Обращает на себя внимание характерная структура остеопорозно измененного тела позвонка: значительное уменьшение количества горизонтальных трабекул и истончение вертикальных.

Рентгенограмма позвоночника при компрессионном переломе нижнегрудного позвонка (указан стрелкой).
У пациентки с постменопаузальным остеопорозом перелом произошел на фоне минимальной бытовой травмы.
| Т-индекс | Диагноз | Риск переломов | Рекомендации (см. табл. 4) |
|---|---|---|---|
| +2,0 до –1 | Нормальная МПКТ | Уровень 1: низкий | Только диетические рекомендации или добавки кальция и витамина D, физические упражнения |
| –1,0 до –2,5 | Остеопения | Уровень 2: умеренный риск | Добавки кальция и витамина D, возможно других препаратов |
| –2,5 или меньше без предшествующих переломов | Остеопороз | Уровень 3: высокий | Обязательно лечение антиостеопоретическими препаратами, предотвращение потерь равновесия |
| –2,5 или меньше с предшествующими переломами | Тяжелый остеопороз | Уровень 4: очень высокий | То же, что и уровень 2, но более интенсивно |
Генетические или конституциональные
- Принадлежность к европеоидной или монголоидной расам
- Семейная предрасположенность (нетравматические переломы у родственников первой степени родства)
- Хрупкое телосложение
- Большая осевая длина шейки бедра
Образ жизни и питания
- Низкое потребление кальция и витамина D
- Курение
- Алкоголизм
- Низкая физическая активность
- Длительная иммобилизация
- Длительное парентеральное питание
- Низкая масса тела
- Отсутствие беременности
Заболевания
- Нарушение менструального статуса (длительная вторичная аменорея, преждевременная менопауза – до 45 лет, позднее начало менструаций)
- Эндокринные болезни (первичный гиперпаратиреоз, тиреотоксикоз, сахарный диабет, синдром Кушинга, болезнь Аддисона, первичный гипогонадизм, гиперпролактинемия)
- Болезни крови (множественная миелома, системный масцотоз, лимфома, лейкоз, пернициозная анемия)
- Воспалительные ревматические заболевания (ревматоидный артрит, анкилозирующий спондилоартрит, полимиозит/дерматомиозит, системная красная волчанка)
- Заболевания ЖКТ (нарушение всасывания, вызванное желудочно-кишечными заболеваниями), болезнь Крона, хронические заболевания печени)
- Хронические обструктивные заболевания легких
- Хронические неврологические заболевания
- Застойная сердечная недостаточность
- Хроническая почечная недостаточность
- Состояние после пересадки органов
Лекарственные препараты
- Глюкокортикоиды (>7,5 мг преднизолона более 6 мес)
- Тиреотропные препараты (тироксин)
- Антикоагулянты (непрямые, прямые)
- Агонисты и антагонисты гонадотропина
- Противосудорожные препараты (фенитоин)
- Фосфат–связывающие антациды
Обязательные
- Анамнез и физический осмотр
- Анализ крови (лейкоциты, СОЭ, уровень кальция, альбумина)
- Анализы фосфатов, щелочной фосфатазы в сыворотке, печеночных трансаминаз, белка сыворотки, электрофорез, анализ мочи
- Рентгенография поясничного и грудного отдела позвоночника
- Определение МПКТ (любым стандартизованным методом, предпочтительней DXA)
- Тестостерон и гонадотропин (у мужчин)
Дополнительные
- Маркеры метаболизма костной ткани в сыворотке и моче
- ПТГ, 25-OHD, тиреотропный гормон в сыворотке, маркеры злокачественных новообразований
- Гонадотропины и свободный кортизол в моче
- Стернальная пункция
- Биопсия крестцово-подвздошной кости после двойной маркировки тетрациклином для гистоморфометрии и анализа костного мозга
| Препарат | Снижение риска переломов | |||
|---|---|---|---|---|
| позв. и непозв. | только позв. | только непозв. | только переломы бедра | |
| Алендронат | + | + | ||
| ГЗТ | +/- | |||
| Ризедронат | + | + | ||
| Кальцитонин МИАКАЛЬЦИК | + | + | ||
| Этидронат | + | |||
| Ралоксифен | + | |||
| Кальцитриол | +/- | |||
| Кальций + витамин D i | + | + | ||
| Примечание. Позв. – позвоночные, непозв. – непозвоночные. | ||||
В настоящее время принято оценивать степень тяжести остеопороза на определении минеральной плотности костной ткани (МПКТ).
Риск переломов примерно удваивается при уменьшении МПКТ на одно стандартное отклонение от пиковой костной массы, а также если пациент уже перенес остеопоретический перелом.
Клинические факторы риска, которые могут быть успешно применены для активного выявления больных с остеопорозом представлены в табл. 2.
К наиболее существенным, частично не зависимым от МПКТ, относятся преждевременная менопауза, длительное лечение глюкокортикоидами (ГК), наличие некоторых заболеваний и переломов до 45 лет, низкий индекс массы тела ( без операций
Индивидуальный подход
к каждому пациенту
Максимальная эффективность
при минимальных затратах
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Остеопороз является заболеванием скелета, для которого характерны снижение прочности костной ткани и повышение риска переломов [1]. В России остеопорозом (ОП) больны 14 млн человек, что составляет 10% населения, в то же время у 20 млн диагностирована остеопения (15%) [2]. Популяционные исследования, проведенные сотрудниками НИИ ревматологии РАМН, демонстрируют, что ОП страдают 33,8% женщин и 26,9% мужчин старше 50 лет. Неутешительна статистика по развитию осложнений ОП – переломов (табл. 1) [3,4].
За последние 20 лет расширились знания о молекулярно–биологических, генетических и др. особенностях костного ремоделирования и патогенеза остеопороза. Это позволяет разрабатывать новые антиостеопоретические препараты.
Препараты, применяемые для профилактики и лечения остеопороза, условно разделены на следующие группы:
• обеспечивающие положительный кальциевый баланс (кальций, витамин D, активные метаболиты витамина D, тиазиды);
• преимущественно подавляющие резорбцию костной ткани (эстрогены, кальцитонин, бисфосфонаты);
• преимущественно стимулирующие образование костной ткани (производные фтора, анаболические стероиды, паратиреоидный гормон);
• препараты, улучшающие качество костной ткани (бисфосфонаты, метаболиты витамина D);
• другие (иприфлавон, оссеин–гидроксиапатит) [5].
Однако несмотря на то, что в арсенале практического врача имеются различные по механизму действия, активности, химической структуре и др. показателям препараты, остается проблемой выбор метода антирезорбтивного воздействия, притом что на фоне приема большинства из них отмечено увеличение минеральной плотности костной ткани (МПКТ) костей различной локализации. Однако более важным аспектом воздействия является способность снижать частоту остеопоретических переломов (табл. 2), т.к. остеопороз – мультифакториальное системное заболевание, приводящее к увеличению риска переломов костей скелета.
Таким образом, в настоящее время обобщенно механизм действия БФ можно представить следующим образом:
• прямое действие на остеокласты, что приводит к нарушению их образования, метаболизма и функциональной активности, индукции их апоптоза и, как следствие, к подавлению костной резорбции;
• физико–химическое связывание с гидроксиапатитом на резорбтивной поверхности и т.д.
В России зарегистрированы следующие препараты, применяемые для лечения больных остеопорозом:
• алендронат,
• ибандронат,
• золедроновая кислота,
• ризендронат.
Если рассматривать фармакологические особенности алендроната, следует отметить, что препарат ограниченно всасывается из желудочно–кишечного тракта. При приеме внутрь за 0,5 и 1 ч до завтрака его биодоступность снижается примерно на 40% по сравнению с более ранним приемом – за 2 ч до завтрака. После всасывания наблюдается достаточно быстрое (в течение 30–60 мин.) распределение алендроната в мягкие ткани с последующим перераспределением в костную ткань либо выведение с мочой. Концентрация препарата в плазме крови после приема внутрь терапевтической дозы весьма мала и составляет около 5 нг/мл. Однако его связывание с белками плазмы достигает достаточно высоких значений – 78%. Около 40–60% от поступившей в системную циркуляцию дозы концентрируется в скелете в зависимости от скорости протекающих в ней процессов ремоделирования, остаточная, неперераспределившаяся часть выводится почками. Алендронат не подвергается метаболизму и обнаруживается в моче в неизмененном виде.
Поступивший в костную ткань препарат прочно связывается с гидроксиапатитом, что определяет его длительное, в течение нескольких лет, нахождение в скелете (период полусуществования алендроната, связанного с костью, составляет около 10 лет) [6]. Этому способствует и то, что даже при разрушении костного матрикса в процессе ремоделирования высвобождающийся БФ повторно связывается с неразрушившимися кристаллами гидроксиапатита.
Основными показаниями для назначения алендроната являются профилактика и лечение постменопаузального, сенильного и стероидного ОП, а также болезни Педжета и гиперкальциемии, обусловленной злокачественными новообразованиями.
Лечение остеопороза включает применение основного патогенетически обусловленного препарата, а также кальция и витамина D в физиологических дозах (табл. 4).
Таким образом, прием трех различных препаратов снижает комплаентность – приверженность пациентов к лечению [11].
Основой для создания указанной комбинированной лекарственной формы также явилось широкое распространение дефицита витамина D в популяции, в первую очередь у лиц пожилого возраста, в том числе у пациентов с ОП. В доступной нам литературе опубликованы данные о клиническом исследовании безопасности и эффективности данной комбинации. В таблице 5 систематизированы данные о дизайне исследования.
Полученные результаты исследования [13] продемонстрировали, что у пациентов, получавших комбинированную терапию, отмечено достоверное повышение уровня циркулирующего 25(ОН)D (биологически неактивной прогормональной формы витамина D). Данный показатель традиционно используется в качестве маркера статуса витамина D. Повышение уровня 25(ОН)D по сравнению с группой пациентов, получавших еженедельно монотерапию – 70 мг алендроната, составило 26%, но в соответствии с существующими критериями дефицита витамина D [13] не достигало значений, свидетельствующих о его устранении. При этом не было отмечено снижения суррогатных маркеров костного ремоделирования (к которым относятся N–телопептид молекулы коллагена I типа, костная специфическая щелочная фосфатаза), изменения уровня ПТГ, развития гипокальциемии, гиперкальциурии и других побочных реакций по сравнению с группой пациентов, получающих алендронат (как у мужчин, так и у женщин).
Таким образом, результаты данного короткого клинического исследования свидетельствуют о том, что комбинированное применение алендроната в дозе 70 мг/нед. и колекальциферола 2600 МЕ 1 раз/нед. сопровождается незначительным, но достоверным повышением уровня 25(ОН)D. Однако вышеперечисленные изменения не сопровождаются значимыми изменениями маркеров костного ремоделирования, которые отмечены при монотерапии алендронатом. К сожалению, в опубликованном материале отсутствуют данные о комплаентности.
Основные направления и механизмы действия витамина D следующие:
• усиление всасывания кальция в желудочно–кишечном тракте;
• активизация процессов костного ремоделирования;
• подавление избыточной секреции паратиреоидного гормона;
• угнетение повышенной костной резорбции;
• улучшение нервно–мышечной проводимости, сократимости и релаксации мышц и др.
С учетом как приведенных данных, так и результатов многочисленных экспериментальных и клинических исследований, свидетельствующих о том, что биологически неактивные препараты природного витамина D, во–первых, лишь ограниченно метаболизируются до обладающего биологической активностью 1α25(OH)2D3 (D–гормона) из–за низкой активности почечного фермента 1α–гидроксилазы у лиц пожилого возраста и, во–вторых, в связи со значительным снижением числа рецепторов к D–гормону в тканях у этого контингента не являются оптимальными для ликвидации дефицита витамина D, широко распространенного в популяции пожилых людей [7], на метаболизм витамина D также оказывают влияние лекарственные препараты и химические агенты (табл. 6).
Таким образом, комбинированная лекарственная форма – 70 мг натриевой соли алендроната и 2800 МЕ колекальциферола или 5600 МЕ колекальциферола может лишь в небольшой степени и только у незначительной части пациентов способствовать коррекции дефицита витамина D и остеопороза.
Алендронат по химическому строению относится к группе амино–бисфосфонатов и является одним из наиболее активных и подробно изученных антикатаболических (антирезорбтивных) средств. Также это бисфосфонаты второго поколения. Механизм его действия, как в случае с другими аминобисфосфонатами, заключается в ингибировании фермента фарнезил–пирофосфатсинтетазы и блокировании пренилирования небольших гуанинтрифосфотаз (ГТФаз), таких как Ras, Rac, Rho cdc42 [8,9,10]. Данные эффекты способствуют постоянному накоплению непренелированных ГТФаз в цитоплазме остеокластов, что сопровождается формированием внутриклеточных сигнальных механизмов, приводящим к нарушению функций остеокластов, снижению их жизнеспособности. Таким образом, развивается апоптоз этих клеток и тормозится костная резорбция [8,10].
По данным исследовательской группы университета Барселоны (Испания), алендронат вызывает дозозависимое повышение продукции клетками такого важного регулятора активности, как ОК–RANKL, не изменяя активность щелочной фосфатазы и экспрессию гена другого члена семейства RANK – RANKL–OPG – остеопротеогерина (OPG). Однако это происходит лишь в культуре дифференцирующихся остеобластов (ОБ) и только в присутствии в культуральной среде витамина D [10].
Второй компонент комбинированного препарата Тевабон, альфакальцидол, является представителем группы витамина D. По фармакологической активности препараты витамина D разделяют на 2 группы:
• обладающие умеренной активностью нативные/природные витамины D2 – эргокальциферол и D3 – колекальциферол, а также структурный аналог витамина D3 – дигидротахистерол. Эти компоненты часто используются в составе поливитаминных препаратов для детей и взрослых. В соответствии с содержанием действующих веществ (200–400 МЕ) препараты этой группы относят к микронутриентам, т.е. пищевым добавкам [14,15];
• активный метаболит витамина D3 (1α25(ОН)2D3 (кальцитриол) идентичен природному D–гормону и его синтетический аналог – альфакальцидол (1α(ОН)D) [14,15].
Механизм действия препаратов обеих групп аналогичен воздействию природного витамина D и заключается в связывании активного метаболита со специфическими рецепторами в органах–мишенях (табл. 7) и обусловленными их активацией фармакологическими эффектами (усиление всасывания кальция в кишечнике, повышение минерализации костного матрикса, рост и дифференцировка клеток и др.).
Различия в действии отдельных препаратов носят в основном количественный характер и определяются особенностями их фармакокинетики и метаболизма. Так, препараты нативных витаминов D2 и D3 подвергаются в печени 25–гидроксилированию с последующим превращением в почках в активные метаболиты, оказывающие соответствующие фармакологические эффекты. Таким образом, в соответствии с указанными выше причинами процессы метаболизма данных препаратов, как правило, снижаются у определенной когорты пациентов. Можно выделить следующие группы:
• лица пожилого возраста;
• пациенты с различными типами и формами первичного и вторичного ОП;
• пациенты с заболеваниями ЖКТ, печени, поджелудочной железы и почек (особенно с хронической почечной недостаточностью);
• лица, принимающие некоторые лекарственные препараты (табл. 6).
Кроме того, дозы витаминов D2 и D3 и их аналогов в лекарственных формах (как правило, близкие к физиологическим потребностям в витамине D – 200–800 МЕ в сутки) у детей и молодых взрослых способны в физиологических условиях усиливать абсорбцию кальция в кишечнике. Однако это не позволяет преодолеть его мальабсорбцию у пожилых пациентов при разных формах ОП и не оказывает отчетливого положительного влияния на костную ткань [16,17].
Этих недостатков лишены препараты, содержащие активные метаболиты витамина D3 кальцитриол и альфакальцидол. Они сходны по спектру фармакологических свойств и механизму действия, но различаются по фармакокинетическим параметрам, переносимости и некоторым другим характеристикам [15–18]. После приема внутрь кальцитриол быстро всасывается в тонком кишечнике. Максимальная его концентрация в сыворотке крови достигается через 2–6 ч и существенно снижается уже через 4–8 ч. Период полувыведения составляет 3–6 ч. При повторном приеме равновесные концентрации достигаются в пределах 7 сут. В отличие от природного витамина D3 кальцитриол вызывает уже через 2–6 ч повышение кишечной абсорбции кальция. Это обусловлено особенностями его метаболизма. Уже после приема внутрь в дозах 0,25–0,5 мкг благодаря взаимодействию с внеядерными рецепторами энтероцитов слизистой оболочки кишечника концентрация его повышается. Предполагают, что экзогенный кальцитриол проникает из крови матери в кровоток плода, выделяется с грудным молоком, выводится с желчью и подвергается энтерогепатической циркуляции.
При значительном сходстве в свойствах и механизмах действия между препаратами активных метаболитов витамина D существуют и заметные различия. Особенностью альфакальцидола как пролекарства является то, что он превращается в активную форму, метаболизируясь в печени до 1α25(ОН)2D3, и, в отличие от препаратов нативного витамина D, не нуждается в почечном гидроксилировании, что позволяет использовать его у пациентов с заболеваниями почек, а также у лиц пожилого возраста со сниженной почечной функцией и существенно сниженной активностью фермента 1α–гидроксилазы. Вместе с тем установлено, что действие кальцитриола развивается быстрее и сопровождается более выраженным гиперкальциемическим эффектом, чем альфакальцидола.
Многочисленные исследования, проведенные как в России (наиболее широко применяемым препаратом альфакальцидола является Альфа Д3–Тева), так и за рубежом, доказывают, что последний оказывает лучший эффект на костную ткань. Особенности фармакокинетики и фармакодинамики этих препаратов определяют режим их дозирования и кратность назначения. Так, поскольку период полувыведения кальцитриола относительно короткий, для поддержания стабильной терапевтической концентрации его следует назначать не менее 2–3 раз/сут. Действие альфакальцидола развивается более медленно, однако после однократного введения оно пролонгируется, что определяет назначение дозы 0,25–1 мкг с кратностью приема 1–2 раза/сут.
Кальцитриол и альфакальцидол относятся к числу наиболее хорошо переносимых и безопасных лекарственных средств, применяемых для профилактики и лечения ОП. Данное положение имеет большое практическое значение в связи с тем, что их применение обычно достаточно продолжительно (может длиться несколько лет). Клинические наблюдения свидетельствуют о том, что при индивидуальном подборе доз препаратов витамина D на основе оценки уровня кальция в плазме крови риск развития побочных эффектов минимален. Связано это с присущей этим препаратам большой широтой терапевтического действия.
Однако при применении активных метаболитов витамина D примерно у 1–4% пациентов возможно развитие ряда побочных эффектов, наиболее частыми из которых являются гиперкальциемия и гиперфосфатемия, что связано с одним из основных механизмов их действия – усилением кишечной абсорбции кальция и фосфора. Оба эти эффекта могут проявляться следующими жалобами:
• недомоганием,
• слабостью,
• сонливостью,
• головными болями,
• тошнотой,
• сухостью во рту,
• запором или поносом,
• абдоминалгиями или дискомфортом в эпигастральной области,
• болями в мышцах и суставах,
• кожным зудом,
• сердцебиением и т.д.
Однако при индивидуально подобранной дозе указанные побочные эффекты наблюдаются достаточно редко.
Для оценки эффективности и безопасности комбинации алендроната в дозе 70 мг и альфакальцидола 1 мкг было проведено несколько клинических испытаний. В таблице 8 систематизированы данные о дизайне одного из исследований [19].
Согласно полученным результатам [19] выявлено, что комбинированное лечение сопровождается достоверным повышением МПКТ в поясничных позвонках (на 6,65%) по сравнению с группой 2 (4,17%). Также отмечено повышение плотности как трабекулярных, так и кортикальных отделов костей (кости предплечья), доказано положительное влияние на показатели прочности скелета в целом.
В другом исследовании [20], проведенном Ringe J.D., Farahmand P., Schacht E. и др. (результаты опубликованы в 2007 г.), наглядно продемонстрировано (табл. 9), что комбинация алендроната и альфакальцидола по влиянию на МПКТ в области поясничных позвонков и шейки бедренной кости, а также по снижению числа вертебральных и вневертебральных переломов достоверно превосходит как комбинацию алендроната и природного витамина D, так и сочетание алендроната и кальция в дозе 1000 мг. Также отмечены снижение частоты падений и уменьшение частоты и выраженности болевого синдрома, связанного с переломами позвонков.
К началу 90-х годов прошлого столетия остеопороз оставался в основном рентгенологическим понятием, на которое врачи разных специальностей обращали внимание, не осознавая в полной мере тяжесть исходов и социальную значимость заболевания. В 1994 г.
К началу 90-х годов прошлого столетия остеопороз оставался в основном рентгенологическим понятием, на которое врачи разных специальностей обращали внимание, не осознавая в полной мере тяжесть исходов и социальную значимость заболевания. В 1994 г. ВОЗ официально признал и определил остеопороз как заболевание, для которого характерно снижение прочности кости и повышение риска переломов. Дальнейшие исследования показали, что прочность кости отражает интеграцию двух главных характеристик: минеральную плотность кости (МПК), измеренную денситометрически, и качество кости (многокомпонентное понятие, включающее архитектонику строения, уровень костного обмена, накопление повреждений, минерализацию и др.). Остеопороз был отнесен ВОЗ к пяти важнейшим заболеваниям человека, таким как инфаркт, инсульт, рак, внезапная смерть.
Остеопоротические переломы являются одной из главных причин заболеваемости, инвалидности и смертности.
В связи с необходимостью и возможностью профилактики остеопоротических переломов Российская ассоциация по остеопорозу приступила к разработке национальных клинических рекомендаций.
Целью данных клинических рекомендаций являлось усовершенствование диагностики остеопороза, увеличение числа больных, получающих адекватное лечение, а также пациентов, у которых при визите к врачу оцениваются факторы риска остеопороза и с которыми обсуждаются вопросы профилактики заболевания.
Первый раздел рекомендаций посвящен диагностике остеопороза и содержит информацию о факторах риска, клинике заболевания, измерении МПК, рентгенологической и лабораторной диагностике, примеры формулировки клинического диагноза. Второй раздел рекомендаций освещает вопросы профилактики и лечения остеопороза с помощью фармакологических и нефармакологических методов терапии. В двух других разделах разбираются вопросы реабилитации пациентов с остеопоротическими переломами, а также профилактики и лечения глюкокортикоидного остеопороза.
Приведем характеристики уровней доказательности, принятые при разработке рекомендаций.
Уровень А — высококачественный метаанализ, систематический обзор рандомизированных контролируемых исследований или данные крупного рандомизированного контролируемого исследования с очень низкой вероятностью системной ошибки, результаты которого могут быть распространены на российскую популяцию.
Уровень D — описание случаев, или неконтролируемое исследование, или мнение экспертов.
При остеопорозе нет характерной клиники, кроме уже развившихся переломов. Вместе с тем проведение остеоденситометрии широкому кругу населения невозможно из-за ограниченности доступа и экономической нецелесообразности. В силу этих причин знание и учет факторов риска при диагностике и профилактике остеопороза приобретают особое значение. Все факторы риска при этом заболевании можно разделить на немодифицируемые и модифицируемые (потенциально изменяемые). Установлены следующие немодифицируемые факторы риска остеопороза: низкая МПК, женский пол, возраст старше 65 лет, гипогонадизм у мужчин и женщин, системный прием глюкокортикоидов более 3 мес (уровень А), белая (европеоидная) раса, отягощенный семейный анамнез по остеопорозу и/или переломам при минимальной травме у родственников в возрасте 50 лет и старше, предшествующие переломы (уровень В), а также иммобилизация (уровень D). Также выделены основные модифицируемые факторы риска остеопороза: склонность к падениям, недостаточное потребление кальция и дефицит витамина D (уровень А), индекс массы тела 2 и/или масса тела
Л. И. Беневоленская, доктор медицинских наук, профессор
Н. В. Торопцова, кандидат медицинских наук
О. А. Никитинская, кандидат медицинских наук
Институт ревматологии РАМН, Москва
Поскольку ОП – заболевание, связанное с повышенным риском переломов, следовательно, для его лечения необходимо выявить лиц, имеющих такую проблему, с тем чтобы предпринять действия, направленные на ее либо устранение, либо хотя бы снижение [4]. Известно, что повышению риска переломов способствуют факторы, влияющие как на прочность кости, так и на риск падений. Существует несколько способов оценки риска переломов.
Другой важной составляющей группы пациентов высокого риска является костная масса, измеряемая путем исследования МПК. Согласно критериям ВОЗ ведущим диагностическим критерием ОП является низкая МПК, что определяется методом двухфотонной рентгеновской абсорбциометрии (ДРА). ДРА принято считать золотым стандартом диагностики ОП и прогнозирования риска переломов костей. Каждому установленному при проведении ДРА снижению МПК в области шейки бедренной кости на 1 стандартное отклонение (SD) соответствует повышение риска переломов проксимального отдела бедренной кости в 2,6 раза и любого другого отдела в 1,6 раза [23]. Рабочее определение ОП базируется на Т-критерии МПК, определенной в шейке бедренной кости. Т-критерий интерпретируется как величина МПК -2,5 SD или ниже среднего значения у взрослых молодых женщин (Т-критерий ≤-2,5 SD). Однако следует понимать, что в целом нет такого порога МПК и значения Т-критерия, ниже которого риск перелома становится абсолютным и выше которого риск перелома полностью исчезает.
Описано уже большое количество клинических факторов риска (КФР) развития переломов. Эти факторы были проанализированы и представлены в новом способе оценки риска переломов, опубликованном в 2008 году и получившем название FRAX [19]. Для алгоритма FRAX были отобраны те КФР, которые продемонстрировали ассоциацию с повышением риска перелома независимо от МПК в шейке бедра. Алгоритм FRAX дает обобщенную оценку риска переломов на основе имеющихся у пациента КФР в сочетании (или без) с данными денситометрии [5].
КФР, используемые при прогнозировании 10-летней вероятности перелома (FRAX) в дополнение или вместо измерения МПК:
- возраст;
- пол;
- индекс массы тела;
- семейный анамнез перелома проксимального отдела бедра;
- отношение к курению;
- прием глюкокортикоидов (ГК);
- ревматоидный артрит (РА);
- другие причины вторичного ОП;
- злоупотребление алкоголем.
Отличительной особенностью модели FRAX является учет региональных особенностей и региональных различий в эпидемиологической ситуации по переломам и продолжительности жизни, что делает оценку прогноза более достоверной. В 2016 г. была разработана и предложена для клинического использования украинская модель FRAX для прогнозирования основных остеопоротических переломов [6]. В настоящее время она доступна на официальном интернет-ресурсе FRAX (https://www.sheffield.ac.uk/FRAX/?lang=uk).
Алгоритм FRAX дает возможность выделить пациентов высокого риска. К таковым относятся пациенты с риском развития основных остеопоротических переломов >20% в течение последующих 10 лет.
Одновременно модель FRAX имеет ограничения, которые необходимо учитывать при ее использовании. А именно, модель FRAX:
- можно использовать только у нелеченных больных;
- не должна применяться для мониторирования эффективности лечения пациентов;
- не может применяться у детей и подростков;
- не может применяться у женщин в пременопаузе;
- не учитывает детали некоторых факторов риска (например, длительность и интенсивность курения; доза и длительность применения ГК, а также способ их введения; длительность и активность течения РА и т. д.);
- не учитывает другие важные факторы риска (падения, маркеры костного ремоделирования, дефицит витамина D, данные ультразвукового исследования костной ткани, др.).
Кроме модели FRAX существуют и другие способы определения порога вмешательства и выделения пациентов высокого риска перелома. Они представлены в таблице. Необходимо отметить, что все предлагаемые критерии охватывают и дублируют основные критерии пациентов высокого риска: предшествующий перелом, низкая МПК, прием ГК, наличие вторичного ОП, на которых, в принципе, базируется модель FRAX. Таким образом, предложенный ВОЗ калькулятор (алгоритм) FRAX подсчитывает индивидуальную 10-летнюю вероятность возникновения остеопоротического перелома на основании комбинации КФР и МПК; он позволяет аккуратно идентифицировать пациентов высокого риска, являющихся наилучшими кандидатами на вмешательства [1, 4, 20].

Таким образом, в последнее время изменился подход к оценке риска переломов при ОП, а также способы установления диагноза ОП, которые основаны прежде всего на определении высокого риска переломов и стратификации пациентов по этому принципу. Так, диагноз ОП базируется на выявлении у пациента следующих критериев:
- на основании перенесенного низкоэнергетического перелома типичной остеопоротической локализации;
- при определении 10-летней вероятности перелома по региональной модели FRAX, превышающей порог вмешательства;
- при определении МПК с помощью ДРА с Т-критерием ниже -2,5 SD.
На рисунке 1 схематически представлен современный алгоритм установления диагноза ОП, базирующийся на определении пациентов высокого риска. Так, рекомендуется устанавливать клинический диагноз ОП на основании высокого риска перелома, выявляемого при денситометрии (методом ДРА), а также у пациентов, перенесших типичный остеопоротический перелом – проксимального отдела бедренной кости (в этом случае даже при отсутствии результатов денситометрии), перелом позвонков, проксимального отдела плечевой кости, таза, ребер, в некоторых случаях – дистального отдела лучевой кости (при наличии остеопении при ДРА) и наконец при выявлении высокого риска переломов при использовании алгоритма FRAX [15, 31]. Исследовательская группа, возглавляемая профессором J. Kanis и соавт. (2015) [20], напротив, считает, что нет необходимости в диагностических критериях ОП, нужно использовать оценку риска переломов по FRAX и инициировать лечение у пациентов с риском, превышающим порог вмешательств.
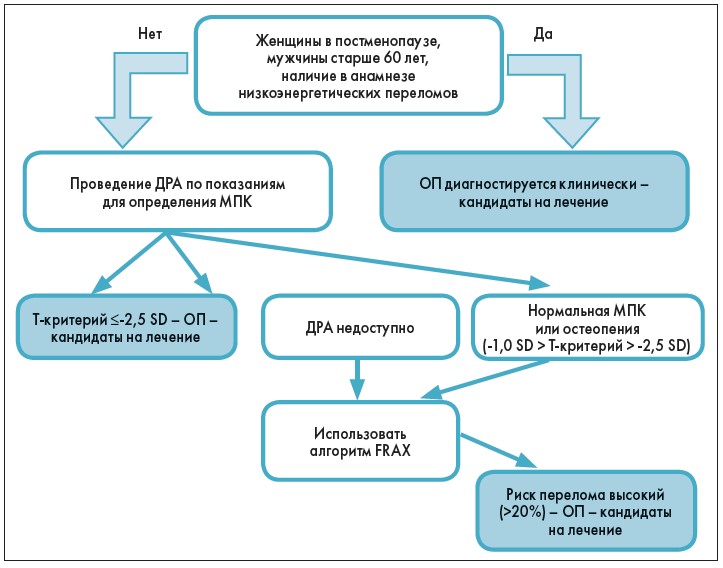
Рис. 1. Современный алгоритм постановки диагноза ОП
При определении тех, кому необходимо фармакологическое вмешательство, выделяют три группы пациентов высокого риска переломов (рис. 2):
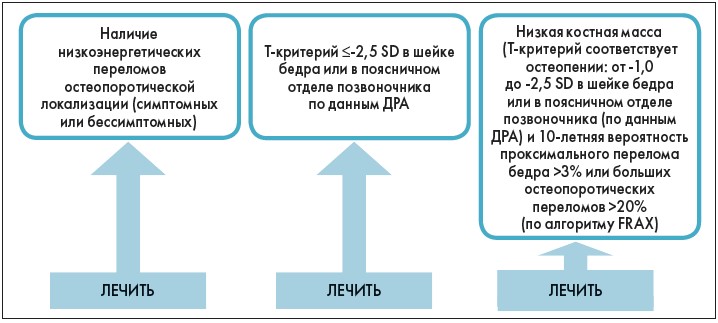
Рис. 2. Рекомендации по фармакологическому лечению пациентов. Выделение групп пациентов, которым показано фармакологическое лечение (адаптировано нами по F. Cosman и соавт. (2014) [15]
- пациенты с низкоэнергетическими переломами в анамнезе;
- пациенты с низкой костной массой (Т-критерий -2,5 SD по данным ДРА);
- пациенты с остеопеническим синдромом и высоким риском остеопоротических переломов (по данным FRAX).
Сегодня в клинической практике применяются лекарственные средства, доказавшие свою эффективность в отношении снижения риска переломов различной локализации (вертебральных и невертебральных) в длительных многоцентровых плацебо-контролируемых клинических исследованиях. Выбор терапии зависит от конкретной клинической ситуации, а при назначении отдельных препаратов – также и от предпочтительного пути введения (перорально или парентерально) [2, 3]. Основной целью фармакологической терапии ОП является уменьшение риска переломов за счет увеличения прочности кости. Нет теста, который мог бы непосредственно измерять прочность костей у живых людей, и пока не существует лекарственного средства, способного полностью предотвратить все переломы. В клинической практике мы полагаемся на косвенные маркеры для оценки снижения риска переломов и мониторирования эффективности терапии, коррелирующие с костной прочностью и риском переломов: МПК и маркеры костного ремоделирования [4].
На протяжении последних двух десятилетий для лечения ОП препаратами первого выбора остаются бисфосфонаты (БФ), которые ингибируют опосредованный остеокластами процесс костной резорбции, в результате чего увеличивается костная масса и улучшается прочность кости, снижается риск переломов различной локализации [12]. Сорокалетний опыт использования БФ для лечения постменопаузального ОП подтвердил благоприятное соотношение пользы и риска.
Поскольку ОП является хроническим заболеванием, то противопереломная (антиостеопоротическая) терапия гипотетически может быть пожизненной. К сожалению, на сегодняшний день доступно мало данных и соответствующих рекомендаций по длительному использованию БФ; также опубликовано мало данных, подтверждающих, что продолжение лечения до 10 лет у пациентов с высоким риском переломов лучше, чем остановка терапии через 3-5 лет. Использование БФ приводит к быстрому и существенному снижению интенсивности костного оборота с максимальным эффектом в течение 3-6 мес. Этот эффект нового равновесного состояния удерживается по крайней мере в течение 10 последующих лет при продолжающемся лечении [9, 11]. При этом каждый из четырех аминобисфосфонатов (алендронат, ризедронат, ибандронат и золедроновая кислота) имеет свой уникальный профиль сродства и связывания с костной тканью, что обусловливает клинически значимые различия в степени воздействия на костный метаболизм и накопления в костной ткани.
При остановке приема БФ обозначено несколько потенциальных параметров, требующих мониторинга для определения продолжающейся потери костной массы. Предполагается, что на потерю антирезорбтивного эффекта может указывать явное снижение МПК и/или повышение уровня маркеров костного ремоделирования.
Наиболее развернутые рекомендации по длительному применению БФ и мониторингу терапии ОП были разработаны британской группой экспертов – National Osteoporosis Guideline Group (NOGG) [26]. Учеными был предложен алгоритм лечения пациентов, в котором рекомендован регулярный пересмотр терапии после 5-летнего применения пероральных БФ и 3-летнего применения парентеральной формы золедроновой кислоты (рис. 3). В настоящее время этот алгоритм продублирован в английских клинических рекомендациях (2017) по профилактике и лечению ОП [14]. При хорошей переносимости и эффективности лечения терапию пероральными БФ после 5 лет можно продолжить у пациентов с высоким риском. К таковым относятся пациенты:
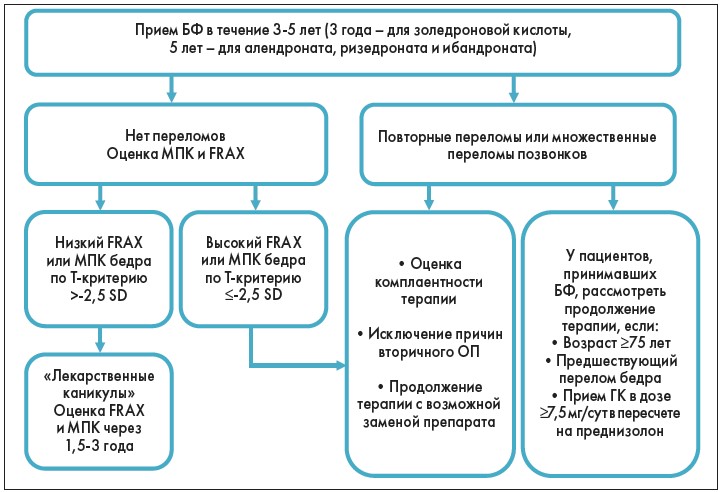
Рис. 3. Алгоритм мониторинга длительной терапии БФ, предложенный британской группой экспертов (2014) [26]
- в возрасте >75 лет;
- имеющие в анамнезе предшествующие переломы бедра или позвонков;
- продолжающие прием ГК в дозе >7,5 мг/сут (в пересчете на преднизолон).
Если на фоне терапии пероральными БФ у пациента произошел ≥1 низкоэнергетический перелом, после оценки того, насколько правильно и регулярно больной принимал лечение, и исключения причин вторичного ОП лечение может быть продлено на срок >5 лет [14, 26]. Терапия должна быть пересмотрена в случае, если у пациента после 5-летнего применения пероральных БФ показатели МПК (Т-критерий) в шейке бедренной кости или поясничном отделе позвоночника остаются на уровне ≤-2,5 SD.
Американским обществом по изучению костей и минералов (American Society for Bone and Mineral Research, ASBMR) в 2016 году также был предложен алгоритм по менеджменту постменопаузальных женщин и длительной терапии БФ [7], который по ключевым моментам созвучен алгоритму NOGG (рис. 4).
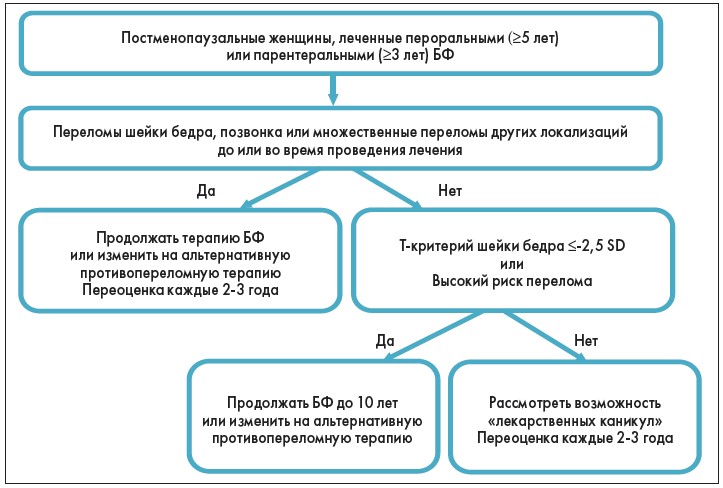
Рис. 4. Алгоритм мониторинга длительной терапии БФ у постменопаузальных женщин, предложенный Американским обществом по изучению костей и минералов (2016) [7]
У постменопаузальных женщин, леченных пероральными БФ в течение 5 лет и парентеральными БФ в течение 3 лет, в случае сочетания неблагоприятных факторов (прежде всего наличие переломов во время лечения) терапия БФ может быть пролонгирована до 10 лет. Эти рекомендации базируются на результатах исследований FLEX и Horizon (расширенная фаза исследований алендроната и золедроновой кислоты), где лечение было продолжено до 10 лет пероральными БФ и до 6 лет при их внутривенном применении. В этих исследованиях было продемонстрировано сокращение количества переломов при увеличении длительности терапии БФ [10]. Одновременно указывается, что преимущества перехода на альтернативную противопереломную терапию после длительного применения БФ недостаточно изучены. Авторы этого алгоритма акцентируют внимание на том, что для оценки высокого риска переломов можно использовать не только модель FRAX, но и другие модели; основными сильными факторами риска перелома являются возраст >75 лет, предшествующий перелом бедра и прием ГК в дозе >7,5 мг/сут. Мониторинг и переоценка лечения включают в себя клиническую оценку, оценку риска перелома и изменения плотности костной ткани с помощью ДРА. Повторная оценка может потребоваться менее чем через 2 года у пациентов с новым переломом или с учетом ожидаемой ускоренной потери костной массы (например, при терапии ГК) [7].
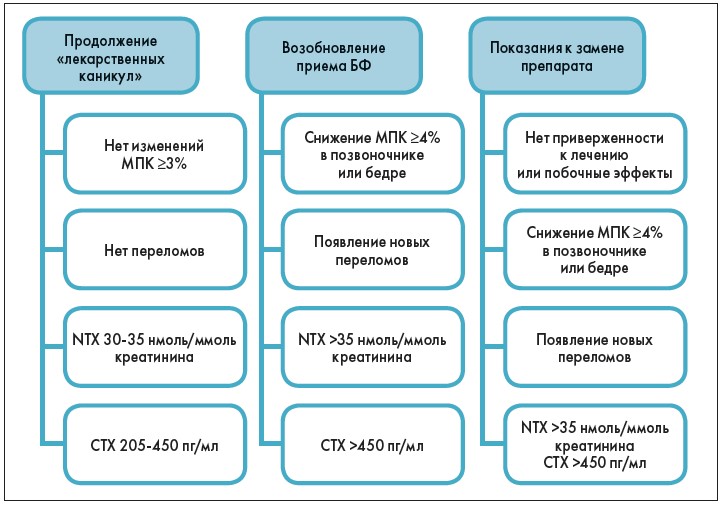
Рис. 5. Подходы к длительному лечению ОП
Примечания. NTX – N-telopeptide cross-links, аминотерминальный перекрестно-связанный пептидный фрагмент коллагена I типа; СТХ – carboxyterminal collagen cross-link, карбокситерминальный перекрестно-связанный телопептид коллагена I типа.
- значимое увеличение уровня маркеров костной резорбции или достижение показателей костного обмена, которые были у пациента до начала лечения БФ;
- снижение МПК до уровня ОП, особенно в проксимальном отделе бедренной кости;
- показатель риска перелома по FRAX, рассчитанный с учетом данных МПК шейки бедра, выше порога терапевтического вмешательства.
В заключение, коротко отвечая на вопросы, заявленные в названии, необходимо отметить следующее.
Кому показано лечение: пациентам высокого риска возникновения остеопоротических переломов.
Когда начинать лечение: сразу же при установлении диагноза ОП (рис. 1, 2), при наличии остеопоротического перелома в анамнезе, Т-критерии ниже -2,5 SD по ДРА и высокой вероятности возникновения переломов по алгоритму FRAX.
СТАТТІ ЗА ТЕМОЮ Кардіологія
У низці рандомізованих клінічних випробувань та їхніх відкритих продовжень голімумаб продемонстрував ефективність при ревматоїдному артриті (РА), псоріатичному артриті (ПсА) й анкілозуючому спондиліті (АС) у пацієнтів, які раніше не отримували біологічної терапії. Водночас клінічні дані щодо використання цього препарату у хворих, які вже отримували біологічне лікування, обмежені. Метою цієї роботи було оцінити ефективність голімумабу як біологічного препарату 1-ї, 2-ї чи 3-ї лінії в пацієнтів із РА, ПсА й АС в умовах реальної клінічної практики. .
Остеоартрит (ОА) – це дегенеративна хвороба суглобів, яка розвивається внаслідок руйнування суглобового хряща й ушкодження інших тканин суглоба. Якщо безпосередня причина ОА невідома, його називають первинним, або ідіопатичним. Первинний ОА є найпоширенішою формою артриту, що вражає 60% чоловіків і 70% жінок віком понад 65 років. Головні фактори ризику ОА – вік, патологічне навантаження на суглоби, надмірна маса тіла й ожиріння, діабет та інші метаболічні порушення, травми й інфекції суглоба тощо. Фізичні вправи, зокрема біг за відсутності травм, не підвищують ризик розвитку ОА, хрустіння пальцями теж не збільшує ймовірність виникнення цього захворювання. Цікаво, що ОА й остеопороз є практично взаємовиключними патологічними станами: в пацієнтів з ОА майже ніколи не розвивається остеопороз, і навпаки.
Рекомендации EACVI о мерах предосторожности, показаниях, приоритетности исследований, защите пациентов и медицинского персонала.
Комбінації ІАПФ із БКК увійшли в медичну практику близько 20 років тому, проте вже знайшли чимало прихильників і мають доказову базу. Поєднання ІАПФ із БКК не лише ефективно знижує АТ, але й проявляє плейотропність: антиішемічний і антиатерогенний впливи, рено- та вазопротекцію. .
Читайте также:


