Генетический анализ на ревматоидный артрит
Ревматоидный артрит носит инфекционный воспалительный характер. Это системное заболевание соединительных тканей организма. Протекает заболевание , п оражая мелкие периферические суставы. Для выявления заболевания проводится диагностика ревматоидного артрита . П ри этом необходима сдача всех соответствующих анализов. На основе результатов доктор назначает лечение.
Причины и симптомы ревматоидного артрита
Изменения в суставах при ревматоидном артрите происходят симметрично. Вначале они наблюдаются в стоп ах , пятнисто-фаланговых и межфаланговых сустав ах . Если вовремя не была проведена диагностика ревматоидного артрита и его лечение, то со временем поражаются все остальные суставы. Зачастую возникновению заболевания способствует генетическая предрасположенность или инфекционные заболевания. Другими причинами ревматоидного артрита могут быть:
- гормональные нарушения;
- переохлаждение суставов;
- инфекционные процессы;
- перенесенные т равмы ;
- стрессовые ситуации (частая причина заболевания у женщин).
Ревматоидный артрит (код по МКБ 10) разделяют на виды: серонегативный М06.0; серопозитивный М05.8 и юношеский М08. При данном заболевании пациенты чаще всего жалуются на боли в пораженных суставах, они носят волнообразный, ноющий характер. Острое воспаление может стать причиной болей в мышцах. Наличие лихорадки подтверждает факт присутствия воспалительного проц есса в организме.
Сразу после пробуждения больные часто чувствуют скованность в суставах, она проходит через полчаса после каких-либо движений. Осматривая пораженные участки, доктор обнаруживает заметные покраснения. В запущенных случаях происходит нарушение функций сустава. Параллельно диагностируется отек или атрофия мышц. Ревматоидный артрит имеет яркую симптоматику, поэтому заметить проявления недуга пациент может сразу самостоятельно. При обнаружении первых признаков необходимо срочно обращаться за помощью к медикам. Правильно проведенная диагностика позволит выставить диагноз и начать своевременное лечение.
Диагностика артрита ревматоидного

При ревматоидном артрите особое внимание уделяется лабораторным исследованиям. Нет такого теста, который одиночно мог бы подтвердить наличие заболевания. Для постановки диагноза " ревматоидный артрит", анализы для диагностики должны проводиться комплексно. При подозрении на данный недуг н еобходимо наличие следующих данных:
- общего анализа крови (обязательно СОЭ);
- о бщего анализа мочи;
- биохимии крови (АЛТ, АСТ, С-реактивный белок, креатинин);
- и сследование на антицитруллиновые антитела и ревматоидный фактор;
- маркеры гепатитов;
- анализа на антинуклеарные антитела.
То лько в сумме перечисленные показатели позволяют определиться точно с диагнозом. Окончательно оценку состояния дает доктор, опираясь помимо этого на результаты инструментального исследования.
Подготовка к анализам крови
Д иагностика артрита ревматоидного о бязательно включает в себя лабораторные исследования. Чтобы результаты были более достоверными, к сдаче анализов необходимо подготовиться заранее:
- За сутки запрещается употреблять алкогольные напитки.
- Т акже ограничить физические нагрузки за сутки до сдачи анализов.
- Исключить лекарственные препараты за две недели, если сделать это невозможно, предупредить медицинского работника, который будет расшифровывать показания.
- За час запрещено курить.
- Необходимо успокоиться, не нервничать, полчаса до процедуры посидеть в тихой обстановке.
- Н е употреблять крепкий чай и кофе.
- Если в один день назначены рентгенография , другие инструментальные исследования, физиотерапия, придется отказаться от сдачи крови.
- Анализ крови нужно сдавать натощак.
Из результатов будет видно, какое количество клеток содержится в единице объема, будут доступны сведения и о скорости оседания эритроцитов (СОЭ). Этот показатель в диагностике наиболее важен.
Правильная подготовка к процедуре и обеспечение стерильности при заборе крови позволят получить достоверную информацию.
Общие анализы
Из общего анализа мочи можно узнать о наличии бактериальных клеток, биохимических субстратах, об общих физико-химических свойствах. При установлении ревматоидного артрита доктора больше всего интересуют следующие показания:
- Н аличие в крови воспалительных бактериальных п ризнак ов - повышенные лейкоциты, изменения в лейкоцитарной формуле. Данные показатели повышаются при инфекциях, при аутоиммунных патологиях меняются редко.
- Присутствие вирусного воспаления - снижение лейкоцитов и повышение лимфоцитов. Такая картина наблюдается при реактивном воспалении суставов, вызывается которое вирусами гепатита.
- Повышенный белок в моче и присутствие лейкоцитов указывают на наличие воспалительного процесса . При ревматоидном артрите такая картина харак терна .
В целом, исследования только мочи и крови крайне неинформативны. Для правильной диагностики, особенно в случаях, когда устанавливается инвалидность при ревматоидном артрите , просто необходимо проходить комплексное обследование.
Общие анализы крови и мочи дают возможность исключить другие заболевания.
СОЭ (скорость оседания эритроцитов)
О собое внимание уделяется при анализе крови скорости оседания эритроцитов (СОЭ). Принцип этого исследования описан ниже.
Кровь довольно сложная по своему составу среда. Кроме воды и клеточных элементов она содержит различные биохимические субстраты, в том числе белок.
Если пробирку с кровью оставить недвижимой, в покое, то эритроциты начинают оседать из-за силы тяжести.
Скорость такого оседания во многом зависит от того, как отдельные эритроциты объединяются в агрегаты.
Последнее может происходить из-за высокого белка, который и вызывает воспалительные реакции.
Если СОЭ повышена, то можно утверждать, что присутствуют воспалительные процессы, которые происходят при ревматоидном артрите. Руки , ноги у пациентов начинают в таких случаях ныть, реагировать на погоду, появляются боли.
СОЭ дает возможность определить активность заболевания, показатели указывают на аутоиммунные активные процессы. При лечении задача доктора - снизить показатели СОЭ до нормального уровня, этот факт будет подтверждать правильность выбранной терапии.
Биохимический анализ крови при ревматоидном артрите
Для биохимического исследования крови забор производится из вены и отправляется в лабораторию для определения наличия тех или иных субстратов. Это могут быть ферменты, белки, кислоты. При ревматоидном артрите внимание уделяется:
- У ровню печеночных ферментов АСТ, АЛТ. Они не могут свидете льствовать о наличии воспаления, но перед тем как лечить ревматоидный артрит рук , ног , д октор должен оценить со стояние печени и подобрать оптимальную терапию.
- Креатинину. Выводится почками как конечный продукт метаболизма белков. При повышенных показателях можно судить о плохой работе почек. Токсичные лекар ст ва в таком случае будут недопустимы к применению.
- Фракции белка. Этот неспецифический показатель подтверждает наличие воспалительного процесса в организме.
Из перечисленного выше следует, ч то ставить диагноз только на основании анализов крови невозможно. Они дают возможность назначать правильное лечение. Отдельно стоит отметить такой биохимический по казатель к ак С-реактивный белок.
C-реактивный белок (СРБ)
Для определения в анализе СРБ доктор должен сделать на направлении особую отметку. Для чего определяют показатель ? При острой фазе воспаления С-реактивный белок является наиболее важным. Без данн ого метаболита наша иммунная система не могла бы отвечать на повреждающие факторы воспалительными процессами. Если показатель превышает норму, это свидетельствует о воспалительном процессе в организме, который носит неизвестную локализацию, характе р может быть вирусным, бактериальным, аутоиммунным. Повышенный СРБ указывает на системную патологию в организме.
Ревматоидный фактор
Ревматоидный фактор определяется при наличии аутоиммунных заболеваний . Что собой он представляет? Это совокупность веществ - выработанные на клетки антитела иммунной системы. Клетки эти входят в оболочку сочленения, т ам-то и образуется ревматоидный фактор. В кровь он поступает из суставной полости и определяется при помощи анализов. Данный показатель повышается при:
- серозном ревматоидном артрите (код по МКБ 10 - М 05.8 );
- СКВ;
- с клеродермии;
- д ерматомиозите;
- наличии о пухоли;
- п аразитарных и инфекционных заболеваниях;
- в аскулите.
Антицитруллиновые антитела
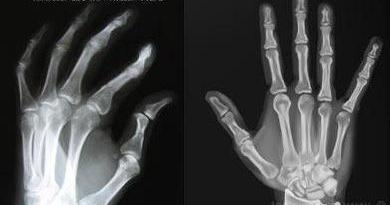
Диагностика ревматоидного артрита лабораторная дает возможность обнаружить в крови антицитруллиновые антитела (АЦЦП). Цитруллин - аминокислота, которая является частью белка. Последний входит в состав соединительной и эпителиальной ткани. Если происходит выработка антител к этой аминокислоте, можно судить о поражениях соединительных капсул в сочленениях. При повышении уровня АЦЦП более 95% можно с уверенностью утверждать о наличии ревматоидного артрита. Уже на ранних стадиях этот маркер присутствует в крови.
Но доверять только этому показателю не стоит, так как есть случаи повышения АЦЦП и при иных системных болезнях.
Антинуклеарные антитела
Если в организме происходят какие-то аутоиммунные процессы, начинается выработка определенного количества антител против белка в собственном организме. Называют эти антитела антинуклеарными. Рекомендуется определять этот показатель, если при анализе обнаружились воспаления неясной природы. К примеру, при повышенной СОЭ.
Однако антинуклеарные антитела не являются высокоспецифическим маркером при диагностике ревматоидного артрита. Показатель этот может также обнаружиться при:
- системных заболеваниях соединительных тканей;
- склеродермии;
- гепатите;
- реактивном артрите.
"Метотрексат"- отзывы при ревматоидном артрите
В базисной терапии при лечении ревматоидного артрита применяется "Метотрексат". Медикамент дает возможность подавлять выраженные симптомы , а также способен предупреждать разрушения костных тканей, обеспечивает стойкое противостояние деформации суставов. Лекарственное в ещество воздействует на клетки, способные к быстрому делению. Препарат оказывает противовоспалительный и противоопухолевый эффект благодаря тому, что происходит нарушение цикла метаболизма фолиевой кислоты.
Принимая "Метотрексат" при ревматоидном артрите, отзывы пациенты в большей степени оставляют положительные. Симптомы поражения суставов (скованность, отечность, боли ) становятся заметно менее выраженными. Прежде чем использовать препарат, необходимо ознакомится с противопоказаниями. Отрицательные отзывы обычно оставляют те, к то бездумно, без назначения доктора применяет лекарство.
"Метипред" при ревматоидном артрите также оказывает благотворное воздействие. Относится препарат к группе глюкокортикостероидов . Н а организм оказывает противовоспалительное, противоаллергическое и иммунодепрессивное действие. Активным веществом здесь является метилпреднизолон .

Инструментальные методы диагностики
Кроме лабораторных исследований при диагностике ревматоидного артрита необходимо использовать инструментальные методы , которые пом огут выявить заболевание и установить правильный диагноз.
Артроскопия. Малоинвазивный хирургический метод. Делается два небольших прокола в колене, вводится камера, благодаря которой предоставляется возможность диагностировать все внутренние изменения. Полученные сведения дают возможность спланировать правильное лечение.
Биопсия. Выполняется процедура под анестезией с помощью артроскопического доступа. Для исследования делается забор синовиальной ткани. Характер повреждений исследуют микроскопическим и гистологическим методом.
Сцинтиграфия сустава. Самый информативный метод. Используется лучевая диагностика. Уже на ранних стадиях выявляются проблемы. Исследование проводят на гамма-томографе.
МРТ. Метод очень чувствителен, дает возможность выявить отеки, эрозии костных тканей, синовит . Но для подтверждения диагноза потребуются дополнительные исследования, так как эти признаки не всегда могут принадлежать данному недугу.
УЗИ суставов. Нетравматичный , экономичный, доступный метод. Превосходит по точности рентгенологический. Есть возможность визуализировать состояние хрящей, сухожилий, связок.
Рентгенография . Для корректировки лечения данный метод используют, чтобы наблюдать за изменениями в развитии костной эрозии. На ранней стадии ревматоидного артрита рентген помогает обнаружить проблемы только на стопах и кистях рук. Обследование не дает возможности обнаружить симметрию развивающихся процессов при ревматоидном артрите.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Ревматоидный артрит (РА) — воспалительное ревматическое заболевание неизвестной этиологии, характеризующееся симметричным хроническим эрозивным артритом (синовитом) периферических суставов и системным иммуновоспалительным поражением внутренних органов. Клиническая картина РА крайне многообразна и во многом зависит от преимущественной локализации воспалительных изменений в соединительной ткани различных органов. Согласно данным ВОЗ, частота встречаемости РА в популяции составляет от 0,6 до 1,3%, при этом у близких родственников она достигает 3–5%, что свидетельствует о генетической детерминированности патологии. Женщины болеют в 2,5–3 раза чаще мужчин, преимущественно в возрасте 35–50 лет, в более поздние возрастные периоды отмечается увеличение частоты заболевания.
РА по-прежнему относится к заболеваниям с неизвестной этиологией, в литературе широко дискутируется вопрос о его мультифакторной природе, в развитии РА активное участие принимают генетические, внешнесредовые, иммунологические, гормональные, инфекционные и другие факторы. В отличие от классических генетических болезней, при которых множество различных генов и их комбинаций предрасполагают к развитию заболевания, РА представляет собой генетически гетерогенное заболевание, в первую очередь обусловленное генетическим несовершенством иммунорегуляторных процессов.
По данным многочисленных исследований, риск развития РА ассоциирован с носительством антигена главного комплекса гистосовместимости класса II HLA-DR4 и HLA-DR1, который включает более 20 аллелей. Активно обсуждаются роли и других генетических факторов, непосредственно не связанных с HLA-DR. К ним относят полиморфизм генов пептидиларгинин дезаминазы, белка тирозин фосфатазы N22 (protein tyrosine phosphatase N22 (PTPN22 C1858T), цитотоксичный Т-лимфоцитсвязанный антиген (CTLA-4 A49G), ген хемокиновых рецепторов 5 CCR5-∆32, ген NO-синтетазы ENOS 4 a/b, ген матриксных металлопротеиназ (MMР) ММР9-1562 C/T. Эти гены являются наименее изученными с точки зрения предрасположенности к РА. Рассмотрим их взаимосвязь непосредственно с РА и другими заболеваниями.
Ген PTPN22 расположен на коротком плече первой хромосомы в позиции 13.2. Он кодирует синтез тирозин фосфатазы – фермента, который регулирует порог активации Т-клеточных рецепторов, участвует в регулировании сигнальной трансдукции, т. е. ретранслирует сигналы извне в ядро клетки. Эти сигналы помогают клетке расти и делиться, выполнять специализированные функции. Белок, синтезируемый под влиянием гена PTPN22, участвует в сигнализации, которая помогает контролировать активность Т-клеток. Т-клетки идентифицируют инородные вещества и защищают организм от инфекции [15, 26, 36].
В 2012 г. учеными G. Song, S. Bae, S. Kim и Y. Li проведено исследование взаимосвязи гена PTPN22, полиморфизмов C1858T с РА в популяциях разных национальностей. Был проведен метаанализ полиморфизма C1858T гена и РА с использованием аллельного контраста и доминантной модели. Сравнивались 17 961 больных РА и 18 611 здоровых людей. Метаанализ показал связь между аллелем Т и РА. При распределении по этническому принципу анализ показал, что T-аллель был в значительной степени связан с РА у европейцев и неевропейцев. Кроме того, прямое сравнение РФ-положительных и РФ-отрицательных субъектов (РФ – ревматоидный фактор) выявило взаимосвязь аллеля Т у пациентов с РФ-положительным РА. Эти исследования подтверждают, что C1858T полиморфизм гена PTPN22 связан с восприимчивостью к РА в различных этнических группах, особенно у европейцев, и T-аллель значительно более распространен у РФ-положительных больных, чем у РФ-отрицательных [32, 41].
Также полиморфизм C1858T гена PTPN22 рассматривался как фактор риска развития РА и системной красной волчанки (СКВ) среди населения Колумбии. В исследование были включены 413 пациентов с РА, 94 пациента с СКВ и 434 здоровых. Результаты исследования доказывают ассоциацию между аллелями С1858T и РА, а также между С1858T и СКВ [31].
Выявлена связь полиморфизма гена у АЦЦП-позитивных (АЦЦП – антитела к циклическому цитруллинированному пептиду) больных РА в Турции. Обследовано 323 пациента с РА и 426 здоровых пациентов, генотипированных методом полимеразной цепной реакции (ПЦР) по полиморфизму C1858T гена. Частота гетерозиготного генотипа (СТ) составила 8,4% у пациентов с РА и 5,4% у здоровых соответственно. Гомозиготный генотип (TT) отсутствовал в обеих группах РА. Таким образом, определено, что полиморфизм C1858T гена PTPN22 является геном восприимчивости АЦЦП-положительного РА в Турции [14].
Была доказана связь полиморфизма C1858T гена PTPN22 и с другими системными заболеваниями, например, с системной склеродермией (СС). Проведенный метаанализ показывает, что полиморфизм C1858T гена PTPN22 связан с восприимчивостью к СС у европейцев, и его существование зависит от этнической принадлежности. Кроме того, у афроамериканцев оказалась намного ниже распространенность аллеля T, чем в других исследуемых группах населения, а европейцы имели самый высокий показатель распространенности [40, 42].
У венгерских больных РА и здоровых людей также был генотипирован полиморфизм С1858T гена PTPN22, результат показал увеличение распространенности аллеля Т у пациентов с РА по сравнению с контрольной группой. Ассоциация была обнаружена как у РФ-серопозитивных, так и у АЦЦП-положительных пациентов. В TT гомозиготном генотипе восприимчивость к РА более чем в 2 раза больше, чем в СТ [39].
Была доказана связь гена PTPN22 у больных с РФ-положительным РА, который был независим от HLA-DRB1 генотипа у больных кавказского происхождения, живущих в Великобритании [22].
Многочисленными исследованиями ученых показано участие полиморфизма C1858T гена PTPN22 в развитии таких заболеваний, как туберкулез [13], сахарный диабет 1-го типа [45], аутоиммунный тиреоидит (АИТ) [28, 46], витилиго [30, 44].
Наименее изученным в отношении предрасположенности к РА является A49G ген цитотоксического Т–лимфоцит-связанного иммуноглобулина 4 (CTLA4). Он расположен на длинном плече второй хромосомы в 33-й позиции. Этот ген является членом надсемейства иммуноглобулинов и кодирует белок, который передает ингибирующий сигнал Т-клеткам. Белок содержит V домен, трансмембранный домен и цитоплазматический хвост. Мутации в этом гене связаны с развитием таких заболеваний, как инсулинзависимый сахарный диабет [1, 10], болезнь Грейвса [36], тиреоидит Хашимото [8, 21, 33], рассеянный склероз [47], гепатит С [20].
Связь наличия этого гена и аутоиммунных заболеваний была выявлена среди жителей Словакии в результате проводимых исследований. Аутоиммунные заболевания щитовидной железы нередко сочетаются с РА [21]. Целью данного исследования было изучение частоты аллелей и генотипов полиморфизма А496G, в 1-м экзоне гена CTLA4 у словацких пациентов с РА, АИТ, как у больных с РА + АИT, так и у здоровых. Обследованы 57 пациентов с РА, 57 – с АИT, 34 – с обеими патологиями (РА + АИT) и 51 здоровый человек. Все были этнически однородны (словаки), проживали в одном географическом районе. А49G генотип и частота аллеля G гена CTLA4 в группе с РА не была существенно выше по сравнению с контролем. Частота GG-генотипа гена CTLA4 была незначительно выше у больных с АИT, чем в контрольной группе. Однако частота GG-генотипа и аллеля G у пациентов с РА и АИT была значительно выше, чем в контрольной группе. Частота GG-генотипа гена CTLA4 у словацких пациентов с РА была ненамного выше по сравнению с контрольной группой [21]. Полиморфизм А49G гена CTLA4 также связан с развитием сахарного диабета 1-го типа [10], АИТ Хашимото [21, 27], ювенильным идиопатическим артритом [34], рассеянным склерозом [47].
Роль гена ММР и полиморфизмов СТ в предрасположенности к РА активно обсуждается в настоящее время. Ген MMP9 расположен на длинном плече 20-й хромосомы между позициями 11,2 и 13,1. Семейство ММР представляет собой цинк- и кальций-зависимые эндопептидазы, способные специфически гидролизовать основные компоненты внеклеточного матрикса. Протеиназы присутствуют во всех без исключения клетках, внеклеточном матриксе и различных биологических жидкостях организма. Физиологически представители семейства ММР синтезируются как препробелки и секретируются как проферменты в очень незначительных количествах. В основном ММР секретируются под действием провоспалительных цитокинов, а главными источниками их продукции считаются активированные макрофаги, нейтрофилы, фибробласты [5].
При РА формируется особый тип воспаления, в т. ч. с повреждающим действием семейства ММР на соединительную ткань. Среди ферментов системы протеолиза наибольшее значение принадлежит семейству ММР, которые, имея особенности доменных структур и функций, действуют на коллаген и протеогликановый матрикс, разрушая основное внеклеточное вещество соединительной ткани. Предполагается, что семейство ММР проявляет более выраженный деструктивный эффект в присутствии оксида азота, выработку которого усиливает индуцибельная NO-синтетаза. Совместное действие медиаторов интерлейкина-1 и фактора некроза опухоли-α вносит значительный вклад в развитие периартикулярного и системного разрушения хрящевой ткани, свойственного РА. Так, при исследовании плазменной активности ММР-3 у пациентов с различными формами РА, остеоартрозом и подагрой была установлена ее значительная активность у больных РА.
Исследование активности ММР-1, -3 и тканевых ингибиторов ММР-1 в сочетании с уровнями С-реактивного белка (CРБ) и цитокинов у пациентов с эрозивными и неэрозивными ревматическими заболеваниями выявило значительное увеличение активности протеиназ в сыворотке крови больных с эрозивным артритом. При этом установлена прямая корреляция между уровнем СРБ и активностью ММР-3, которые лучше всего коррелировали с клиническими проявлениями РА. Следовательно, можно утверждать, что диагностически значимым является определение активности ММР-3 и уровня СРБ в сыворотке крови больных РА. Результаты исследования свидетельствуют о том, что активность ММР-3 в большей степени, чем цитокины, отражает степень воспаления при РА. Указанный функциональный потенциал позволяет рассматривать ММР-3 как одну из основных протеиназ, участвующих в процессах деструкции соединительной ткани при РА, что дает основание рекомендовать ее в качестве маркера указанной деструкции [9].
Согласно современным данным, можно выделить 2 протеиназы, представляющие соответственно подсемейство стромелизинов – ММР-3 (стромелизин 1) и подсемейство желатиназ – ММР-9 (желатиназа В), с максимальной активностью участвующих в нарушении структуры соединительной ткани и отвечающих на аутоиммунное воспаление и эрозирование суставов при РА.
Также наличие гена ММР связано с такими заболеваниями, как болезнь Кавасаки [27], колоректальный рак [35], эндометриоз и аденомиоз [37]. Установлена значимость полиморфных локусов генов MMP-3, MMP–9, ADAM33 и TIMP3 в качестве маркеров риска развития хронической обструктивной болезни легких [3]. Определенную роль играет наличие функционального полиморфизма промоторного региона генов ММР-2 и ММР-9 в развитии острых коронарных осложнений [2].
Ген NOS3 расположен на длинном плече 7-й хромосомы в позиции 36. Производит оксид азота, который причастен к расслаблению гладких мышц сосудов, а также является мощным посредником биологических ответов, участвующих в патогенезе аутоиммунных ревматических заболеваний, таких как СКВ и РА. Было проведено исследование с целью изучения влияния гена eNOS 4a/b на восприимчивость к СКВ и РА у пациентов, живущих на острове Крит (Греция); население генетически однородное. В исследование включены 145 здоровых лиц и 190 пациентов с СКВ. Аналогичным образом проанализирована другая группа: 235 здоровых и 202 больных РА. Результаты исследования показали, что наличие полиморфизма 4a/b гена eNOS может выступать в качестве фактора риска развития СКВ и в то же время этот ген может быть геном восприимчивости к РА [4].
Итальянскими учеными C. Salvarini, L. Boiardi и B. Casali был проведен анализ потенциальных ассоциаций полиморфизмов Glu-Asp298 в экзоне 7 и 4a/b полиморфизма в интроне 4 гена eNOS с восприимчивостью к болезни Бехчета [24], а данные турецких ученых свидетельствуют о взаимосвязи гена eNOS и развития ишемической болезни сердца у жителей Южной Турции [23]. Мутация гена eNOS приводит к заболеваниям молочных желез [29], диабетической ретинопатии [24], заболеваниям сердечно-сосудистой системы [7, 16–18].
Еще одним геном предрасположенности к РА является ген CCR5 – это ген хемокиновых рецепторов 5, кодирующий β-хемокиновые рецепторы. Ген находится на коротком плече 3-й хромосомы в позиции 21,31. Белок, кодируемый этим геном, – важный рецептор для макрофагов вирусов, включая ВИЧ. Дефектные аллели этого гена были связаны с сопротивлением ВИЧ-инфекции [4, 43]. Экспрессия гена CCR5 была также обнаружена в линии промиелобластных лейкозных клеток. Предполагается, что этот белок может играть роль в гранулоцитарной пролиферации и дифференцировке. Ученый S. Han установил, что полиморфизм гена CCR5 является генетическим фактором риска для развития радиографического поражения суставов при РА [19]. Ген CCR5 выявляется в различных иммунных клетках и влияет на патогенез РА. При его исследовании определялась связь 4-х полиморфизмов гена CCR5 – 1118 и 303A, 927-С и 4833G и их гаплотипов с восприимчивостью к РА. Были обследованы 157 пациентов с РА и 383 здоровых индивидуумов. Между здоровыми людьми и больными РА не было отмечено статистически значимых отличий в генотипах, аллелях и гаплотипах по выбранным полиморфизмам [19]. Полиморфизмы 1118 и 303A гена CCR5 показали существенную связь с тяжестью радиографических рецессивных моделей и в результате анализа многомерной логистической регрессии были признаны независимыми предикторами радиографической тяжести РА [19, 38]. Также полиморфизмы 1118 и 303A гена CCR5 показали существенную связь с сужением суставной щели пораженных суставов при РА. Эти результаты доказывают, что генетические полиморфизмы гена CCR5 являются независимым фактором риска для установления радиографической тяжести, особенно с развитием эрозий при РА [48]. Также выявлена взаимосвязь гена ССR5 с развитием ювенильного РА [12].
Таким образом, согласно данным литературы, мы проанализировали непосредственную связь этих генов с предрасположенностью к РА. Можно сделать выводы, что дальнейшее изучение наличия у пациентов с РА таких генов является очень актуальным в настоящий момент для того, чтобы оценить их влияние на возможность развития РА, варианты клинического течения, лечения и прогноз этого заболевания.
Ревматоидный артрит (РА) сокращает жизнь человека на 10-15 лет. Уже в первые 5-7 лет болезни половина пациентов утрачивает трудоспособность, а через 20 лет с момента заболевания число инвалидов увеличивается до 60-90%. Раннее выявление РА играет важную роль в оценке активности, стадии заболевания и течения патологии, а также в составлении прогноза болезни и эффективности лечения.
В статье мы рассмотрим, какие показатели крови при артрите повышены, узнаем, как снизить СОЭ при ревматоидном артрите, выясним причины повышения С-реактивного белка и укажем основные принципы лечения заболевания.
Значимость лабораторных исследований
РА —, распространенное и тяжелое аутоиммунное заболевание. Для него характерны такие признаки, как опухание и покраснение кожных покровов над пораженным суставов, тугоподвижность и утренняя скованность в суставе, болезненность, особенно после физической активности, местное повышение температуры и другие проявления в зависимости от формы болезни.
Чтобы определить ревматоидный артрит, выделяют широкий спектр биомаркеров или показателей крови.
Наиболее значимы для артрита:
- аутоантитела,
- показатели острой фазы воспалительного процесса,
- цитокины,
- показатели активации эндотелия,
- показатели активации субпопуляции лимфоцитов,
- показатели метаболизма костной и хрящевой ткани,
- генетические маркеры.
Для анализов на артрит и артроз используют кровь, синовиальную жидкость и синовиальную ткань.
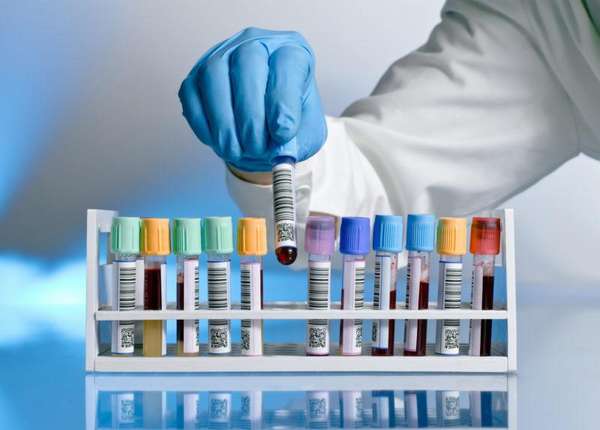
Основные анализы
Какие анализы необходимо сдавать при ревматоидном артрите и болях в суставах, решают специалисты: терапевт, ревматолог, иммунолог и другие.
В большинстве клинических случаев назначают исследования, которые мы подробно рассмотрим ниже.
Диагностика РА требует дифференциального подхода, поскольку патология имеет похожие клинические признаки с рядом других заболеваний. Первоначально врач назначает общий анализ крови и мочи.
Например, количество лейкоцитов при РА редко превышает норму и свидетельствует об аутоиммунном характере заболевания. Если патология вызвана вирусом, то содержание лейкоцитов будет пониженным, а лимфоцитов – повышенным. Такой процесс наблюдается при вирусном поражении суставов, например, при гепатите.
Показатель уровня гемоглобина при РА снижен до 110 г/л, при норме в 120-140 г/л. Это вызвано тем, что при РА жизненный период эритроцитов снижается или уменьшается их выработка в костном мозге, впоследствии это приводит к уменьшению гемоглобина в крови. По мере ухудшения состояния больного, уровень гемоглобина понижается.
Анализ мочи необходим для исключения схожих патологий. У больного РА выявляется повышенный уровень белка и наличие лейкоцитов в моче, но эти показатели —, не специфические для РА.
СОЭ определяет наличие воспалительного процесса и его интенсивность. Чем выше показатель отклонения от нормы, тем интенсивнее процесс воспаления суставов. СОЭ определяется при общем анализе крови.
Индикатор используют для диагностики острой и хронической инфекции, аутоиммунных заболеваний, инфарктов внутренних органов. Уровень СОЭ увеличивается при злокачественных опухолях, по время беременности, при приеме некоторых лекарственных препаратов (например, салицилатов).
Норма СОЭ у женщин 2-15 мм/час, у мужчин 1-10 мм/час. Повышение СОЭ до 20-30 мм/час происходит при анемиях, в период беременности или менструации. Значительное повышение более 60 мм/час говорит о наличии воспаления, аутоиммунного заболевания, злокачественной опухоли, которая сопровождается распадом тканей, или лейкозе.
Показатель СОЭ не специфичен и его можно использовать только в совокупности с другими индикаторами. Однако это самый распространенный способ определения наличия и интенсивности воспаления.
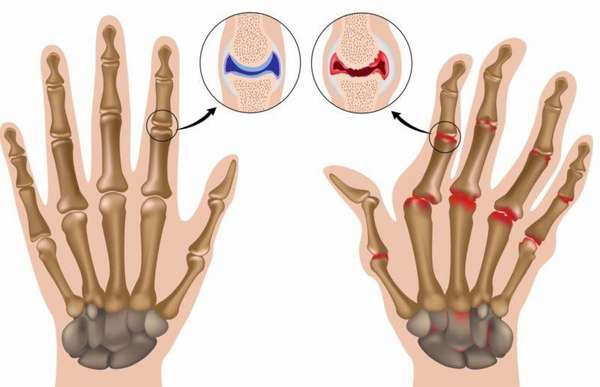
Биохимический анализ крови устанавливает наличие воспаления и его интенсивность.
- белок гаптоглобин свидетельствует о сильном воспалительном процессе при РА,
- фибриноген выше нормы 2-4 г/л говорит об интенсивном аутоиммунном процессе, его превышение указывает на опасность образования тромбов,
- сиаловые кислоты в норме составляют 2-2,33 ммоль/л, превышенные показателя свидетельствует о наличии воспаления в соединительной ткани сустава и разрушении коллагена,
- кроме того, проводят лабораторные анализы на белки сыворотки (серомукоиды), иммуноглобулины и пептиды.
В зависимости от превышения нормы по указанным маркерам определяется интенсивность воспалительного процесса.
C-реактивный белок используется наряду с показателем СОЭ для определения воспалительного процесса. Чем выше показатель С-реактивного белка, тем тяжелее и интенсивнее процесс воспаления.
В норме его значение не превышает 5 мг/л, при РА показания бывают на уровне от 400 мг/л и больше. У детей С-реактивный белок выступает маркером наличия бактерий в крови при заболеваниях костей и суставов.
Повышенный уровень С-реактивного белка отмечается при бактериальных и вирусных инфекциях в остром периоде, инфаркте миокарда, злокачественных опухолях и аутоиммунных заболеваниях.
Уровень роста С-реактивного белка прямо пропорционален СОЭ , т.е. чем выше СОЭ, тем выше С-реактивный белок.
Но есть исключения:
- показатель С-реактивного белка резко повышается даже при незначительном заражении тканей, СОЭ при этом остается в пределах нормы,
- уровень С-реактивного белка не увеличивается, а СОЭ растет при некоторых вирусных инфекциях, тяжелой интоксикации, некоторых формах хронического артрита.
Уровень С-реактивного белка изменятся в течение суток, поэтому следует измерять его в динамике.
Ревматоидный фактор (РФ) представляет собой антитела, которые синтезируются клетками синовиальной оболочки сустава. Отсюда они попадают в кровь, образуют иммунные комплексы и повреждают стенки сосудов и синовиальную оболочку.
РФ используют для диагностики ряда заболеваний (опухоли, гельминтоз, васкулит). Его присутствие в крови еще не говорит о наличии РА.
У здорового человека РФ в крови отсутствует. При РА выявление РФ 25-50 МЕ/мл считается умеренным повышением, 50-100 МЕ/мл – высоким, более 100 МЕ/мл – предельно высоким.
У детей РФ может появляться из-за частых ОРВИ, гриппе или стафилококко-стрептококковой инфекции. После лечения РФ пропадает, если этого не происходит, значит, в организме протекает аутоиммунная реакция. Также РФ может повышаться в период полового созревания, в 13-15 лет из-за скачков половых гормонов.
РА имеет две формы по ревматоидному фактору: серопозитивную и серонегативную. При серопозитивной форме анализ на РФ будет положительным. От этого зависит тактика лечения больного.
Пациенты с серопозитивной формой РА страдают от более тяжелого течения болезни: сильного воспаления, более трудного достижения ремиссии, выраженностью деструктивного процесса в суставах и внесуставных проявлений.
Что такое АЦЦП? Расшифровка АЦЦП: антитела к циклическому цитруллинированному пептиду. 
АЦЦП —, специфический маркер РА. При ревматоидном артрите в анализе крови характерно их высокое содержание (до 95%), которое показывает наличие повреждений тканей суставной капсулы.
Если ткани находятся в здоровом состоянии, норма показателя находится в пределах от нуля до трех единиц/мл. При развитии патологии норма при анализе на АЦЦП при ревматоидном артрите возрастает от 58 до 87 Ед./мл.
Высокие показатели свидетельствуют о значительных процессах разрушения хряща сустава.
АЦЦП обнаруживаются уже на начальной стадии заболевания, это особенно ценно для ранней диагностики РА (до 6 месяцев). Они вырабатываются за год до появления первых признаков патологии.
Анализ на АЦЦП при ревматоидном артрите необходим при отрицательном РФ (серонегативная форма болезни).
Его показатели не изменяются в течение болезни, поэтому анализ не информативен для отслеживания динамики развития патологии или ухудшения патологического процесса.
Антинуклеарные тела воспроизводятся иммунной системой. Они работают против ядерных белков клеток. Анализ на антинуклеарные тела делают в случае выявления воспаления, происхождение которого не ясно, и считается самым распространенным в диагностике аутоиммунных заболеваний.
Такие тела выявляются более чем у 90% пациентов с заболеваниями соединительной ткани суставов. Кроме этого, анализ используют для диагностики множества инфекционных, воспалительных и онкологических патологий.
Для ревматоидного артрита они не специфические, но присутствуют в организме при таких патологиях, как системная красная волчанка, коллагенозы, гепатит, склеродермия и другие.
Анализы на маркеры гепатита В и С обусловлены тем, что болезнь может проявлять себя как аутоиммунное заболевание. В таком случае воспаление пораженных суставов выступает единственным признаком болезни.
Маркеры вирусных гепатитов делят на специфические и неспецифические. Специфические позволяют определить вид вируса, а неспецифические —, определить заболевание в процессе его развития.
Своевременная диагностика гепатита В позволяет вылечить заболевание до начала его прогрессирования, можно определить вид вирусного возбудителя, время заражения, этап болезни и ее течение. На основе полученных результатов исследования составляют наиболее эффективную схему лечения.
При гепатите С выявление индикаторов на начальном этапе позволяет избежать обострения и развития цирроза. Иногда можно избежать развития хронического течения болезни и устранить вирус полностью.
Для проведения качественного анализа на маркеры при гепатите проводится распределение иммуноглобулинов (Ig) по классам М и G. В случае когда в крови обнаружен IgM, в организме диагностируют хронические процессы. При наличии IgG говорят, что болезнь уже была перенесена.
К признакам, указывающим на острую форму заболевания, специалисты относят:
- выявление поверхностного HbsAg антигена,
- наличие белка HBeAg,
- присутствие иммуноглобулина анти-HBc.
HbsAg антиген – это наиболее ранний маркер вирусного заболевания, проходящего в острой фазе. Он обнаруживается в анализах по прошествии 4 или 6 недель после инфицирования, когда процесс проходит острую либо преджелтушную стадию. Такие маркеры обнаруживаются даже в случае отсутствия признаков вирусного возбудителя.
HbeAg антиген формируется на раннем этапе патологии и в преджелтушный период. Маркер свидетельсвует об активном процессе распространения вируса в организме. Если он обнаруживается на протяжении 4 и более недель, то это значит, что болезнь находится в хронической форме.
Наличие анти-Hbs говорит о патологии, находящейся в конце острого этапа развития. Эти маркеры могут обнаруживаться в течение 10 и больше лет, их наличие указывает на формирование иммунитета.
Анти-Hbe указывает на динамику заражения. Соотношение показателей (anti-Hbe:HbeAg) помогает контролировать течение болезни и прогнозировать ее исход.
Антитела anti-Hbc IgM к маркеру HbcAg могут находиться в крови от 3 до 5 месяцев, их обнаружение указывает на наличие острой формы гепатита В.
Антитела анти-HbcIgG к маркеру HbcAg указывают на настоящее присутствие патологии либо на то, что болезнь была перенесена ранее.
Однако в анализах могут присутствовать не только маркеры вирусных гепатитов, рассмотренные выше. Если речь идет о группе С, к результатам присоединяется HCV-RNA – рибонуклеиновая кислота, она свидетельствует о патологии, обнаруживается в печеночных тканях либо в крови.
Рассмотрим антитела к гепатиту С.
Анти-HCV total присутствуют в случае острой либо хронической формы патологии, они выявляются спустя 6 недель после инфицирования. Даже в случае успешного самоизлечения организма, что встречается в 5% случаев, их обнаруживают в течение 5-8 лет. 
Анти-HCV core IgG обнаруживаются на 11 неделе после заражения. При хронической стадии эти антитела выявляются постоянно, их количество снижается после выздоровления и с трудом определяется лабораторными исследованиями.
Анти-NS3 присутствуют в крови на начальном этапе формирования болезни, их повышенное количество указывает на острую стадию гепатита С.
Маркеры вирусного гепатита С анти-NS4, анти-NS5 выявляются только на последних этапах развития патологии, когда имеет место поражение печени. Их уровень после выздоровления падает, а после применения Интерферона в качестве лечения они могут полностью исчезнуть.
Антитела к гепатиту А IgM выявляются сразу после появления желтухи, представляя собой диагностический маркер гепатита А-группы в остром периоде болезни. Эти антитела присутствуют в крови на протяжении от 8 до 12 недель, а у 4 % пациентов могут выявляться на протяжении 12 месяцев.
Достаточно скоро после формирования IgM в крови начинают формироваться антитела IgG – после появления они сохраняются в течение всей жизни и гарантируют наличие стойкого иммунитета.
Если в крови обнаружены анти-HAV–IgG и отсутствуют анти-HAV–IgM, можно говорить об имеющемся иммунитете к гепатиту А на фоне перенесенной ранее инфекции, либо это указывает на проведенную вакцинацию против вируса.
Анти-HAV–IgG формируется в сыворотке примерно через 14 суток после проведения вакцинации и после того, как было произведено введение иммуноглобулинов. При этом количество антител больше если, пациент перенес инфекции, нежели после того, как произошла пассивная передача.
Важно! Антитела этого типа передаются от матери к плоду трансплацентарным способом и часто обнаруживаются у малышей, возраст которых превышает 1 год. Количество суммарных антител по отношению к HAV определяется и используется только с эпидемиологической целью или же чтобы выявить предвакцинальный статус.
Антитела IgM преобладают в случае острой инфекции и проявляются, как правило, на ранней стадии процесса. Затем они обнаруживаются на протяжении всей жизни, причем у 45% взрослых пациентов выявляется наличие антител в сыворотке.
Генетические анализы при РА назначаются для выявления антигенов, определяющих предрасположенность к аутоиммунным заболеваниям. Такие индикаторы могут подтвердить или опровергнуть диагноз. Обнаружение антигена у здорового человека не всегда будет свидетельствовать о потенциальной угрозе развития заболевания.
Интерпретация результатов анализов
Для диагностики врач проводит качественный и количественный анализ результатов лабораторных исследований. Он тщательно сопоставляет данные как в начале обращения пациента при дифференциальной диагностике, так и в динамике для контроля результатов терапии. Дать заключение на основе анализов способен только специалист.
Заключение
Своевременный и качественный анализ крови при ревматоидном артрите позволяет выявить болезнь на ранней стадии, предотвратить развитие тяжелых форм заболевания, а также дифференцировать подозрения на другие схожие патологии.
Для диагностики РА может потребоваться множество исследований. Они необходимы как для установки точного диагноза, так и для контроля эффективности лечения. С их помощью корректируют и подбирают наиболее подходящую терапию в динамике.
Читайте также:


