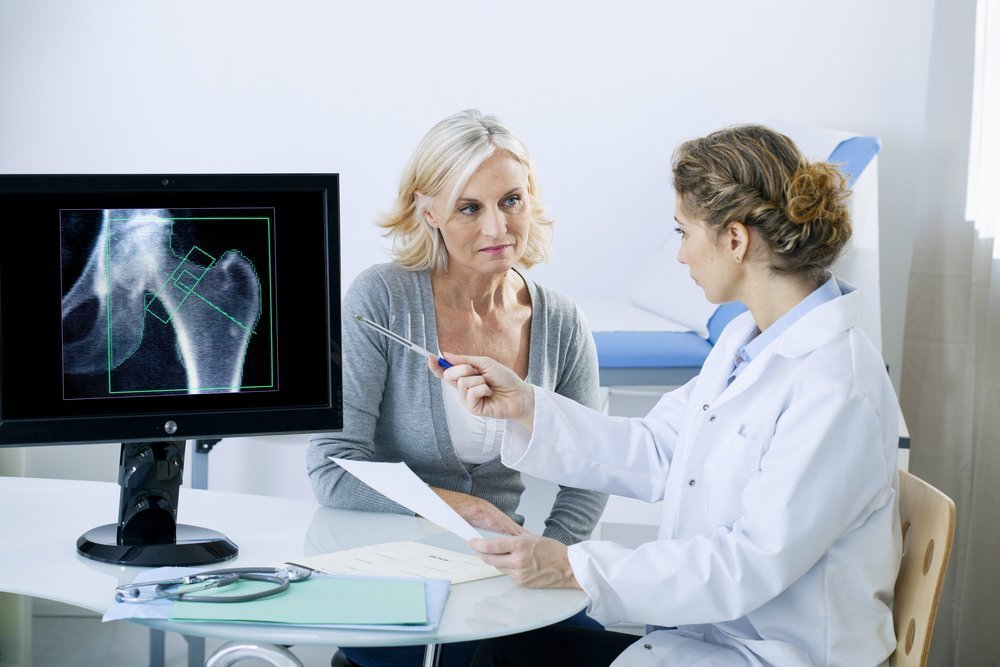
Биохимические основы развития остеопороза

Структура статьи
- Этиология
- Диагностика
- Клинические лабораторные исследования
- Маркеры формирования костной ткани
- Маркеры состояния обмена
- Маркеры резорбции костной ткани
- Прогностическая значимость
- Лабораторная программа : Метаболизм костной ткани
Этиология
Для остеопороза характерно снижение минеральной плотности с сопутствующими изменениями количества и микроархитектуры костной ткани, что сопровождается нарушением прочности скелета и повышением опасности переломов, особенно позвоночника, шейки бедра и запястья.
Масса костной ткани зависит от взаимодействия между клетками, формирующими (остеобласты) и разрушающими (остеокласты) кость. Индивидуальный пик костной массы, который в норме достигается к 25-30 годам, зависит от генетических и ненаследст-венных факторов: гормонального статуса, физических нагрузок, питания. Нарушение гор-монального статуса, несбалансированное питание, малоподвижный образ жизни, курение, чрезмерное потребление алкоголя являются факторами риска снижения костной массы Таким образом, остеопороз - гетерогенное заболевание, он может быть классифицирован как первичный или вторичный в соответствии с причинами, ответственными за потерю костной массы.
Диагностика
Начальный этап диагностики остеопороза – это выявление факторов риска на основе данных пациента:
- низкое содержание кальция в рационе;
- дефицит витамина D;
- заболевания ЖКТ (снижение всасываемости кальция);
- ранняя менопауза;
- длительные периоды иммобилизации
- длительный прием глюкокортикоидов, гормонов щитовидной железы;
- заболевания щитовидной железы, надпочечников, почек, печени;
- низкий индекс массы тела;
- вредные привычки (курение,алкоголь);
- низкая физическая активность.
Денситометрия - измерение плотности костной ткани, основано на измерение минерального компонента костной ткани – кальция.
В настоящее время для ранней диагностики остеопороза используют различные методы костной денситометрии, позволяющие выявить уже 2-5% потери массы кости, оценить динамику плотности костной ткани в процессе развития заболевания или эффективность лечения. Применяются изотопные методы (моно - и двухфотонная абсорбциометрия), рентгеновские (моно - и двухэнергетическая абсорбциометрия, количественная компьютерная томография ) и ультразвуковые. С помощью монофотонной, моноэнергетической и ультразвуковой денситометрии исследуют периферические отделы скелета. Эти методы наиболее подходят для скрининга остеопороза или предварительного диагноза. Наиболее универсальным является применение двухэнергетической рентгеновской абсорбциометрии (DEXA) – золотой стандарт, позволяющей измерять содержание костного минерала в любом участке скелета, а также определять содержание солей кальция, жира и мышечной массы во всем организме. Стандартными (автоматическими) программами для таких денситометров являются программы для поясничных позвонков, проксимальных отделов бедра, костей предплечья и программа "все тело".
Независимо от того, как рассматривать остеопороз – как заболевание или синдром, - риск переломов, определяемый при денситометрии, не может быть одинаковым для всех костей скелета. Поэтому выбор его участков для исследования является чрезвычайно важ-ным, Чтобы сделать этот выбор, необходимо помнить о том, что в костной ткани имеются два разных слоя. Компактное (кортикальное) вещество вносит основной вклад в прочность кости, но характеризуется невысокой скоростью метаболических процессов. Губчатое (трабекулярное) вещество, напротив, весьма активно в плане обмена веществ. Отмечено, что разные виды остеопороза по-разному сказываются на этих двух слоях.
При преимущественном поражение трабекулярного вещества – развивается постменопаузальный, гипогонадальный, стероидный остеопороз; кортикального вещества – сенильный, гипертиреодный, гиперпаратиреодный, диабетический остеопороз. При многих видах остеопороза наблюдается тенденция постепенного "распространения" остеопороза от осевого скелета (прежде всего позвонков), где появляются первые признаки остеопороза, к периферическому. Поэтому, учитывая чрезвычайную ценность ранней диагностики остеопороза, в целом следует отдать предпочтение исследованию осевого скелета. Исследование периферических отделов (большеберцовая, пяточные кости, фаланги пальцев) часто называют скриниговыми.
Клинические лабораторные исследования
В основе патогенеза развития остеопороза лежит дисбаланс процессов костного ремоделирования (костеообразования) и костной резорбции: либо преобладает ускоренная резорбция, либо сниженое костеообразование, либо замедление обеих составляющих костного обмена. В норме количество новообразованной ткани эквивалентно разрушенной.
Основная цель ранней биохимической диагностики остеопороза состоит в оценке интенсивности костного метаболизма. Для этого используются специальные биохимические маркеры, которые можно разделить на три группы.
Наибольшее значение в дифференциальной диагностике заболеваний скелета метаболического характера имеет оценка гормонального статуса больных, в частности парати-реоидного гормона (ПТГ), половых стероидных и гонадотропных гормонов, а также витамина Д, участвующего с ПТГ в регуляции обмена кальция. Определение концентрации кальция, фосфора и общей активности щелочной фосфатазы сыворотки крови использу-ются в оценке общего статуса больного и имеет вспомогательное, но не диагностическое значение.
Маркеры формирования костной ткани
Остеокальцин – основной неколлагеновый белок костного матрикса, который син-тезируется остеобластами. Синтез остеокальцина зависит от витамина К и Д, что до некоторой степени снижает чувствительность и специфичность определения остеокальцина, как маркера метаболизма костной ткани. Но, именно ,его концентрация в крови отражает метаболическую активность остеобластов костной ткани, поскольку остеокальцин крови – результат нового синтеза, а не освобождения его при резорбции кости. Он синтезируется остеобластами во внеклеточное пространство кости, часть попадает в кровоток, где он и может быть проанализирован. Высокий уровень ПТГ подавляет выработку белка остеобластами, в результате чего снижается его концентрация в костной ткани и в крови. По мнению многих авторов, этот показатель "возможный" прогностический индикатор усиления заболевания костей.
Кальцитонин – полипептидный гормон, выделяемый С-клетками щитовидной железы. Основной эффект кальцитонина – снижение уровня кальция в крови и отложение в кости. По своему действию является антагонистом паратгормона. Кальцитонин действует через специфические рецепторы (в костях, почках), в результате чего тормозится резорбция костей и выход кальция из кости.
Костный фермент щелочной фосфатазы (b ALP) Его исследование, наряду с общей активностью щелочной фосфотазы (ЩФ), существенно повышает информативность при дифференциальной диагностике заболеваний скелета и печени. Щелочная фосфотаза ассоциируется с активностью остеобластов и поэтому ее определение дополняет картину формирования костной ткани.
Маркеры состояния обмена
Паратгормон (ПТГ) – является одним из основных регуляторов кальциево-фосфорного обмена, синтезируется паращитовидными железами в ответ на уменьшение внеклеточной концентрации кальция. Он активирует резорбцию костной ткани и приводит к поступлению кальция и фосфора в кровь. Тиреотроопный гормон (ТТГ), наоборот, способствует усвоению кальция и препятствует его выводу из костной ткани. Между тем, уровень кальция в крови должен быть постоянным, если его мало, то риск развития сердечной патологии высок и регуляторная система нашего организма идет на все, чтобы содержание кальция в крови было нормальным, "забирая" его у скелета, мыщц.
Кальций, фосфор – основные минеральные компоненты костной ткани. Разные формы и стадии остеопороза могут проявляться различными сдвигами в концентрациях этих минералов. Другой аспект проблемы нарушения кальциевого гомеостаза – дефицит витамина Д. Хорошо известно, что с возрастом наблюдается прогрессирующее снижение кишечной абсорбции не только кальция, но и витамина Д, а также образование витамина Д в коже. В 2006 году группа экспертов Американского национального фонда по изучению остеопороза показала, что лечение препаратами кальция и витамина Д экономически эффективно и выгодно в целях профилактики остеопороза.
Маркеры резорбции костной ткани
Для оценки эффективности лечения остеопороза используют, как правило, маркеры резорбции, поскольку их снижение под влиянием терапии начинается уже через 2-3 недели и достигает плато через 3-6 месяцев (НИИ трансплантологии и искусственных органов МЗ РФ). Выявление нормального или значительно повышенного уровня маркера резорбции при однократном определении уже имеет диагностическое значение.
Деоксипиридинолин (ДПИД). На сегодняшний день ДПИД считают самым адекватным маркером резорбции кости. Костный коллаген характеризуется наличием поперечных связей между отдельными молекулами коллагена, которые играют большую роль в его стабилизации и представлены в виде деоксипиридинолина. Выход ДПИД в сосудистое русло из кости происходит в результате его разрушения остеокластами. ДПИД не подвергается дальнейшим метаболическим превращениям и выводится с мочой в неизменном виде. Его экскреция повышается при многих видах остеопороза.
beta-CrossLaps – (С-концевые телопептиды) образующиеся при деградации колагена 1 типа, который составляет более 90 % органического матрикса кости. Измерение beta-CrossLaps позволяет оценить темпы деградации относительно "старой" костной ткани. В норме малые фрагменты коллагена, образующиеся при его деградации, поступают в кровь и выводятся почками с мочой. У пациентов со сниженной функцией почек содержание beta-CrossLaps в сыворотке крови возрастает вследствие снижения экскреции. При патологическом увеличении резорбции костной ткани (пожилой возраст, остеопороз) коллаген 1 типа деградирует в большом объеме, что приводит к увеличению уровня фрагментов коллагена в крови.
В настоящее время все больше появляется данных о влиянии полиморфизмов генов на минеральную плотность костной ткани (МПКТ). Группой ученых из ГУ института ревматологии РАМН были получены данные о влиянии полиморфизма гена ВМР4 на ми-неральную плотность костной ткани и маркеры костного ремоделирования в группах женщин в постменопаузе, имеющих остеопороз.Обнаружена значимая ассоциация полиморфизма этого гена (6007С – Т полиморфизма 4 экзона) с МПКТ поясничного отдела и маркерами костного ремоделирования. При этом средний уровень щелочной фосфатазы был снижен, а значение уровня CrossLaps были высокими. Эти данные свидетельствуют о более низкой интенсивности процессов костеообразования и более высокой интенсивности процессов костной резорбции.
Изучение аллельного полиморфизма сети генов костного ремоделирования является перспективным направлением для выявления генотипов предрасположенности к остеопорозу.
Таким образом, определение уровня биохимических маркеров резорбции и ремоделирования кости позволяет:
- при профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования и резорбции костной ткани;
- оценить и прогнозировать уровень потери костной массы;
- оценить эффективность проводимой терапии уже через 2-3 месяца
Прогностическая значимость
Высокие уровни маркеров резорбции костей, превышающие норму в 2 раза, связывают с двукратным увеличением риска переломов; пациенты с остеопорозом, имеющие уровни маркеров резорбции костей, превышающие нормы в 3 раза, имеют другую метаболическую костную патологию (включая злокачественную). Таким образом, показаниями для исследования маркеров метаболизма костной ткани являются:
- определение риска развития остеопороза;
- мониторинг в период мено - и постменопаузы;
- мониторинг при проведении гормональной заместительной терапии;
- оценка эффективности терапии антирезорбционными препаратами
Лабораторная программа: Метаболизм костной ткани
Маркеры формирования костной ткани
- Остеокальцин
- Щелочная фосфатаза
- Паратгормон (ПТГ)
- Неорганический фосфор
- Ионизированный кальций Маркеры резорбции костной ткани
- Деоксипиридинолин (ДПИД)
- CrossLaps – коллаген 1 типа
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гормональные факторы патогенеза остеопороза
Витамин D и его активные метаболиты являются компонентами гормональной системы, регулирующей фосфорно-кальциевый обмен, и участвуют, с одной стороны, в минерализации костной ткани, с другой - в поддержании гомеостаза кальция. Биологическое действие активных метаболитов витамина D заключается, главным образом, в стимуляции кишечной абсорбции кальция и фосфора, активации обмена и усилении экскреции кальция с мочой.
Показатель, отражающий статус витамина D в организме. 25(OH)D - основной метаболит витамина D, присутствующий в крови. Он образуется преимущественно в печени, при первой ступени гидроксилирования витамина D, обладает умеренной биологической активностью. 25(OH)D в крови пере.
Гормон роста, стимулирующий рост костей, мышц и органов. Пептидный гормон. Вырабатывается соматотрофами передней доли гипофиза под контролем соматостатина и соматолиберина. Основные эффекты: стимуляция линейного роста, поддержание целостности тканей и уровня глюкозы к.
Основной регулятор обмена углеводов. Инсулин – полипептидный гормон, продуцирующийся бета-клетками поджелудочной железы, главный регулятор углеводного обмена. В норме его секреция стимулируется увеличением уровня глюкозы в крови. Повышение концентрации инсулина вызывает усиленное поглощени.
Первоначальный, но временный эффект ПГЕ2 ингибирование активности остеокластов. Среди системных гормонов стимулирующее действие на ПГЕ2 оказывает ПТГ, а ГК являются ингибиторами скелетного ПГЕ2.
Методы измерения костной ткани
Для клиницистов важно, чтобы измерения предоставляли информацию, с помощью которой можно помочь пациентам (например, сократить количество переломов). За последние несколько десятилетий было разработано много методов, позволяющих с высокой степенью точности измерять костную массу количественно в различных участках скелета (фотонная или рентгеновская денситометрия, компьютерная томография, абсорциометрия).
Полезную информацию об обмене костной ткани позволяют получить некоторые инвазивные методы. Гистоморфологический анализ гребня подвздошной кости, даёт возможность получить сведения о скорости образования костной ткани на клеточном и тканевом уровне, однако информации о величине костной резорбции недостаточно. Кроме того, исследование обмена костной ткани ограничивается небольшой областью губчатого вещества и внутренней поверхностью кортикального слоя, что не всегда отражает происходящее в других отделах скелета.
- Диагностика остеопороза возможна только при частичной потере костной массы.
- Не позволяет прогнозировать уровень потери костной массы.
- Оценка изменения плотности костной ткани возможна только через 1,5 - 2 года после назначения терапии.
- Отсутствие возможности быстрой коррекции терапии остеопороза.
Биохимические маркёры ремоделирования кости
Наиболее важный неколлагеновый белок матрикса кости. Остеокальцин (Оsteocalcin, GLA protein) — основной неколлагеновый белок кости, включённый в связывание кальция и гидроксиапатитов. Синтезируется остеобластами и одонтобластами, состоит из 49 аминокислот. Молекулярный вес приблизительно 5.
Биохимические маркёры костной резорбцииОпределение натощак кальция в утренней порции мочи (соотнесенного с экскрецией креатинина), является самым дешёвым методом оценки резорбции кости. Этот метод полезен для определения значительно усиленной резорбции, малочувствителен.
Деоксипиридонолин (ДПИД) является перекрёстной пиридиновой связью, присущей зрелому коллагену и не подвергающейся дальнейшим метаболическим превращениям. Он выводится с мочой в свободной форме (около 40%) и в связанном с пептидами виде (60%). Определение Дпид в моче имеет ряд преимуществ.
Основной материал поперечных связей коллагена в костях. Костный коллаген характеризуется наличием поперечных связей между отдельными молекулами коллагена, которые играют большую роль в его стабилизации и представлены в виде деоксипиридинолина (лизилпиридинолина, ДПИД) и пиридинолина (ок.
- высокая специфичность для обмена костной ткани;
- отсутствие метаболических превращений до выведения с мочой;
- возможность проводить исследования без предварительных диетических ограничений.
Значение биохимических маркёров для диагностики и мониторирования терапии остеопороза
Проведённые наблюдения за терапией основными видами групп препаратов, позволили сделать следующие выводы:
- повышение уровня щёлочной фосфатазы и остеокальцина в сыворотке крови часто отмечается при лечении пациентов с остеопорозом фторидами. Определение этих маркёров рекомендовано для контроля за стимулирующим воздействием фторидов на костеобразование;
- антирезорбционные препараты, такие как эстрогены и бифосфонаты, приводят при остеопорозе, который развился после менопаузы, к значительному снижению концентрации маркёров резорбции и синтеза костной ткани, вплоть до пременопазуального уровня.
Определение уровня биохимических маркёров резорбции и ремоделирования кости позволяет:
- при профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования и резорбции костной ткани;
- оценить и прогнозировать уровень потери костной массы;
- дать оценку эффективности назначенной терапии уже через 2 - 3 месяца;
- выбрать наиболее эффективный препарат и определить оптимальный уровень его дозировки индивидуально для каждого пациента;
- быстро оценить эффективность проводимой терапии и существенно сократить материальные и временные затраты пациента на лечение.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Остеопороз – системное прогрессирующее заболевание костей, при котором происходит уменьшение костной массы, нарушение микроархитектоники кости, потеря прочности костной ткани. Кости становятся хрупкими, что увеличивает риск возникновения переломов. Признаки остеопороза определяются более, чем у 30% женщин старше 50 лет и более, чем у 20% мужчин.
Остеопороз является важной медико-социальной проблемой в наши дни. По различным статистическим данным, количество переломов костей по причине остеопороза с каждым годом увеличивается. Возможно, это связано с устареванием населения планеты и многочисленными факторами риска.
Причины остеопороза
Основной патобиохимической причиной развития данного заболевания является нарушение фосфорно-кальциевого обмена, что проявляется в виде нарушения структуры костной ткани и ослаблении ее опорных свойств.
Процесс синтеза и распада костной ткани осуществляется специализированными клетками, которые находятся в костях – остеобластами и остеокластами. Остеобласты принимают участие в синтезе нового вещества кости, тогда как остеокласты разрушают его. В норме эта система находится в равновесии, на смену разрушенным клеткам синтезируются новые. То есть, существует определенный баланс между активностью остеокластов и остеобластов.
В период роста человека процессы синтеза кости преобладают, и прочность кости увеличивается. Но у мужчин к 50-60 годам и у женщин после наступления менопаузы начинают доминировать процессы, приводящие к разрушению костной ткани. Прогрессирование деструктивных процессов при остеопорозе приводит к деформации кости и компрессии позвонков.
Снижение костной массы не сразу заметно, но существенно увеличивает риск переломов костей при небольших нагрузках. По статистике переломы возможны у 40% женщин и у 15% мужчин. По некоторым оценкам, риск возникновения переломов у женщин из-за остеопороза составляет около 50%, а у мужчин доходит до 20%.
Повышенная частота остеопороза у женщин может объясняться влиянием эстрогенов. Наступление менопаузы сопровождается снижением содержания эстрадиола, гормона необходимого для нормального роста кости. В постменопаузе признаки остеопороза обнаруживаются у 80% женщин. Однако, следует отметить, что не у всех женщин с низким содержанием эстрогенов прогрессирует остеопороз.
Переломы костей возможны, практически в любой локализации опорно-двигательного аппарата человека. Переломы шейки бедра чаще возникают при падениях у ослабленных пациентов, а переломы позвонков могут возникать при подъеме тяжестей. Другая частая локализация переломов – кости предплечья, плечевая кость.
![]()
Основные гормоны остеопороза
Костная ткань состоит из органического матрикса, специализированных клеток, минеральных веществ и воды. Органический матрикс составляет около 35% веса кости. На 90% он состоит из коллагена первого типа и других белков, таких как остеокальцин. На долю неколлагеновых белков приходится около 10%. Остеокальцин, как основной неколлагеновый белок кости, составляет 3% от всех белков кости.
Основным неорганическим компонентом кости является гидроксиапатит – соединение кальция и фосфора. Без этих элементов невозможно нормальное построение костной ткани.
Процесс поступления, выведения кальция и фосфора контролируется гормонами:
- кальцитонином, который вырабатывается С-клетками щитовидной железы и обладает гипокальциемическим действием, усиливая поступление кальция из крови в кости;
- паратгормоном, который вырабатывается клетками паращитовидной железы. При повышении его концентрации происходит вымывание кальция из костной ткани и активация остеокластов;
- метаболитом витамина D - кальцитриолом.
Равновесие паратгормон-кальцитонин находится в зависимости от содержания кальция и витамина D. Нарушение этого баланса приводит к сбою процессов резорбции кости (распада) и ее синтеза. По механизму действия данные гормоны являются антагонистами, поэтому именно их баланс обеспечивает нормальный обмен минералов в костях.
Кроме того, на обменные процессы влияют такие гормоны, как инсулин и соматотропный гормон (гормон роста), которые стимулируют синтез костного матрикса.
Маркеры остеопороза
Поскольку органический матрикс постоянно обновляется, то в процессе синтеза коллагена кости и при его распаде образуются отдельные фрагменты – N-телопептиды и С-телопептиды. Содержание конечных участков телопептидов – бета-Crosslaps и N-терминального пропетида проколлагена I типа (Р1NP) отражает активность процессов формирования и распада костной ткани.
Р1NP образуется и высвобождается в кровяное русло только при синтезе коллагена, поэтому его считают маркером формирования кости. Бета-Crosslaps высвобождается из зрелого коллагена 1 типа и в большей степени отражает степень резорбции кости.
Лабораторная диагностика остеопороза
Таким образом, при распаде костной ткани вещества, составляющие костный матрикс поступают в кровяное русло. Контроль за их наличием в крови используется для оценки состояния костной ткани.
Другим специфическим способом оценки формирования кости является определение концентрации специфических молекул, участвующих в сшивке молекул коллагена. Эти поперечные связки называются дезоксипиридинолин (ДПИД). Определение в моче молекул ДПИД является высокоспецифичным маркером разрушения кости.
Дополнительными методами лабораторной оценки состояния костной системы являются определение содержания гормонов, активности ферментов, белков и других веществ, участвующих в метаболизме костной ткани. К основным параметрам, которые можно выполнить в клинико-диагностических лабораториях, относятся:
- паратгормон,
- кальцитонин,
- остеокальцин,
- кальций (общий, ионизированный),
- фосфор,
- витамин D,
- костная фракция щелочной фосфатазы (остаза).
Через 2-3 месяца после начала терапии лабораторные данные дают возможность оценить ее эффективность.
Следует учитывать, что лабораторные показатели необходимо сочетать с данными денситометрии, которая в настоящее время является одним из основных методов в диагностике остеопороза.
Широко применяются молекулярно-биологические методы оценки состояния генетических факторов в развитие остеопороза – полиморфизм гена рецептора витамина D, полиморфизмы гена фермента ароматазы (CYP19A1) и гена рецептора эстрогенов (ESR1).
Для комплексной оценки причин, приводящих к развитию заболевания необходимо проводить анализ всех данных, которые способствуют его развитию. К ним относятся общий гормональный статус, характер питания (нехватка витаминов и кальция), прием лекарственных препаратов, генетические причины (синдром Марфана, синдром Элерса-Данлоса).
![]()
Факторы риска остеопороза
За время изучения данного заболевания сформировалось понимание о влиянии основных причин и факторах риска в формировании этой патологии костей.
К основным факторам риска относятся:
- Пожилой возраст.
Влияние возраста очевидно, поскольку в период жизни после 50-60 лет преобладают процессы резорбции (распада) и наблюдается снижение костной массы. В старческий период происходит снижение функциональной активности остеобластов, специализированных клеток кости, ответственных за синтез межклеточного вещества кости.
- Менопауза и ранняя менопауза.
Период менопаузы у женщин сопровождается снижением уровня эстрогенов, что негативно отражается на метаболизме костного матрикса. Считается, что недостаток эстрогенов влияет на содержание активных веществ, в частности, интерлейкина 6, участвующего в обмене костной ткани.
- Нарушения обмена кальция.
Недостаточное поступление кальция, являющегося одним из основных минералов кости, приводит к нарушению формирования костного матрикса. Нарушение поступление кальция может возникать в результате снижения его потребления с пищей, недостаточности витамина D, заболеваний желудочно-кишечного тракта (синдром мальабсорбции, резекция желудка, хронический панкреатит).
- Прием некоторых лекарственных средств.
Показано, что длительный прием глюкокортикоидных препаратов, диуретиков, тиреоидных гормонов, антикоагулянтов (гепарина), противосудорожных средств (фенитоин) сопровождается потерей костной массы. Одним из объяснений негативного влияния глюкокортикоидов является их угнетающее действие на остеобласты.
Кроме того, выделяют и другие факторы риска, повышающие вероятность развития остеопороза:
- генетические причины,
- значительное снижение физической активности,
- заболевания желудочно-кишечного тракта,
- заболевания щитовидной железы,
- алкоголизм, табакокурение и чрезмерное употребление кофе.
Таким образом, совокупность факторов риска и работа внутренних механизмов (гормоны, ферменты, минеральные вещества, витамины) определяют баланс ремоделирования кости и процессов резорбции. Нарушение биохимических механизмов и наличие факторов риска существенно увеличивают скорость процессов остеопороза.
Профилактические мероприятия, назначенные врачом-эндокринологом, помогут снизить нежелательные последствия разрушения костной ткани и улучшить качество жизни.
Читайте также: