Спинальная амиотрофия верднига-гофмана что это такое причины
Спинальная мышечная атрофия 1 типа – это тяжелое заболевание, при котором шансы на излечение отсутствуют. В настоящее время самым эффективным способом борьбы с патологией остается дородовая диагностика и аборт по медицинским показаниям. Но если предотвратить рождение больного ребенка не удалось или для родителей это неприемлемо, то семье придется столкнуться с трудностями ухода и лечения ребенка-инвалида.
Этиология амиотрофии Верднига-Гоффмана
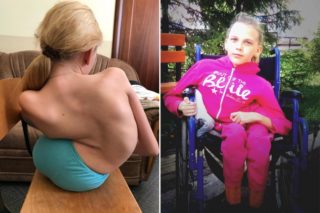
При генетических нарушениях у пациентов постепенно отмирают двигательные нейроны спинного мозга. Без достаточной иннервации мышцы конечностей и внутренних органов не могут выполнять свою функцию и нормально питаться. В них тоже начинаются процессы отмирания. Это и есть спинальная амиотрофия.
Спровоцировать генетические поломки могут различные вредные факторы – воздействие токсических веществ и радиации на половые клетки, неблагоприятные факторы и заболевания матери во время беременности, в меньшей степени – курение и алкоголизм родителей.
Чаще всего это мутация в первом поколении, поскольку пациенты с симптомами спинальной амиотрофии Верднига-Гоффмана крайне редко доживают до репродуктивного возраста.
Симптомы заболевания

Патология проявляется очень рано – первые признаки становятся видны до того, как малышу исполнится полгода. В особенно тяжелых случаях симптомы отмечаются еще у плода в виде слабых или очень слабых шевелений. При рождении у ребенка может отмечаться сниженный тонус мышц. Чаще всего болезнь диагностируется в 2-3 месяца, когда малыш не начинает вовремя держать голову.
Характерные особенности больных:
- прогрессирующая мышечная слабость;
- прекращение активных движений вплоть до паралича;
- сниженный сосательный рефлекс, постоянное недоедание;
- сохранение чувствительности кожи;
- поражение больших групп мышц, постепенное расширение пораженной области.
Спинальная амиотрофия 1 типа отличается стремительным развитием. В течение нескольких месяцев присоединяются тяжелые осложнения – дыхательная недостаточность и аспирационная пневмония. Из-за сниженного сосательного и глотательного рефлекса малыши не могут полноценно питаться, единственный способ их накормить – внутривенный.
Этому состоянию обычно сопутствует целый букет других врожденных патологий – деформации костей, нарушения формирования суставов и кровеносных сосудов, гидроцефалия, олигофрения. Существуют и менее злокачественные формы болезни – они прогрессируют медленнее, имеют меньше сопутствующих патологий, первые проявления возникают позже. При 2 типе пациенты могут дожить до подросткового возраста, при 3 – до зрелости.
Как ставится диагноз
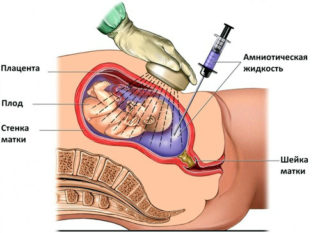
Выявить спинальную мышечную атрофию Верднига-Гоффмана можно до или после рождения ребенка. Пренатальная диагностика основана на выявлении генетического дефекта. Для этого требуется получить генетический материал ребенка из пуповинной крови, амниотической жидкости или ворсин хориона. Инвазивные методы диагностики опасны для развития беременности, поэтому родители часто отказываются от них. Если патология выявлена, это показание к аборту.
Рождение детей со спинальной мышечной атрофией (СМА) Верднига-Гоффмана возможно по нескольким причинам. Не во всех больницах есть возможность дородовой диагностики болезни и генетического консультирования родителей до зачатия малыша. Родители проводят анализ в основном по собственному желанию и могут до момента родов не знать о том, что малыш будет тяжело болен. Иногда диагноз ставится на позднем сроке, когда прерывать беременность поздно. Играет роль и принципиальное неприятие абортов у некоторых родителей – даже зная о будущей патологии, они принимают решение рожать.
После родов диагноз ставит неонатолог или детский невролог. Важен неврологический статус маленького пациента – нарушение двигательной активности и угасание рефлексов при сохранении чувствительности. Для постановки окончательного диагноза назначается анализ ДНК. МРТ и КТ позвоночника важны, чтобы отличить СМА от других патологий. Нарушения в двигательных ядрах спинного мозга не визуализируются.
Лечение мышечной атрофии и профилактика
Лечение спинальной амиотрофии Верднига-Гоффмана симптоматическое. Избежать развития болезни или существенно замедлить нарастающие нарушения невозможно, но можно снять выраженность симптомов. Терапия проводится тремя основными способами – медикаментозное лечение, лечебная физкультура и устройства, облегчающие существование больных детей и их родственников.
Из медикаментозных средств при спинальной мышечной атрофии 1 типа применяются ноотропные препараты и нейрометаболиты – они улучшают передачу импульсов в нервно-мышечных синапсах. При нарушениях глотательного рефлекса единственный возможный путь введения препаратов – инъекционный.
Лечебная физкультура и массаж помогают повысить тонус мышц, улучшить кровоснабжение и замедлить процессы атрофии. Быстро прогрессирующая спинальная амиотрофия при болезни Верднига-Гоффмана не дает детям возможности выполнять активные движения. Гимнастика построена только на пассивных действиях – их осуществляют родители.
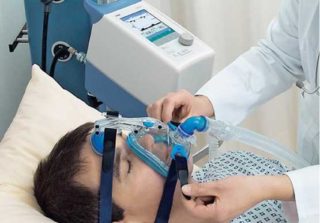
На поздних этапах заболевания жизнь пациентов значительно облегчают портативные аппараты ИВЛ. Это позволяет детям находиться дома в привычной обстановке. У пациентов с более легкими формами, проявляющимися после полугода или в подростковом возрасте, применяются автоматизированные инвалидные коляски.
Поскольку причина спинальной амиотрофии в генетическом дефекте, предотвратить заболевание можно только одним путем – не допускать рождения детей, у которых диагностирована патология. Важную роль играет генетическое консультирование. Пациенты с самой легкой формой генетически обусловленной гибели нейронов (3 тип, болезнь Кугельберга-Валандера) доживают до репродуктивного возраста и имеют шанс рождения детей с более тяжелыми формами, чем у них самих.
Общая проблема всех заболеваний, которые можно диагностировать до родов – не для всех родителей приемлемо прерывание беременности даже по медицинским показаниям. Кроме того, тест на спинальную мышечную атрофию 1 типа у детей не является обязательным. Большая часть диагнозов этого заболевания ставится уже после рождения ребенка, и родители оказываются перед печальным фактом, что ребенок страдает неизлечимым заболеванием.
Осложнения и прогноз
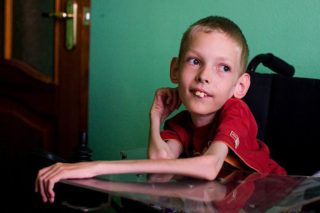
Болезнь Верднига-Гоффмана быстро прогрессирует – чем раньше оно проявилось, тем быстрее придет к летальному исходу. Маленькие пациенты неизбежно гибнут. Средний срок жизни таких детей – около двух лет, максимальная продолжительность – до 8 лет, если первые признаки болезни появились в 5-6 месяцев.
Другие виды спинальной амиотрофии, не относящиеся к болезни Верднига-Гоффмана, имеют более благоприятный прогноз. Сколько живут пациенты, зависит от возраста, в котором манифестировала патология. Раннее начало – неблагоприятный признак, если симптомы появились в подростковом возрасте (3 тип), то пациент может дожить до старости только с частичной утратой двигательной активности.
Основные осложнения спинномозговой атрофии Верднига-Гоффмана:
- нарушение сосательного рефлекса и общая гипотрофия ребенка;
- нарушение глотания, попадание пищевых масс в дыхательные пути и аспирационная пневмония;
- атрофия межреберных мышц и диафрагмы, дыхательная недостаточность и полная невозможность самостоятельного дыхания.
Последнее – основная причина смерти пациентов.
Нарушение функций спинного мозга крайне опасно для жизни и не дает никаких шансов на выживание. Единственная возможность предотвращения – совершенствование методов дородовой диагностики и генетического консультирования.
Амиотрофия Верднига-Гоффмана — это наиболее злокачественная спинальная мышечная атрофия, развивающаяся с рождения или в первые 1-1,5 года жизни ребенка. Характеризуется нарастающими диффузными мышечными атрофиями, сопровождающимися вялыми парезами, прогрессирующими до полной плегии. Как правило, амиотрофия Верднига-Гоффмана сочетается с костными деформациями и врожденными аномалиями развития. Диагностическую основу составляет анамнез, неврологический осмотр, электрофизиологические и томографические исследования, анализ ДНК и изучение морфологического строения мышечной ткани. Лечение слабо эффективно, направлено на оптимизацию трофики нервной и мышечной тканей.
МКБ-10
- Причины
- Патогенез
- Симптомы амиотрофии
- Врожденная форма
- Ранняя детская форма
- Амиотрофия Кугельберга-Веландера
- Диагностика
- Лечение амиотрофии Верднига-Гоффмана
- Немедикаментозная терапия
- Медикаментозная терапия
- Хирургическое лечение
- Новейшие разработки
- Прогноз
- Профилактика
- Цены на лечение
Общие сведения
Амиотрофия Верднига-Гоффмана является самым тяжелым вариантом из всех спинальных мышечных атрофий (СМА). Ее распространенность находится на уровне 1 случай на 6-10 тыс. новорожденных. Заболевание имеет несколько форм: врожденную, промежуточную (раннюю детскую) и позднюю. Целый ряд специалистов выделяет последнюю форму как самостоятельную нозологию — амиотрофию Кугельберга-Веландера. Отсутствие этиотропного и патогенетического лечения, ранний летальный исход ставят курирование пациентов с болезнью Верднига-Гоффмана в ряд наиболее сложных задач, стоящих перед современной неврологией и педиатрией.

Причины
Амиотрофия Верднига-Гоффмана — наследственная патология, кодируемая поломкой в генетическом аппарате на уровне локуса 5q13 5-й хромосомы. Ген, в котором происходят мутации, получил название survival motor neuron gene (SMN) — ген, ответственный за выживание мотонейронов. У 95% пациентов с болезнью Верднига-Гоффмана отмечается делеция теломерной копии этого гена. Тяжесть СМА прямо коррелирует с протяженностью участка делеции и сопутствующим наличием изменений (рекомбинации) в генах H4F5, NAIP, GTF2H2.
Носителем измененного гена, обуславливающего возникновение заболевания, является каждый 50-й человек. Но благодаря аутосомно-рецессивному типу наследования, патология у ребенка проявляется только тогда, когда соответствующая генетическая аберрация имеется и у матери, и у отца. Вероятность рождения ребенка с патологией в такой ситуации составляет 25%.
Патогенез
Результатом аберрации SMN-гена является недоразвитие мотонейронов спинного мозга, локализующихся в его передних рогах. Следствием становится недостаточная иннервация мышц, приводящая к их выраженной атрофии с потерей мышечной силы и прогрессирующим угасанием способности совершать активные двигательные акты. Основную опасность представляет слабость мышц грудной клетки, без участия которых невозможны движения, обеспечивающие дыхательную функцию. При этом сенсорная сфера на всем протяжении заболевания остается интактной.
Симптомы амиотрофии
СМА I клинически манифестирует до 6-месячного возраста. Внутриутробно может проявляться вялым шевелением плода. Зачастую мышечная гипотония отмечается с первых дней жизни и сопровождается угасанием глубоких рефлексов. Дети слабо кричат, плохо сосут, не могут держать голову. В отдельных случаях (при более позднем дебюте симптомов) ребенок учится держать голову и даже сидеть, но на фоне развития заболевания эти навыки быстро исчезают. Характерны ранние бульбарные нарушения, понижение глоточного рефлекса, фасцикулярные подергивания языка.
Данная амиотрофия Верднига-Гоффмана сочетается с олигофренией и нарушениями формирования костно-суставного аппарата: деформациями грудной клетки (воронкообразной и килевидной грудной клеткой), искривлением позвоночника (сколиозом), контрактурами суставов. У многих пациентов выявляются другие врожденные аномалии: гемангиомы, гидроцефалия, косолапость, дисплазия тазобедренных суставов, крипторхизм и пр.
Течение СМА I наиболее злокачественное с быстро нарастающей обездвиженностью и парезом дыхательной мускулатуры. Последний обуславливает развитие и прогрессирование дыхательной недостаточности, выступающей основной причиной летального исхода. В связи с нарушением глотания возможен заброс пищи в дыхательные пути с развитием аспирационной пневмонии, которая может явиться смертельно опасным осложнением спинальной амиотрофии.
СМА II дебютирует после 6-месячного возраста. К этому периоду дети имеют удовлетворительное физическое и нервно-психическое развитие, в соответствии с возрастными нормами приобретают навыки держать голову, переворачиваться, садиться, стоять. Но в подавляющем большинстве клинических случаев дети так и не успевают научиться ходить. Обычно эта амиотрофия Верднига-Гоффмана манифестирует после перенесенной ребенком пищевой токсикоинфекции или другого острого инфекционного заболевания.
В начальном периоде периферические парезы возникают в нижних конечностях. Затем они достаточно быстро распространяются на верхние конечности и мускулатуру туловища. Развивается диффузная мышечная гипотония, происходит угасание глубоких рефлексов. Наблюдаются контрактуры сухожилий, тремор пальцев, непроизвольные мышечные сокращения (фасцикуляции) языка. На поздних стадиях присоединяются бульбарные симптомы, прогрессирующая дыхательная недостаточность. Течение более медленное, чем у врожденной формы болезни Верднига-Гоффмана. Пациенты могут доживать до 15-летнего возраста.
СМА III - наиболее доброкачественная спинальная амиотрофия детского возраста. Манифестирует после 2-х лет, в отдельных случаях в период от 15 до 30 лет. Отсутствует задержка психического развития, длительное время пациенты способны самостоятельно двигаться. Некоторые из них доживают до глубокой старости, не теряя способности к самообслуживанию.
Диагностика
Больные спинальной мышечной атрофией I типа находятся под наблюдением детских неврологов и неонатологов. Большое значение имеет возраст манифестации заболевания – для амиотрофии Верднига-Гоффмана характерно развитие с момента рождения до 6 месяцев. В анамнезе часто имеются сведения о позднем и вялом шевелении плода во время беременности.
- Лабораторные тесты. В биохимическом анализе крови обнаруживается небольшое повышение концентрации креатинфосфокиназы. У некоторых пациентов данный показатель может находиться в пределах нормальных значений. При анализе газов крови выявляется снижение парциального давления кислорода (paO2) и увеличение углекислого газа (paCO2).
- Спирометрия. Вследствие выраженной мышечной слабости дыхательной мускулатуры при измерении функции внешнего дыхания отмечаются рестриктивные нарушения в виде снижения жизненной емкости легких.
- ЭНМГ. При выполнении игольчатой электронейромиографии удается зафиксировать следующие изменения – резкое уменьшение скорости проведения и амплитуды вызванных потенциалов, спонтанную биоэлектрическую активность в покое (фасцикуляции, фибрилляции).
- Гистология. При патоморфологическом исследовании мышечного биоптата обнаруживается пучковая атрофия мышечных волокон, чередующаяся с неизмененной мышечной тканью, гипертрофированными миофибриллами и соединительнотканными разрастаниями.
- ДНК-анализ. Верифицирующий тест, позволяющий достоверно установить диагноз. Методом полимеразной цепной реакции выявляется генетическая мутация (делеция) SMN1 экзона 7.
Амиотрофию Верднига-Гоффмана следует дифференцировать с другими генетически обусловленными нервно-мышечными заболеваниями, имеющими такое же быстропрогрессирующее течение. К ним относятся врожденные структурные миопатии, ювенильный боковой амиотрофический склероз, синдром Фукуямы.
Лечение амиотрофии Верднига-Гоффмана
Для прохождения лечения все больные подлежат обязательной госпитализации в стационар. В тяжелых ситуациях (например, при выраженной гипоксемии вследствие слабости дыхательных мышц) пациентов переводят в отделение реанимации и интенсивной терапии и подключают к аппарату ИВЛ. На сегодняшний день не существует этиотропной терапии амиотрофии Верднига-Гоффмана. Все мероприятия носят симптоматический и паллиативный характер. Применяются следующие методы лечения:
- Обеспечение питания. Так как процесс глотания у многих пациентов затруднен, особое внимание уделяется вопросу кормления. Консистенция пищи должна быть полутвердой, положение ребенка – вертикальным. При необходимости устанавливается назогастральный зонд.
- Физиотерапия. Для улучшения метаболизма в мышечных тканях проводятся сеансы электрофореза, электростимуляция модулированным током, грязевые аппликации.
- ЛФК. С целью повышения мышечного тонуса необходимы регулярные физические упражнения – пассивные (выполняются специалистом) с постепенным переходом на активные (выполняются самим пациентом).
- Ортопедическое лечение. Для борьбы с костно-суставными деформациями, а также для их предупреждения используются ортопедические приспособления (корсеты, ортезы, иммобилизирующие шины), фиксирующие различные части тела.
- Респираторная поддержка. Важное место в лечении занимает устранение кислородной недостаточности. В зависимости от тяжести состояния больного назначаются ингаляции кислорода через лицевую маску/назальную канюлю или неинвазивная вентиляция легких через портативные аппараты ИВЛ.
Для достижения максимального эффекта лечение должно быть комплексным, проводиться непрерывно и подбираться индивидуально для конкретного пациента. Лекарственные препараты, применяющие для лечения амиотрофии Верднига-Гоффмана следующие:
- Метаболические средства. Для улучшения метаболических процессов в нервных клетках и мышечной ткани назначается коэнзим Q10, L-карнитин, ноотропы. Также для стимуляции регенерации нервной ткани используют высокие дозы витаминов группы В (В1, В6, В12).
- Вальпроаты. Противоэпилептические препараты из группы производных вальпроевой кислоты способны увеличивать образование белка выживания мотонейронов (SMN), что впоследствии может улучшать клиническое течение заболевания.
- ИПП и прокинетики. Ингибиторы протонной помпы (пантопразол) и ЛС, ускоряющие моторику желудочно-кишечного тракта (итоприд), помогают в борьбе с гастроэзофагеальным рефлюксом, который часто возникает у больных АВГ вследствие выраженного нарушения глотания.
- Муколитики и отхаркивающие средства. С целью борьбы с такими дыхательными проблемами как слабое откашливание, скопление в дыхательных путях густой мокроты, применяются препараты разжижающие мокроту (ацетилцистеин) и стимулирующие ее отхаркивание (терпингидрат).
При развитии грубых деформаций грудной клетки и позвоночника или крайне выраженных контрактур суставов показаны ортопедические операции. У лежачих больных, страдающих постоянно рецидивирующими пневмониями, выполняется трахеостомия. При гастроэзофагеальном рефлюксе, резистентном к медикаментозному лечению, прибегают к лапароскопической фундопликации Ниссена.
Ведутся постоянные исследовательские работы по поиску эффективного лекарства для терапии спинальной мышечной атрофии. Наиболее перспективным направлением считается генная терапия. В клинической практике уже используются антисмысловые олигонуклеотиды, исправляющие дефекты матричной РНК в гене SMN2 (Спинраза).
В конце 2019 года был зарегистрирован и одобрен к клиническому применению препарат Золгенсма, который содержит функционально полноценный ген SMN1. Доставка этого гена в нервные клетки производится с помощью аденоассоциированного вируса, проникающего через гематоэнцефалический барьер. Использование Золгенсмы приводит к значительному увеличению продукции белка SMN1 и улучшению состояния пациентов.
Прогноз
Врожденная амиотрофия Верднига-Гоффмана имеет крайне неблагоприятный прогноз. При ее манифестации в первые дни жизни ребенка, его гибель, как правило, происходит до 6-месячного возраста. При начале клиники после 3-х месяцев жизни, летальный исход наступает в среднем к возрасту 2 года, иногда — к 7-8 годам. Ранняя детская форма характеризуется более замедленным прогрессированием, дети погибают в возрасте 14-15 лет.
Профилактика
Первичная профилактика амиотрофии Верднига-Гоффмана заключается в пренатальной диагностике. При обнаружении в биоптатах ворсин хориона или амниотической жидкости мутации SMN1 показано прерывание беременности. Вторичная профилактика сводится к предупреждению осложнений – аспирационной пневмонии, контрактур суставов, инфекций нижних дыхательных путей.

Амиатрофия Верднига-Гоффмана относится к орфанным (редким) патологиям, частота встречаемости которой 1:6000. Характеризируется крайне тяжелым течением и быстрым прогрессированием, приводящим к стойким и выраженным деформациям опорно-двигательного аппарата и летальному исходу.
- Что это?
- Причины заболевания
- I тип амиотрофии
- II тип
- III тип
- IV тип
- Диагностика
- Методы лечения
- Прогноз: сколько живут пациенты?
- Что нужно запомнить?
Что это?
Спинальная амиотрофия – генетическое заболевание, при котором обнаруживается мутации в 5 хромосоме в генах SMN1 и SMN2. Эти гены отвечают за сохранение и нормальное функционирование мотонейронов – нервов, которые отправляют импульс к скелетной мускулатуре. В результате отсутствия стимуляции мышц они атрофируются. У больных отмечается дегенеративные процессы в спинном мозге: разрушаются двигательные нейроны, нарушается функционирование передних рогов спинного мозга. В головном мозге изменения происходят в двигательных ядрах.
При мышечной амиотрофии Верднига мутирует ген SMN1, который препятствует гибели мотонейронов. Ген SMN2 выполняет эту функцию только частично и его возможности быстро истощаются. Течение и тяжесть патологии зависит от локализации и объема поражения в генном аппарате.

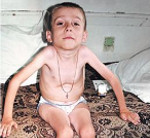
Фото 2
Спинальная амиотрофия вне зависимости от ее типа и формы – генетическое врожденное заболевание. Зачастую, первые признаки патологии обнаруживаются в младенческом возрасте либо еще во время беременности матери ребенка.
Одинаково распространена как у мужчин, так и женщин. Основное условие ее развития – наличие дефектного гена у обоих родителей, которые могут быть здоровыми и являются лишь носителями дефектной хромосомы.
В результате нарушения проводимости нервных импульсов от мотонейронов к мускулатуре происходит атрофия мышц нижних и верхних конечностей, диафрагмы, органов ЖКТ, сердца и другие. На фоне этого деформируются кости и суставы. Наиболее опасным проявлением является нарушения дыхательной функции и работы сердца.
В зависимости от тяжести течения, локализации дефектов и клинических проявлений выделяют 4 формы амиотрофии. Пациенты с любой формой амиотрофии являются инвалидами. Они не способны самостоятельно себя обслуживать, и нуждаются в постоянном уходе и медицинском наблюдении.
Причины заболевания
Основная причина развития спинальной амиотрофии – генетическая мутация у родителей и передача рецессивного гена плоду. Но, что привело к ее возникновению, ученым еще не известно. Мутация может произойти спонтанно, без видимых на то причин. Предполагаемыми причинами болезни являются следующие факторы:
- вирусные заболевания;
- нарушение экологии;
- прием во время беременности наркотиков, алкоголя, курение;
- воздействие терратогенных факторов;
- ионизирующее излучение.
В большинстве случаев родители узнают о том, что являются носителями опасного гена, только после рождения ребенка с диагнозом.
При некоторых вариантах амиотрофии толчком для прогрессирования мышечной дистрофии могут быть перенесенные вирусные заболевания, инсоляция, гормональный сбой.
I тип амиотрофии
Наиболее злокачественный и распространенный тип патологии – амиотрофия Верднига-Гоффмана. Диагностируется у детей раннего возраста либо внутриутробно. У детей после рождения отмечается снижение и угасание всех рефлексов. Им сложно сосать грудь, из-за чего часто возникает необходимость кормить ребенка через зонд.
Мышечная гипотония приводит к слабости шейных мышц – дети не могут научиться держать головку, самостоятельно переворачиваться, сидеть, стоять и ходить. У большинства детей возникают трудности с глотанием. В большинстве случаев амиотрофию диагностируют в течение 6 месяцев после рождения. Родители обращают внимание на вялость ребенка и малоподвижность, прогрессирующее снижение мышечного тонуса. Также младенцы плохо набирают вес.
Характеризируется поражением диафрагмы, которая участвует в дыхательном акте. Многие пациенты самостоятельно не дышат. Из-за выраженной дыхательной недостаточности многие дети не доживают до года. Продлить им жизнь удается с помощью ИВЛ и питания через зонд. 95% детей умирают до 4 лет.
Патология сопровождается прогрессирующими деформациями опорно-двигательной системы.
Помимо поражения мышц и костей, часто выявляется отставание в умственном развитии.
Справка. Заподозрить диагноз можно еще во время беременности матери, когда отмечается слабое шевеление плода, нарушение сердечной деятельности, отставание в развитии.
II тип
Промежуточная амиотрофия. Диагностируется у детей 3 месяцев—1,5 года. В более раннем возрасте диагноз трудно установить из-за особенностей мышечной системы у детей. Из-за выраженной мышечной гипотонии и снижения сухожильных рефлексов младенцы не могут научиться ползать и ходить. Лишь в 25% возможно, что ребенок сможет самостоятельно сесть.
Сопровождается поражением костно-суставной системы. У многих искривляется позвоночник, деформируется грудная клетка, атрофируются суставы рук и ног. Родители отмечают похудение ребенка либо прекращение набора веса.
Особенность этого типа амиотрофии – возможное внезапное прекращение ее развития. Несмотря на ремиссию, утратившиеся способности практически невозможно восстановить. Прогрессирование болезни может возобновиться либо ускориться после перенесенного ОРВИ или ОРЗ и других заболеваний, снижающих иммунитет. Из-за атрофии диафрагмы нарушается работа легких, ослабевает работа легких, из-за чего возникает одышка и тахикардия. Вовлечение в процесс мускулатуры органов пищеварения, бульбарные нарушения приводят к неспособности самостоятельно принимать пищу.
III тип
Болезнь Кугельберга-Веландера – вариант поздней амиотрофии. При данной форме диагноза первые признаки возникают после двух лет, либо во взрослом возрасте. Дети, которые уже умеют ходить, внезапно становятся неловкими, жалуются на боль в ногах при хождении. Они слишком часто падают, неуверенно ходят и практически перестают бегать. Многие родители замечают изменения походки и внезапно появившуюся неуклюжесть. Вначале развития патологии поражаются мышцы ног, затем атрофируются мышцы верхних конечностей и других частей тела. Из-за снижения объема мышц также отмечается снижение веса.
У некоторых больных может наступить период ремиссии, в который прекращается прогрессирование диагноза. Этот период может продлиться от нескольких недель, до нескольких десятков лет.
Нарушение дыхательной функции наиболее опасное проявление атрофии мускулатуры.
Со стороны психики и умственного развития нарушения не выявляются.
IV тип
Первые признаки и симптомы появляются в 30-50 лет. Основными жалобами является слабость мышц, тремор. Из-за атрофии появляются контрактуры в области суставов, с ограничением их подвижности. Больные резко худеют.
Часто сопровождается искривлением позвоночника и деформацией грудной клетки.
Первыми в процесс вовлекаются мышцы ног, после постепенно вовлекаются руки. Как правило, дыхательная и глотательная функция не нарушена.
Большинство пациентов самостоятельно ходят, но хромают, испытывают боль и дискомфорт. В редких случаях прогрессирование амиотрофии приводит к потере способности ходить, и больные вынуждены передвигаться на инвалидной коляске.
Диагностика
Основным методом диагностики является генетическое исследование. Для проведения тестирования используют кровь. В некоторых случаях для подтверждения диагноза проводят биопсию пораженных тканей.
Для определения тяжести болезни, объема поражений и нарушения функционирования мышечной системы проводят электромиографию.
Также обследовать необходимо и других близких родственников пациента.
Важно! Для пренатальной диагностики исследуют околоплодные воды. Такой метод применяется только при наличии симптомов и генетической предрасположенности у родителей.
Методы лечения
Генетическое заболевание является неизлечимым и практически не поддается коррекции. При прогрессирующем течении практически невозможно предотвратить и остановить мышечную атрофию. Несмотря на развитие генной инженерии, ученым не удалось создать лекарство, способное устранить генетический сбой.
Лечение направлено на поддерживание жизненно важных функций организма, облегчение состояния больного и предотвращение деформации скелета. Для этого применяют следующие методы:
- искусственная вентиляция легких – показана при дыхательной недостаточности;
- физиопроцедуры – массаж, ЛФК, электрофорез, лечебные ванны и другие;
- ношение корсета и других ортопедических приспособлений;
- витаминотерапия;
- применение ноотропов и препаратов, улучшающих питание нервной ткани: актовегин, трентал, церебролизин и другие.
Паллиативная терапия направлена на облегчение состояние тяжелобольных пациентов.
Ученые всего мира пытаются создать препарат для лечения патологии. Известно, что уже разработано несколько препаратов, которые возможно сумеют помочь пациентам. Они находятся на стадии клинических испытаний и их эффективность и безопасность для организма только изучается.
Родителям детей с тяжелым, неподдающимся лечению, диагнозом, для рождения здорового ребенка необходимо планировать беременность с репродуктологом. Искусственное оплодотворение, использование донорской спермы или яйцеклетки, экстракорпоральное оплодотворение – одни из способов родить здорового ребенка носителям дефектного гена.
Прогноз: сколько живут пациенты?
Спинальная амиотрофия крайне тяжелое заболевание, которое существенно ухудшает качество жизни больных и является одной из причин младенческой смерти. Пациенты с таким диагнозом являются инвалидами и зачастую не в силах самостоятельно себя обслуживать.
Многие пациенты не могут ходить и стоять, передвигаясь с помощью инвалидной коляски. При поражении рук больные не способны делать элементарных вещей: есть, держать небольшие предметы, читать, умываться и прочее. Они нуждаются в дополнительном уходе и постоянном медицинском наблюдении. При тяжелом течении они дышать лишь с помощью аппарата ИВЛ и питаются через зонд.
Продолжительность жизни во многом зависит от формы заболевания. Наиболее тяжелой является амиотрофия Верднига, при которой больные дети редко достигают 4 лет. Пациенты со вторым типом болезни редко доживают до совершеннолетия. Наиболее благополучным являются второй и третий тип болезни, при которых пациенты достигают зрелого возраста.
В настоящее время спинальная амиотрофия относится к неизлечимым заболеваниям, часто приводит к летальному исходу.
Читайте также:


