Опухоли головы и шеи клиническое руководство
К опухолям головы и шеи относят онкологические заболевания носа, рта, гортани, глотки, слюнных желез, придаточных пазух. Опухоли эндокринной, лимфатической, центральной нервной системы и глаз в эту группу не входят.
Доля опухолевых образований области головы и шеи составляет около 20% онкологической заболеваемости. Часто эти опухоли оказываются очень агрессивны: они быстро растут, дают множественные метастазы и с трудом поддаются лечению. Для того, чтобы успешно справляться с опухолями головы и шеи, онкологи взаимодействуют с узкими специалистами, в частности, с отоларингологами, стоматологами и дерматологами.

По расположению различают опухоли губ, слизистой оболочки и полости рта, языка, слюнных желез, глотки, гортани, носа, околоносовых пазух.
Опухоли головы и шеи могут иметь соединительнотканное, эпителиальное, нейрогенное происхождение. По степени зрелости клеток среди них выделяют высокодифференцированные и незрелые, последние хуже поддаются лечению и ухудшают общий прогноз.
Спровоцировать развитие опухолей головы и шеи могут различные причины. Вот лишь некоторые из них:
- злоупотребление алкоголем;
- курение и нюхательно-жевательный табак;
- употребление спиртосодержащих жидкостей для ополаскивания полости рта;
- некоторые вирусы (вирус Эпштейна-Барр, вирус папилломы человека и др.);
- профессиональные вредности (контакт с древесной и текстильной пылью, сажей, краской, металлом и др.);
- радиоактивное излучение;
- регулярное употребление слишком горячей пищи.
Чаще всего новообразования головы и шеи возникают у пациентов в возрасте старше 50 лет. Клинические проявления опухолей данной группы в зависимости от расположения и стадии могут быть очень разнообразными.
Рак губы
До 95% случаев рака губы встречается у мужчин, типичным местом локализации опухоли является нижняя губа. С точки зрения гистологии, злокачественные опухоли губы обычно представляют собой плоскоклеточный рак. Ему чаще всего предшествуют предраковые состояния — хронические трещины, ограниченный гиперкератоз, бородавчатый предрак и др.
Для рака губы на разных стадиях развития характерны местные изменения в виде вдавления или болезненной эрозии, покрытой корочками. Со временем рак губы захватывает все большую площадь и может изъязвляться. Благодаря особенностям расположения рак губы легко распознается на ранних стадиях, поэтому хорошо поддается лечению.
Рак полости рта
До 50% злокачественных опухолей полости рта приходится на рак языка, еще 20% случаев составляет рак дна ротовой полости. Опухоль часто развивается на месте лейкоплакии (характерных роговых пластинок), гиперкератической красной волчанки или красного плоского лишая.
Внешне рак полости рта может иметь вид язвы или инфильтрата (уплотнения). В ряде случаев опухоль выступает над поверхностью слизистой. По строению ткани среди онкологических заболеваний полости рта преобладает плоскоклеточный рак, реже встречается аденокарцинома. Для рака полости рта характерно быстрое и незаметное прорастание в здоровые окружающие ткани и метастазирование в региональные лимфоузлы.
Уже на ранних стадиях рака ротовой полости пациентов беспокоят боль и неприятные ощущения, позднее присоединяются затруднения при глотании и разговоре, припухлость, язвочки, кровотечения из ротовой полости. По мере роста опухоли все симптомы усиливаются, что и становится поводом для обращения к врачу.
Рак слюнных желез
В структуре злокачественных опухолей головы и шеи рак слюнных желез составляет 3–5%. Преимущественно поражаются крупные околоушные железы, а опухоли малых слюнных желез в основном локализуются на нёбе. В слюнных железах можно обнаружить следующие формы:
- мукоэпидермоидный рак;
- ацинозно-клеточный рак;
- цилиндрома;
- аденокарцинома.
Рак слюнных желез дает метастазы в близлежащие лимфатические узлы, иногда — в легкие и кости. Клинически он протекает безболезненно, при осмотре можно обнаружить лишь уплотнение. При прорастании в соседние ткани рак слюнных желез вызывает парез лицевого нерва.
Рак гортани и глотки
Рак гортани в структуре всех злокачественных опухолей составляет около 2%. Наиболее частые его морфологические варианты- плоскоклеточный рак и аденокарцинома. Опухоль может прорастать в стенки органа или имеет вид бугристых разрастаний на широком основании. Рак верхнего отдела гортани считается очень опасным, при поражении голосовых связок прогноз благоприятнее, так как опухоль в этом случае растет медленнее и редко дает метастазы.
Пациенты с раком гортани долгое время жалуются на першение в горле, ощущение инородного тела. При поражении надгортанника рано появляются боли при глотании, если опухоль возникла в области голосовых связок, у больного может наблюдаться охриплость голоса вплоть до полного его исчезновения.
На рак глотки приходится до 12% опухолей головы и шеи. Для него характерны ранние метастазы в лимфоузлы. Рак гортани развивается в труднодоступном для обозрения месте, часто без каких-либо симптомов, поэтому, как правило, обнаруживается на поздних стадиях, когда у пациента уже затрудняется носовое дыхание, ухудшается слух, появляется гнусавость голоса.
Диагностика и лечение
Многие опухоли головы и шеи можно обнаружить при простом осмотре. Если поражается носовая полость, пазухи, гортань или глотка, для осмотра используют специальные инструменты с зеркалами, а также эндоскопическое оборудование. При пальпации можно обнаружить увеличенные лимфатические узлы, а также саму опухоль в виде уплотнения, подвижного или спаянного с соседними тканями.
Новообразования мягких тканей, околоушных слюнных желез легко обнаружить при помощи ультразвукового исследования. Большую роль в детализации строения опухолей головы и шеи играют рентгенологические методы исследования — компьютерная и магнитно-резонансная томография. Окончательный диагноз позволяет установить биопсия ткани опухоли и ее гистологическое изучение.

Радикальный способ лечения опухолей головы и шеи — хирургическое удаление новообразования и региональных лимфатических узлов. Для опухолей первой стадии бывает достаточно только операции, на второй стадии хирургическое лечение комбинируют с радиологическим. Иногда курс лучевой терапии назначают перед оперативным вмешательством для уменьшения размеров опухоли и предупреждения появления метастазов. Облучению в обязательном порядке подвергаются также расположенные в непосредственной близости от опухоли лимфатические узлы.
При раннем обнаружении опухоли в носовой полости, синусах, глотке применяют эндоскопический доступ, если образование небольшое, ограничено капсулой и находится на поверхности слизистой, может быть использована крио- или лазерная деструкция,фотодинамическая терапия. Это наиболее щадящие способы лечения. После удаления опухоли из-за особенностей ее расположения и функционирования пациентам часто необходима пластика в области шеи и лица.
Комбинацию лучевой и химиотерапии применяют с паллиативной целью, когда опухоль невозможно удалить полностью.

Заболеваемость
В 2002 году заболеваемость плоскоклеточным раком головы и шеи (МКБ-10 C00–C10, C12–C14, C32) в странах Европы составила 36 случаев на 100 тыс. чел. в год среди мужчин и 7 случаев на 100 тыс. чел. в год среди женщин, а смертность 18 и 3 на 100 тыс. чел. в год, соответственно. По Европейским данным ежегодно регистрируется 139000 новых случаев плоскоклеточного рака головы и шеи. Более 90% всех злокачественных новообразований головы и шеи относятся к плоскоклеточному раку.
В Европе относительная выживаемость для плоскоклеточного рака головы и шеи составила 72% (1-летняя) и 42% (5-летняя выживаемость) у взрослых. 5-летняя выживаемость у женщин выше (51%), чем у мужчин (39%). На выживаемость значительное влияние оказывает возраст. Для более молодой возрастной группы (15-45 лет) 5-летняя выживаемость составила 54%, тогда как в группе пожилого возраста (.75 лет) 35%.
Диагноз
Гистологический диагноз должен быть установлен на основе биопсийного материала в соответствии с классификацией ВОЗ.
Стадирование должно быть основано на физикальном осмотре, РГ ОГК, эндоскопическом исследовании органов головы и шеи, компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) головы и шеи. МРТ более предпочтительна для любой локализации опухоли, кроме гортани и гортаноглотки. КТ ОГК может быть выполнена для выявления метастатического поражения легких или второй опухоли. Применение позитронно-эмиссионной томографии (ПЭТ) с использованием 2-[18F]фтор-2-дезокси-Д-клюкозы или ПЭТ-КТ в целях стадирования изучается. В целом специфичность ПЭТ ниже, чем чувствительность, поэтому этот метод может быть более информативен для выявления метастазов или синхронных опухолей, чем для выявления пораженных лимфоузлов на шее. Стадирование плоскоклеточного рака головы и шеи должно производиться согласно TNM классификации, а группировка по стадиям в соответствии с таблицей №1. По данным 7-го издания классификации AJCC, опухоли Т4 стадии делятся на Т4а (операбельные) и Т4b (неоперабельные). IV стадия подразделяется соответственно на IVa и IVb, а также IVc (при наличии отдаленных метастазов).
Современная оценка факторов риска должна быть основана на тех же принципах, что и для рака ротоглотки (связь заболевания с вирусом папилломы человека (HPV), курением).
Классификация TNM для плоскоклеточного рака головы и шеи (TNM, седьмое издание 2009).
Стадия I T1N0M0
Стадия II T2N0M0
Стадия III T3N0M0 T1-3N1M0
Стадия IVA T1-3N2M0 T4aN0-2M0
Стадия IVB T4bNлюбаяM0 TлюбаяN3M0
Стадия IVC TлюбаяNлюбая M1
Лечение
Во всех случаях должен быть использован мультидисциплинарный лечебный подход. Диета пациента должна быть должным образом скорректирована и соблюдена. Перед проведением лучевой терапии пациенты должны быть осмотрены стоматологом и при необходимости получить соответствующее лечение.
Лечение зависит от локализации первичной опухоли и ее распространенности. Плоскоклеточный рак придаточных пазух носа и носоглотки встречается редко, поэтому пациентов с такими локализациями обычно не включают в клинические исследования, по результатам которых разрабатываются рекомендации, основанные на принципах доказательной медицины. Таким образом, эти локализации не включены в данные клинические рекомендации. При ранних стадиях заболевания (I-II стадии) хирургическое лечение и дистанционная лучевая терапия (или брахитерапия) одинаково эффективны с точки зрения локорегионарного контроля заболевания. Однако данный вывод основывается только на результатах ретроспективных клинических исследований, поскольку рандомизированных исследований, посвященных этому вопросу, не проводилось. Современная лучевая терапия должна проводиться в трехмерном конформном режиме или с модулируемой интенсивностью.
Стандартным подходом лечения местнораспространенных операбельных опухолей (III и IV стадии) является хирургическое лечение с реконструкцией и последующей лучевой (ЛТ) или химиолучевой терапией (ХЛТ) с включением производных платины в монорежиме (для пациентов из группы высокого риска: прорастание капсулы лимфоузла или наличие опухолевых клеток по краю резекции) [I,A]. Однако для операбельных пациентов, хирургическое лечение которых, может привести к значительному ухудшению качества жизни и/или при неблагоприятном прогнозе, калечащие операции не оправданы, таким пациентам рекомендовано проведение одновременной ХЛТ.
Одновременная ХЛТ является стандартом лечения пациентов с неоперабельными опухолями [I,A]. Лучевая терапия, проводимая одновременно с цетуксимабом, продемонстрировала более высокую частоту ответа, безрецидивную и общую выживаемость по сравнению с лучевой терапией [II, B]. Прямого сравнения эффективности комбинации ЛТ с цисплатином или цетуксимабом не проводилось, что осложняет принятие решения в пользу того или иного подхода. С другой стороны следует помнить о том, что результаты одновременной ХЛТ основаны на большом числе пролеченных пациентов (тысячи), это лечение токсично и эго эффективность у пожилых пациентов сомнительна. С другой стороны эффективность комбинации ЛТ с цетуксимабом была оценена на небольшом числе пациентов (двести), эффективность была похожей или более высокой, чем для одновременной ХЛТ. Комбинация с цетуксимабом была менее токсичной, однако, ее эффективность у пожилых пациентов также под вопросом.
Роль индукционной терапии была пересмотрена, поскольку комбинация на основе таксанов и производных платины (TPF) продемонстрировала более высокую эффективность в лечении местно-распространенного рака по сравнению с комбинацией платины и фторурацила (PF) [I, A]. Однако, в настоящее время, индукционная химиотерапия не считается стандартным подходом в лечении местно-распространенного рака. Индукционная химиотерапия с последующей ХЛТ (так называемая последовательная ХЛТ) все еще изучается. Токсичность данного метода может быть значительной, что негативно отражается на результатах лечения.
Индукционная химиотерапия по схеме TPF с последующей лучевой терапий может быть вариантом органосохранного лечения местнораспространенного рака гортани или гортаноглотки у пациентов, ответивших на лечение, в противном случае выполняется ларингоэктомии [II, A]. Другой вариант лечения ― это ХЛТ. По данным одного рандомизированного исследования одновременная ХЛТ позволяет добиться более высокой частоты сохранения гортани в течение первых двух лет после окончания лечения, не влияя при этом на выживаемость, по сравнению с индукционной ХТ + ЛТ (у пациентов, ответивших на лечение) или только ЛТ [II A].
Выбор органосохранного лечения, на основе индукционной ХТ или одновременной ХЛТ зависит от различных факторов (анатомическая локализация, предполагаемая комплаентность пациента/переносимость лечения, соматический статус и др.). Кроме того, не каждому пациенту может быть проведено органосохранное лечение. Пациентам с массивной опухолью, распространяющейся на хрящи гортани, такое лечение не показано. Оба варианта лечения (на основе индукционной ХТ или одновременной ХЛТ) не оказывают негативного влияния на безрецидивную и общую выживаемость, поскольку в случае неэффективности возможно проведение хирургического вмешательства по жизненным показаниям [II, A]. Не смотря на это, у пациентов подвергнутых комбинированным методам лечения, отмечено снижение частоты отдаленного метастазирования.
Локо-региональный рецидив и отдаленные метастазы
В отдельных случаях при локализованных рецидивах могут быть рассмотрены хирургический подход (при операбельной опухоли) или повторная лучевая терапия. Для большинства больных стандартным методом является паллиативная химиотерапия. Пациентам с хорошим соматическим статусом в качестве первой линии терапии может быть рекомендована комбинация цетуксимаба с цисплатином или карбоплатином + 5-ФУ, которая продемонстрировала увеличение продолжительности жизни, по сравнению с PF [II, A]. Пациентам, которые не смогут перенести полихимиотерапию, может быть проведена монохимиотерапия.
Стандартным может считаться еженедельное введение метотрексата [I, А]. Поскольку не было проведено прямого сравнения эффективности метотрексата и таксанов в монотерапии, сложно утверждать о целесообразности применения последнего в монорежиме. Цетуксимаб менее токсичен, а его активность сравнима с метотрексатом.
Наблюдение
Ответ на лечение должен оцениваться путем клинического обследования и применением КТ или МРТ области головы и шеи в зависимости от метода, который применялся до лечения.
Оценка ответа на ЛТ или одновременную ХЛТ может быть выполнена при помощи ФДГ-ПЭТ (или ПЭТ-КГ), на основании которых можно решить вопрос о целесообразности шейной лимфодиссекции.
Цель наблюдения ― раннее выявление потенциально курабельных локорегиональных рецидивов и вторых опухолей. Физикальное обследование с радиологическими методами визуализации должны быть выполнены при подозрении на рецидив. При неоднозначных результатах обследования особенно после ХЛТ может быть применен ФДГ-ПЭТ. В таких ситуациях прогностическая ценность отрицательного результата более значима, чем положительного.
В то же время особое внимание должно быть уделено побочным эффектам от лечения, среди которых нарушение глотания и дыхания. Ежегодно должно проводиться рентгеновское исследование органов грудной клетки. Через 1, 2 и 5 лет после облучения шеи рекомендуется оценивать функцию щитовидной железы (уровень сывороточного ТТГ).
Заболевание развивается, когда опухоль локализуется на слизистой оболочке альвеолярного отростка или мягких тканях дна полости рта c переходом на кость.
Эпидемиология
Частота поражения мягких тканей дна полости рта составляет 20% и слизистой альвеолярного отростка нижней челюсти 4% от всех злокачественных новообразований полости рта. Мужчины болеют в 5-7 раз чаще чем женщины. Большинство случаев встречается в возрасте 50-70 лет.
Факторы риска
Курение повышает риск заболеть раком полости рта в несколько раз. Причем в равной степени, опасно курение сигарет, сигар и трубок. Степень риска зависит от стажа курения, возраста курильщика и количества выкуриваемых сигарет. Повышает риск употребление крепких алкогольных напитков.
Большую роль играет неудовлетворительная гигиена полости рта. Кариозные зубы и плохо изготовленные протезы травмируют слизистую оболочку полости рта, что повышает вероятность развития предрака и рака полости рта.
К факторам риска также относят такие предраковые заболевания, как болезнь Боуэна, эритроплазия Кейра, язвенная лейкоплакия, паппилломатоз.
Классификация МКБ – 10:
С03.1 – нижний альвеолярный отросток и десна
С04 – дно полости рта


Клиническая картина
Часто больные обращаются к врачу, когда опухоль уже достигает больших размеров, отмечается распад новообразования, зловонный запах изо рта, кровотечение. Их также могут беспокоить припухлости или язвы во рту, расшатывание и выпадение зубов, кровоточивость слизистой оболочки полости рта. Позднее присоединяются жалобы на затрудненное открывание рта, трудность или невозможность приема пищи, обилие слюны, похудание.
Диагностика
- Тщательный клинический и инструментальный осмотр полости рта, пальпация.
- Соскоб, мазки с эрозированных или язвенных поверхностей для цитологического исследования.
- Цитологическое исследование пунктата неизъязвленных опухолей и увеличенных лимфоузлов (рис. 1).
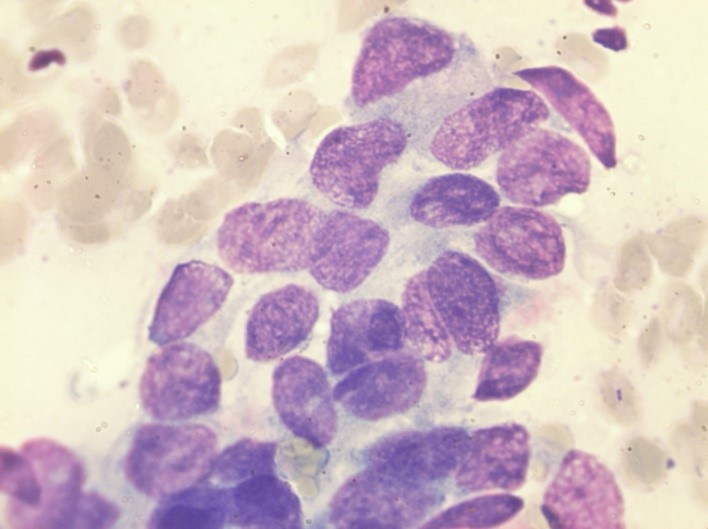
Рис.1 Цитологическое исследование
- Биопсия опухоли, гистологическое исследование (рис.2).
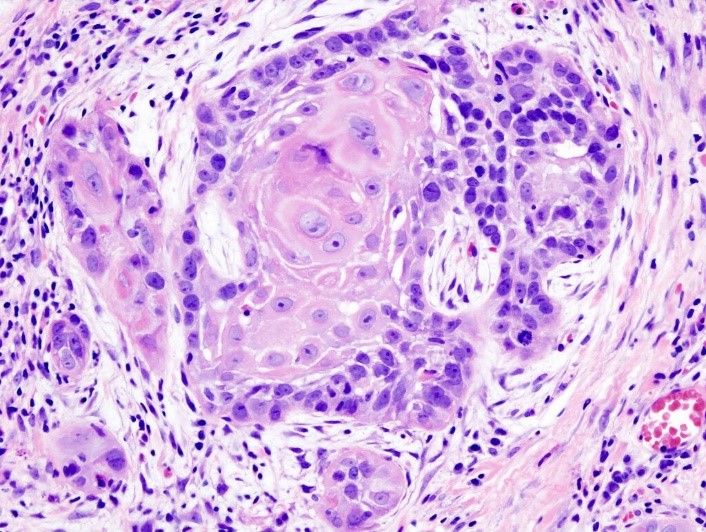
Рис.2 Гистологическое исследование. Плоскоклеточный рак
- рентгенологическое исследование нижней челюсти.
- УЗИ первичной опухоли при локализации процесса на дне полости рта.
- УЗИ области шеи – для выявления субклиничеких метастазов.
- КТ, МРТ с контрастным усилением или без (по показаниям) (рис.3.).
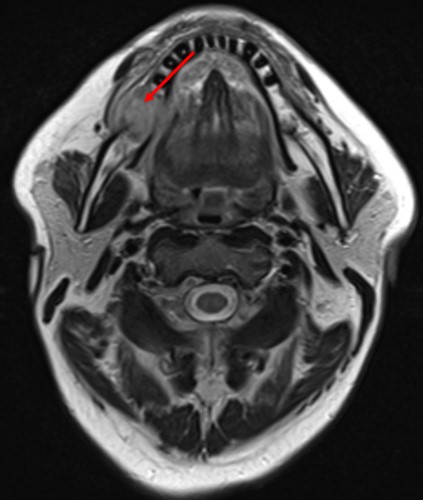
Рис.3 МРТ с внутривенным контрастированием
Тактика лечения
При T1–T2, N0 рекомендуется выполнение оперативного вмешательства с/без шейной лимфодиссекцией (в зависимости от толщины опухоли по данным УЗВТ) или в случае отказа пациента от оперативного вмешательства рекомендована лучевая терапия.
При T3N0, T1-3, N1-3, T4a любое N рекомендуется оперативное лечение с одно- или двухсторонней шейной лимфодиссекцией с последующей лучевой терапией.
Виды реконструкции нижней челюсти:
- пластика кожно-мышечным лоскутом с использованием кивательной мышцы;
- пластика торакодорзальным лоскуктом;
- ромбовидный шейный-лицевой кожно-мышечный лоскут;
- кожно-мышечный лоскут на коротких мышцах шеи;
- кожно-мышечный лоскут на большой подкожной мышцы шеи;
- пластика малоберцовой кости с микрососудистого анастомоза;
- пластика подвздошной костью;
- пластика участком ребра с микрососудистого анастамоза.
Лучевая терапия проводится по радикальной программе.
- PF + Cet: Цисплатин + 5-фторурацил + цетуксимаб
- DС + Cet: Доцетаксел + цисплатин + цетуксимаб
- Pacli+Carbo+Cet: Паклитаксел + карбоплатин AUC + цетуксимаб
- Pacli+Carbo+Cet: Паклитаксел + карбоплатин AUC 2,0 + цетуксимаб
- PF :Цисплатин + 5-фторурацил. Карбоплатин AUC-5 + 5-фторурацил
- Pacli+Carbo: Паклитаксел + карбоплатин AUC-5–6. Паклитаксел + карбоплатин AUC-2
- DС: Доцетаксел + цисплатин
- Ниволумаб
- Пембролизумаб
В первый год физикальный осмотр и сбор жалоб рекомендуется проводить каждые 1-3 месяца, во второй год – каждые 2-6 месяцев, спустя 3-5 лет – 1 раз в 4-8 месяцев. Через 5 лет с момента операции обследования проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы по теме:
- Ганцев Ш.Х. онкология – М, 2012 г – С.204-205.
- Опухоли головы и шеи: рук/ А.И. Пачес.- 5-е изд., доп. И перераб.-М.: Практическая медицина , 2013. -478 с.
- Клинические рекомендации Злокачественные новообразования полости рта. 2020г. – 62 с.
- WHO Classification of Head and Neck Tumours-International Agency for Research on Cancer. 2017. – 347 с.
- Shah. Head and Neck Surgery and Oncology 5 ed (2020) – 859 с.

Авторская публикация:
Косачев В.А.
Ординатор отделения опухолей головы и шеи
НМИЦ онкологии им Н.Н. Петрова

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент

- Дмитрий Николаевич, насколько сейчас актуальна проблема злокачественных новообразований головы и шеи?
- Эта тема была актуальна всегда, с самого начала формирования нашей специальности, с 1950-60-х годов. Хирургическая же онкология стала выходцем из общих хирургических специальностей, несколько позднее появилась химиотерапия и лучевая терапия. Во вновь появляющиеся направления приходили новые специалисты.
Онкология головы и шеи это единственная область, которая имеет широкую мультимодальность - в лечении онкологических больных с опухолями этих локализаций принимают участие не только хирурги-онкологи, лучевые терапевты и химиотерапевты, но и нейрохирурги, микрохирурги, офтальмологи и челюстно-лицевые хирурги. В качестве иллюстрации, приведу пример: буквально на прошлой неделе в клинике Московского медико-стоматологического университета мы проводили совместную операцию у пациента с опухолью верхней челюсти. В операционную бригаду кроме меня как хирурга-онколога входил челюстно-лицевой хирург, который осуществлял пластику тех дефектов, которые мы имели, врач-офтальмолог ввиду того, что опухоль затрагивала среды глаза. Врач нейрохирург выполнял свой нейрохирургический этап операции. Все это без учета врача-анестезиолога и прочих стандартных членов хирургической команды. И вот такая мультидисциплинарная бригада позволяет с максимальной эффективностью оказывать помощь нашим пациентам. Отсюда собственно и сложность специальности – она очень и очень многообразна.
- Какова на данный момент ситуация с заболеваемостью? Количество случаев растет?
- Растет статистика по заболеваемости онкологическими заболеваниями в целом, как в России, так и за рубежом. И здесь не все сводится только лишь к тому, что онкология захватывает новые рубежи. Большая доля этих цифр относится на счет роста выявляемости онкологических заболеваний. Это как раз положительный момент современной системы диагностики, профилактической и санитарно-просветительской работы с населением. Люди чаще обращаются к специалистам, улучшаются способы диагностики, выявляемость онкологических заболеваний становится более интенсивной и это тоже дает статистический прирост.
Не то, что бы опухоли становились более агрессивными или частыми. Большой процент в приросте заболеваемости - это случаи более частого выявления.
Для примера рак кожи, особенно базально-клеточный рак, занимает 2-3 место по России среди злокачественных новообразований. Значительная часть из этих случаев локализована в области головы и шеи, но не выделяется в отдельную статистическую группу.
- Возможно ли выделить определенную группу риска развития злокачественных опухолей головы и шей среди населения?
- Опять же этот вопрос требует поправки на широкую палитру диагнозов. По опухолям кожи есть четко определенные группы риска, одна из них люди, подвергающиеся интенсивному ультрафиолетовому облучению. Одним из факторов риска возникновения опухолей орофарингеальной зоны и гортани является курение. Все же сейчас, благодаря эффективной санитарно-просветительской работе, количество курящих прогрессивно уменьшается и мы , онкологи, также отмечаем изменение спектра опухолей, вызываемых данным фактором.
Есть уже не теоретическое, а доказанное вирусное происхождение определенных типов опухолей головы и шеи, в частности рака носо- и ротоглотки, а это большая отдельная группа пациентов. Исходя из знаний о природе появления опухоли, вырабатываются новые тактики лечения для этой группы больных, в основе которых как раз лежит выявление фактора вирусного поражения.
Что касается рака щитовидной железы, Чернобыльская катастрофа дала некоторый прирост этих опухолей. Экологический фактор, безусловно, как и физические факторы воздействия тоже играет свою роль.
Традиционно физическим канцерогенным фактором является ультрафиолетовое излучение, что актуально для рака кожи и меланомы. Для многих опухолей актуально воздействие радиационного излучения. И на сегодняшний день внимание уделяется также электромагнитному излучению, которое в отдельных спектрах может оказывать вредное, в том числе и канцерогенное воздействие.
- Дмитрий Николаевич, вы говорите, что выявляемость опухолей растет, а на какой стадии в основном к вам попадают пациенты?
- Безусловно, хотелось бы выявлять злокачественные опухоли на самых ранних стадиях. На сегодняшний день в основном это зависит от взаимодействий врачей-онкологов с врачами других специальностей, потому что первичное выявления опухолей головы и шеи в меньшей степени относится к врачам-специалистам в этой узкой области. По сути, первоначальные обращения пациентов и выявления опухолей относятся к работе врачей первого контакта. Для опухолей полости рта и ротоглотки это врачи стоматологи. Большую роль в выявлении достаточно широкого спектра опухолей головы и шеи играют врачи-оториноларингологи. Дерматологи диагностируют опухоли кожи, врачи-эндокринологи, например, опухоли щитовидной железы.
И мы проводим активную междисциплинарную работу со всеми этими специалистами. Но средние показатели выявляемости опухолей головы и шеи первой и второй стадии составляют не более 60%. Рак щитовидной железы сейчас неплохо выявляется на ранних стадиях благодаря тому, что люди активно наблюдаются, своевременно выполняются пункции, здесь картина в целом позитивная.
Ситуация, когда все опухоли выявляются , – идеальная. В нашей стране на сегодняшний день по статистике активное выявление опухолей, я не говорю сейчас про опухоли головы и шеи, а в целом про всю онкологию, находится на грани 30-40% и эту цифру хотелось бы увеличить. Активность подразумевает то, что пациент не обращается с жалобами, а опухоль выявляется при профилактических осмотрах, проведении обследований по поводу других заболеваний, варианты могут быть различными. Но все же пока большинство пациентов обращаются к врачам самостоятельно, уже с определенным спектром жалоб, обусловленных развитием опухоли.
Есть определенные критерии, различные симптомы, которые не находят специфического выражения в конкретной болезни, но могут быть индикаторами наличия в организме опухоли. Например, длительное, не связанное ни с чем увеличение температуры тела, появление каких-то выделений в стуле или при мочеиспускании, снижение массы тела, не связанное с фитнесом или диетой. Та же история с неэффективностью привычных лекарственных средств в стандартных ситуациях. Например, если у вас болит голова и применяемый раньше в подобных случаях препарат перестал действовать, то, возможно, причина боли изменилась. На самом деле довольно много маркерных, триггерных точек, которые заставляют насторожиться. Но самое главное это длительное существование какого-то симптома, который не излечивается и который существует относительно продолжительный промежуток времени.
И здесь есть важный момент – некий сформировавшийся миф, который требует развенчания, что рак или злокачественная опухоль не имеют симптомов на ранней стадии. Это не совсем так. Когда мы начинаем беседовать с пациентом, разбирать анамнез его заболевания, большинство отмечает те или иные симптомы, предшествовавшие врачебному приему и постановке диагноза. Проблема в том, что мы не всегда активно посещаем специалистов, отмечая те или иные изменения в самочувствии. Большинство пациентов выжидает или прибегает к народным средствам, самолечению, тем самым отдаляя момент посещения врача. И одна из задач онкологической службы это потерянное время максимально сократить.
- Активное внимание в рекомендациях и руководствах отводится скринингам, какова их роль на практике?
- Это, бесспорно, важный вопрос, которым мы активно занимаемся, в частности, касаясь меланомы и рака щитовидной железы.
Крайне важно из большого числа потенциальных пациентов отбирать именно тех, у которых имеет смысл проводить этот скрининг. Тогда вы суживаете направления исследований до более узкого числа лиц, которым они действительно могут принести большую пользу. Не следует при этом забывать и про экономическую эффективность. Безусловно, важное место в скрининге занимают профосмотры.
- Каковы инновационные подходы к лечению рака головы и шеи?
- Трудно выделить какие-то уникальные разработки именно в сфере онкологии головы и шеи. Мы встроены в общий тренд развития современной онкологии и пользуемся всеми доступными на сегодняшний день новиками.
Если говорить конкретно, за последние 10–15 лет существенно поменялся технический подход к проведению лучевой терапии. Разработаны новые аппараты: кибер-нож, гамма-нож - принципиально новые технические решения, позволяющие делать данный вид терапии более безопасным и эффективным. Расширен спектр диагностических возможностей: современные ультразвуковые аппараты, рентгеновские и магнитные томографы, проведение позитронно-эмиссионой томографии. Различные способы морфологической диагностики, гистохимическое, цитохимическое исследования, которые позволяют улучшить диагностический процесс.
Химиотерапия – это лидер по инновациям среди всех онкологических направлений, разрабатываются новые препараты, большой интерес представляют так называемые таргетные средства целевого направленного действия, которые воздействуют как на определенные измененные участки онкогенов, так и структуры патологических клеток. Эти работы сейчас являются наиболее перспективными.
То, что касается хирургии, то это малоинвазивные вмешательства, реконструктивная хирургия у онкологических больных. То, о чем я говорил в самом начале нашей встречи, - мультимодальные вмешательства, когда присутствуют несколько специалистов. Это то, чем занимаются онкологи сегодня. Но если рассматривать общую концепцию противораковой борьбы, то важное направление это разработка новых способов максимально раннего выявления злокачественных новообразований.
Второй не менее важный аспект это санитарно-просветительская работа. Все это в совокупности приводит к тому, что для лечения начальных стадий опухолей нам может и не потребоваться такого широкого арсенала столь дорогостоящих средств. Лечение станет более компактным экономически и социально более эффективным, пациенты выздоравливают и возвращаются к работе, качество их жизни растет. Этот аспект очень важен, ведь в центре всего для нас находится именно пациент.
Читайте также:


