Consilium medicum боль в спине
Кафедра нервных болезней ММА им. И.М.Сеченова
Б оли в спине занимают ведущее место по количеству дней нетрудоспособности среди работающего населения. Показано, что до 80% людей в течение жизни испытывают боли в пояснично-крестцовой области. В 13,8% случаев длительность таких болей составляет не менее 2 нед в течение предшествующих опросу 6 мес, 17% пациентов страдают хроническими болями, а 11% испытывают социальную дезадаптацию из-за болевого синдрома [7, 15, 17].
Известно, что выраженность дегенеративных изменений позвоночника не коррелирует с клинической картиной, поэтому их наличие не должно определять ни лечебной, ни экспертной тактики. Более того, в подавляющем большинстве случаев отмечается рецидивирующее течение болей в пояснице при постоянной сохранности патологических изменений анатомических структур позвоночника, а отсутствие корреляции болевого синдрома с размером и локализацией межпозвоночной грыжи стало вполне нормальной ситуацией.
Так, по данным магнитно-резонансной томографии (МРТ), у асимптомных обследованных в возрасте от 25 до 39 лет более чем в 35% случаев, а в группе старше 60 лет - в 100% случаев выявлялись протрузии дисков по крайней мере на одном уровне. Асимптомные грыжи дисков, по данным компьютерной томографии, МРТ, миелографии, встречаются в 30-40% случаев [18, 26].
Серьезным препятствием при решении проблемы патофизиологии болей пояснично-крестцовой локализации является невозможность в большинстве случаев точно установить источник болевой импульсации. Отчасти это обусловлено сложностью строения и функционирования структур пояснично-крестцовой области, включающих кости, суставы, связки, жировую ткань, несколько слоев мышц, периферические нервы, нервные корешки, чувствительные и вегетативные ганглии, а также спинной мозг. Каждая из этих структур отвечает на повреждение единственным в своем роде способом реагирования на травму - выбросом биохимически и иммунологически активных медиаторов, стимулирующих чувствительные рецепторы. Это в свою очередь запускает очень сложные и еще не до конца изученные нейрофизиологические механизмы формирования ощущения боли.
Наиболее распространенной причиной формирования болевого синдрома в нижней части спины является остеоартроз (ОА) фасеточных суставов позвоночника, обусловливающий болевую афферентацию с последующим рефлекторным вовлечением мышц.
ОА рассматривается как группа заболеваний, имеющих разную этиологию, но приводящих к однотипному биологическому, морфологическому и клиническому исходу. ОА - самое распространенное дегенеративное заболевание суставов, в основе которого лежит поражение гиалинового хряща и субхондральных отделов костей, хотя гипертрофии подвергаются и все остальные ткани внутри и вокруг пораженных суставов. Обычно первые, клинически асимптомные изменения появляются после 20 или 30 лет, а к 70-летнему возрасту они отмечаются практически у всех. В 40 лет те или иные патологические изменения в опорных суставах имеются почти у каждого, хотя клинические симптомы отмечаются лишь у немногих. Заболеванию одинаково подвержены и мужчины, и женщины, но у мужчин оно начинается раньше. Несмотря на то что ОА - собирательное понятие, общие патофизиологические, морфологические и клинические проявления ОА, его гетерогенность позволяют различать первичный (идиопатический) ОА, т.е. проявления естественного биологического старения, и вторичный (когда известен причинный фактор). Первичный ОА развивается в периферических суставах, особенно часто в дистальных и проксимальных межфаланговых суставах кистей, I запястном, I плюснефаланговом, тазобедренном и коленном суставах, межпозвоночных дисках и суставах позвоночника, особенно шейного и поясничного отделов. Вторичный ОА вызывают многие факторы, например любые причины, приводящие к изменениям в микроокружении хондроцитов, а также процессы на уровне клеток и тканей, которые формируют "общий конечный путь" развития болезни. К этим факторам относятся врожденные аномалии суставов, генетические дефекты, инфекционные, метаболические, эндокринные и неврологические заболевания; любой патологический процесс, ведущий к повреждению нормальной структуры и функции гиалинового хряща (ревматоидный артрит, подагра, хондрокальциноз и т.д.); острые и хронические травмы (включая переломы) или окружающих сустав тканей (например, длительная перегрузка сустава или группы суставов у лиц некоторых профессий - работников литейного производства, угольных шахт, водителей автобусов).
Клинические проявления ОА начинаются незаметно и постепенно как невоспалительное заболевание, обычно поражающее только один или небольшое число суставов. Самый ранний симптом - боль, обычно усиливающаяся при нагрузке на суставы. Отмечается также утренняя скованность после периода покоя, но она длится недолго (не более 15-30 мин) и ослабевает в результате движений. По мере прогрессирования болезни объем движений постепенно уменьшается, развиваются сгибательные контрактуры, возникает болезненность, а иногда крепитация или ощущение трения в суставе. Весьма характерно увеличение пораженного сустава, вызываемое пролиферативными реакциями со стороны хряща, кости, сухожилий, связок и капсулы, а также синовиальной оболочки, в которых со временем появляются признаки хронического воспаления. По мере растяжения связок нарастает нестабильность сустава и усиливается локальная боль, обусловленная раздражением рецепторов растянутой суставной капсулой, фомируется состояние гипералгезии.
Гипералгезия является усиленным ответом на нормальный болевой стимул и состоит из двух компонентов: первичной и вторичной. Первичная гипералгезия связана с местом повреждения тканей и возникает первично (в основном) от сенситизированных ноцицепторов. Ноцицепторы становятся чувствительными за счет веществ, высвобождающихся в месте повреждения. Эти вещества, включающие моноамины (серотонин и гистамин), нейроактивные пептиды (вещество Р и кальцитонин-ген-родственный пептид), кинины и брадикинины, продукты метаболизма арахидоновой кислоты (простагландины и лейкотриены), цитокины и др. Имеется также категория ноцицепторов, называемых "спящими" или "молчащими", которые в норме неактивны, но становятся активными после тканевого повреждения (под влиянием эндогенных субстанций, связанных с повреждением). Вследствие тканевого повреждения афферентный вход в спинной мозг значимо возрастает, что ведет к развитию вторичной гипералгезии.
В центральной нервной системе увеличившийся афферентный вход от сенситизированных ноцицепторов и вновь активированных "молчащих" афферентов обусловливает увеличение высвобождения нейроактивных активирующих аминокислот и пептидов в задних рогах спинного мозга. Вследствие этого возбудимость центральных нейронов второго порядка увеличивается, происходит расширение зоны периферической ткани, из которой может продуцироваться боль (вторичная гипералгезия). Физиологически нормальная или подпороговая афферентация от кожной поверхности, соответствующей проекции повреждения, становится болевой из-за увеличения возбудимости центральных нейронов (аллодиния). Это изменение центральной возбудимости относят к понятию "центральная сенситизация" и рассматривают как принципиально ответственную за развитие вторичной гипералгезии.
Результаты катамнестического опроса

Динамика оцениваемых показателей в процессе курсового лечения
Ноцицептивная афферентация при болях, обусловленных поражением суставов позвоночника, осуществляется в результате выброса альгогенных соединений (ионы водорода и калия, серотонин, гистамин, простагландины, брадикинин, субстанция Р) в межклеточную жидкость, окружающую ноцицепторы. Эти вещества играют ключевую роль в формировании боли, обусловленной повреждением, ишемией и воспалением. Кроме прямого возбуждающего действия на мембраны ноцицепторов, имеется непрямой механизм, связанный с нарушением локальной микроциркуляции. Повышенная проницаемость капилляров способствует экстравазации таких активных веществ, как кинины плазмы и серотонин, что в свою очередь нарушает физиологическую и химическую среду вокруг ноцицепторов и усиливает их возбуждение. Продолжающийся выброс медиаторов воспаления может вызывать длительную импульсацию с развитием сенситизации ноцицептивных нейронов и формированием "вторичной гипералгезии" поврежденной ткани, способствующей хронизации патологического процесса [5].
Повышение чувствительности первичного ноцицептора в пораженной периферической ткани приводит к повышению активности нейронов, посылающих импульсацию в спинной мозг и ЦНС, однако необходимо подчеркнуть, что в очаге воспаления может генерироваться спонтанная электрическая активность, обусловливающая стойкий болевой синдром. Таким мощным индуктором болевой чувствительности являются провоспалительные компоненты - брадикины, гистамин, нейрокинины, оксид азота, которые обычно обнаруживаются в очаге воспаления. Простагландины (ПГ) сами по себе не являются модераторами боли, они лишь повышают чувствительность ноцицепторов к различным стимулам, а их накопление коррелирует с развитием интенсивности воспаления и гипералгезией. Простагландины как бы опосредуют вовлечение "спящих" ноцицепторов в процесс формирования вторичной воспалительной гипералгезии и периферической сенситизации. После того как было установлено значение циклооксигеназы-2 (ЦОГ-2) в каскаде превращения арахидоновой кислоты в провоспалительные ПГ, интерес к ее роли в развитии болевого стимула и снижении боли при подавлении ЦОГ-2 существенно возрос. Исследования показали, что активность ЦОГ-2 в развитии гипералгезий, действительно, играет большую роль. ЦОГ-2 может индуцироваться и в спинном мозге после развития периферического воспаления, а ее селективные ингибиторы, непосредственно воздействующие на поясничный отдел спинного мозга, прекращают воспалительную гипералгезию. При воспалительной реакции на периферии в спинно-мозговой жидкости повышается уровень ПГ, которые проявляют чрезвычайную чувствительность к ингибиции ЦОГ-2 [5].
Совокупность этих процессов с клинической точки зрения можно представить как синдромы компрессионного поражения пояснично-крестцовых корешков и рефлекторные: миофасциальные, мышечно-тонические, поражение связочного и суставного аппарата позвоночника [3, 8, 9].
Наиболее часто в клинической практике встречаются рефлекторные болевые синдромы [4]. Особенностью болевых синдромов поясничного отдела позвоночника является сочетание рефлекторных мышечно-тонических и миофасциальных синдромов с изменениями в эмоциональной сфере, которые способствуют хронизации состояния.
Подходы к лечению люмбоишиалгического синдрома включают перечень препаратов от простых или комбинированных анальгетиков до оперативного вмешательства. Препаратами первого ряда в этом перечне являются нестероидные противовоспалительные препараты (НПВП) [18, 23].
НПВП представляют собой гетерогенную группу, в которую входит не менее ста веществ, относящихся к нескольким основным химическим группам (производные салициловой, индоловой, пропионовой, гетероарилуксусной, энолиоковой кислот). К сожалению, "химическая" классификация мало полезна для прогнозирования как клинической эффективности, так и выраженности различных побочных эффектов препаратов. Исследования в области синтеза новых НПВП связаны именно с неудовлетворенностью критерием отношения "риск/польза" при их использовании. В целом доля пациентов, у которых отмечаются побочные эффекты, достигает 25%, в то время как у 5% пациентов могут развиться опасные для жизни осложнения [6]. Закономерность их появления обусловлена механизмом действия НПВП. Механизм действия НПВП состоит в ингибировании ЦОГ - ключевого фермента в каскаде метаболизма арахидоновой кислоты, которая является предшественником ПГ, простациклинов и тромбоксанов [13]. В настоящее время выделены два изофермента ЦОГ. ЦОГ-1 является структурным ферментом, постоянно присутствующим в большинстве тканей, участвующим в регуляции многих физиологических процессов [6]. ЦОГ-2 в норме в большинстве тканей не присутствует, ее экспрессия увеличивается на фоне воспаления и приводит к повышению уровня провоспалительных субстанций (ПГ групп F и I). Именно ингибирование ЦОГ-2 рассматривается как один из важнейших механизмов противовоспалительной, анальгетической активности, а ингибирование ЦОГ-1 - как механизм развития большинства побочных эффектов [6]. Кроме того, имеются экспериментальные данные, свидетельствующие о том, что ЦОГ-2 ингибиторы обладают центральным действием, проявляющимся подавлением развития центральной сенситизации [24].
В настоящее время единственным доступным селективным ЦОГ-2-ингибитором в инъекционной форме является мелоксикам. Результаты его клинического применения свидетельствуют о достаточно низкой частоте развития побочных гастроэнтерологических осложнений [16] и достаточной эффективности при лечении люмбоишиалгического синдрома [1, 12, 14].
Исходя из известных данных, нами было проведено двухэтапное исследование эффективности мелоксикама (препарат Мовалис) при хронических рецидивирующих болях в спине на фоне ОА. Первый этап включал анализ результатов ступенчатого курсового лечения (инъекции и последующий оральный прием 15 мг мелоксикама), второй - анализ интенсивности, частоты и длительности болевого синдрома в течение последующих 2 лет.
Исследование проводилось в пяти российских регионах. Были обследованы 767 пациентов в возрасте 49,0±13,5 года (из них 57,4% - женщины и 42,6% - мужчины). В исследование не включались пациенты, имеющие повышенную чувствительность к препаратам из группы НПВП, язвенную болезнь в стадии обострения, почечную или печеночную недостаточность, беременность или кормление грудью, нарушения гемостаза или получавшие антикоагулянты.
В результате обследования у 571 пациента (74,4%) выявлена люмбоишиалгия (доминирование мышечно-суставного синдрома), у 193 пациентов (25,2%) - радикулопатия (чувствительные расстройства корешкового типа, мышечная слабость, изменение рефлексов), у 3 пациентов (0,4%) - другая патология, при которой наблюдался люмбоишиалгический синдром. Средняя длительность заболевания составила 45,2±75,3 мес, средняя длительность обострения - 1,0±1,5 мес.
Структура исследования включала оценку исходного состояния пациентов по показателям: спонтанная боль, боль при движении, степень ограничения двигательной функции (каждый показатель оценивался по 10-балльной шкале). В соответствии с протоколом исследования оценка тех же показателей проводилась через 1 ч после 1-й внутримышечной инъекции 15 мг мелоксикама (1-й визит) и 3-й инъекции препарата (2-й визит), которые делались в течение 3 дней. Эти же показатели оценивались в конце 2-й или 3-4-й недели перорального применения препарата в дозе 15 мг (3-й визит). Конкретный срок лечения при оральном применении препарата определялся на основании клинических критериев, исходя из желания достичь максимального эффекта у каждого конкретного пациента. Полученные изменения регистрируемых показателей фиксировались в протоколе, в котором отражались также анамнестические данные, характеристики физикального обследования и затем обрабатывались статистически.
Больным также проводились мануальная терапия, постизометрическая релаксация, вакуумный и ручной массаж, лечебная физкультура, блокады триггерных зон с местными анестетиками.
Целесообразность контрольной группы нивелировалась предшествующим опытом применения НПВП. Из 767 обследованных пациентов 361 (47%) принимал ранее НПВП, прием которых был прекращен по одной из следующих причин: 8,3% пациентов отмечали наличие побочных явлений, 35,5% - отсутствие ожидаемого эффекта, 5,7% указывали другие причины, в том числе финансовые.
Результаты исследования представлены в таблице.
На фоне курсового лечения хотя бы одно побочное явление отмечалось у 4,7% пациентов (36 человек). Их появление в ряде случаев носило характер субъективных ощущений, что прямым образом связать с проводимой терапией не представлялось возможным.
Результаты эффективности лечения подвергались оценке как со стороны исследователей, так и со стороны пациентов. Исследовательской группой эффективность лечения мелоксикамом была оценена как очень хорошая в 41% случаев, хорошая - 50,6%, удовлетворительная - 6,7% и плохая - 1,7%. При оценке эффективности лечения пациентами рубрика "очень хорошая" не использовалась. Как хороший эффект лечения оценили 78% пациентов, удовлетворительный - 20,5%, неудовлетворительный - 1,5%.
На втором этапе в исследовании приняли участие 362 пациента, средний возраст которых составил 51,5±14,3 года, такого же полового состава. С диагнозом люмбоишиалгия - 88,4%, радикулопатия - 11,6%.
Результаты опроса пациентов (см. рисунок) показали, что частота, длительность и интенсивность болевого синдрома в последующие 2 года после курса лечения мелоксикамом (повторный курс провел 31 пациент) снизились в среднем на 50%, независимо от клинического доминирования люмбоишиалгического синдрома или радикулопатии.
Подобный отдаленный результат можно было бы объяснить существованием механизмов воздействия ЦОГ-2-ингибиторов на механизмы болевой памяти, что подтверждено пока только в экспериментальных работах [25].
Реализация такого воздействия представляется связанной с системой так называемого нейроматрикса, т.е. пространственной нейрональной организацией, содержащей сенсорный образ тела. Клиническими моделями такой системы являются фантомные боли в ампутированной конечности и боли у пациентов с параплегией при полной перерезке спинного мозга [20, 22, 25].
Таким образом, представленные результаты исследования показали достаточную эффективность инъекционной формы ЦОГ-2-ингибитора мелоксикама, закрепляемую последующим пероральным применением препарата, который оказался эффективным и безопасным при комплексной терапии болей в спине, обусловленных мышечно-тоническим, миофасциальным синдромом или компрессионной радикулопатией. При этом эффективность курсового лечения пролонгируется в последующие годы, указывает на вероятное воздействие мелоксикама на центральные механизмы болевого синдрома, что определяет устойчивость положительного результата лечения.
Школа для пациента
Данные рекомендации разработаны при участии доцента, зав. отелением лечебной физкультуры, мануальной терапии и массажа медицинского центра Управления Делами Президентаа РФ В.И. Зубкова
Чаще всего причиной боли в спине становится изменение межпозвоночных дисков — особых хрящевых прокладок между позвонками. Кроме того, боли в спине могут быть вызваны чрезмерным напряжением мышц из-за перегрузок и другими причинами.
Рисунки правильного (синее) и неправильного (красное) положения туловища.

Для лечения болей в спине используют ряд методов, и самыми распространенными являются лечебная физкультура и лекарственная терапия.
Выполнять упражнения нужно ежедневно, в медленном темпе, не задерживая дыхания. Упражнения не должны вызывать боль!
Упражнения для острого периода

И.П. лежа. Поочередные выпрямления ног в коленях,
опираясь бедрами о валик.

И.П. лежа, ноги согнуты. Поочередное сгибание
согнутых ног к животу.

И.П. лежа, ноги согнуты. Поочередное отведение
коленей в стороны.

И.П. лежа, ноги согнуты. Руки вверх — вдох,
прижать колено к животу — выдох. То же — другой ногой.

И.П. лежа, ноги врозь. Ротация ног внутрь и наружу.

И.П. лежа, руки к плечам. Круги согнутыми руками
вперед и назад.
Упражнения для подострого периода

И.П. упор на коленях. Сгибание позвоночника.
При возвращении в и.п. не прогибаться.

И.П. лежа на животе (под животом валик).
Поочередные приподнимания ног от кушетки на 3-5 см
и удержание их в этом положении 4-6 с.

И.П. лежа. Приподнимание крестца.

И.П. лежа, ноги согнуты. Одновременное сгибание ног
к животу.

И.П. лежа на животе, руки в стороны (под животом валик).
Приподнять голову и плечи от кушетки на 3-5 см
и удержание в этом положении 4-6 с.

И.П. лежа, ноги согнуты, руки на животе. Приподнимание
головы и плеч. Фиксация этого положения 2-4 с.
Можно ли избежать осложнений от приема лекарств?
Как принимать Целебрекс ®
Целебрекс ® можно принимать в любое время дня, независимо от приема пищи, запивая небольшим количеством воды.
Дозировки Целебрекса при терапии боли в спине: начальная доза 400 мг с последующим приемом 200 мг каждые 12 часов.
Длительность лечения определяет врач.
Источник: Consilium medicum. Справочник поликлинического врача, № 12, 2007 г.
Примерно у 10% пациентов она приобретает хронический персистирующий или рецидивирующий характер [2, 3]. Хроническая боль в спине (ХБС) отказывает негативное влияние на различные компоненты качества жизни, включая физическое функционирование, психологическое благополучие и качество сна [4–6].
Клинически значимая бессонница – это нарушение засыпания или поддержания сна, а также сон, после которого не наступает ощущение отдыха и восстановления сил, сохраняющиеся более 1 мес. Бессонница является причиной серьезного стресса и крайне неблагоприятно влияет на повседневное функционирование. Данное состояние может как являться самостоятельным нарушением, так и сопутствовать другим соматическим или психиатрическим состояниям. По данным Диагностического и статистического руководства по психическим расстройствам 4-го пересмотра (Diagnostic and Statistical Manual of mental disorders – DSM-IV), распространенность нарушений сна в общей популяции составляет 6%, в то время как у пациентов с ХБС этот показатель значительно выше: от 50 до 88% [7].
Сон необходим для восстановления после физической и умственной активности, улучшения способности к адаптации [8].
Болевой синдром приводит к нарушению глубины и продолжительности сна, снижает его качество, эффективность, а также меняет активность и подвижность во время сна (фрагментирование сна). Нарушение сна включает в себя изменение таких показателей, как общее количество часов сна, число пробуждений с момента начала сна, число ночных пробуждений, продолжительность времени до наступления засыпания, общее количество времени, проведенного в кровати, глубина сна, ранние утренние пробуждения вследствие болей, а также пробуждения в результате неудобного положения тела (см. таблицу). Эффективность сна определяют как соотношение общего времени, проведенного в кровати, и собственно сна [9].
Нарушения сна при ХБС характеризуются низким качеством сна, снижением эффективности сна и укорочением его продолжительности, поздним засыпанием, фрагментарностью архитектуры сна, повышением двигательной активности во время сна и отсутствием ощущения отдыха после сна (нарушение реакций активации на электроэнцефалограмме – ЭЭГ) [10]. В ходе исследования, проведенного в Великобритании, 70 пациентов с ХБС предъявляли жалобы на значительные изменения сна по сравнению с контрольной группой [11]. Сходные результаты были получены в ходе проведенного в Норвегии исследования 457 пациентов с ХБС [12].
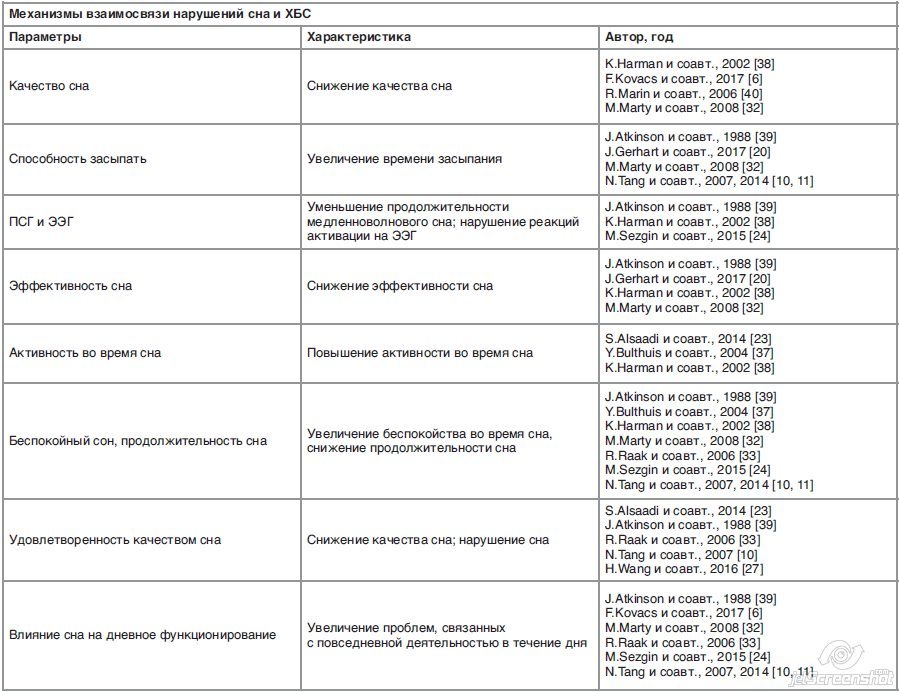
Депривация сна вызывает усиление болевого синдрома за счет гипералгезии. Увеличение интенсивности болевого синдрома напрямую связано со снижением субъективного качества сна [13]. Исследования у здоровых добровольцев продемонстрировали, что депривация сна помимо гипералгезии вызывает снижение болевого порога тепловой чувствительности [14], а также способность к когнитивному контролю боли [15]. Кроме того, нарушения сна приводят к снижению физической и когнитивной продуктивности. Так, у пациентов с фибромиалгией утомление оказывается более значимым фактором снижения трудоспособности, чем собственно болевой синдром [16]. В ходе исследования, проведенного в США, 29% работников сообщали, что засыпали на работе, а 12% – что опаздывали на работу в результате того, что проспали вследствие недостатка сна [17]. Нарушения сна связаны с повышением риска дорожно-транспортных происшествий и несчастных случаев на рабочем месте [18].
Следует отметить, что некоторые лекарственные препараты, используемые для контроля хронического болевого синдрома, например опиоиды, могут вносить вклад в нарушение сна за счет нарушения его архитектуры (уменьшение продолжительности медленноволнового сна – стадии III и IV) и нарушать сон в середине ночи [19]. Вероятно, эти эффекты опиоидов могут снижать эффективность терапии за счет влияния на интенсивность болевого синдрома.
Характер нарушений сна зависит от особенностей болевого синдрома при конкретном заболевании [20]. Клинические исследования в области взаимосвязи боли и сна в основном фокусируются на состояниях, сопровождающихся хроническим болевым синдромом, включая фибромиалгию, остеоартрит, синдром раздраженного кишечника, головные боли и мигрени, синдром хронической усталости [21], в то время как исследований, касающихся нарушений сна при ХБС, меньше, несмотря на высокую распространенность данного состояния.
В ходе исследования, проведенного S.Alsaadi и соавт. (2014 г.), была выявлена двусторонняя взаимосвязь между интенсивностью болевого синдрома и качеством сна. Так, ночь плохого сна провоцировала более высокую интенсивность болевого синдрома в течение дня, в то время как высокая интенсивность болей в течение дня обычно сопровождалась ухудшением качества сна следующей ночью. Такая двусторонняя взаимосвязь не зависела от продолжительности болевого синдрома и симптомов психологического дистресса [23].
Результаты исследований демонстрируют повышение уровня цитокинов и провоспалительных медиаторов в результате нарушения сна, что приводит к повышению чувствительности к болевым стимулам [28–30]. M.Haack и соавт. (2007 г.) впервые продемонстрировали наличие взаимосвязи между укорочением времени сна, повышением болевой чувствительности и увеличением уровня интерлейкина (ИЛ)-6 у женщин с экспериментально вызванной болью [29]. K.Heffner и соавт. подтвердили эти данные, показав, что низкое качество сна приводит к повышению уровня ИЛ-6 и усилению болевого синдрома у пациентов с ХБС [30]. Недостаточное качество сна или малая его продолжительность, вероятно, нарушает нормальную регуляцию уровня воспалительных медиаторов и иммунных процессов, что может приводить к повышению чувствительности ноцицептивных нейронов. Улучшение качества сна у пациентов с болью в спине может способствовать уменьшению выраженности болевого синдрома за счет регуляции уровня ИЛ-6, однако данная гипотеза требует дальнейшего подтверждения.
N.Tang и соавт. в своем исследовании подчеркивают [31], что люди с нарушением сна склонны недооценивать его качество, несмотря на достаточную его продолжительность. Существуют данные, свидетельствующие о том, что качество сна тесно связано с его архитектурой, изменения которой могут возникать на фоне болевого синдрома. Эта гипотеза находит подтверждение в экспериментальных исследованиях, продемонстрировавших ощущение отсутствия отдыха у обследуемых, которым во время медленноволнового сна вызывали болевые ощущения в мышцах, без изменения общей продолжительности сна. В настоящее время неизвестно, как боль в спине влияет на медленноволновой сон; необходимо проведение дополнительных исследований для оценки изменений архитектуры сна в данной популяции пациентов.
Результаты нескольких исследований класса B демонстрируют взаимосвязь нарушений сна и повседневного функционирования, с увеличением продолжительности времени в положении сидя и лежа в течение дня, выраженной сонливостью и утомляемостью [32–34]. По имеющимся данным, улучшение сна на фоне когнитивно-поведенческой терапии или приема триазолама способствует уменьшению выраженности болевого синдрома за счет улучшения ночного сна [34].
Оценку сна можно проводить как по субъективным, так и по объективным параметрам [35]. Субъективная оценка сна обычно включает использование заполняемых пациентом валидных и надежных опросников: Питтсбургского индекса качества сна (Pittsburgh Sleep Quality Index – PSQI) и Шкалы сна для исследования медицинских результатов [22]. Для объективной оценки сна необходимо проведение полисомнографии (ПСГ) или актиграфии. ПСГ – стандартный метод объективной оценки сна, включающий одновременную регистрацию ЭЭГ (активность головного мозга), электроокулограммы (движение глаз) и электромиограммы (мышечная активность). ПСГ – сложный и дорогостоящий метод, что ограничивает его применение в рамках клинических исследований. Актиграфия позволяет оценить движения во время сна и длительность и эффективность сна, а также его нарушения. Метод позволяет объективно отличить сон и бодрствование путем оценки числа движений как опосредованного показателя сна. Метод является менее дорогостоящим и сложным, по сравнению с ПСГ, и демонстрирует достаточно высокую согласованность результатов с ПСГ [36].
Результаты нескольких исследований с применением шкал качества сна, включая PSQI, демонстрируют резкое снижение качества сна у пациентов с ХБС, причем наличие депрессии и тревоги вносило дополнительный вклад в ухудшение ночного сна [37, 38]. Пациенты сообщали об ухудшении сна на 55% на фоне появления боли в спине [40].
При оценке эффективности сна с использованием актиграфии и ПСГ были выявлены противоречивые результаты. В ходе одного из исследований 86% пациентов с ХБС демонстрировали эффективный сон. При использовании актиграфии в ходе двух исследований не было выявлено изменений эффективности сна по сравнению с контрольной группой [38].
При анализе ЭЭГ-паттернов у пациентов с ХБС во время сна было выявлено значительное увеличение сигма-активности в окципитальной и фронтальной областях по сравнению с контрольной группой, что указывает на ухудшение сна [38].
У пациентов с ХБС регистрировалось укорочение III и IV стадий сна (5%) по сравнению со II стадией сна (66%) по данным ПСГ, что указывает на уменьшение продолжительности глубокого восстанавливающего сна [39].
Таким образом, существуют хорошо согласующиеся данные, свидетельствующие о выраженных нарушениях сна у пациентов с ХБС по сравнению с контрольной группой. Результаты исследований также демонстрируют взаимосвязь нарушений сна и снижения дневного функционирования у пациентов с хроническим болевым синдромом. Однако данные о снижении эффективности сна и повышении двигательной активности в период сна на фоне ХБС противоречивы и характеризуются низким уровнем доказательности.
Проведенный анализ литературных данных демонстрирует необходимость включения оценки качества сна в рутинное обследование пациентов с ХБС [11], а также учета факторов, способствующих его нарушению: избыточное потребление кофе, алкоголя, табака; недостаток воздуха; некомфортная температура в помещении и др. [40]. Наличие двусторонней взаимосвязи между нарушениями сна и болевым синдромом позволяет предполагать, что имеющиеся нарушения сна без соответствующего лечения могут затруднять лечение боли в спине и способствовать усилению психологического дистресса.
Читайте также:


