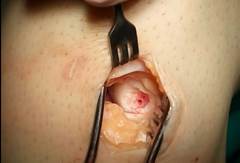
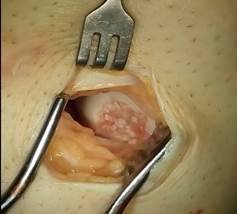
Травматическая отслойка хряща левого бедра
На развитие заболевания могут оказать влияние такие факторы, как изменение гормонального фона, большая нагрузка на суставы вследствие тяжелого физического труда или профессионального спорта, чрезмерный износ опорно-двигательного аппарата, травма, снижение кровотока сустава, наследственная особенность в строении сустава.
Болезнь Кенига начинается с небольшого дискомфорта в области сустава. Заболевание развивается медленно, но в случае травмы может протекать остро и болезненно.
Обнаружили перечисленные симптомы? Запись на приём
Различают четыре фазы развития заболевания:
- для первой фазы характерна некоторая болезненность в пораженном суставе при физической нагрузке. Рентгенологическое исследование может показать очаг распада кости.
- для второй фазы характерен более выраженный болевой синдром, особенно при сгибании в области сустава, отечность за счет присоединения воспалительного процесса. На рентгене очаг поражения более выражен.
- при третьей стадии болезни Кенига происходит неполное отслоение кусочка хряща, при этом боль усиливается, особенно при подъеме по лестнице. На рентгенологическом снимке отмечается тень омертвевшего участка кости.
- на четвертой стадии заболевания все симптомы ярко выражены, на рентгене определяется внутрисуставное тело, так как омертвевший кусочек хряща полностью отделен от кости.
Первым этапом диагностики данных заболеваний является осмотр врача травматолога-ортопеда или ревматолога. Врачом собирается анамнез жизни и профессиональной деятельности человека, информация о перенесенных заболеваниях и травмах.
Рекомендуем обратиться к врачу! 276-00-15
Основа диагностики всех заболеваний опорно-двигательного аппарата – МРТ исследование, кроме этого врачом могут быть назначены рентген пораженных суставов, УЗ-исследование суставов, лечебно-диагностическая пункция сустава.
Для выяснения наличия воспалительного процесса необходимо сдать клинический и биохимический анализ крови, включая специфические белки и анализ крови на наличие инфекций. Дополнительно необходимо сделать рентген легких.
Диагностическая артроскопия показана в отдельных случаях, когда другие методы диагностики не дают точных результатов. Артроскопия – это методика, при которой исследуется полость сустава с помощью комплекса эндоскопического оборудования и инструментов. Система линз, помещенных в металлическую трубку, соединенную со световым кабелем, вводится в сустав, при этом изображение с камеры передается на внешний монитор, по которому врач отслеживает свои действия. С помощью эндоскопии возможно не только детально рассмотреть изменения в суставе, но и сфотографировать патологические процессы и взять кусочек ткани для исследования.
Консервативное лечение болезни Кенига включает в себя назначение противовоспалительных нестероидных препаратов, препаратов улучшающих кровообращение в суставах и восстановление структуры хряща. Назначаются препараты для снятия боли, а также иммуномодуляторы и препараты для поддержания микрофлоры кишечника.
При хирургическом лечении методика определяется в зависимости от фазы заболевания - либо отслоившийся кусочек хряща крепится к месту отслойки, либо он полностью удаляется с полным восстановлением хряща при помощи хондропластики, а именно метода туннелизации.
Перед операцией необходима консультация хирурга, где совместно с пациентом выбирается способ оперативного вмешательства. Врачом планируется дата оперативного хирургического вмешательства, пациент направляется на подготовку к операции. Обязательный набор предоперационного обследования находится в разделе Подготовка к операции.
После консультации врача сосудистого хирурга и УЗДС вен нижних конечностей вам будет рекомендован компрессионный трикотаж либо эластичное бинтование нижних конечностей. Это необходимо для предотвращения возникновения тромботических осложнений во время и после оперативного вмешательства.
Накануне операции с вечера рекомендуется отказаться от обильного приема пищи и сделать очистительную клизму. Также за 2-е недели до и 2-е недели после операции рекомендовано отказаться от употребления алкоголя и курения. В день операции не кушать и не пить.
При поступлении в палату стационара клиники "Первая Хирургия" (которая по вашему желанию может быть одно-, двух- или трехместной), вы выполняете подготовительные мероприятия: снимаете верхнюю одежду, выполняете гигиенические процедуры и туалет, переодеваетесь в одноразовую одежду для операционной и надеваете компрессионные чулки. Питание, все предметы личной гигиены, одноразовая одежда (халат и тапочки) входят в стоимость размещения в палате стационара. С того момента, как вы приехали в клинику "Первая Хирургия" на операцию, и до момента выписки вы будете находиться под постоянным присмотром персонала клиники. 24 часа в сутки вас будут сопровождать исключительно опытные медицинские сестры реанимационного отделения высшей категории со стажем работы более 15 лет.
Накануне или непосредственно в день операции на консультации у врача анестезиолога-реаниматолога вам будет предложен тип анестезиологического пособия. Подробно ознакомиться с видами анестезии и их особенностями в клинике"Первая Хирургия" вы можете на странице отделения Анестезиология.
Хирургическое лечение болезни Кенига проводится под спинно-мозговой анестезией или эндотрахеальной анестезией.
Хирургическое лечение болезни Кенига проводится при наличии неподвижного или полуподвижного фрагмента без патологического вовлечения в процесс суставной поверхности с целью формирования каналов для питания сосудами кости сустава. Операция выполняется при помощи артроскопии через два разреза до 1 см.
Если фрагмент полуподвижный, и дефект кости незначителен, фрагмент прикрепляют на место при помощи рассасывающихся гвоздей или канюлированных винтов (компрессионные типа Герберта).
При большом дефекте кости, его уменьшают с помощью специального аутрансплантата. Свободные внутрисуставные тела удаляют, но при более крупных размерах возможна их фиксация винтом с целью сращения, но если перспектива сращения не велика, то их удаляют с последующим проведением хондропластики.
После операции пациент переводится в палату, ему назначается антибактериальная терапия, при необходимости обезболивающая терапия. Из стационара пациент может быть выписан на следующие сутки после операции.
Снятие швов производится на 7 сутки.
В реабилитационном периоде назначаются хондропротекторы (играют роль смазки в суставе) как в таблетках, так и при помощи внутрисуставного введения. При снятии острого периода назначаются физиопроцедуры, озонотерапия, лечебная гимнастика, бассейн.
От пациента требуется снижения нагрузки на сустав, рекомендуется пользоваться тростью, артезом, ходунками или костылями – теми, что порекомендует врач.
- артроз коленного сустава
- усиление болевого синдрома и ограничение объема движений в суставе вплоть до его блокады.
Консультации, осмотр, диагностику и лечение заболеваний суставов в клинике "Первая Хирургия" проводят ведущие травмотологи-ортопеды г.Москвы с высшей категорией, что предельно снижает риск возникновения осложнений, сводя их к нулю
Лицензия Департамента Здравоохранения г. Москвы № ЛО-77-01-018291 от 25.06.2019

Повреждения хряща коленного сустава встречаются очень часто и не заживают самостоятельно. Считается, что у более половины пациентов, которым выполнялась артроскопия коленного сустава по поводу его повреждения, обнаруживается патология хряща разной степени выраженности, а повреждения 4 ст. по Оутербриджу встречаются у каждого 20 пациента младше 40 лет с травмой коленного сустава. Современные исследования позволяют констатировать факт увеличения площади хрящевых дефектов у пациентов с повреждением хряща и развития тяжелого артроза с течением времени. Конечно, эндопротезирование решает проблему полностью, но применимость метода у молодых пациентов вызывает споры в связи с недостаточно высокой выживаемостью современных конструкций. Так как сама возможность органотипичного восстановления суставного хряща на современном этапе развития медицины остается недоказанной, актуальность и значимость разработки и внедрения любых методов восполнения полнослойных дефектов хряща для возможности отсрочки эндопротезирования, не вызывают сомнений. Известно, что гиалиновый хрящ, локализуясь в хрящах носа, гортани, трахеи и бронхов, в реберных хрящах имеет схожее строение и отличается лишь соотношением хондроцитов и коллагеновых волокон [6,7,8].
Исходя из этого, мы предложили забирать хрящевой трансплантант из ребра в достаточном объёме с целью восполнения травматических дефектов хряща крупных суставов.
Цель исследования
Повышение эффективности лечения больных с посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствия дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, – к хрящевой части ребер.
Клинический материал и методы
В работе представлены результаты оперативного лечения 15 пациентов, в возрасте от 18 до 43 лет, мужчин 13, женщин 2, проходивших лечение в отделении травматологии и ортопедии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского в период с 2015 по 2016 год включительно. Основными жалобами были боль и нарушение функции коленного сустава.
Все пациенты имели травматический костно-хрящевой дефект III-IV степени по Оутербридж размерами от 2 до 3,5 см², локализовавшийся на одном из мыщелков бедра. Давность травмы составляла от 2 нед. до 6 мес. Диагноз устанавливался на основании МРТ и артроскопии.
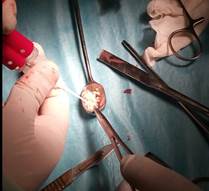
В качестве оперативного лечения был применен разработанный нами новый способ замещения дефектов хрящевой ткани. На суставных поверхностях артроскопически визуализировали дефект, шейвером формировали границы дефекта, осуществляли дебриджмент. Следующим этапом выполняли забор реберного хряща. Для этого в реберной части на уровне 9 ребра продольным разрезом осуществляли доступ к перихондриуму, последний рассекался вдоль и распатором отводился в стороны. При помощи тонкого костного долота шириной 1 см производился забор хряща на всю толщину, размером 2 см. Перихондриум ушивали без установки дренажей. Далее выполняли миниартротомию, для открытого доступа к зоне дефекта хряща.
Полученный хрящ измельчали скальпелем в крошку до 0,1*0,1 мм. Заливали крошку фибриновым клеем Tissucol и погружали полученную смесь в зону дефекта, плотно прижимая импактором и удерживая до полного застывания. Для замещения дефекта необходима соответствующая консистенция клеево-хрящевой смеси, близкая по своим свойствам к пластилиновой массе. Для этого нами определены оптимально объёмные соотношения фибринового клея и хрящевой крошки. Она составляет 20-40% объёма клея и от 80-60% объёма хрящевой крошки соответственно. Смесь с соотношением меньшего, чем 20%, объёма клея является в конечном итоге непрочной структурой, так как частицы хрящевой крошки недостаточно связаны между собой, если объем клея составляет более 40%, смесь является слишком жидкой для замещения дефектов. Так как надежность фиксации аутотранспланта в ложе не вызывала сомнений, послеоперационную иммобилизацию конечности проводили не более 2 нед. Затем рекомендовали функциональное лечение, включающее пассивные и активные движения в суставе. Полную осевую нагрузку разрешали через 6 нед.
Результаты и обсуждение
Результаты оперативного лечения оценивались на основании данных МРТ и шкалы оценки KOOS в сроки от 3 до 11 мес. с момента операции. Всем пациенты проходили тест KOOS самостоятельно до и после проведенного лечения. Из исследования были исключены 3 пациента как недоступные для оценки результата в послеоперационном периоде. Таким образом были обработаны данные МРТ и шкалы оценки у 12 пациентов.
На контрольных МРТ у всех обследованных пациентов были признаки заполнения хрящевого дефекта и восстановления субхондральной кости.
До операции оценка по шкале KOOS составила по разделам: симптомы 42 %, боль 70.5 %, ограничение активности в повседневной жизни от 52 %, функционирование сустава при занятиях спортом и активном отдыхе от 5 %, общее качество жизни от 18.75 %, общий итог 40 %.
После оперативного лечения по предложенной методике: симптомы от 75% до 100%, боль от 58% до 97%, ограничение активности в повседневной жизни от 82% до 100%, функционирование сустава при занятиях спортом от 30 % до 90%, общее качество жизни от 43,75% до 87,5%, общий итог от 66% до 97%.
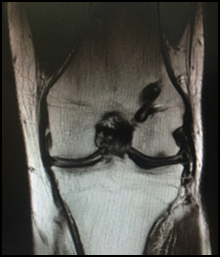
Пациент Х. (31 год) поступил с жалобами на боль, ощущение нестабильности в левом коленном суставе, ограничивающее повседневную активность Со слов пациента производственная травма во время соревнований по пятиборью спасателей. Диагностирован разрыв передней крестообразной связки левого коленного сустава, повреждение хряща. Протокол МРТ: разрыв передней крестообразной связки левого коленного сустава. Травматическая отслойка хряща суставной поверхности медиального мыщелка бедра. Большое количество жидкости в полости сустава
Выполнена артроскопическая пластика передней крестообразной связки материалом из сухожилий изящной и полусухожильной мышц.
Осуществили с помощью предлагаемого способа замещение дефекта хряща медиального мыщелка бедренной кости (фиг. 1,3) измельченным аутохрящом ребра смешанным с фибриновым клеем (фиг. 2), пропорции смеси для замещения дефекта составили 35 % фибринового клея и 65% хрящевой крошки, объем смеси составил 3 см³.
Через 4,5 месяца после операции – протокол МРТ: структура и интенсивность мр-сигнала от хрящевой поверхности, покрывающей суставную поверхность мыщелков, незначительно нарушена, равномерной толщины. Зона отслойки хряща полностью восстановлена (Фиг.4). Пациент передвигается с полной нагрузкой на оперированную конечность, объём движений в оперированном суставе полный, боли нет.
Таким образом, результаты наблюдений показали, что данный способ позволяет успешно и малотравматично восстанавливать поврежденную хрящевую ткань.
фиг. 1
фиг. 2
фиг.3
фиг.4
В результате травм или заболеваний повреждается суставной хрящ, но он обладает очень ограниченной способностью к регенерации. В этой зоне отсутствует васкуляризация и, как следствие, клетки крови и костного мозга, а также хондроциты не могут мигрировать в место дефекта. Поэтому в случае изолированного поражения хряща регенерация выражена слабо. При остеохондральных дефектах происходит повреждение суставного хряща и подлежащей субхондральной кости, вызывающее разрыв кровеносных сосудов и создающее сообщение дефекта с костным мозгом. В этом случае запускается процесс регенерации, начинающийся с образования гематомы, формирующейся из поврежденных кровеносных сосудов или костного мозга. Фибриновая сеть гематомы задерживает тромбоциты, выделяющие, различные биоактивные факторы, стимулирующие в свою очередь, сосудистую инвазию и миграцию недифференцированных мезенхимальных клеток в гематому, постепенно преобразующуюся в фибриновый сгусток. В течение нескольких дней после травмы мезенхимальные клетки размножаются и могут дифференцироваться в хондроциты, синтезирующие коллагеновый матрикс. Получающийся регенерат плохо организован и содержит преимущественно коллаген первого типа [1,7,8].
Независимо от генеза, при отсутствии лечения повреждённого гиалинового хряща, обладающего ограниченной способностью к регенерации, в коленном суставе могут возникать распространённые дегенеративные изменения [7].
Множественные дискуссии и усилия хирургов в сфере восстановления суставного хряща приводят к внедрению широкого спектра хирургических вмешательств. В настоящее время существует три парадигмы пластики хрящевых дефектов. Первая подразумевает стимуляцию развития волокнистой соединительной ткани на месте дефекта в результате вскрытия костных каналов и миграции фибробластов. Вторая предполагает трансплантатацию ауто- или аллогенного хряща с субхондральной костной платиной и подлежащей костью из ненагружаемых участков коленного сустава или от трупа (мозаичная хондропластика). В третьем подходе используются аутокультуры хондроцитов, которые фиксируются к месту дефекта различными коллагеновыми мембранами и гидрогелями. Предложены модификации первого способа, при которых применяются синтетические спейсеры дефекта, в которые из вскрытых костных каналов мигрируют полипотентные клетки (ChondroGuide). Cтруктура и состав спейсеров способствует их дифференциации в хондроциты [3,4,5].
Установлено, что при артропластике в случае наличия дефектов суставных поверхностей воспалительного, травматического или дегенеративного происхождения необходимо их закрывать материалами, изолирующими обнаженную (лишенную хрящевого покрова) кость от полости сустава таким образом, чтобы были возможны свободные движения и скольжение сочленяющихся суставных концов, что лучше всего обеспечивается свойствами нативного гиалинового хряща или способствующими его восстановлению прокладками интерпозиционной артропластикой [2,3]. Предложено более 50 видов прокладок для интерпозиционной артропластики, но ни одна из них не дает искомого результата.
Положительный результат предложенного нами способа достигается тем, что для замещения дефектов хрящевой ткани используется имплантация измельченного аутологичного хряща, смешанного с фибриновым клеем. Трансплантат забирается с хрящевой части ребра практически в любом требуемом объеме, а пропорции смеси для замещения дефекта составляют 20-40 % фибринового клея и 60-80% хрящевой крошки, что позволяет обеспечить нужную консистенцию и прочность фиксации.
Заключение
Таким образом, предлагаемый способ замещения дефектов хрящевой ткани позволяет рассматриваться как эффективный метод оперативного лечения больных с деструктивно-дистрофическими и посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствие дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, – к хрящевой части ребер.
Повреждения хряща могут возникать как в обычных бытовых условиях, так и во время занятий спортом при резких ротационных движениях в коленном суставе.
При остром повреждении клиническая оценка крайне сложна. Клиническая картина может варьировать от полного отсутствия жалоб до острой интенсивной боли. В ряде случаев на первое место могут выступать симптомы повреждения передней крестообразной связки и разрывов мениска.
Определенного алгоритма клинического осмотра при травматическом повреждении хряща не существует. Диагноз позволяет предположить анализ анамнеза и механизм травмы. Необходимо исключить повреждение крестообразных связок и менисков.
Изолированное повреждение хряща на обычных рентгенограммах не выявляется, только при повреждении субхондральной кости или если с момента травмы прошло более месяца, можно увидеть повышение плотности или неровность суставной поверхности (в случае вдавленного перелома, перелома медиальной поверхности латерального мыщелка бедренной кости).
Данные МРТ очень важны для постановки правильного диагноза при повреждении хряща, однако полученные изображения должны быть достаточно высокого качества.
Артроскопия является наиболее ценным и точным методом диагностики повреждений хряща, так как позволяет достоверно определить распространенность и глубину травматического повреждения и посттравматических изменений.
Травматические и посттравматические изменения хряща имеют множество различных проявлений, поэтому единую классификацию повреждений создать очень сложно. Bauer и Jackson предложили классификацию хондральных повреждений, включающую 6 категорий и основанную на выраженности изменений, затрагивающих внутрисуставной хрящ.
- Тип 1 (трещина) – повреждение хряща представлено изолированной трещиной, которая может доходить до субхондральной кости.
- Тип 2 (звездчатый дефект) – несколько разнонаправленных линий переломов, часто с центральным дефектом. Линии переломов могут достигать субхондральной кости.
- Тип 3 (лоскутный дефект) – поврежденный лоскут прикреплен к предлежащему интактному хрящу. Глубина повреждения может достигать субхондральной кости.
- Тип 4 (кратер) – отделение полнослойного фрагмента хряща с обнажением субхондральной кости.
- Тип 5 (фибрилляция) – при этом типе повреждения имеется зона поверхностной фибрилляции без отделения хряща на большом протяжении. Этот тип повреждения очень сложно отличить от дегенеративного повреждения.
- Тип 6 (деградация) – разрушение и отделение хряща с обнажением субхондральной кости. Этот тип также сложно, а часто невозможно отличить от дегенеративных поражений хряща. Локализация зоны повреждения может указывать на причину повреждения.
Во время диагностики и лечения повреждений хряща необходимо обращать особое внимание на целостность передней и задней крестообразных связок. Острая и хроническая нестабильность коленного сустава, связанная с повреждением этих связок, очень часто приводит к повреждению суставного хряща.
- Медиальный мыщелок бедра.
Зона повреждения практически всегда находится на латеральной поверхности медиального мыщелка бедра (в области межмыщелкового возвышения). В данной зоне могут встречаться любые виды травматических повреждений хряща.
- Латеральный мыщелок бедра.
Типы повреждений латерального мыщелка бедренной кости сходны с типами повреждений медиального мыщелка. Повреждения, возникающие в этой области, ограничены боковой трещиной, образующейся вследствие винтообразного механизма перелома и большего размера латерального мениска. Такие повреждения также могут распространяться и на латеральную порцию латерального мыщелка бедра. Поперечные линейные трещины (щелеобразные переломы) в некоторых случаях достигают медиальной стороны.
Чаще всего причиной остеохондральных переломов являются прямая травма, вывих надколенника и разрыв ПКС. Вывих надколенника нередко приводит к смещению костно-хрящевого фрагмента с медиальной стороны надколенника и с латерального края латерального мыщелка бедренной кости.
Лечение
Лечение травматических повреждений хряща зависит от их глубины и распространенности, клинической картины и сопутствующих повреждений.
Травматические повреждения хряща (исключение – субхондральная гематома), включающие в себя разрушение суставной поверхности, нестабильные фрагменты хряща и вовлечение в процесс субхондральной кости определяют выбор метода лечения.
Применяются различные подходы:
- Невмешательство.
Если выявлены небольшие поперечные трещины хряща, лучше оставить их нетронутыми, так как чрезмерная механическая обработка может привести к еще более выраженным повреждениям.
- Удаление нестабильных хрящевых фрагментов.
Лоскутные повреждения хряща, выраженные фибрилляции и нестабильные участки должны быть устранены.
- Стимуляция регенерации фиброзного хряща.
Индукция образования волокнистого хряща зависит от различных факторов, наиболее благоприятными из которых являются следующие:
- Молодой возраст пациента,
- Стабильный хрящ, окружающий дефект;
- Отсутствие нестабильности, связанной с повреждением капсульно-связочного аппарата;
- Отсутствие угловой деформации нижней конечности,
- Небольшой размер дефекта (менее 15 мм),
- Неповрежденные мениски.
К неблагоприятным факторам, которые следует учитывать, прибегая к методам индукции формирования фиброхрящевой ткани, относятся:
- Большой размер дефекта (более 15 мм),
- Нестабильные края,
- Наличие угловой деформации нижней конечности,
- Нестабильность связочного аппарата,
- Пожилой возраст,
- Ожирение,
- Локализация дефекта в области бедренно-надколенникового сочленения.
Существует множество различных методик стимуляции репарации хрящевой ткани:
- Рассверливание по Pridie,
- Субхондральная абразивная хондропластика,
- Микрофрактурирование.
- Пересадка хряща.
Доступны следующие методики трансплантации хряща и костно-хрящевых блоков:
И.Е. МИКУСЕВ, Г.И. МИКУСЕВ, Р.Ф. ХАБИБУЛЛИН
Казанская государственная медицинская академия
Республиканская клиническая больница МЗ РТ, г. Казань
Микусев Глеб Иванович
кандидат медицинских наук, врач-травматолог
420064, г. Казань, ул. Оренбургский Тракт, д. 138, тел. (843) 237-34-27, е-mail: [email protected]
Статья посвящена одному из тяжелых и относительно редких повреждений, встречающихся в практике хирургов и травматологов — травматической отслойке кожи. Описание этого вида патологии в хирургических руководствах и учебниках не отличается особой полнотой. Поверхностное знакомство хирургов и травматологов с травматической отслойкой кожи иногда способствует просмотру этого повреждения. Даны четкие рекомендации по диагностике и лечению травматической отслойки кожи.
Ключевые слова: травматическая отслойка кожи, диагностика, лечение.
I.E. MIKUSEV, G.I. MIKUSEV, R.PH. KHABIBULLIN
Kazan State Medical Academy
Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
The article considers one of the severe and relatively rare damages which occur in the practice of surgeons and traumatologists — traumatic skin detachment. The description of this type of pathology in textbooks and work manuals is not full. Sketchy knowledge of surgeons and traumatologists of traumatic skin detachment sometimes leads to omitting such an injury. Clear guidelines for the diagnosis and treatment of traumatic skin detachment are given.
Key words: traumatic skin detachment, diagnostic, treatment.
Травматическая отслойка кожи как самостоятельный вид травмы впервые была описана французским хирургом Morel-Lavallee в 1848 году (цит. по К.К. Кодзаеву [1]). В отечественной литературе первое сообщение о decollement de la peau появилось в 1930 г. [2], а первая журнальная статья — в 1936 г. [1]. Однако описания этого вида патологии до настоящего времени в хирургических руководствах и учебниках или вообще не приводятся или же не отличаются особой полнотой. Относительная редкость травмы и поверхностное знакомство хирургов и травматологов с травматической отслойкой кожи иногда способствует просмотру этого повреждения [3]. В данное сообщение включены результаты клинических наблюдений 53 больных в возрасте от 3 до 78 лет.
Травматическая отслойка кожи возникает вследствие грубого механического воздействия различных движущихся предметов, большей частью вращающимся колесом. Из 53 случаев в наших наблюдениях у 18 больных травматическая отслойка кожи возникла при наезде колеса автобуса, троллейбуса, грузовой и легковой автомашины. Падение с лестницы или крыши, удар тяжелым предметом, касательное соскальзывание тяжелого предмета или прижатия им, сдавливание движущимся вагоном, автомобилем, протаскивание тела по земле трамваем и т.д. — все эти факторы могут привести к травматической отслойке кожи.
По нашим наблюдениям, отслоение кожи не всегда проходит одинаково, на что также указывал и В.К. Красовитов (1947) [4]. Практически можно выделить три основных типа травматической отслойки кожи.
Первый тип: превалирует размозжение подкожной жировой клетчатки в зоне отслойки с разделением ее на участки, связанные с кожей, а оставшаяся часть — с фасцией (рис. 1 — закрытая травматическая отслойка кожи по 1-му типу и рядом открытая травматическая отслойка кожи по 1-му типу). При этом происходит полное нарушение кровоснабжения кожи из-за повреждения питающих сосудов.
Травматическая отслойка кожи по I типу: а — закрытая травматическая отслойка кожи по I типу; б — открытая травматическая отслойка кожи по I типу


Второй тип: на первое место выдвигается подкожный разрыв жировой клетчатки, не сопровождающийся грубым нарушением ее и глубжележащих тканей, при этом большая часть подкожно-жировой клетчатки отходит вместе с кожей, образуя довольно толстый пласт, содержащий достаточное количество питающих сосудов (рис. 2 — закрытая травматическая отслойка кожи по 2-му типу и рядом открытая травматическая отслойка кожи по 2-му типу).
Рисунок 2.
Травматическая отслойка кожи по II типу: а — закрытая травматическая отслойка кожи по II типу; б — открытая травматическая отслойка кожи по II типу


Третий (смешанный, комбинированный) тип: участки размозжения подкожно-жировой клетчатки чередуются с участками, где сохранилась большая часть этой клетчатки вместе с кожей в виде пласта (рис. 3 — смешанная, комбинированная закрытая отслойка кожи).
Смешанная, комбинированная закрытая отслойка кожи

По-видимому, тип отслойки кожи зависит от механизма травмы, в основном от быстроты перемещения повреждающего предмета по отношению к области тела, от физических свойств тканей на поврежденном участке и от возраста пострадавшего.
Клинически, как по нашим наблюдениям, так и по данным других авторов [5, 6], могут быть выделены закрытые и открытые травматические отслойки кожи. Среди наблюдаемых больных закрытая отслойка кожи встретилась у 13 больных.
Все отслойки кожи еще со времен Morel-Lavallee принято разделять на три группы: малые, средние и большие, но, к сожалению, без уточнения размеров участка повреждения.
Для установления правильного диагноза травматической отслойки кожи очень важным является уточнение механизма травмы, т.к. механизм возникновения отслойки — это грубое механическое воздействие различных движущихся предметов и при этом приложение силы под некоторым углом.
При повреждениях, где имеется сильный ущерб мягких тканей, особенно при повреждениях колесом движущегося транспорта и т.п., надо всегда помнить об отслоениях кожи. Тем не менее, по нашим наблюдениям, диагностические ошибки при этом виде повреждения, особенно в случае закрытой отслойки кожи, допускаются. Мы полагаем, это связано с тем, что практические врачи хирургического профиля с травматической отслойкой кожи мало знакомы. При поступлении подобных больных, особенно при закрытых травматических отслойках кожи, как правило, выставляется диагноз ушиб мягких тканей и подкожная гематома травмированной области, которая достоверно подтверждается пункциями с удалением кровянистого содержимого. При сочетании повреждения конечностей на разных уровнях (особенно при дорожно-транспортных травмах) основное внимание в первую очередь уделяется открытым повреждениям, не предполагая о возможном тяжелом закрытом повреждении, таком как травматическая отслойка кожи.
Вышеизложенное наглядно показывает следующее клиническое наблюдение.
Больная И., 16 лет, для дальнейшего лечения поступила в КазНИИТО 06.02.1985 г., через 4 месяца после травмы — переднее колесо автобуса проехало через правую голень, а затем наехало (но не переехало!) и на левое бедро. После травмы больная доставлена в травматологическое отделение БСМП г. Набережные Челны, где был установлен диагноз: открытый перелом костей правой голени с обширным повреждением мягких тканей, разрыв наружно-боковой связки левого коленного сустава с гемартрозом. Травматический шок II ст. При обследовании больной на левом бедре четко были видны следы от протектора колеса с участками кровоподтеков без повреждения кожного покрова.
При поступлении больной на фоне противошоковых мероприятий выполнена первичная хирургическая обработка открытого повреждения костей правой голени с восстановлением кожного покрова. Только через сутки после госпитализации выявлена травматическая отслойка кожи левого бедра от верхней трети его до уровня коленного сустава (по-видимому, по первому типу). В дальнейшем наступил полный некроз кожи циркулярно на левом бедре на участках травматической отслойки кожи, что осложняло лечение пострадавшей в связи с тяжелым повреждением и правой голени. К сожалению, подобные диагностические ошибки в наших наблюдениях встретились в 6 случаях, что связано с недостаточным вниманием при обследовании и выяснением механизма травмы у пострадавших.
Лечение больных с травматической отслойкой кожи представляет определенные трудности, и шаблонного подхода при этом не должно быть. Как показали наши наблюдения, способы лечения прежде всего зависят от типа и площади отслойки.
При обширных закрытых отслойках кожи возможны два способа лечения, в зависимости от типа отслоения. Как показали наши наблюдения, при первом типе закрытой травматической отслойки, когда превалирует размозжение подкожно-жировой клетчатки в зоне повреждения, необходима обработка кожи по В.К. Красовитову, когда с кожного лоскута и фасции полностью удаляется подкожно-жировая клетчатка. При втором типе отслойки обработка кожи по типу свободного полнослойного трансплантата является излишней, так как в толще кожно-подкожного лоскута содержится достаточное количество питающих сосудов. В случае смешанной (комбинированной) отслойки показана частичная обработка кожных лоскутов по Красовитову.
Однако до операции практически невозможно установить в каждом отдельном случае закрытой травматической отслойки кожи тип повреждения. Поэтому мы предлагаем очень простую методику уточнения типа отслоения до начала основного оперативного вмешательства.
Больной Т., 33 года, доставлен 8/Ш 1983 г. с диагнозом закрытого перелома костей правой голени; находился в состоянии алкогольного опьянения. Со слов жены, правая нижняя конечность пострадавшего попала под колесо троллейбуса. Рентгенологически выявлен перелом дистального метафиза правой малоберцовой кости без смещения. Под наркозом проведена ревизия отслоенного лоскута через диагностические насечки на голени и бедре. Выделилось около 700-800 мл кровянистого отделяемого с капельками жира (но без жировой ткани!). Выявлен второй тип закрытой отслойки кожи с подкожной клетчаткой, а начиная от уровня головки малоберцовой кости до средней трети правой голени, через насечки установлено повреждение фасции этой зоны с частичным повреждением малоберцовых мышц. Поэтому насечки на этом участке соединены между собой по типу лампасного разреза и мышцы подшиты на свое место кетгутом. Швы на рану. В насечки введены резиновые выпускники, наложены циркулярная повязка стерильным бинтом, смоченным раствором риванола. Фиксация задней гипсовой лонгетой.
В случаях обширной открытой отслойки, когда имеется лишь одна питающая ножка, должна проводиться обработка кожи по Красовитову. Однако здесь допустимо частичное использование отслоенного кожно-подкожного лоскута при относительной целости клетчатки, начиная от питающей ножки, для местной пластики по типу реплантации при равной длине и ширине ножки (1:1), а вся остальная отслоенная ткань должна обрабатываться по типу полнослойного кожного трансплантата.
Лишь в случае отслойки кожно-подкожных лоскутов в размерах 1:1 или 1:1,5 возможно пришивание их без обработки по Красовитову. Однако и здесь хирургу необходимо убедиться в целости питающей ножки, т.е. в толщине ножки лоскута.
Отслоенные цилиндрические трубки кожи с подкожной клетчаткой с проксимальной питающей ножкой снабжаются кровью гораздо лучше, чем лоскут с дистальной ножкой. Поэтому, убедившись в жизнеспособности такого цилиндрического лоскута, последний после нанесения насечек может быть подшит на прежнее место. Естественно, и в этих случаях жизнеспособность лоскута будет зависеть от типа травматической отслойки.
Ввиду того, что для хирургической обработки отслоенных лоскутов по Красовитову необходимо длительное время (до 3-5 ч.), в некоторых случаях на конечностях возможна обработка кожных лоскутов дерматомом, что значительно ускоряет и упрощает методику кожной пластики. При удалении подкожной клетчатки ножом (скальпелем) или ножницами значительно травмируются глубокие слои трансплантата, что может неблагоприятно отразиться на его приживлении [2, 3]. Мы в одном случае обширной отслойки комбинированного типа на всем бедре провели обработку кожного лоскута дисковым электродерматомом (толщина кожных лоскутов — 0,8-0,9 мм), причем кожно-подкожный лоскут с дистальной питающей ножкой над сухожилием четырехглавой мышцы был реплантирован на свое место. В послеоперационном периоде некроз двух кожных лоскутов наступил в основном из-за сильной травматизации кожи передней поверхности бедра (наезд колесом легковой автомашины) и по задней поверхности (протаскивание по асфальту).
Как показали наши клинические наблюдения, независимо от того, как была обработана отслоенная кожа: вручную скальпелем, или ножницами по типу полнослойного перфорированного лоскута, или по типу толстого расщепленного кожного лоскута дерматомом, или даже совсем не было обработки кожи при втором типе отслойки — наиболее поврежденные участки кожи (осаднение, ушиб, имбибиция на всю толщину кровью) в послеоперационном периоде некротизируются.
Возникает вопрос о целесообразности иссечения явно нежизнеспособных участков травмированной отслоенной кожи. К сожалению, не всегда имея под рукой готовый стерильный дерматом, щадя пострадавшего и боясь причинить ему дополнительную травму при взятии расщепленных кожных лоскутов, большинство хирургов стараются на время (как биологическую повязку) реплантировать явно нежизнеспособные кожные лоскуты (после обработки по Красовитову укладывают их на свое прежнее место). По нашему твердому убеждению, эту тактику следует признать неправильной, что подтверждается и другими авторами [8].
В заключение следует указать, что обширное повреждение кожного покрова конечности должно считаться столь же серьезной травмой для конечности, как, например, повреждение магистральных сосудов и нервных стволов. Правильная тактика хирурга с проведением первичной кожной пластики по показаниям является единственной мерой, которая, возможно, в некоторых случаях спасает не только конечность, но и жизнь пострадавшего. Лечение больных с указанными повреждениями должно начинаться с обязательного переливания крови, кровезаменителей, назначения комплекса витаминов, метилурацила и т. д.
Успех оперативного вмешательства при обширных повреждениях кожного покрова зависит от радикальности хирургической обработки раны, правильного выбора метода кожной пластики с безукоризненным его осуществлением и от надлежащего послеоперационного ухода.
1. Кодзаев К.К. Травматическая отслойка кожи // Вестн. хир. — 1936. — Т. 42, кн. 117-118. — С. 11-18.
2. Алексеев В.В. 2 случая decollement de la peau // Вестн. хир. — 1930. — Т. 21, кн. 62-63. — С. 212-213.
3. Paul D. Zur Versorgung von Skalpierungsverletzungen // Beitr. Orthop. Traumatol. — 1975. — Vol. 3. — S. 190-192.
4. Красовитов В.К. Первичная пластика отторгнутыми лоскутами кожи // Краснодар, 1947. — 236 с.
5. Рубашев С.М. К вопросу о лечении травматической отслойки кожи // Вестн. хир. — 1936. — Т. 47, кн. 127. — С. 87-88.
6. Элькин М.А. К вопросу о лечении травматической отслойки кожи // Хирургия. — 1939. — № 1. — С. 60-62.
7. Гугуцидзе А.Г. Травматическая отслойка кожи // Труды НИИТО МЗ Грузинской ССР. — Тбилиси, 1972. — Т. XI. — С. 233-237.
8. Schiefer R. Die Ablederungsverletzung (Ein Beitrag zur Anwendung des grossen Vollhautlappens) // Zbl Chir. — 1966. — Vol. 24. — S. 869-874.
Читайте также:


