Гетеротопическая оссификация тазобедренного сустава
Под гетеротопической оссификацией понимают образование зрелой костной ткани в мягких тканях организма. Среди больных неврологического профиля гетеротопическая оссификация развивается чаще всего у перенесших тяжелую черепно-мозговую травму, позвоночно-спинномозговую травму. Частота развития гетеротопической оссификации при этих состояниях варьирует от 11 до 76%, однако к ограничению движений приводит лишь в 10- 20% из этих случаев [Buschbacher R., 1992]. Причины и патогенез гетеротопической оссификации до конца не ясны. Возможно, определенную роль играют локальные дисметаболические, дисциркуляторные факторы. Существует предположение о нарушении нейрогенного контроля над превращением мезенхимальных клеток в остеобласты [Stover S. и соавт., 1991]. К факторам риска развития гетеротопической оссификации относятся: повышение мышечного тонуса; длительное (более двух недель) пребывание в коме; переломы длинных трубчатых костей; ограничение объема движений в суставах конечностей. К настоящему времени нет достоверных данных о том, что на частоту развития этого осложнения влияет интенсивность пассивных гимнастических упражнений в суставах конечностей.
Эктопическая кость формируется обычно в области крупных суставов (локтевых, плечевых, тазобедренных, коленных) снаружи от суставной капсулы, а также в области переломов длинных трубчатых костей через 1-3 месяца после травмы. Оссификация околосуставных тканей наиболее часто встречается после травм локтевого сустава, возможно, это объясняется хорошим кровоснабжением этой области и частым образованием обширных гематом. Оссификаты локализуются в соединительной ткани между пластами мышц, но не в самих мышцах.
Клиническая картина характеризуется болью, отеком, эритемой и индурацией пораженной области, иногда - повышением температуры, может напоминать тромбофлебит или септический артрит. Если очаг поражения локализуется в области сустава, может наблюдаться ограничение подвижности в этом суставе вплоть до развития анкилоза. К осложнениям гетеротопической оссификации относятся компрессия нервных стволов, развитие пролежней, повышен риск развития тромбофлебита глубоких вен.
Ранняя диагностика основывается на клинических данных, а также на повышении в крови уровня щелочной фосфатазы. Обычная рентгенография выявляет первые признаки оссификации не раньше чем через 7-10 дней после развития клинических проявлений. Для раннего обнаружения эктопической кости в настоящее время используют метод трехфазного сканирования [Freed J. и соавт., 1982]: в области формирования оссификатов в первую фазу исследования наблюдается локальное усиление кровотока и концентрация в мягких тканях радиоактивных индикаторов.
Лечение гетеротопической оссификации включает назначение медикаментозных средств, лечебной гимнастики, по показаниям - оперативное вмешательство. Из медикаментозных препаратов применяют препараты этидроновой кислоты, которая, как показали исследования, при спинальной травме уменьшает частоту и выраженность эктопического костеобразования при минимальных побочных действиях [Stover S. и соавт. 1976]. В России к настоящему времени лицензирован отечественный препарат этидроновой кислоты "Ксидифон". При спинальной травме препарат назначают в течение 6-9 месяцев: первые три месяца - в дозе 20 мг/кг/день, в течение последующих 3-6 месяцев - в дозе 10 мг/кг/день. Для уменьшения воспалительных явлений могут применяться также нестероидные противовоспалительные средства (индометацин, ксефокам, салицилаты). Важным профилактическим и лечебным средством являются упражнения лечебной гимнастики (пассивные и активные), направленные на сохранение в суставах должного объема движений. Данные о том, что энергичные физические упражнения приводят к развитию гетеротопической оссификации либо ухудшают ее течение, научно не подтверждаются [Bontke С., Boake С., 1996]. В ряде случаев манипуляции, направленные на увеличение объема движений в анкилозированном суставе, выполняют под анестезией. Иногда требуется оперативное вмешательство, на правленное на удаление либо частичную резекцию оссификата. К осложнениям таких операций относятся кровотечение, инфицирование, а также рецидив оссификации. Рецидивы наблюдаются значительно реже, если операция выполнена после завершения созревания костной ткани. Поэтому оперативные вмешательства выполняют не ранее чем через 12-18 месяцев после травмы. Для предупреждения рецидива после оперативного удаления оссификата иногда применяют лучевую терапию низкими дозами, назначают длительные курсы препаратов этидроновой кислоты.
Внескелетная оссификация — образование кости в тканях, где её быть не должно. Оссификаты могут возникать в повреждённых связках, сухожилиях, суставных сумках, мышцах. Чаще формируются около крупных суставов или мест переломов через несколько месяцев после травмы, начала болезни. Патология приводит к нарушению функции сустава, снижению двигательной активности и качества жизни.
Оссификаты тазобедренных суставов
Оссификаты суставов — где развиваются и как диагностируются
Процесс оссификации может быть длительным, занимать несколько месяцев. Интенсивность образования эктопической костной ткани зависит от размера очага, его близости к суставу, нагрузок, которые он испытывает.
Этиология и патогенез появления этих костных образований до конца не ясен. Но на сегодняшний день определены основные факторы заболевания:
- массивные ушибы мягких тканей, переломы трубчатых костей, суставные травмы;
- заболевания центральной и периферической нервной системы, в том числе травмы позвоночника, головного мозга, инсульты, которые сопровождаются мышечным гипертонусом и утратой сознания;
- операции на костных структурах.
Внескелетная оссификация, по статистическим данным, наблюдается почти у 40% больных с нервной и суставной патологией. Способность к движениям в поражённом участке утрачивается в среднем у одного из десяти заболевших.
В месте гематомы повреждённые ткани распадаются, начинает формироваться соединительная ткань. Вокруг очага возникают грануляции, где начинается биосинтез костных и хрящевых образований. Формируются хондроидная ткань и костные трабекулы.
Постепенно происходит минерализация, часть молодых костных структур созревает, другая часть — атрофируется. То есть одновременно идёт остеогенез и разрушение, резорбция.
Оссификат со временем покрывается плотной капсулой, внутри которой находится губчатая кость.
Костные новообразования формируются в различных тканях организма:
- В мышцах оссификация на рентгеновских снимках имеет форму кружевной ткани: между костными перемычками есть просветления. Эта картина напоминает саркому, необходимо тщательное обследование.
- В сухожилиях и связках костные образования образуются в местах максимального натяжения.
- В суставных сумках окостенение провоцируется вывихами, возникает в повреждённых участках капсулы. На рентгене видна дугообразная тень вокруг суставного конца пострадавшей кости.
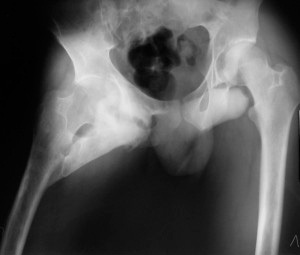
Костные новообразования
Жалобы возникают после травмы, операции, на фоне заболевания:
- отёчность;
- боль, усиливающаяся при движениях;
- затруднения движений.
Осмотр врача выявляет:
- повышение температуры, покраснение кожи, кровоизлияния в области сустава;
- уплотнение кожных покровов;
- ограничение объёма движений, вплоть до полной неподвижности;
- определение при пальпации локальных уплотнений;
- снижение чувствительности кожи над суставом.
Данную патологию можно спутать с рядом заболеваний — тромбофлебит, артрит, саркома, посттравматическая гематома. Поэтому производится тщательное обследование больного.
Применяются различные методы обследования, которые помогают выявить процесс и степень его зрелости. Прежде всего, больному назначают рентгенографию.
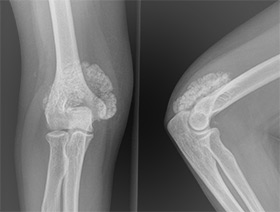
Рентгенография
На снимках через несколько недель после полученной травмы можно увидеть расплывчатую тень или несколько нечётких островков около поражённого участка. Через 2 месяца они уплотняются, контуры становятся чёткими.
Примерно через полгода формирование оссификата заканчивается, он считается созревшим и имеет структуру кости. На рентгене хорошо видна покрывающая оссификат плотная капсула, соответствующая кортикальному слою, внутри расположена более рыхлая губчатая костная ткань.
Иногда может быть сращение с ближайшей костью, образование рядом схожих по структуре элементов.
Проводится биопсия уплотнений. Анализ крови показывает повышение уровня щелочной фосфатазы (маркер остеогенной трансформации).
Оссификаты нижних конечностей типичны для спинальных травм, верхних конечностей характерны для инсультов и черепно-мозговых травм.
Оссификаты тазобедренных суставов как осложнение встречаются при запущенном коксартрозе, поражении спинного мозга разной этиологии, при переломе шейки бедра, после эндопротезирования. Оперативным путём удалить костное образование полностью часто затруднительно. Операции должны быть щадящими. Цель — вернуть возможность обслуживать себя и самостоятельно передвигаться.
Костные новообразования коленного сустава встречаются у спортсменов, формируются достаточно быстро, по мере роста значительно нарушают двигательные функции.
Голеностопный сустав повреждается в результате вывихов, после растяжения связок, переломов костей стопы.
Чаще всего эктопические кости формируются около локтевого сустава. Он хорошо кровоснабжается, поэтому травмы сопровождаются образованием обширных гематом. Оссификаты расположены в межмышечной соединительной ткани, они возникают после травм головного мозга, инсультов.
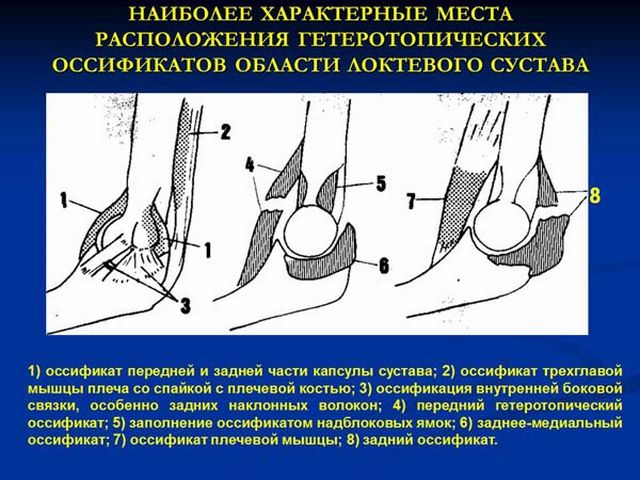
Расположения гетеротопических оссификатов локтевого сустава
Кроме того, инсульты приводят к контрактуре плечевого сустава, что является причиной оссификации связок и сухожилий приводящих мышц плеча.
Патология приводит к следующим последствиям:
- анкилоз;
- тромбозы сосудов;
- развитие пролежней;
- нарушение иннервации из-за сдавления периферических нервов;
- злокачественное перерождение оссификата.
Лечение внескелетной оссификации
Основной метод — операция.
Оперативное вмешательство проводится при полностью сформированном оссификате, то есть примерно через год после травмы. Если пытаться удалить его раньше, возникают осложнения и рецидивы. Для решения вопроса об оперативном лечении обязательно заключение рентгенолога о зрелости оссификата.
Показания к операции:
- большой оссификат;
- сдавление нервного ствола или крупного сосуда;
- значительное ограничение движений;
- безуспешность консервативной терапии.
Консервативное лечение используется до и после операции:
- НПВС;
- Кортикостероиды;
- локальная радиотерапия.
Физиотерапия (теплолечение, электрофорез, ультразвук) применяется с осторожностью, по строгим показаниям, так как может стимулировать рост оссификатов.
Проводится двигательная реабилитация с разработкой суставов. ЛФК важно выполнять в любом случае. Нагрузку дозировать очень осторожно. Нельзя совершать резких, размашистых движений, перегружаться. Повреждение оссификата во время занятий может привести к его росту, усилению болей. Поэтому заниматься следует только под руководством доктора.
В настоящее время практически не разработана. После операций и травм суставов лучше воздержаться от раннего массажа, теплового лечения, интенсивных занятий гимнастикой.
Оссификаты тазобедренных и других суставов встречаются часто, приводят к ограничению движений и нарушению самообслуживания. Причины и механизм их формирования до конца не выяснены. Нередко бывают рецидивы. Но своевременное консервативное и оперативное лечение, проведение упорных реабилитационных мероприятий дают хорошие результаты.
Гетеротопическая оссификация относится к нарушениям, которые при гистологическом и рентгенологическом исследовании характеризуются развитием кости (остеоиндукция) в мягких тканях которые в норме не имеют остеогенных свойств. Внескелетную оссификацию нельзя относить к физиологической и представляет собой патологический процесс.
Морфология гетеротопических оссификатов
Гетеротопическое костеобразование привлекает внимание исследователей и клиницистов. Формирование в тканях очага обызвествления является основным условием для возникновения гетеротопической кости. Возле такого очага образуется грануляционная ткань, включающая остеокласты, остеобласты и фибробласты. В мезенхиме присутствуют клетки, способные к костно-хрящевому образованию. Разнообразные виды гетеротопических оссификатов описаны с учетом той материнской ткани, в которой образуется новая костная ткань: оссификация связки, сухожилия, мышцы или суставной капсулы.
Прослежено, что именно в участках гемотомы развиваются обширные оссификаты. Наблюдается, что в внекостных оссификатах в зависимости от периода развития выявляют незрелую волокнистую кость, пластинчатую кость, которая имеет характерную остеонную структуру, хондроид.
Наиболее ранние (на 20-й день после травмы) описаны гистологические наблюдения структуры формирующихся оссификатов. В оссификате выявлялась грануляционная ткань, перемежающаяся с остеоидом и молодыми костными трабекулами. Обызвествления костной ткани не отмечено. В результате можно предполагать, что костеобразование может рассматриваться как следствие активизации остеогенных потенций клеток грануляционной ткани.
Нередко можно обнаружить очаги хондроида в более поздние сроки (2-3 мес.) среди зрелых костных трабекул. Отсутствие между ними четких границ указывает о подобных механизмах метаплазии. Наряду с участками остеогенеза, обнаруживаются деструктивные костные трабекулы. Имеют место их атрофия и лизис, остеокластическая резорбция. По поверхности оссификата могут формироваться капсула или очаги склероза, тогда как внутри оссификат представлен губчатой костной тканью. Обычно в длительно существующих оссификатах межтрабекулярные пространства выполнены в основном жировой или ретикулофиброзной тканью, содержащей единичные кровеносные сосуды и клетки.
Экспериментальные исследования на животных по моделированию формирования посттравматических оссификатов, углубленный морфологический анализ материала позволили выделить шесть стадий их развития:
- Стадия катаболизма поврежденных тканей.
- Стадия накопления пула клеток за счет пролиферации соединительнотканных клеток, а также заноса плюрипотентных клеток стволовых пространств формирование соединительной ткани.
- Стадия образования остеоида.
- Стадия минерализации остеоида и образование губчатой костной ткани.
- Стадия перестройки и созревания новообразованной кости.
- Стадия относительной стабильности (зрелости) оссификата.
Рентгенологическая диагностика
С помощью рентгенологического метода исследования дают возможность определить локализацию, величину, форму, структуру, зрелость и взаимоотношения очагов внескелетного гетеротопического образования с прилежащими тканями.
Подводя итог можно сказать, что травматический оссификат приобретает постепенно все основные признаки скелетной кости. По поверхности оссификата формируется кортикальный слой, в центре оссификата — губчатая костная ткань.
Оссифицирующаяся гематома
Особенностью оссифицирующейся гематомы является ее форма, она может быть круглая или овальная, относительно равномерное окостенение. Может быть частичное окостенение, не обязательно гематома оссифицируется полностью.
Оссификация мышц
Размеры и форма оссификации мышц бывают различные, как правило окостенение в мышце имеет неправильную ветвистую форму, иногда состоит из нескольких частей, соединяющихся тонкими перемычками. Оссификаты, возникающие в мышцах после массивного ушиба, на рентгенограммах обычно имеют вид перистых напластований на кость. Они напоминают кружевную ткань из-за многочисленных просветлений в их толще. Именно такие формы оссификатов можно ошибочно принять за остеосаркому.
Оссификация сухожилий, связок и суставной капсулы
В сухожилиях оссификаты в основном располагаются в зоне сосредоточенного действия сил мышечного натяжения. Формирующиеся костные трабекулы располагаются по направлению действия сил мышечного натяжения.
Характерно, с помощью рентгенологического исследования можно определить, окостенение тканей суставной капсулы, которое наблюдается при застарелых вывихах крупных суставов. Оссификации подвергается та часть капсулы и перикапсулярных тканей, которая испытывает давление вывихнутого суставного конца кости. Рентгенологически визуализируется узкая тень, охватывающая в виде дуги вывихнутый суставной конец.
Наиболее трудны в диагностике гетеротопические оссификаты, развитие которых происходит через стадию предварительного обызвествления. Они не отличаются определенной стадийностью и характерными рентгенологическими особенностями.
Факторы риска
На сегодняшний день в мире не существует единой теории, объясняющей причину возникновения гетеротопических оссификатов. Еще в 1959 году К.Д. Логачев отмечал, что гетеротопическое окостенение мягких тканей может возникать при различных органических повреждениях нервной системы:
- травмах спинного мозга,
- сирингомиелии,
- энцефалитах,
- миелитах и миеломах,
- повреждениях и заболеваниях периферических нервов и др.
Эти наблюдения послужили основой предположения, что в генезе посттравматических окостенений мягких тканей, ведущую роль может играть одно из нарушений нервной системы. Так, случаи миелопатии сопровождались оссификацией желтой связки, также образование оссификатов наблюдалось при травмах головного мозга.
Когда гетеротопическая оссификация возникает спонтанно, в таких случаях ее относят к идиопатической.
Главным механизмом развития внескелетного остеогенеза есть остеоиндукция. Модуляция экспрессии генов неспецифических соединительнотканных клеток-предшественников и их направленная дифференциация в остеопрогениторные называется — остеоиндукцией. В качестве фактора, индуцирующего остеогенез, выступают костные морфогенетические белки КМБ, а именно КМБ-2, КМБ-3, КМБ-4, КМБ-6. Они содействуют дифференцировке мезенхимальных клеток в остеобласты и стимулируют пролиферацию клеток.
Важную роль играет рекомбинантный костный морфогенетический белок-2 ( rh КМБ-2). Доказано, что через 21 день после инъекции в неостеогенные ткани (в мышцу, возле мышцы, подкожно и в жировую ткань) этого белка в низкой концентрации (5 мкг) крысам линии Вистар наблюдалось формирование во всех областях гетеротопических оссификатов. Этот факт был подтвержден рентгенологическими, гистологическими и биохимическими методами исследований.
Также было установлено, что в сформированных гетеротопических оссификатах, активность щелочной фосфатазы и содержание кальция были значительно выше, чем у животных контрольной группы.
В экспериментах на мышах доказано, что костный морфогенетический белок-4 (КМБ-4) в условиях in vivo и in situ может индуцировать в скелетной мышце эктопическое формирование кости. Аналогичные качества зафиксированы и для костного морфогенетического белка 3 b (КМБ-3 b ).
Исследовали функцию костного морфогенетического белка-2 (ВМР-2) в оссификации связок позвоночника. С этой целью суммарная РНК была выделена из культивированных клеток связок позвоночника у пациента с гетеротопической оссификацией и проведен анализ информационной РНК, ответственной за синтез ВМР-2.
Экзогенный ВМР-2 повышал активность щелочной фосфатазы в клетках связок позвоночного столба у пациентов с гетеротопической оссификацией. Исследователи пришли к выводу, что ген ВМР-2 экспрессируется в клетках связок пациентов с гетеротопической оссификацией, а экзогенный ВМР-2 стимулирует остеогенную дифференцировку сухожильных клеток. Исследователи пришли к выводу, что экспрессия гена ВМР-2 может быть показателем формирования гетеротопического остеогенеза в тканях связок.
Также было установлено, что ВМР-2 может содействовать гетеротопической оссификации в дегенеративно измененных скелетных мышцах.
В гетеротопических оссификатах желтой связки обнаружено присутствие морфогенетического белка хрящевого происхождения (CDMP -1) и экспрессия его гена. Этот белок и информационная РНК, программирующая его биосинтез, были найдены только в веретенообразных клетках и в хондроцитах желтой связки в области оссификации. В клетках неоссифицированных участков они не определялись.
Было установлено, что в гетеротопических оссификатах связок позвоночного столба происходит увеличение простагландин-12-синтетазы, индуцируемой механическими напряжениями. В таких оссификатах увеличивается биосинтез информационной РНК на 240%, концентрация дибутурил-цАМФ и на 200% щелочной фосфатазы как маркера остеогенной дифференцировки, в то время как в клетках, прилежащих к оссификатам, их повышения не наблюдалось. На основе представленных данных можно сделать вывод, что остеогенная дифференцировка клеток связок зависит от системы простагландин-12/цАМФ.
В последние время учеными обнаружен ген hcs 24, идентифицированный к соединительнотканному ростовому фактору (CTGF ). В культуре клеток, полученных из гетеротопических оссификатов передней длинной связки позвоночного столба человека и инкубированных в присутствии рекомбинантного человеческого CTGF / hcs 24, было установлено, что он играет не только важную роль в оссификации передней длинной связки, но и индуцирует остеогенез в других клетках, расположенных вне области оссификата.
В культуре клеток были изучены остеогенные свойства клеток передней длинной связки позвоночника с областью гетеротопической оссификации и у больных со спондилолизом. Обнаружено, что под действием витамина D , в клетках оссифицированной связки наблюдался биосинтез остеокальцина. У пациентов со спондилолизом клетки эту способность не приобретали. Таким образом, можно прийти к выводу, что в условиях гетеротопической оссификации клетки связок приобретают остеобластический фенотип.
Экспериментальные исследования на мышах, у которых индуцирован дефицит бигликана и фибромодулина — малых богатых лейцином протеогликанов ответственных за регуляцию образование матрикса, продемонстрировали создание гетеротопических оссификатов в сухожилиях.
В последние время в мире представлений о регенеративной медицине необходимо учитывать роль стволовых полипотентных клеток, которые могут дифференцироваться в различных направлениях и заполняют стволовые пространства органов и тканей. В костном мозге находятся полипотентные стромальные клетки, занос которых, в условиях травмы или оперативного вмешательства, может быть условием для формирования гетеротопических оссификатов. Одним из условий образования оссификата есть экспрессия гена остеогенного транскрипционного фактора Runx 2/ Cbfa -1. В культуре тканей были проверены два теоретических предположения:
- первое — могут ли клетки из кости или мышцы и фасций (два клеточных типа) способствовать формированию оссификатов.
- Второе: определить роль стромальных клеток, индуцированных травмой или в результате операции (одна клетка + фактор), в возникновении оссификата. Исследователи докали правомерность существования двух теорий.
Лечение и профилактика гетеротопической оссификации
Хирургическое удаление гетеротопических оссификатов является радикальным методом лечения. В качестве профилактического средства используют нестероидные противовоспалительные препараты (индометацин и др.), бисфосфонаты или локальную радиационную терапию. Была применена профилактическая радиотерапия после артропластики тазобедренного сустава.
В результате пришли к выводу, что одноразовое облучение может быть рекомендовано для пациентов, которым противопоказаны стероидные и нестероидные противовоспалительные препараты.
Прогнозы и перспективы
Если в клиническом плане наиболее важно создание методов профилактики окостенения, а также предупреждение рецидивов после хирургического удаления очага гетеротопической оссификации, то мы считаем, овладение в эксперименте процессом гетеротопического остеогенеза, то есть создание модели костеобразования в различных тканях, может служить экспериментальной базой для изучения методов управления остеогенезом в аспекте регенеративной медицины.
Постижение механизмов регенерации даст возможность доктору управлять процессом остеогенеза при травматических повреждениях костей или при лечении дефектов кости после резекции опухоли или какого-либо другого патологического процесса.
ISSN: 1819-1495
E-ISSN: 2541-867X

К.А. Егиазарян
ФГБОУ ВО РНИМУ им Н И Пирогова Минздрава России, г. Москва
Россия
д.м.н., доцент, заведующий кафедрой травматологии, ортопедии и ВПХ
Г.В. Коробушкин
ФГБОУ ВО РНИМУ им Н И Пирогова Минздрава России, г. Москва
Россия
д.м.н., профессор кафедры травматологии, ортопедии и ВПХ
И.В. Сиротин
ФГБОУ ВО РНИМУ им Н И Пирогова Минздрава России, г. Москва
Россия
к.м.н., доцент кафедры травматологии, ортопедии и ВПХ
А.С. Абилемец
ФГБОУ ВО РНИМУ им Н И Пирогова Минздрава России, г. Москва
Россия
ординатор кафедры травматологии, ортопедии и ВПХ
Р.Р. Юусибов
ФГБОУ ВО РНИМУ им Н И Пирогова Минздрава России, г. Москва
Россия
ординатор кафедры травматологии, ортопедии и ВПХ
Н.А. Субботин
ФГБОУ ВО РНИМУ им Н И Пирогова Минздрава России, г. Москва
Россия
студент 6 курса
№ 1 - 2020

Егиазарян К.А., Коробушкин Г.В., Сиротин И.В., Абилемец А.С., Юусибов Р.Р., Субботин Н.А.
КЛИНИЧЕСКИЙ СЛУЧАЙ ОПЕРАТИВНОГО ЛЕЧЕНИЯ ПРИОБРЕТЕННОЙ ГЕТЕРОТОПИЧЕСКОЙ ОССИФИКАЦИИ У ПАЦИЕНТА С ТЯЖЕЛОЙ СОЧЕТАННОЙ ТРАВМОЙ
Цель – рассмотреть клинический случай лечения пациентки с тяжелой сочетанной травмой и дальнейшим развитием гетеротопической оссификации области тазобедренного сустава.
Материалы и методы. Представлен краткий обзор мировой литературы по проблеме гетеротопической оссификации у пациентов, перенесших тяжелую сочетанную травму. На рассмотрение представлен клинический пример лечения пациентки Б. 29 лет, пострадавшей в результате ДТП, с развившейся впоследствии гетеротопической оссификацией тазобедренного сустава как отдаленного осложнения тяжелой сочетанной травмы.
Результаты. Проведено лечение больной с тяжелой сочетанной травмой, с развитием гетеротопической оссификации области тазобедренного сустава в отдаленном периоде. Выполнено оперативное лечение – эндопротезирование тазобедренного сустава. Получен хороший функциональный результат через 2 года (86 из 100 баллов по Шкале Харриса).
На основании клинического примера мы продемонстрировали эффективность существующих методов диагностики на различных сроках лечения гетеротопической оссификации, с целью минимизации процента радикального лечения, минимизации инвалидизации пациентов с отдаленными последствиями тяжелой сочетанной травмы.
Выводы. Выявление данной проблемы на более раннем этапе формирования патологического процесса, оценка важности процесса для дальнейшей реабилитации и качества жизни пациента позволили бы более тщательно провести диагностику, изучение мировой литературы по данной проблеме и принять решение о раннем хирургическом лечении, что, возможно, позволило бы обойтись менее радикальными методами коррекции.
Нам не удалось найти достаточного количества описанных случаев развития гетеротопической оссификации у пациентов с тяжелой сочетанной травмой в литературе с оценкой рационального времени для оперативного вмешательства.
Необходимо обратить особое внимание на изучение проблемы гетеротопической оссификации, что, возможно, позволит нам в дальнейшем использовать механизмы патоостеогенеза для решения предоставленных нам задач, избегать конечной инвалидизаци пациентов после тяжелой сочетанной травмы, несмотря на полную ликвидацию посттравматических изменений.
Ключевые слова: гетеротопическая оссификация; политравма; остеорегенерация; оссификат
Гетеротопическая оссификация (ГО) – процесс образования зрелой пластинчатой костной ткани в местах, нетипичных и морфологически несвойственных для образования костной ткани, не имеющих в основном пуле клеток, клеток предшественников остеообразования.
Классификация ГО [1, 2]
ГО условно делится на два основных типа:
Приобретенная форма, представленная в основном травматическим генезом происхождения.
Наследственная форма.
I. Приобретенная форма делится по морфологии поврежденной системы:
1. Основной очаг повреждения, выделяемый как триггер развития ГО, находится в узлах опорно-двигательного аппарата.
2. Основной очаг повреждения находится на одном из уровней ЦНС:
2.1. Повреждения спинного мозга.
2.2. Повреждения головного мозга.
2.3. Повреждения оболочек мозга.
II. Наследованная форма ГО разделяется по субстрату образования костной ткани и различным мутациям в разных генах:
1. Образование костной массы через энхондральный путь (прогрессирующая оссифицирующая фиброплазия).
2. Образование костной массы через интрамембранозный путь и путь мышечной гетероплазии (прогрессирующая костная гетероплазия, наследственная остеодистрофия Олбрайта).
Выделение условий развития ГО
Краткое описание механизмов развития ГО
На данный момент точный механизм развития ГО до конца не изучен. Отчасти это связано с полиморфностью возможных тригеров развития и большим количеством сложнейших каскадов биохимических реакций.
Однако известны некоторые части сложнейшего механизма образования ГО.
В случае повреждения какого-либо отдела ЦНС в мировой литературе выделяют отсутствие тормозного (регулирующего) действия ЦНС на метаболизм клеток предшественников MSC. К основным молекулам кандидатам регуляторам клеточной функции MSC относят лептин, глутамат, кальцитонин, вещество P, вазоактивный кишечный пептид и катехоламины. В случае повреждения ЦНС возникает дисбаланс концентрации данных регуляторных субстанций и гиперстимуляция клеток предшественников MSC по пути остеогенеза [5].
Также рассматривают системные факторы в сочетании с местными стимулирующими факторами, такими как интерлейкины SIRS (системного воспалительного ответа) – гиперпродукция IL-6, Il-10 [6], MCp-1, MIP1f, Hif1α [7].
С учетом таких морфологических и биохимических особенностей процесса развития ГО формируется примерная модель пациента, имеющего предрасположенность к формированию приобретенной формы ГО – больше всего под описание подходит пациент с сочетанной или множественной травмой.
Способы профилактики развития ГО
На данный момент в мировой литературе представлен медикаментозный вариант профилактики развития ГО путем приема нестероидных противовоспалительных препаратов (NSAIDs) (основной представитель в данной группе – Индометацин) [8]. Также рассматриваются варианты направленной лучевой терапии [9].
Исходя из этого, можно выделить следующие клинические факторы риска развития ГО [10]:
1. Наличие у пациента черепно-мозговой или спинальной травмы.
2. Возраст пациента моложе 30 лет.
3. Ампутации, множественные травмы конечностей.
4. Тяжесть сочетанной травмы, определенная по шкале ISS 16 и более.
5. Длительное нахождение в коме, длительное нахождение на ИВЛ.
6. Травма ЦНС с преобладанием мышечной спастичности.
7. Мужской пол.
8. Высокий уровень интерлейкинов воспаления (точнее, их дисбаланс) – IL-6, IL-10, MCP-1, MIP1a, MCp-1, MIP1f, Hif1α – является признаком развития SIRS [11].
9. Местная или генерализованная инфекция.
Каждый из приведенных клинических факторов риска имеет под собой определенную морфологическую основу, так или иначе влияющую на представленные выше механизмы развития ГО.
На данный момент хирургическое лечение ГО является наиболее результативным. Показания к хирургическому лечению – увеличение амплитуды движения в суставах конечности, придание конечности нормального положения (выведение из патологического положения). Релиз захваченных в очаг оссификации сосудисто-нервых структур в случае их механического сдавления, перегибания.
Осложнения и опасности при хирургическом лечении
В связи с потенциальной неограниченностью роста оссификата сохраняется высокий риск большой интраоперацонной кровопотери из-за большого объема удаляемой ткани, потери основных стабилизаторов сустава в случае параартикулярного расположения патологического очага, травмы сосудисто-нервных структур. Отмечается высокий риск присоединения инфекции в послеоперационном периоде, связанный с образованием полости (минус ткань), а также более высокий риск развития тромбоэмболических осложнений (большая мягкотканная травма, выход тканевого фактора свертываемости в русло). Высока вероятность развития рецидива ГО.
Рассмотрение вопроса о наиболее рациональном выборе времени для хирургического лечения ГО с целью минимизации рисков развития представленных выше осложнений
В мировой литературе бытует два основных мнения о времени для хирургического лечения:
1. Рецидив ГO менее вероятен, если операция задерживается до тех пор, пока ГO не снизит свою метаболическую активность, подтвержденную при помощи сцинтиграфии [12].
2. Более свежие научные работы говорят о том, что стоит удалять оссификаты до критического снижения метаболической активности, что минимизирует интраоперационную травму, позволяет остановить процесс до вовлечения в него важных структур [12].
Хирургическое иссечение ГО до достижения метаболической активности оссификата по данным сцинтиграфии представляет больший клинический интерес, так как подобная тактика позволяется снизить интраоперационную травму, сохранить еще не затронутые процессом образования, избежать или снизить риск многих осложнений, связанных с травматизацией тканей. Меньшая интраоперационная травма снижает местную активность медиаторов воспаления и позволяет снизить вероятность повторной активизации MSC по пути развития остеогенерации и рецидива ГО. Это позволяет намного раньше активизировать пациента в послеоперационном периоде.
КЛИНИЧЕСКИЙ ПРИМЕР
Рисунок 1. Рентгенограмма левого тазобедренного сустава в аксиальной проекции. Выполнена на 35-е сутки от момента травмы. Имеются начальные рентгенологические признаки формирующейся гетеротопической оссификации большого и малого вертелов
На 37-е сутки после травмы выполнен интрамедуллярный остеосинтез костей голени.
На момент выписки пациентка активизирована, самостоятельно ходит без опоры на правую нижнюю конечность. Движения в левом тазобедренном суставе в полном объеме, безболезненные. Обращает на себя внимание некоторый дискомфорт при движении в левом тазобедренном суставе, однако он никак не ограничивает амплитуду движений, не препятствует активизации.
Через 1,5 года после травмы больная обратилась с жалобами на отсутствие движений в левом тазобедренном суставе. На рентгенограмме левого тазобедренного сустава определяется гетеротопическая оссификация области левого тазобедренного сустава Brooker класс 4 [13] (рис. 2), топически на основании рентгенограмм определяется поражение капсульно-связочного аппарата сустава и подвздошной мышцы слева.
Рисунок 2. Рентгенограмма таза через 1,5 года после получения травмы. Определяется гетеротопическая оссификация капсульно-связочного аппарата левого тазобедренного сустава и подвздошной мышцы слева
Была проведена сцинтиграфия, на которой отмечена высокая метаболическая активность гетеротопического очага окостенения (184 % накопления фармпрепарата от нормы), от оперативного вмешательства принято решение отказаться.
На сцинтиграфии от 2015 года (через 4 года после травмы) выявлена минимальная метаболическая активность очага оссификации (76 % накопления фармпрепарата от нормы).
На рентгенограмме от 2016 года (через 5 лет от момента травмы) выявлено, что оссификат без динамики.
Больная предъявляла жалобы на отсутствие движений в левом тазобедренном суставе, хромоту, снижение качества жизни. С целью определения точной локализации объемного образования и оценки поражения окружающих структур выполнена компьютерная томография таза (рис. 3).
Рисунок 3. Компютерная томография таза через 5 лет после травмы. Определяется гетеротопическая оссификация области левого тазобедренного сустава. Локализации объемного образования в области капсулы и подвздошной мышцы области левого тазобедренного сустава
С целью восстановления движения в левом тазобедренном суставе принято решение о проведении оперативного лечении. Решено определить объем вмешательства интраоперационно: выполнить только удаление оссификатов или после удаления оссификатов выполнить эндопротезирование тазобедренного сустава.
Риски проведения оперативного вмешательства : предполагалась кровопотеря, в области, затронутой развитием гетеротопической оссификации, расположены артерии, огибающие шейку бедренной кости; артерии включены в костную ткань, что затрудняет гемостаз. Был выставлен высокий риск полной девитализации головки бедренной кости с последующей интраоперационной оценкой вероятности асептического некроза в дальнейшем.
Интраоперационно : оссификаты представляют из себя полностью оссифицированную капсулу левого тазобедренного сустава и левую подвздошную мышцу (рис. 4). При иссечении гетеротопических оссификатов выявлено, что все основные источники кровоснабжения головки бедра включены в патологический процесс, при их полном иссечении для возвращения возможности движений в суставе головка бедренной кости останется девитализированной. Принято решение о тотальном эндопротезировании тазобедренного сустава (рис. 5). Выполнено гистологическое исследование удаленных оссификатов (рис. 6). По результатам исследований удаленная ткань соответствует компактному костному веществу.
Рисунок 4. Фотография интраоперационной раны. Стрелкой обозначена зона гетеротопической оссификации по ходу подвздошной мышцы. Плотность ткани соответствовала плотности кортикальной кости. Оссификат соответствовал капсуле сустава и левой подвздошной мышце
Рисунок 5. Контрольная рентгенограмма костей таза после иссечения оссификатов и выполнения тотального эндопротезирования левого тазобедренного сустава
Рисунок 6. Микропрепарат удаленной ткани, вещество соответствует компактной костной ткани
Функциональный результат: по шкале Харриса 86 баллов из 100, что соответствует хорошему результату (рис. 7-10).
Рисунок 7. Контрольная рентгенограмма костей таза через 2 года после проведенного оперативного лечения
Рисунок 8. Демонстрация функции левого тазобедренного сустава через 2 года после проведенного оперативного лечения (отведение)
Рисунок 9. Демонстрация функции левого тазобедренного сустава через 2 года после проведенного оперативного лечения (сгибание)
Рисунок 10. Демонстрация функциилевого тазобедренного сустава через 2 года после проведенного оперативного лечения (сгибание)
Первичные проявления гетеротопической оссификации области тазобедренного сустава у больной выявлены на 35-й день с момента травмы.
Прием НПВС для профилактики развития ГО не был достаточно успешным.
Тактика выполнения оперативного вмешательства после полного формирования оссификата позволяет существенно снизить риски развития рецидива ГО, однако приводит к необходимости выполнения большего объема операции и также обуславливает более радикальные типы операций, не позволяя останавливаться на органосохраняющих методах.
Проблема ГО у больных с тяжелой сочетанной травмой по сей день остается дискутабельной и требует дальнейшего изучения.
Информация о финансировании и конфликте интересов
Исследование не имело спонсорской поддержки.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
1. Elfimov SV, Kuznetsova NL, Solodovnikov AG. Prognosing of heterotopic ossification after operations and injuries to hip joint. Polytrauma . 2011; (2): 14-19. Russian (Елфимов С.В., Кузнецова Н.Л., Солодовников А.Г. Прогнозирование гетеротопической оссификации после операций и травм тазобедренного сустава //Политравма. 2011. № 2. С. 14-19)
2. Ruoshi X., Jiajie Hu , Xuedong Z. , Yingzi Y. Heterotopic ossification : Mechanistic insights and clinical challenges . Bone. 2018; 109: 134-142
3. Loder S, Agarwal S , Sorkin M , Breuler C , Li J , Peterson J et al. Lymphatic contribution to the cellular niche in heterotopic ossification. Ann Surg . 2016; 264 (6): 1174-1180
4. Qureshi AT, Dey D, Sanders EM, Seavey JG, Tomasino AM, Moss K et al. Inhibition of m ammalian t arget of rapamycin s ignaling with r apamycin p revents t rauma -i nduced h eterotopic ossification. American Journal of Pathology. 2017; 187(11): 2536-2545
5. Dey D, Bagarova J , Hatsell SJ , Armstrong KA , Huang L , Ermann J et al. Two tissue-resident progenitor lineages drive distinct phenotypes of heterotopic ossification. SciTransl Med . 2016; 8 (366): 366ra163
6. Agarwal S, Loder SJ , Sorkin M , Li S , Shrestha S , Zhao B et al. Analysis of bone-cartilage-stromal progenitor populations in trauma induced and genetic models of heterotopic ossification. Stem Cells. 2016; 34 (6): 1692-701
7. Agarwal S, Loder SJ, Breuler C, Li J, Cholok D, Brownley C et al. Strategic targeting of multiple BMP receptors prevents trauma-induced heterotopic ossification. MolTher. 2017; 25(8): 1974-1987
8. Milakovic M, Popovic M, Raman S, Tsao M, Lam H, Chow E. Radiotherapy for the prophylaxis of heterotopic ossification: a systematic review and meta-analysis of randomized controlled trials. Radiotherapy and Oncology. 2015; 116(1): 4-9
9. Kan SL , Yang B , Ning GZ , Chen LX , Li YL , Gao SJ at al. Nonsteroidal anti-inflammatory drugs as prophylaxis for heterotopic ossification after total hip arthroplasty. Medicine ( Baltimore) . 2015; 94(18): e828
10. Agarwal S, Loder SJ, Cholok D, Peterson J, Peterson J , Li J et al. Scleraxis -l ineage cells contributeto ectopic bone formation in muscle and tendon . Stem Cells . 2017 ; 35 ( 3 ): 705 - 710
11. Qureshi AT, Dey D, Sanders EM, Seavey JG, Tomasino AM, Moss K et al. Inhibition of m ammalian t arget of rapamycin s ignaling with r apamycin p revents t rauma -i nduced h eterotopic ossification. American Journal of Pathology. 2017; 187(11): 2536-2545
12. Zhang X , Jie S , Liu T , Zhang X . Acquired heterotopic ossification in hips and knees following encephalitis: case report and literature review. BMC Surgery . 2014; 14: 74
13. Hug KT , Alton TB , Gee AO . Classifications in brief: Brooker classification of heterotopic ossification after total hip arthroplasty. Clin Orthop Relat Res. 2015; 473(6): 2154-2157
Читайте также:


