Некроз при переломе руки
В настоящее время растет число пострадавших с тяжелыми открытыми травмами конечностей.
Причинами этого являются, с одной стороны, рост числа дорожно-транспортных происшествий, с другой — улучшение средств пассивной безопасности автомобилей,защищающих жизненно важные органы и повышающих выживаемость пострадавших.
В настоящее время растет число пострадавших с тяжелыми открытыми травмами конечностей.
Причинами этого являются, с одной стороны, рост числа дорожно-транспортных происшествий, с другой — улучшение средств пассивной безопасности автомобилей,защищающих жизненно важные органы и повышающих выживаемость пострадавших. Улучшение догоспитальной помощи и совершенствование интенсивной
терапии также повышают выживаемость пострадавших после тяжелых высокоэнергетических травм, что делает
актуальной проблему последующего лечения повреждений конечностей в этой группе .
При высокоэнергетической травме одной из наиболее часто травмируемых областей является голень. При этом,как правило ,видно из рентгенограмм, около 30% переломов голени являются открытыми. Около половины открытых переломов костей голени осложняются развитием дефектов мягких тканей . Причинами этого являются, с одной стороны, уникальные анатомические особенности данного сегмента: большеберцовая кость на всем протяжении
по переднемедиальной поверхности укрыта только тонким слоем кожи и подкожной жировой клетчатки.
Эти ткани легко повреждаются и отслаиваются при травмах голени. С другой стороны, область голени является одной из наиболее плохо кровоснабжаемых областей тела , что приводит к частому развитию некроза покровных тканей при открытых переломах костей голени.
В настоящее время не подвергается сомнению утверждение, что состояние покровных тканей при открытых переломах костей голени играет первостепенную роль в прогнозировании частоты развития осложнений, консолидации перелома и восстановлении функции конечности . Наличие дефекта мягких тканей в области перелома костей голени приводит к развитию глубокого нагноения раны, некрозу участков большеберцовой кости вследствие высыхания и инфицирования, развитию хронического воспаления
окружающих тканей.
Избежать осложнений и в короткие сроки восстановить функцию поврежденной конечности у пострадавших с открытыми переломами костей голени,осложненными дефектами мягких тканей, позволяет реконструкция покровных тканей в ранние сроки .
Для этого используются местные и свободные реваскуляризированные лоскуты различного тканевого состава. Сообщается о хороших функциональных результатах лечения пострадавших с открытыми переломами
костей голени при использовании тактики раннего восстановления покровных тканей.
Однако другими авторами упоминаются трудности применения данной тактики в практической медицине. Одной из главных проблем проведения неотложных реконструктивных операций является тяжесть состояния пострадавших. Около 30% пострадавших с тяжелыми открытыми переломами костей голени имеют сочетанные повреждения, значительно влияющие на нее. Выполнение обширных реконструктивных вмешательств пациентам в нестабильном
состоянии сопряжено с высоким риском развития жизнеугрожающих осложнений.
В настоящее время общепринятой является схема оценки тяжести состояния пострадавших по критериям Pape–Krettek и применение в наиболее тяжелых группах пострадавших тактики Damage Control,основным принципом которой является минимизация дополнительной травмы от первичной операции и выполнение окончательной хирургической реконструкции поврежденной области после стабилизации состояния пациента . Однако описание применения и модификации данной тактики при тяжелых открытых переломах костей голени в литературе практически не встречаются.
Другой проблемой является то, что имеется большое количество методов реконструкции покровных тканей в области голени. Это и кожно-фасциальные лоскуты на широком основании, и кожно-фасциальные
лоскуты с осевым типом кровоснабжения, и кожно-фасциальные лоскуты на перфорантных сосудах, и
различные местные мышечные лоскуты, и свободные реваскуляризированные лоскуты различного тканевого состава.
Вопрос выбора лоскута определенного тканевого состава, типа взаимоотношения с донорским ложем и типа кровоснабжения для восстановления мягко-тканого окружения при тяжелом открытом переломе
недостаточно освещен в литературе. Выбор между кожно-фасциальными лоскутами на широком основании, кожно-фасциальными лоскутами с осевым типом кровоснабжения, кожно-фасциальными лоскутами на перфорантных сосудах, различными местными мышечными лоскутами, свободными реваскуляризированными лоскутами различного тканевого состава затруднителен для хирурга, занимающегося реконструкцией конечности. Однако работы, посвященные данной актуальной тематике, встречаются редко и не представляют четкого и простого алгоритма для проведения реконструкции мягких тканей при тяжелом открытом переломе костей голени.
В НИИ скорой помощи им.Н.В. Склифосовского ретроспективно и проспективно изучали ход и результаты лечения у 84 пострадавших с тяжелыми открытыми переломами костей голени, осложненными дефектами мягких тканей. Все повреждения получены в результате высокоэнергетической травмы.
По величине небольшие дефекты мягких тканей (менее 0,5% поверхности тела) имелись у 56 пациентов, обширные дефекты мягких тканей(более 0,5% поверхности тела) отмечены у 28 больных.
У всех пострадавших обнаженной функциональной структурой в ране была большеберцовая кость, а в
5 случаях — также малоберцовая кость.У 56 пациентов (группа сравнения) по понятным причинам лечение проводилось без четкого алгоритма.
У этих больных была применена тактика отсроченного восстановления покровных тканей. Восстановление
мягких тканей голени методами пластической хирургии в этой группе осуществляли в поздние сроки после
длительных попыток консервативного лечения. При этом лишь у 4 пострадавших при поступлении были
использованы кожно-фасциальные лоскуты на широком основании. Сложные реконструктивные операции по замещению дефекта мягких тканей лоскутом выполнены только у 38 пациентов, а закрытие дефекта
мягких тканей методом острого укорочения сегмента — у 6 пострадавших этой группы; восстановление
мягких тканей с помощью длительного местного лечения проведено в 11 случаях. Средний срок выполнения
реконструктивных операций по восстановлению мягко тканого покрова голени в группе сравнения соста-
вил 45,8 сут после травмы (от 0 до 112 сут).
У 28 пострадавших (исследуемая группа) мы применили разработанный нами алгоритм раннего восстановления покровных тканей голени .
При наличии первичного дефекта мягких тканей в области перелома выбор способа реконструкции зависел, в соответствии с алгоритмом, от тяжести состояния при поступлении по критериям Pape–Krettek. Так,5 пострадавшим, поступившим в стабильном состоянии, применяли как свободные реваскуляризированные, так и местные осевые мышечные лоскуты для восстановления мягкотканого покрова в ходе первичной операции.
Если состояние пострадавшего при поступлении оценивалось как пограничное (8 случаев), то после интенсивной терапии и стабилизации гемодинамики, после выполнения хирургической обработки раны и стабилизации перелома проводили первичную реконструкцию мягких тканей местными лоскутами. При наличии обширного дефекта мягких тканей и необходимости применения свободных реваскуляризированных лоскутов реконструкцию проводили
отсроченно, через 4–5 сут после травмы, после окончательной стабилизации состояния пациента. Если
состояние пострадавшего при поступлении оценивали как нестабильное (2 случая), то после хирургической
обработки раны и фиксации перелома накладывали на область перелома окклюзионные повязки, а вос-
становление мягких тканей выполняли в отсроченном порядке через 4–5 сут после травмы, преимущественно используя местные лоскуты с осевым типом кровоснабжения. У одного пострадавшего, поступившего в критическом состоянии, реконструкцию мягких тканей голени выполняли с длительной отсрочкой (на 15 сут), после окончательной стабилизации состояния и лечения сочетанных повреждений. При развитии вторичного дефекта мягких тканей в области перелома (11 пострадавших) применяли тактику ранней некрэктомии, в срок до 10 сут после травмы, до развития раневой инфекции, с одномоментным замещением образовавшегося дефекта мягких тканей. Выбор определенного лоскута для замещения мягких тканей осуществляли на основании схемы, описанной
Для восстановления покровных тканей в области перелома в основной группе мы преимущественно
использовали мышечные лоскуты как обладающие наилучшей васкуляризацией и наилучшими санационными свойствами.
При наличии дефекта мягких тканей в области перелома костей голени оценивали его величину и локализацию. По величине различали небольшие дефекты менее половины площади кисти пациента(0,5% поверхности тела пациента) и протяженностью обнаженного участка большеберцовой кости менее ширины кисти пациента на уровне головок пястных костей. Также различали обширные дефекты мягких тканей, превышающие по величине половину площади кисти пациента (0,5% поверхности тела пациента),а по протяженности обнаженного участка большеберцовой кости — более ширины кисти на уровне головок пястных костей.
По локализации различали дефекты на пяти различных уровнях голени при ширине уровня, примерно
соответствующей ширине кисти на уровне головок пястных костей. Для закрытия небольших дефектов
мягких тканей I уровня применяли лоскуты из медиальной и латеральной головок икроножных мышц (у 2 пациентов основной группы). При выделении этих лоскутов считали необходимым иссечение плотного апоневроза по передней поверхности мышцы для обеспечения контакта перелома с хорошо васкуляризированной мышечной тканью. Для замещения небольших дефектов мягких тканей на II и III уровнях голени мы применяли мышечный лоскут из медиальной половины камбаловидной мышцы (17 пациентов).
Резервными методами для замещения дефектов мягких тканей I, II и III уровней являются медиальный и
латеральный кожно-фасциальные лоскуты голени на широком основании (2 пациента). Для восстановления
мягких тканей при дефекте на IV и V уровнях голени мы считаем необходимым применение свободных
реваскуляризированных лоскутов, в частности, свободного реваскуляризированного лоскута из латеральной
широкой мышцы бедра (1 пациент). При невозможности (по причине тяжести состояния пострадавшего
или выраженного атеросклероза артерий голени) применения свободных реваскуляризированных лоскутов
на этих уровнях выполняли замещение дефекта местным икроножным (суральным) кожно-фасциальным
лоскутом на ретроградном кровотоке (1 пациент).
У пострадавших с открытыми переломами костей голени, осложненными обширными дефектами мягких тканей, размеры которых превышают ширину I уровня, и площадью более половины площади кисти пострадавшего, мы применили свободные реваскуляризированные лоскуты (4 пострадавших). Закрытие расщепленным кожным лоскутом поверхности мышечных лоскутов проводили, как правило, одномоментно, за исключением случая пересадки большого мышечного лоскута площадью около 2% поверхности тела. В этом случае аутодермопластику проводили отсроченно, чтобы избежать потери расщепленного кожного трансплантата большой площади при некрозе мышечного лоскута.
В ходе исследования в исследуемой группе и группе сравнения оценивали частоту развития некроза
пересаженного лоскута, требующего дополнительных операций, частоту развития глубокой раневой инфекции, некроза значительных участков большеберцовой кости, хронического остеомиелита. Также в отдаленном периоде, через 10–12 мес после травмы, оценивали частоту развития несращения большеберцовой кости и частоту выраженных ограничений движений голеностопного и коленного суставов. Функциональный результат в исследуемой и контрольной группах оценивали по шкале LEFS. Статистическую обработку данных
проводили в программе MedCalc. Анализ значимости различий количественных признаков выполняли по
критерию Стьюдента, анализ значимости различий качественных признаков проводили по методу Фишера(уровень достоверности — 0,05).
РЕЗУЛЬТАТЫ
При анализе результатов в исследуемой группе частота некроза лоскута, требовавшего выполнения дополнительной операции по восстановлению покровных тканей, составила 21,4%, в группе сравнения — 25%.
Различия, возможно, связаны с лучшим подбором лоскута в исследуемой группе, а также с более ран-
ним выполнением операций по пересадке лоскутов в исследуемой группе, до развития фиброза сосудисто-нервных пучков. Однако эти различия не являются статистически значимыми, так как вероятность нулевой
гипотезы (p) составляет 0,792, что значительно больше доверительной вероятности, равной 0,05.
Частота глубокой раневой инфекции в исследуемой группе составила 11,1%, а в группе сравнения — 37,5%.
При статистическом анализе выявлена высокая статистическая значимость этих различий (p=0,011). Такие
различия мы объясняем тем, что раннее восстановление мягких тканей предотвращает инфицирование
высоковирулентными госпитальными штаммами бактерий и развитие раневой инфекции в подлежащих
тканях. Также преимущественное использование в исследуемой группе мышечных лоскутов, обладающих
наилучшими санационными свойствами, способствует снижению частоты гнойных осложнений.
В исследуемой группе, где применен алгоритм раннего восстановления покровных тканей голени при
открытых переломах, частота некроза значительных участков большеберцовой кости составила 14,4%, что
существенно ниже, чем в группе сравнения — 50%. При статистической проверке выявлена очень высокая значимость этих различий (p=0,0017). По нашему мнению,эти данные говорят о том, что раннее восстановление
покровных тканей голени позволяет сохранить жизнеспособность, предотвратить некроз и инфицирование деваскуляризированных и обнаженных участков большеберцовой кости, что, в свою очередь, предотвращает образование дефектов кости. Как следствие выше изложенных фактов, мы отметили существенное снижение частоты развития поздней хронической инфекции в форме остеомиелита (14,8% в основной группе, против 53,6% в контрольной). При статистической проверке по методу Фишера выявлена также очень высокая значимость этих различий (p=0,0008).
ОБСУЖДЕНИЯ РЕЗУЛЬТАТОВ
При сравнении результатов нашего исследования с результатами других авторов данные о частоте некрозов лоскутов и глубокой инфекции в основном сопоставимы . Во всех исследованиях отмечено, что ранняя реконструкция мягких тканей голени у пострадавших с тяжелыми открытыми переломами позволяет
значительно сократить частоту раневой инфекции за счет предотвращения некроза и инфицирования подлежащих тканей. Также многие авторы отмечают, что ранняя реконструкция мягкотканого окружения перелома позволяет значительно снизить частоту некрозов лоскутов. Это обусловлено тем, что в ранние сроки не успевают развиться воспалительные изменения сосудистых пучков, к которым подключаются свободные
лоскуты, а также не происходит дополнительной потери тканей вследствие инфицирования и воспаления,
что позволяет применять более простые методы для закрытия дефекта. Сроки раннего закрытия у различных авторов варьируют от 72 ч до 10 сут.
Однако работ по вопросу выбора тактики реконструкции мягких тканей у пострадавших с открытыми
переломами костей голени мало .
Большинство авторов сходятся во мнении, что пересадка мышечного лоскута является наиболее
эффективным методом восстановления мягких тканей при открытых переломах костей голени. Однако
вопросы выбора определенного метода в зависимости от анатомических характеристик дефекта освещены
недостаточно. В основном это схемы разделения голени на верхнюю, среднюю и нижнюю треть. Однако, как
было показано в нашем предыдущем исследовании, эта схема требует уточнения.
Однако мы считаем, что подсчет площади дефекта с точностью до квадратного сантиметра не имеет клинического значения, к тому же пациенты встречаются разного роста и разной комплекции, соответственно дефект мягких тканей одной и той же площади не может быть закрыт одними и теми же методами. Поэтому схема примерной оценки площади и протяженности дефекта по отношению к площади и ширине кисти пациента имеет, по нашему
мнению, большее клиническое значение.
ЗАКЛЮЧЕНИЕ
Качество мягкотканого окружения играет важнейшую роль в предотвращении развития гнойных осложнений и сохранении жизнеспособности большеберцовой кости у пострадавших с тяжелыми открытыми переломами костей голени. Применение разработанного в нашей клинике алгоритма раннего восстановления покровных тканей статистически значимо снижает частоту развития глубокой раневой инфекции и хронического остеомиелита. Раннее восстановление покровных тканей позволяет сохранить жизнеспособность обнаженных участков большеберцовой кости, что предотвращает развитие дефектов костной ткани.
Важным результатом применения систематизированного подхода к восстановлению покровных тканей у
пострадавших с тяжелыми открытыми переломами костей голени является статистически значимое снижение сроков стационарного лечения пострадавших.
Каждый человек в день рождения имеет в своем скелете 270 костей. Позже часть из них (это кости черепа, таза и позвоночника) сращивается и сохраняется порядка 205 штук. Все они объединены в одно целое при помощи суставов, связок и прочих соединений. Скелет это опора всего организма. Без полноценной костной системы человек не будет иметь возможности двигаться, да и просто стоять тоже. Следовательно опорная функция это важная способность жизнедеятельности.
Заболевания костей приводят к изменению походки, сложности при наклонах или поворотах, непосредственно деформации конечностей или позвоночника. Могут быть врожденными, приобретенными в следствие травмы, быть осложнением от перенесенного ранее заболевания. Подвержены ему все.
Что такое некроз кости
Нужно разобраться с темой некроз костей —, что это такое. Кость это ткань, требующая энергию. Если кровообращение будет нарушено или остановлено, произойдет отмирание, деформация и уничтожение ткани. Некрозу подвержены предплечья, колени, тазобедренные суставы, плечевые кости и лодыжки.
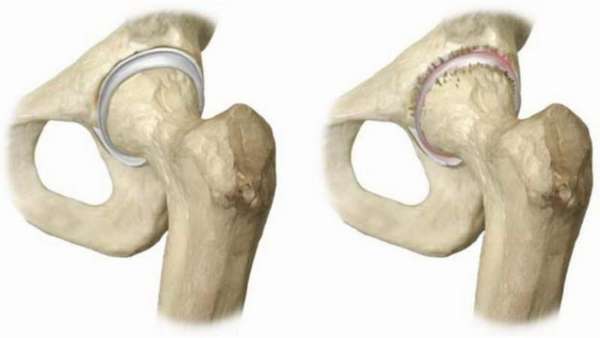
Называют асептическим некрозом его из за того, что заболевание проходит в отсутствие воспалительного процесса, без микроорганизмов-возбудителей. Его различия:
- полный (общий) некроз. При нем атрофируется кость целиком или почти целиком,
- неполный (частичный). Поражение происходит на каком-то пространстве,
- поверхностный (кортикальный). Отмирание происходит на поверхности кости,
- центральный (глубокий). Разрушается происходит глубоко внутри.
Некроз костной ткани обычно встречается у людей 25-45 лет. Стремительное прогрессирование заболевания приводит к утрате трудоспособности, если своевременно не диагностировать и не лечить его.
Причины некроза
При изменении снабжения костной ткани кровью, начинается некроз, который обычно наступает в следующих случаях:
- вследствие травмы. Перелом, ушиб или во время операции при повреждении сосудов механическим способом. Симптомы некроза проявляются не скоро —, через 1.5-2 года,
- длительный приём кортикостероидов. Этими препаратами лечат артриты, аллергические или аутоиммунные болезни. Их применение приводит к сужению кровеносных сосудов, и проблемам с питанием клеток кости, остеопорозу,
- нарушение метаболизма, лишний вес. При плохом питании процветает атеросклероз, когда наслоение холестерина в кровеносных сосудах ведет к их забиванию. В добавок, излишнюю нагрузку на нижние конечности влечет за собой лишний вес,
- плохие привычки и алкоголизм. Ведут к развитию атеросклероза,
- аутоиммунные заболевания. Для их лечения используется кортикостероиды, которые сужают стенки кровеносных сосудов, доводят их до истощения питания,
- заболевания позвоночника. При наличии межпозвоночной грыжи, происходит сдавливание нервных окончаний и сосудов, вследствие чего костная ткань не получает питание в полном объеме. Начинается аваскулярный некроз головки бедренной кости. Асептический некроз головки плечевой кости начнется при такой же ситуации в верхнем отделе позвоночника (шейный, грудной),
- прочие причины. Из за того, что асептический некроз сопровождается другими хроническими и острыми заболеваниями, то понять причины его появления не получается.
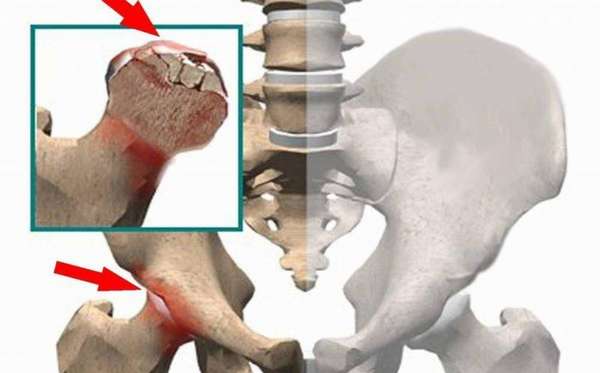
Болезнь встречается и у детей. Почему так происходит до конца не понятно. Зачастую развивается вместе с наследственным заболеванием при котором происходит недоразвитость позвоночника.
Классификация заболевания
Выделяются этапы:
- первый этап. От 0 до 6 месяцев. Ограничения двигательной функции нет, но разрушается губчатое вещество в самой кости, форма не меняется,
- второй этап —, стадия сдавленного перелома. Тоже продолжительность шесть месяцев. Из за увеличенной нагрузки на головку кости случается перелом балок костной ткани. Балки сминаются и начинается процедура деформации самой кости,
- третий этап —, стадия рассасывания. Протяженность около полутора лет. Осколки кости с мертвыми тканями перерабатываются крепкими клетками, поврежденные участки наполняются соединительной тканью. Подпитка клеток и тканей продолжает осуществляться и растут новые кровеносные сосуды. Но уже прерывается возможность роста шейки кости, что приводит к ее укорачиванию,
- четвертый этап —, конец. Соединительная ткань становится костной. Прерывается правильная структура костной ткани. Искажение и утолщение вертлужной впадины тазобедренного сустава (или любого другого) ведет к дезорганизации соединения кости с суставом.
Сколько займет времени и какова будет интенсивность каждой из четырех стадий напрямую зависит от возраста, здоровья в целом и физической подготовки каждого человека.
Немаловажную роль играет на каком из этапов была обнаружена болезнь и приступили ли к лечению.
Симптомы асептического некроза коленного сустава
Соединение большеберцовой и бедренной костей ноги с надколенником образуют коленный сустав. Сверху образована бедренная кость с утолщениями (мыщелки) и нижняя —, большеберцовая. Коленная чашечка (надколенник) играет роль ограничителя разгиба и находится спереди.
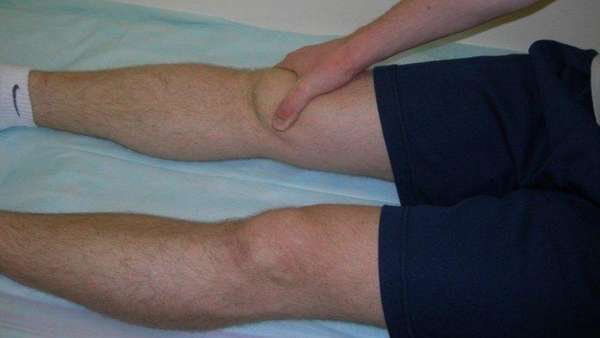
Клетки в костных тканях омертвевают, что приводит к их разрушению.
При данном некрозе болезнь протекает в три стадии со следующими симптомами:
- начальная (первая) стадия. Боль носит кратковременный характер, усиливающаяся от нагрузок. Иногда сопровождается отеканием коленного сустава,
- вторая стадия. Боль уже постоянная, хочется распрямить ногу, появляется хромота,
- третья стадия. В полость выходит суставная мышца, боль то средняя, то сильная, суставу сложно двигаться.
Большая часть пациентов с таким диагнозом это люди пенсионного возраста (80%), молодых всего около 20%.
Диагностика заболевания
В 21 веке идет целенаправленное изучение этого заболевания. Изучаются причины развития болезни. Потому что, как правило, у большей части пациентов точный диагноз ставится аж через 10-15 месяцев с начала болезни.
Чтобы установить точный диагноз нужно провести диагностику. Симптомы и первые проявления зависят от конкретного места некроза. Этапы:
- врач первично делает осмотр, находит поврежденные суставы, уточняет силу мышц, их подвижность и локальные рефлексы,
- далее пациент отправляется на рентген. К сожалению показывает лишь последние стадии,
- прохождение магнитно-резонансная томографии. Это самый точный метод. При помощи ее некроз определяется на первых признаках отмирания костей. Недостаток ее в том, что процедура это дорогая и присутствует не в каждом лечебном учреждении,
- в процессе диагностирования некроза определяется показатель образования кости и уровни углеводного, минерального и жирового обмена.
Чтобы лечение было максимально эффективным важно быстро и верно обнаружить болезнь, дать ее точное название, а главное определить причину, по которой некроз «,пришел», к человеку.
Лечение асептического некроза коленного сустава
Главный залог терапии это оказание помощи больному вовремя. Врачи рекомендуют обращаться к медицинским работникам при первых признаках и недомоганиях, тогда остеонекроз коленного сустава или асептический некроз медиального мыщелка бедренной кости, или любой другой некроз можно будет вылечить.
При диагностировании у пациента заболевания асептический некроз коленного сустава лечение носит медикаментозные назначения и если не помогает, то используют хирургическое вмешательство.
В современной медицине используются два типа лечения:
- Консервативный.
- Хирургический.
К лечению медикаментами прибегают на первых порах. Чтобы избавиться от некроза используют:
- лекарства, улучшающие местное кровообращение (сосудистые),
- кальцийсодержащие препараты, для восстановления костной ткани (с тидроновой кислотой),
- витамин Д, повышающий прочность костей,
- препараты, способствующие восстановлению хряща и уменьшению воспалительных процессов, болевые ощущения,
- витамины группы В, чтобы восстановить здоровый синтез белка и усвоение магния,
- обезболивающее,
- для расслабления мышц, поврежденных конечностей, давая возможность нормализовать импульсы и кровоснабжение.
Чтобы полученный результат этого типа лечения закрепился показана лечебная физкультура, физиотерапевтические процедуры и медицинский массаж. Благодаря этому комплексу мер кости и ткани будут укрепляться и противостоять недугам в дальнейшем.
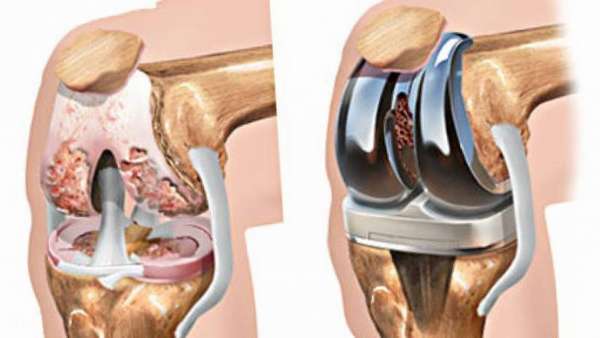
К сожалению, асептический некроз коленного сустава или некроз головки бедренной кости часто не диагностируется на ранних стадиях, когда консервативное лечение может помочь. Либо болезнь определилась рано, но медикаментозное лечение не оказало результата. Тогда остается лишь прибегнуть к способам хирургического вмешательства.
Оно бывает двух видов:
- эндопротезирование. В поврежденный сустав вставляется имплант (может быть искусственным или из собственных тканей больного),
- артродез. При такой операции окончания костей обрезаются и соединяются так, чтобы они могли срастись. Боль пройдет, но и подвижности сустава не будет. Делают такую операцию редко.
Порой только хирургические манипуляции помогут человеку избавиться от боли и дать возможность жить полноценно.
Лечение народными средствами могут использоваться только на первоначальной стадии болезни. Они не являются самодостаточными, а могут лишь дополнять консервативные методы лечения.
Что может помочь выздоровлению:
- скипидар. Он применяется как компресс для активизации кровоснабжения клеток кости,
- жир животных. Свиное сало или жир нутрии перетапливают в равных долях и намазывают больные суставы,
- капуста. Для создания нагрева делают компресс из капустного листа, смазанного медом.
Рецептом народной медицины огромное количество.
Диета
Пациент в период лечения и далее должен придерживаться принципов правильного питания, чтобы привести в норму свой обмен веществ и метаболизм в организме. Алкоголь запрещен.
При сбалансированном питании в организм человека попадают:
- хондропротекторы (омега3 жирные кислоты),
- минералы (магний, фосфор, фтор и прочее),
- витамины группы В.
Главное стараться, чтобы продукты поступали внутрь в свежем и сыром виде, без применения термообработки. Это сохранит витамины и минералы в виде, доступном для легкого усвоения.
Реабилитация
Ограничиваются физические нагрузки на заболевший сустав, но не целиком, чтобы не атрофировать его совсем и осложнить состояние. Применяются умеренные физические нагрузки под контролем врача. Показаны занятия лечебной физкультурой.
Назначается электростимуляция мышц, массаж.
Заключение
При своевременном обращении к врачу, некроз суставов в настоящее время это не приговор. Врач назначит квалифицированное лечение, согласно стадии заболевания, определит путь лечения: медикаментами или при помощи хирургической операции. Пациент может дополнить свое лечение народными средствами.
После выздоровление стоит продолжать соблюдать правильный образ жизни и здоровое питание, чтобы организм был способен противостоять любым болезням.
- Recent Entries
- Archive
- Friends
- Profile
- Memories
Лечение некроза кожи мягких тканей
Проблемы и возможности восстановительного лечения больных с некрозом мягких тканей и костей конечностей
Причиной возникновения некроза тканей является нарушение питания определенного участка тканей вследствие травмы или ее гнилостного воспаления, а чаще совместное влияние того и другого. Происходит это из-за воздействия на клетки механической силы (разрывы, сдавления), а также вследствие развивающейся инфекции и высоких или низких температур.
Некротизироваться могут любые ткани и органы. На быстроту и степень распространения омертвения оказывает влияние продолжающееся механическое воздействие, присоединение инфекции, а также особенности анатомо-физиологического строения поврежденного органа.
Лечебные мероприятия направлены на поддержание общего состояния с использованием активной инфузионной терапии (крови, кровезаменителей, антибиотиков, витаминов и др).
Местное лечение заключается в удалении некроза в пределах здоровых тканей, а объем оперативного вмешательства зависит от вида гангрены, которая бывает сухой и влажной. Сухая протекает благоприятно, и оперативное вмешательство показано при формировании демаркационной линии. При влажной гангрене, когда резко выражены общие проявления, сопровождающиеся тяжелой интоксикацией, проводится немедленная ампутация конечности в пределах здоровых тканей, то есть выше уровня границы некроза.
Известно, что более дифференцированные ткани поражаются гораздо раньше. Поэтому при некрозе мышц и кожи сухожилия и кости оказываются в относительно не пораженном состоянии. При оперативном вмешательстве необходимо учитывать данное явление и не удалять некротизированные участки на всю глубину, а иссекать только пораженные (костную ткань не иссекать независимо от состояния жизнеспособности) с замещением полноценным питающимся кожно-подкожным лоскутом на ножке. Гнойные осложнения ликвидировать путем регионарной инфузии антибиотиков.
При выявлении непораженных костей и сухожилий они закрываются пластическим материалом по одному из существующих методов. В таких случаях удается сохранить сегмент конечности и предотвратить инвалидность пострадавшего. Таких больных было 11.
Все они оперированы по принятой нами методике, которая заключалась в катетеризации магистрального сосуда, удалении некротизированных мягких тканей с замещением мягкотканного дефекта лоскутом на питающей ножке.
У 5-ти из них было повреждение голени, у двух–стопы, у одного–предплечья, а у трех некроз кисти.
У всех больных очень тяжелое повреждение с поражением мягких тканей и кости, у 2-х больных с закрытым переломом голени в результате неправильного лечения (наложена циркулярная гипсовая повязка) наступил некроз голени, потребовавший некрэктомии сегмента.
У одного больного, поступившего через 3-е суток от момента повреждения предплечья, были признаки некроза сегмента на уровне перелома. У другого больного некроз пяточной кости и таранной кости, которые в процессе лечения были удалены.
У трех больных–открытый перелом нижней трети костей голени с острым гнойным осложнением и некрозом большеберцовой кости в пределах 10–15 см.
У одной больной, кисть которой попала под пресс, развился некроз мягких тканей кисти и другие повреждения. Все больные требовали нестандартного подхода в восстановительном лечении.
Поскольку степень повреждения и пораженности рассматриваемых больных очень разнообразна, а систематизация затруднительна, в качестве иллюстрации приведем несколько различных видов поражений.
Примером может быть больная Б. 26 лет.
Во время работы на прессе правая кисть попала под него. Пациентка доставлена в хирургическое отделение районной больницы.
Следовало учесть механизм образования вокруг кисти раны, вызванной от сдавления прессом и возникшей по краю его воздействия. Можно было предположить, что мягкие ткани так поражены, что рассчитывать на их восстановление после воздействия двухтонного пресса нельзя. Образовавшаяся рана на уровне лучезапястного сустава с тыльной поверхности и по верхней борозде с ладонной стороны ушита наглухо, наложена гипсовая шина.
В течение нескольких дней четко обозначались явления некроза поврежденного участка кисти и признаки тяжелой интоксикации.
Поступила в областную больницу из ЦРБ, где была предложена ампутация кисти и формирование культи, в тяжелом состоянии. Правая кисть на тыле от уровня лучезапястного сустава, на ладонной поверхности от верхней ладонной борозды – некротизирована. В обозначенной области кожа черного цвета, местами твердая, все виды чувствительности отсутствуют, из-под струпа и из раны обильное гнойное отделяемое. При рассечении струпа кровотечения нет, а выделяется обильный зловонный гной. Функция кисти полностью нарушена. Рентгенография – костных изменений нет, посев детрита на флору и чувствительность к антибиотикам.
Диагноз: тяжелая травма с размозжением и некрозом части кисти и 2, 3, 4, 5-го пальцев правой кисти.
Оперирована. Катетеризована плечевая артерия через a.Collateralis ulnaris superior и начата инфузия пенициллина 20 млн. ЕД. в составе инфузата.
Сухожилия глубоких сгибателей и разгибателей сшиты над торцом обработанных фаланг.
После иссечения некротических тканей и туалета раны кисти, в области грудной клетки и живота выкроен кожно-подкожно-фасциальный лоскут по размерам дефекта кисти и пальцев, которые помещены в этот лоскут (рис. 2).
Через четыре недели от момента операции питающая ножка пересаженного лоскута отсечена. Кисть после отсечения питающей ножки После заживления ран больная выписана домой.
Инфузия антибиотиков в артерию продолжалась в течение 40 суток с перерывами между оперативными вмешательствами в течение двух недель. Через два месяца от момента заживления ран сформирован второй палец, а по заживлении ран больная выписана и приступила к работе (рис. 4, 5).
Таким образом, предпринятая нами тактика с использованием пластических приемов под прикрытием длительного регионарного введения антибиотиков дала возможность сохранить в определенной степени функцию кисти и, самое главное, предотвратить инвалидность еще молодой женщины.
У всех больных произошло приживление лоскута, у некоторых с явлениями краевого некроза, с последующим заживлением ран самостоятельно, или с добавлением расщепленного кожного лоскута.
Сложной подгруппой больных с тканевыми некрозами были больные с некрозом более глубоко расположенной костной ткани.
Полученный предыдущий опыт лечения больных с мягкотканным некрозом позволил пересмотреть отношение к отчленению некротизированной части конечности, то есть не проводить ее ампутации.
Из практической хирургии и научных исследований известно (М. В. Волков, В. А. Бизер, 1969; С. С. Ткаченко, 1970; М. В. Волков, 1974; Т. П. Виноградова, Г. И. Лаврищева, 1974; И. В. Шумада и др. 1985), что пересаженные консервированные костные аллотрансплантаты, поначалу выполняющие фиксирующую роль, затем превращаются в нормальную кость, а впоследствии осуществляют стабилизирующую и функционально-опорную роль.
Процесс восстановления кости до нормального функционального состояния в зависимости от свойств трансплантата не одинаков. В частности, Т. П. Виноградова, Г. И. Лаврищева (1974) в своей фундаментальной работе четко дифференцировали активность регенерации в зависимости от характеристик трансплантата. Наиболее активным в регенерации и эффективным в лечении больных с костными дефектами является аутотрансплантат, на втором месте замороженный аллотрансплатат, а затем уже лиофилизированный.
Данные представления вынудили нас задуматься о целесообразности использования аутотрансплантата в качестве пластического материала, причем источником его сделать неотторгнувшийся некротизированный фрагмент при тяжелых открытых переломах длинных костей конечностей. Такой способ был использован при лечении 11 больных с тяжелыми повреждениями конечностей с гнойными осложнениями и некрозом мягких тканей и костей.
изобретения. При поступлении больного обследуют. Проводят клинические, лабораторные, бактериологические, функциональные, рентгенологические и другие виды исследования.
Катетеризируют магистральную артерию и налаживают введение антибиотиков в составе инфузата. По ликвидации воспалительных явлений некротические мягкотканные образования иссекают. Обеспечивают фиксацию с помощью авторских фиксаторов (внеочаговых–компрессионно-дистракционно го или стержневого аппаратов) или иммобилизации с помощью гипсовой повязки.
Костные отломки обрабатывают для создания контактности–при поперечном переломе в торцовой части, а при косых переломах–по его форме, но с обеспечением максимального контакта костных фрагментов с фиксацией названными фиксаторами.
Имеющийся мягкотканный дефект замещают лоскутом на питающей ножке, для нижней конечности–с противоположной ноги, а для верхней конечности–с грудобрюшной области.
По приживлении лоскута, через 30 суток от момента замещения дефекта, питающую ножку лоскута отсекают. Гипсовую иммобилизацию или фиксацию компрессионно-дистракционным аппаратом осуществляют до полной консолидации.
Иллюстрацией применения способа может служить больной К. 35 лет.
Поступил через три недели после открытого оскольчатого перелома обеих костей правой голени в средней трети, со смещением отломков.
Лечился в районной больнице. Развился остеомиелит правой голени с некрозом тканей и дефектом их 6x8 см с некрозом концов отломков большеберцовой кости и спицевой остеомиелит пяточной кости в результате проводимого скелетного вытяжения. Явления общей воспалительной реакции.
Рентгенография показала спиральный оскольчатый перелом обеих костей голени со смещением отломков.
Оперирован. Катетеризирована бедренная артерия через возвращающую подвздошную артерию. Введено 10 млн. ЕД. пенициллина. Некрэктомия мягких тканей. Иссечены заостренные нежизнеспособные концы проксимального и дистального отломков около 1 см для создания опороспособной конгруэнтности. На опиле кости с обеих сторон кровоточивости нет, кость белого цвета. Фрагменты взяты на исследование. Концы отломков большеберцовой кости лишены надкостницы около 5 см сверху и снизу, отломки бледно-сероватого цвета.
Костные отломки сопоставлены конец в конец и фиксированы с помощью аппарата Илизарова.
Инфузия антибиотиков в течение недели, а затем пластика мягкотканного дефекта с укрытием обнаженных фрагментов большеберцовой кости кожно-подкожно-фасциально-мышечным лоскутом, выкроенным с противоположной голени.
Пересаженный лоскут прижился, питающая ножка по прошествии 32 суток отсечена. Аппарат Илизарова снят через 2 месяца. Наложена циркулярная гипсовая повязка.
Рентгенография через четыре месяца от момента начала лечения показала, что отломки срослись. Разрешена нагрузка на ногу.
Морфологическое исследование костной ткани, взятой при иссечении отломков.
Морфологическая картина состояния жизнеспособности костной ткани.
Изучено 16 препаратов, взятых у больных с открытым осложненным переломом длинных костей с некрозом мягких тканей и прилежащей кости.
Взяты фрагменты проксимального и дистального отломков сломанной кости. Фиксированы в 12 % растворе нейтрального формалина. После декальцинации в 5 % растворе азотной кислоты и заключения в целлоидин сделаны срезы, которые окрашивались гематоксилином и по Ван-Гизону.
Костная ткань лишена остеоцитов, местами гомогенного строения, линии склеивания не контурируются. Тинкториальные свойства резко нарушены. Зоны базофилии чередуются с участками оксифильной окраски. В некоторых местах видны очаги полного некроза костной ткани (тающая кость). Процесс остеогенеза не выражен. Между участками некротизированной кости в некоторых препаратах видно формирование рубцовой ткани, в которой прослеживаются лимфоидные инфильтраты с наличием плазмоцитов.
В связи с нестандартностью тактического и хирургического решений остановимся подробнее на обсуждении больных данной группы.
Двое больных поступили с явно выраженным некрозом голени, и некрозом предплечья – один. Сомнений в действиях не вызывали, в планах было сохранить коленный сустав при повреждении голени и локтевой сустав при повреждении предплечья, что довольно успешно удалось.
У остальных больных удалось не только сохранить пораженный сегмент, но и восстановить анатомическое и функциональное состояние поврежденной конечности.
У всех оперированных предложенным способом больных наступила консолидация костных отломков и восстановление функции ноги или руки, в зависимости от исходного повреждения конечности. Самое главное, что некротизированная кость не иссекалась. Она сыграла роль аутотрансплантата. Таким образом, в несколько раз сократились сроки лечения больных в сравнении с традиционными способами лечения, даже с признанным самым прогрессивным в наше время способом билокального остеосинтеза, при всех возможностях которого для коррекции длины сегмента конечности требуется не менее двух лет при дефекте кости в 10 см.
При желании шире ознакомиться с травматолого-ортопедическими проблемами и возможностью их решения, можете заказать книги, отражающие наш опыт.
Читайте также:


