Костная пластика при переломе лучевой кости
Костная пластика (греч. plastike ваяние, пластика; син. остеопластика) — хирургическая операция, производимая для восстановления целости или изменения формы кости человека, а также с целью стимуляции регенераторных процессов в костной ткани и связанная с перемещением собственных или чужеродных костных фрагментов.
Виды костной пластики
Существует три основных вида костной пластики:
- аутопластика, при которой используют собственные кости оперируемого;
- аллопластика, когда используют кости другого индивидуума, принадлежащего к тому же виду;
- ксенопластика [прежний термин — гетеропластика] — пересадка кости, взятой от организма другого биологического вида.
Костная пластика может быть:
- свободной, когда пересаживаемый фрагмент полностью отделяют от материнской кости,
- и несвободной — трансплантат сохраняет связь с материнской костью.
Костная пластика применяется:
- как самостоятельная операция с целью возмещения дефекта кости, восстановления целости или изменения формы кости;
- для стимуляции костной регенерации как компонент основной операции, например как дополнение при металл остеосинтезе;
- как комбинированная КП, когда один костный трансплантат (обычно алло-) служит фиксатором костных фрагментов, а второй (чаще ауто-) является строительным материалом для мозоли и стимулятором костной регенерации.
Показания для костной пластики
Костная ауто- и аллопластика показана при:
- оперативном лечении несросшихся переломов, ложных суставов и дефектов костей,
- проведении переднего или заднего спондилодеза, артродеза, пластических операций на суставах,
- ампутациях и различных реконструктивных операциях на костях.
Замещение суставных концов костей диафизов или целиком отдельных костей (напр., при злокачественных опухолях последних) получило заметное распространение, что связано с развитием методов приготовления костных алло трансплантатов больших размеров.
Противопоказанием для К. п. является наличие сопутствующих воспалительных явлений, кожных поражений в виде язв, фурункулов, пиодермии и т. д. Однако К. п. в некоторых случаях используется при оперативном лечении остеомиелита и инфицированных ложных суставов.
Пластика скользящим трансплантатом по Xахутову производится гл. обр. при ложных суставах большеберцовой кости без диастаза. Из передневнутренней поверхности кости после продольного разреза надкостницы циркулярной пилой выпиливают широкую костную пластинку длиной в 15—20 и шириной в 1—1,5 см (из обоих концов кости до костномозгового канала). После получения трансплантата края отломков освобождают от рубцовой ткани, щель ложного сустава заполняют костной стружкой. Трансплантат поворачивают на 180° (дистальный конец его становится проксимальным), перекрывая место ложного сустава, и укрепляют его кетгутовыми швами и, если необходимо, винтами.
Пластику по Гревсу — Вруну применяют при ложных суставах с дефектом кости. После под надкостничного выделения отломков вскрывают костномозговые полости, костный дефект заполняют трансплантатом, взятым из большеберцовой кости вместе с надкостницей и слоем губчатого вещества. Свободное пространство между отломками, кроме того, заполняют костными стружками и осколками, полученными при обработке концов отломков. Эта операция применяется редко.
Пластика по Матти. При этом виде К. п. производят освежение концов отломков, вскрывают костномозговые полости и в отломках выдалбливают глубокие желоба длиной 6—8 см. После сопоставления отломков желоба заполняют губчатым веществом кости, взятого из большого вертела или из большеберцовой кости, а также стружками, полученными при образовании желобов.
Пластика по Фемистеру показана при фиброзных ложных суставах без смещения отломков. Поднадкостнично освобождают в зоне ложного сустава отломки и, не нарушая фиброзного соединения, укладывают трансплантат, перекрывая щель ложного сустава. Трансплантат берут из крыла подвздошной кости или из большеберцовой кости.
Пластика пристеночным трансплантатом по Богданову производится в сочетании с металлическим остеосинтезом. Поднадкостнично выделяют концы отломков, составляющих ложный сустав, вскрывают костномозговые полости, сопоставляют отломки и фиксируют их металлическим штифтом внутрикостно или металлической пластинкой. После этого на освеженную боковую поверхность обоих отломков укладывают ауто- или алло трансплантат, метод часто применяют при ложных суставах без большого укорочения.
В зоне ложного сустава долотом сбивают тонкие пластинки кортикального слоя вместе с покрывающей их надкостницей и мышцами. Т. о., вокруг зоны повреждения кости создается костно-надкостничный футляр с сохраненной васкуляризацией и иннервацией, что обеспечивает благоприятные условия остеогенеза. После производства основной костно-пластической операции рану послойно зашивают.
Интраэкстрамедулярную пластику по Чаклину применяют для лечения ложных суставов и обширных дефектов длинных трубчатых костей. Производят экономное освежение концов отломков и их сопоставление. Интрамедуллярный трансплантат берут из проксимального конца большеберцовой кости без надкостницы, экстрамедуллярный — с надкостницей. Трансплантат без надкостницы вбивают поочередно в костномозговую полость обоих отломков, а трансплантат с надкостницей укладывают снаружи в подготовленное ложе и укрепляют кетгутом (рис. 4).
Костная пластика по типу вязанки хвороста. В 1961 г. М. В. Волков предложил метод замещения костных дефектов и полостей тонкими пластинами замороженной кортикальной аллогенной кости без надкостницы, фиксированными друг с другом кетгутовыми циркулярными швами в связку, напоминающую вязанку хвороста.
Кожная пластика. Показания. Виды и способы кожной пластики.
Кожная пластика — пересадка кожи разными способами, применяемая для закрытия раневой поверхности при свежих ранах.
Все виды кожной пластики можно разделить на два принципиальных варианта:
1) Свободная кожная пластика;
2) Несвободная кожная пластика.
а) ожоги III—IV степени (первичная пластика после ранней некрэктомии),
б) обширные кожные раны,
в) вяло гранулирующие и длительно не заживающие раны и язвы,
г) рубцовые деформации кожи различного происхождения,
д) устранение дефектов после удаления пигментных пятен и т. П
Свободная кожная пластика
Свободная кожная пластика имеет столетнюю историю. В 1869 г. Дж.Л. Реверден (J.L. Reverden) впервые перенёс несколько маленьких кусочков кожи на незаживающую гранулирующую поверхность в области локтя. Впоследствии С. Шкляровский (1870), А.С. Яценко (1871),
М.С. Янович-Чаинский (1871), а также Дж.С. Дэвис (J.S. Davis, 1917) подробно разработали и усовершенствовали пересадку кожи мелкими кусочками на гранулирующие поверхности ран.
Способ Яценко-Ревердена
Под местным обезболиванием скальпелем или бритвой срезают мелкие трансплантаты (тонкий слой эпидермиса) диаметром 0,3-0,5 см с наружной поверхности бедра, предплечья или передней брюшной стен- ки и переносят черепицеобразно на рану. Затем на рану с трансплантатами накладывают повязку с индифферентным жиром (вазелиновым маслом) на 8-10 сут. Метод применяют редко в связи с быстрым разрушением эпидермиса.
Последнее изменение этой страницы: 2016-07-11; Нарушение авторского права страницы
Перелом лучевой кости без смещения не требует операции. Целая локтевая кость выполняет опорную функцию, и при надежной фиксации с помощью лангета и соблюдении режима покоя конечности лучевая кость быстро срастается. Перелом со смещением требует особого подхода, методика лечения и время восстановления работоспособности во многом зависят от характера перелома.
Совмещение осколков при переломе лучевой кости со смещением
Существуют случаи, когда при переломе со смещением кости части кости расходятся незначительно.
Такие переломы лучевой кости со смещением могут быть вылечены без оперативного вмешательства. Совмещение незначительно разошедшихся осколков должно выполняться только хирургом. После этой процедуры руку фиксируют, ограничивая подвижность, и тщательно контролируют срастание. Повторный рентген для определения правильности сопоставления осколков делается после исчезновения отека.
Когда перелом лучевой кости со смещением требует оперативного вмешательства?
Если при переломе части кости значительно смещены относительно друг друга, необходимо хирургическое вмешательство, во время которого производится репозиция (сопоставление) осколков и их фиксация. Эти меры позволяют предотвратить неправильное срастание, которое исправимо, но требует оперативного вмешательства и приносит дополнительные страдания пациенту
Возможные осложнения перелома лучевой кости со смещением при правильном лечении
Реабилитационные мероприятия после срастания перелома лучевой кости со смещением.
Кроме совмещения костных осколков оперативное вмешательство требуется при переломах головки лучевой кости, при котором от кости откалывается небольшой осколок. В этом случае осколок удаляют, не приращивая.
Даже грамотное лечение переломов лучевой кости не является гарантией от возникновения осложнений. Так, при дефиците кальция и других микроэлементов в организме, может быть недостаточной интенсивность разрастания костных волокон. Отсутствие подвижности зафиксированной руки способна привести к вялости мышц, если до операции физическая подготовка пациента была недостаточной. Отек, остающийся некоторое время после снятия лангета или гипса, не относится к числу осложнений, это – нормальное явление, вызванное застойными процессами из-за неподвижности, которое довольно скоро проходит.
Диета при переломе лучевой кости со смещением
Для того чтобы на месте перелома как можно скорее образовалась соединительная костная мозоль, необходимо обеспечить организм кальцием, который содержится в твороге, сыре, молоке и многих других продуктах.

Усвоению кальция могут помешать чрезмерно жирная пища и щавелевая кислота, содержащаяся в шпинате, петрушке, щавеле и некоторых других видах зелени.
Некоторые продукты способны снабжать организм не только кальцием, но и другими необходимыми для восстановления костной ткани веществами (например, витаминами А, Е и D). При переломах рекомендуют включать в рацион:
- рыбные блюда,
- фрукты,
- орехи,
- тыквенные и кунжутные семечки,
- мед.
Исключить из меню, кроме указанных выше жирных блюд и зелени, содержащей щавелевую кислоту, необходимо:
- алкоголь,
- чай,
- кофе,
- газированные напитки.
Эти продукты способны замедлять процесс срастания кости.
Физическая активность в период реабилитации после перелома лучевой кости со смещением
В период срастания подвижность руки ограничена, однако после снятия лангета или гипса нельзя сразу же возвращаться к привычной активности. Место срастания в первые несколько недель еще слишком хрупко, а мышцы за время неподвижности отвыкли от нагрузки. Специальные тренировки помогут руке быстрее восстановить работоспособность без риска получения дополнительных травм.
- Положить руку от локтя до кисти на стол и выполнять сгибательные и разгибательные движения кистью.
- В том же положении поворачивать раскрытую ладонь, касаясь поверхности поочередно то одним, то другим ребром.
С течением времени рекомендуют переходить к упражнениям, тренирующим мелкую моторику (собирание спичек, детской мозаики, паззлов и пр.).
В качестве реабилитационных процедур медики часто назначают физиотерапию и массаж.
Виды и варианты костной пластики
Большое разнообразие видов и вариантов костной пластики требует их систематизации, что имеет и теоретическое, и практическое значение (схема 13.1.1).
Биологическая характеристика пересаженной кости играет важную роль и в значительной мере определяет как содержание, так и исходы операций.
Идентичность антигенной структуры костных аутотрансплаитатов тканей воспринимающего ложа определяет более благоприятный ход репаративных процессов после аутопластических операций и преимущества аутокостного материала в клинической практике.
Широко распространено использование аллотрансплантатов (участков костей, взятых у трупов), консервация которых осуществляется путем замораживания или обработки различными консервантами. Пока еще не получили широкого применения ксеногенные ткани (от животных) в связи с их высокой реактогенностыо.
Особое место среди костно-пластических материалов занимают брефотрансплантатыкостные ткани, взятые у мертворожденных либо умерших новорожденных. Их важной особенностью является относительная невыраженность антигенных свойств, что позволяет определить их положение как промежуточное между ауто и аллотрансплантатами.
Структура, размеры и форма пересаженной кости. Определяют площадь контакта трансплантата с окружающими тканями и скорость проникновения в него клеток воспринимающего ложа. Известно, что кортикальные (пластинчатые) трансплантаты медленнее подвергаются перестройке, чем губчатые. Участки кости могут быть смешанными по структуре и иметь в своем составе и губчатую, и кортикальную ткань.
Существенное значение имеют размеры и форма пересаженной кости. Чем меньше размеры костных фрагментов и чем больше площадь их поверхности, тем лете могут быть обеспечены питание глубоких слоев клеток пересаженной кости за счет диффузии, а также их перестройка под действием окружающих тканей.
При использовании крупных аутотрансплантатов сохранение жизнеспособности глубоких слоев клеток может быть обеспечено лишь путем восстановления кровоснабжения. Если же пересажена крупная аллокость, то гибель ее клеток неизбежна. Процессы замещения последних клетками окружающих тканей могут протекать в течение многих лет и так и не завершиться окончательно. Те же изменения возникают относительно быстро при использовании трансплантатов малых размеров, и в частности костной стружки.
Варианты питания пересаженной кости. Сохранение питания пересаженных тканей имеет при костной пластике первостепенное значение. Известно, что восстановление кровоснабжения сохраняет пластические свойства пересаженной аутокости, что приводит к ее приживлению в воспринимающем ложе в сроки, близкие к срокам сращения при переломах. Исключительно важна и способность к относительно быстрой перестройке в соответствии с условиями механической нагрузки. В настоящее время изучаются возможности пересадки и кровосиабжаемых аллотрансплантатов.
Для некровоснабжаемых фрагментов кости единственным путем питания в первые дни после пересадки является диффузия питательных веществ из окружающих тканей. В последующем вторым источником становится постепенное восстановление кровообращения путем соединения сосудов трансплантата с сосудами окружающих тканей.
Связь пересаженной кости с донорским ложем. Сохранение связей костного фрагмента (а следовательно, и источников питания) с донорским ложем определяет и его потенциальные биологические возможности. С одной стороны, сохранение источника кровоснабжения качественно улучшает пластические свойства пересаженных тканей. С другой — питающая ножка ограничивает возможность перемещения кости.
Соответственно выделяют и виды костной пластики: свободную, несвободную и комбинированную (схема 13.1.2). Последняя предполагает одновременное использование двух методов пересадки костей.
Остеогенез при костной пластике
Аутопластика. При использовании кровоснабжаемых аутотрансплантатов жизнеспособность кости сохраняется, в связи с чем течение репаративных процессов может практически не отличаться от остеогенеза при обычном переломе.
Еще в начале XX в. было установлено, что некровоснабжаемые костные участки ребра, большеберцовой и подвздошной костей постепенно рассасываются при их пересадке в подкожную жировую клетчатку живота и шеи, а также при имплантации в мышечную ткань. Однако они, напротив, сохраняют свою структуру, находясь в непосредственном контакте с костным ложем. При этом может наступить сращение, процессы которого по своему характеру аналогичны процессам остеорепарации при переломах, хотя и протекают значительно медленнее.
С накоплением научных фактов большинство исследователей пришли к одному выводу: остеоциты в составе некровоснабжаемого костного аутотрансплантата способны к выживанию и могут участвовать в последующих репаративных процессах, однако масштабы сохранения жизнеспособности пересаженной костной ткани определяются многими факторами, среди которых наиболее важными являются структура трансплантата (кортикальные, губчатые), его размеры (площадь поверхности, толщина), степень васкуляризации воспринимающего ложа и характер фиксации. Так, по данным A.Berggren и соавт. (1982), выживают в среднем около 30% клеток при пересадке губчатого и лишь 3% при пересадке кортикального аутотрансплантата.
В любом случае в первые 2 нед происходит гибель клеток, лишенных питания. В последующем кортикальные аутотрансплантаты, имеющие незначительные остеогенетические возможности, играют главным образом роль остеокондуктора, медленно реваскуляризуясь. Мертвые участки кости под влиянием сосудистой инвазии из окружающих тканей подвергаются резорбции с образованием пор и полостей. На этом месте формируется новая кость за счет плюрипотентных клеток костного мозга и окружающих тканей.
Губчатые участки кости, напротив, имеют большие остеогенетические потенции, которые могут проявляться образованием кости уже на 2-й неделе после пересадки.
Алло- и ксенопластика. В отличие от аутопластического материала клеточные элементы алло- и ксенотрансплантатов при пересадке всегда погибают. Мертвая кость фактически становится инородным телом, реакция на которое определяется различиями в антигенной структуре белков, образующих вещество трансплантата и ткани воспринимающего ложа, а также состоянием иммунной системы организма.
Функция костных трансплантатов и влияние различных факторов. По современным представлениям, костный трансплантат имея три физиологические функции. Во-первых, это остеоиндукция (образование новой кости), которая характерна для кровоснабжаемых аутотрансплантатов и лишь частично — для некровоснабжаемого аутопластического материала.
Во-вторых, эти же виды трансплантатов могут стать источниками костеобразующш клеток. В-третьих, все разновидности кровоснабжаемых костных трансплантатов способны (в различной степени) к остеокондукции, т. е. являются матриксом, на котором откладывается вновь образованная кость. При каждом варианте костной пластики существуют свои возможности в реализации этих функций, что в значительной степени определяется рядом факторов (табл. 13.2.1).
Отметим важную роль состояния воспринимающего ложа. В хорошо кровоснабжаемых тканях процессы приживления и перестройки любой пересаженной кости протекают значительно быстрее и благоприятнее, чем в рубцово-измененном ложе.
В последнем случае транспортировка питательных веществ и клеточных элементов в зону остеогенеза резко замедляется и может оказаться недостаточной для достижения цели операции. Снижение уровня кровоснабжения тканей воспринимающего ложа играет сравнительно несущественную роль при пересадке кровоснабжаемых аутотрансплантатов, но имеет исключительное значение при использовании некровоснабжаемой аутокости, питание которой в первое время осуществляется лишь за счет диффузии веществ из окружающей среды.
На выживание и участие отдельных клеток трансплантата в репаративных процессах влияют и такие условия, как состояние внутренней среды организма, расстояние от костных клеток до источника кровоснабжения, показатели диффузии экстрацеллюлярной жидкости, наличие барьеров на пути питания и, наконец, формирование электрических полей.
Фиксация трансплантата и площадь его соприкосновения с реципиентным костным ложем во многом определяют ход остеогенетических процессов, скорость сращения и перестройки трансплантата. При лечении больных с дефектами костей конечностей значение этих факторов, как правило, более велико, чем при лечении больных с переломами той же локализации.
Ход репаративных процессов по понятным причинам во многом определяется общим состоянием и возрастом больных. При нормальных показателях гомеостаза, у молодых людей и особенно у детей возможности костно-пластических процессов несравнимо выше, чем у лиц пожилого возраста.
Выбор метода костной пластики
Взгляды хирургов на показания к использованию различных методов костной пластики существенно изменялись на протяжении истории развития костно-пластической хирургии. С современных позиций, костная пластика не показана при краевых дефектах и костных полостях, когда механическая прочность участка кости снижается несущественно.
В этих случаях достаточно заполнить полость путем пломбировки мышечными или другими мягкотканными лоскутами. При относительно небольших тотальных дефектах кости решением проблемы может быть остеосинтез костных отломков с укорочением, что на верхней конечности может не сопровождаться заметным нарушением функции.
Показания к костной пластике возникают в двух случаях: 1) при краевых дефектах костей, если их образование сопровождается значительным снижением механической прочности кости и, таким образом, может привести к патологическому перелому; 2) при тотальных дефектах трубчатых костей, когда остеосинтез с укорочением невозможен либо значительно нарушает функцию конечности.
Показания к использованию различных методов костной пластики определяются многими факторами. Значительные расхождения в точках зрения по этому вопросу определяются тремя основными причинами. В первую очередь, это связано с тем, что лишь немногие хирурги хорошо владеют всеми известными методами костной пластики.
Во-вторых, для того чтобы оценить опыт костно-пластических операций, необходимо наблюдение за больными в течение 5—10 лет. В-третьих, исключительное разнообразие вариантов возникновения дефектов костей и условий проведения операций затрудняет для каждого автора выделение достаточно однородных групп пострадавших, обследование которых позволило бы прийти к достоверным выводам.
В микробнозагрязненной или инфицированной ранах предпочтение должно быть отдано кровоснабжаемым аутотканям (в том числе кожно-костным комплексам), которые значительно более устойчивы к развитию инфекции. При диафизарных дефектах величиной до 8—10 см широкое распространение в нашей стране получила костная пластика по Илизарову. Могут использоваться кровоснабжаемые и некровоснабжаемые костные трансплантаты, а также различные сочетания некровоснабжаемых ауто- и аллотканей.
При дефектах костей большей величины значительными преимуществами обладают методы свободной аутопластики, в частности — кровоснабжаемыми трансплантатами, которые позволяют решить проблему в относительно короткие сроки. Менее эффективна при лечении данной категории больных костная пластика по Илизарову в связи с исключительной продолжительностью лечения.
Несмотря на неоднозначность подходов хирургов к выбору метода лечения больных в некоторых случаях, накопленный опыт уже определил приоритеты. Так, при значительных по величине дефектах одной или обеих костей предплечья предпочтение может быть отдано пересадке кровоснабжаемых аутотрансплантатов из малоберцовой кости.
При сочетании дефекта кости с дефектом кожи и(или) обширными Рубцовыми изменениями тканей наилучшим выходом из положения часто является пересадка кровоснабжаемого кожно-костного комплекса (например, малоберцовая кость с кожно-фасциальным лоскутом, паховый лоскут с участком подвздошной кости и др.).
Наконец, при аваскулярных ложных суставов. Вышеизложенные положения соответствуют взглядам далеко не всех специалистов. Подходы к решению проблем костной пластики всегда индивидуальны, и искусство хирурга в том и состоит, чтобы найти оптимальный метод лечения (или их сочетание) для каждого конкретного больного.
Лучевая кость — это одна из костей предплечья. Один из ее концов, участвующий в образовании лучезапястного сустава, называется дистальным концом. Переломы этого конца лучевой кости являются одними из самых распространенных переломов, и эта кость из двух костей предплечья также ломается чаще всего.
Одним из наиболее распространенных вариантов переломов дистального конца лучевой кости является т.н. перелом Коллеса, при котором дистальный фрагмент смещается к тылу. Этот перелом впервые был описан в 1814 году ирландским хирургом и анатомом Абрахамом Коллесом, в честь которого он и получил свое название.
Другие варианты переломов дистального конца лучевой кости включают:
- Внутрисуставной перелом. Линия перелома распространяется на суставную поверхность лучевой кости.
- Внесуставной перелом. Линия перелома не захватывает суставную поверхность.
- Открытый перелом. В области перелома имеется рана, через которую зона перелома сообщается с внешней средой. Такие переломы требуют неотложной помощи в связи с высоким риском инфицирования.
- Оскольчатый перелом. Характеризуется наличием более двух костных фрагментов.
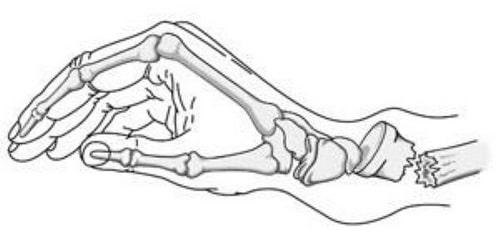
При переломе Коллеса дистальный фрагмент лучевой кости смещается к тылу.
Необходимо максимально точно классифицировать тип перелома, поскольку некоторые переломы лечить бывает сложней, чем другие. К примеру, сложней лечить внутрисуставные переломы, открытые переломы, оскольчатые переломы и переломы со смещением.
Иногда одновременно с лучевой костью ломается и вторая кость предплечья — локтевая. Такие переломы называют переломами дистального конца локтевой кости.
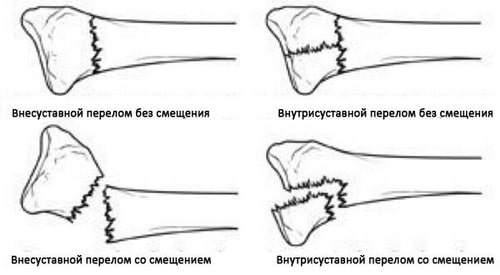
На данном рисунке представлены некоторые типы переломов дистального конца лучевой кости.
Остеопороз (состояние, характеризующееся хрупкостью костной ткани и увеличением риска переломов) может приводить к перелому дистального конца лучевой кости даже в результате незначительного падения. Многие такие переломы у лиц старше 60 лет возникают в результате падения с высоты собственного роста. Поэтому важным аспектом профилактики этих переломов является поддержание хорошего состояния костной ткани. Некоторые переломы хоть и не всегда, но можно предотвратить, использую защитные приспособления для лучезапястного сустава.
Перелом в области лучезапястного сустава, как и любой другой перелом, характеризуется немедленно развивающимся болевым синдромом, локальной болезненностью, отеком и кровоизлияниями. Во многих случаях возникает деформация сустава.
Если выражен болевой синдром, имеет место деформация запястья, онемение или изменение окраски пальцев (они не выглядят розовыми, как обычно), необходимо срочно обратиться к врачу.
Для подтверждения диагноз доктор назначит рентгенографию лучезапястного сустава. Это наиболее распространенный и доступный метод диагностики переломов. Рентгенография позволяет выявить перелом и оценить характер смещения фрагментов.
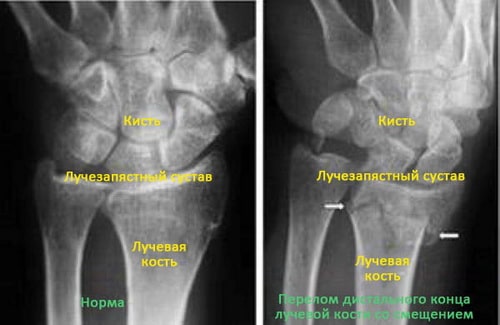
(Слева) Рентгенограмма нормального лучезапястного сустава. (Справа) Стрелками показан перелом дистального конца лучевой кости.
При лечении любого перелома придерживаются одного основного правила: необходимо вернуть фрагменты в их нормальное положение и создать условия, чтобы они сохраняли это положение до наступления сращения.
Если фрагменты кости сохраняют приемлемое положение, достаточно иммобилизации гипсовой повязкой на срок, необходимый для сращения перелома.
При смещении фрагментов и высокой вероятности нарушения функции конечности в будущем необходимо устранение этого смещения. Репозиция — это технический термин, под которым подразумевается устранение смещения фрагментов. Если при этом не делается никаких разрезов, репозиция называется закрытой.
После восстановления нормального положения фрагментов конечность иммобилизируется шиной или гипсом. На первые несколько дней, когда отек в области перелома увеличивается, обычно накладывается лонгета, которая затем переводится в глухую гипсовую повязку. Через 2-3 недели, когда отек уменьшается и повязка расслабляется, она меняется на новую.
В зависимости от типа перелома доктор может несколько раз в процессе лечения назначить контрольную рентгенографию для исключения возможного повторного смещения фрагментов. Обычно в течение первых трех недель рентгенография выполняется еженедельно, а затем через 6 недель после травмы. При переломах без смещения и стабильных переломах она может выполняться реже.
Гипс снимается через 6 недель после травмы, после чего начинается физиотерапия, направленная на восстановление подвижности и функции лучезапястного сустава.
Иногда смещение фрагментов слишком велико, и его невозможно устранить закрыто или удержать фрагменты в правильном положении в гипсе. В последующем это может отразиться на функции конечности. В таких случаях может быть показано оперативное лечение.
Техника операции. При операции обычно выполняется доступ к зоне перелома и выполняется сопоставление фрагментов под контролем глаза (открытая репозиция).
В зависимости от характера перелома выполняется его фиксация тем или иным способом:
- Гипс
- Металлические спицы
- Пластина и винты
- Наружный фиксатор (аппарат наружной фиксации)
- Любые сочетания описанных способов
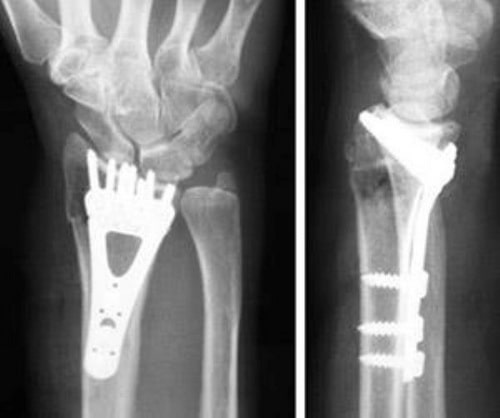
Фиксация перелома дистального конца лучевой кости пластинкой и винтами.
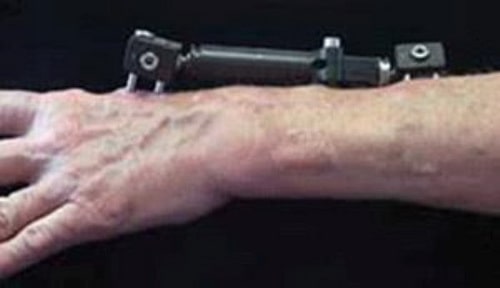
Открытые переломы. При всех открытых переломах показано хирургическое лечение в максимально ранние сроки (в первые 8 часов после травмы). Во время операции все поврежденные ткани тщательно очищаются от загрязнения, для профилактики инфекции назначаются антибиотики. Фрагменты могут быть зафиксированы внутри или с использованием наружного фиксатора. При значительном повреждении мягких тканей в области перелома доктор может временно наложить наружный фиксатор. После заживления тканей вторым этапом может быть выполнена открытая репозиция и внутренняя фиксация перелома.
Поскольку существует множество вариантов переломов дистального конца лучевой кости и множество способов их лечения, восстановительный период будет различным у разных пациентов. Более подробную информацию об этом вы сможете получить у своего лечащего врача.
Боль при большинстве переломов сохраняется от нескольких дней до пары недель. Многие пациенты легко справляются со своими болевыми ощущениями местными аппликациями льда, приданием конечности возвышенного положения и самыми простейшими безрецептурными лекарственными препаратами.
Доктор может порекомендовать вам комбинировать прием ибупрофена и парацетамола. В сочетании друг с другом они гораздо более эффективны, чем по отдельности.
В некоторых случаях исходная гипсовая повязка по уменьшении отека расслабляется и заменяется на новую. Последняя снимается через 6 недель после травмы.
Гипсовую повязку в процессе лечения не следует подвергать действию влаги. Когда вы принимаете душ, ее необходимо закрывать полиэтиленовым пакетом. Будучи намоченным, гипс высыхает достаточно долго. Если это произошло, рекомендуем воспользоваться феном для волос.
Большинство хирургических ран также нельзя мочить в первые 5 дней после операции или до момента снятия швов, в зависимости от того, что наступит раньше.
После операции или после наложения гипса необходимо максимально быстро восстановить движения пальцев кисти. Если у вас не получается нормально двигать пальцами через 24 часа в связи с выраженным болевым синдромом или отеком, обратитесь с этим вопросом к врачу.
В такой ситуации доктор может ослабить гипс или послеоперационную повязку. В некоторых случаях для восстановления полноценной функции необходимы занятия с физиотерапевтом.
Некупируемый стандартными средствами болевой синдром может быть признаком комплексного регионарного болевого синдрома (рефлекторной симпатической дистрофии), который необходимо лечить максимально быстро и агрессивно с использованием медикаментозных средств и блокад.
Большинство пациентов с переломами дистального конца лучевой кости без проблем возвращается к своей повседневной деятельности. Когда это произойдет, зависит от типа перелома, характера лечения и ответа организма на проводимое лечение.
Практически у всех пациентов сохранятся некоторая тугоподвижность лучезапястного сустава. Через 1-2 месяца после снятия гипса или после операции она обычно уменьшается и далее продолжает уменьшаться еще в течение 2 лет после травмы. При необходимости ваш лечащий врач через несколько дней или недель после операции или сразу после снятия гипса направит вас к физиотерапевту.
Большинство пациентов могут возобновить легкие физические нагрузки, например, плавание или тренировки в зале на нижнюю половину тела через 1-2 месяца после снятия гипса или 1-2 месяца после операции. Интенсивные физические нагрузки, например, лыжи или футбол, могут быть возобновлены через 3-6 месяцев после операции.
Полное восстановление обычно занимает не меньше 6 месяцев.
В течение первого года после травмы обычно сохраняются некоторые болевые ощущения при физических нагрузках, а иногда они могут сохраняться дольше или вообще постоянно, особенно это касается высокоэнергетических повреждений, пациентов в возрасте 50 лет или пациентов с исходным остеоартритом лучезапястного сустава. Тугоподвижность обычно выражена минимально и никак не влияет на функцию конечности в целом.
Одним из причин переломов дистального конца лучевой кости является остеопороз. Считается, что пациенты с такими переломами подлежат обследованию на это заболевание, особенно если у них есть и другие факторы риска остеопороза. Более подробно об этой проблеме вы можете поговорить со своим лечащим врачом.
Читайте также:


