Имплантант для лучевой кости

Повреждения головки лучевой кости составляют примерно 4% всех переломов, более 50% всех переломов проксимального отдела предплечья и более 30% из них встречаются в комбинации с переломами локтевой кости 4. Эпидемиология переломов головки и шейки лучевой кости колеблется между 25 и 39 на 100 000 взрослого населения в год, с примерно равным распределением между полами и средним возрастом пациентов 40 лет [3,5]. Около 10% этих травм сопровождаются вывихами, нестабильностью предплечья или другими переломами [5]. Около половины от общего числа составляют переломы шейки лучевой кости, заболеваемость увеличивается с возрастом и снижается частота сложных переломов [3,5].
В лечении переломов головки лучевой кости существует ряд проблем, таких как определение показаний и выбора метода внутренней фиксации или первичного эндопротезирования, диагностики и способа восстановления связочного аппарата, выбора между первичной тотальной резекцией, либо удалением фрагмента головки лучевой кости, а также проблема выбора дизайна эндопротеза в случае первичной артропластики [1]. Как правило, основной целью оперативного лечения нестабильных переломов является восстановление вальгусной стабильности в локтевом суставе, что обеспечение возможности ранней функциональной нагрузки на локтевой сустав [2].
Цель исследования – улучшение результатов лечения больных с повреждениями проксимального отдела лучевой кости.
В задачу исследования входила разработка индивидуальной модели эндопротеза головки лучевой кости для практической травматологии и ортопедии.
Материалы и методы исследования. Для восстановления вальгусной стабильности при сложных повреждениях локтевого сустава, требующих экстренного оперативного вмешательства в первые сутки с момента травмы, нами была предложена индивидуальная модель эндопротеза головки лучевой кости [патент РФ № 140147 от 27.04.2014 Бюл. № 12]. Кроме того, важнейшим критерием, определявшим показания к ее имплантации, был возраст пациентов – более 70 лет, что обусловлено невысоким уровнем физической активности пожилых людей и малой нагрузкой на плечелучевое сочленение.
Индивидуальная модель эндопротеза головки лучевой кости представляет собой монолитную конструкцию, выполненную из костного цемента на основе полиметилметакрилата. Имплантат содержит цилиндрическую шляпку с углублением в торце, обеспечивающую оптимальный контакт в зоне плечелучевого сочленения, а коническая ножка для усиления прочности армирована спицей типа Киршнера со спиралевидным окончанием, помещенном в шляпку. На ножке в продольном направлении расположены ребра жесткости, обеспечивающие первичную ротационную стабильность ножки эндопротеза в костномозговом канале. Эндопротез изготавливали интраоперационно индивидуально в формообразующих, в которых учитывалась протяженность дефекта, а также диаметр костномозгового канала лучевой кости.

Рис.1. Фотография индивидуальной модели эндопротеза головки лучевой кости
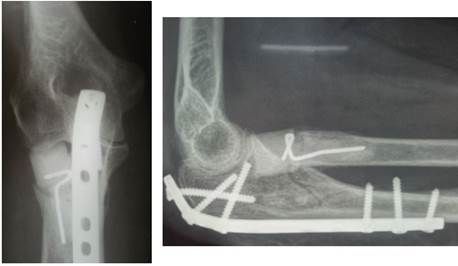
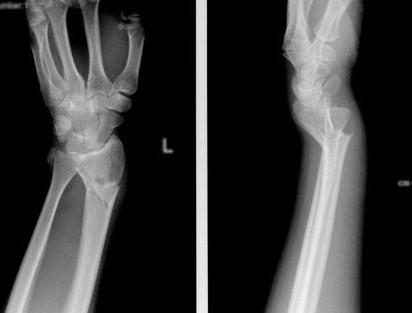
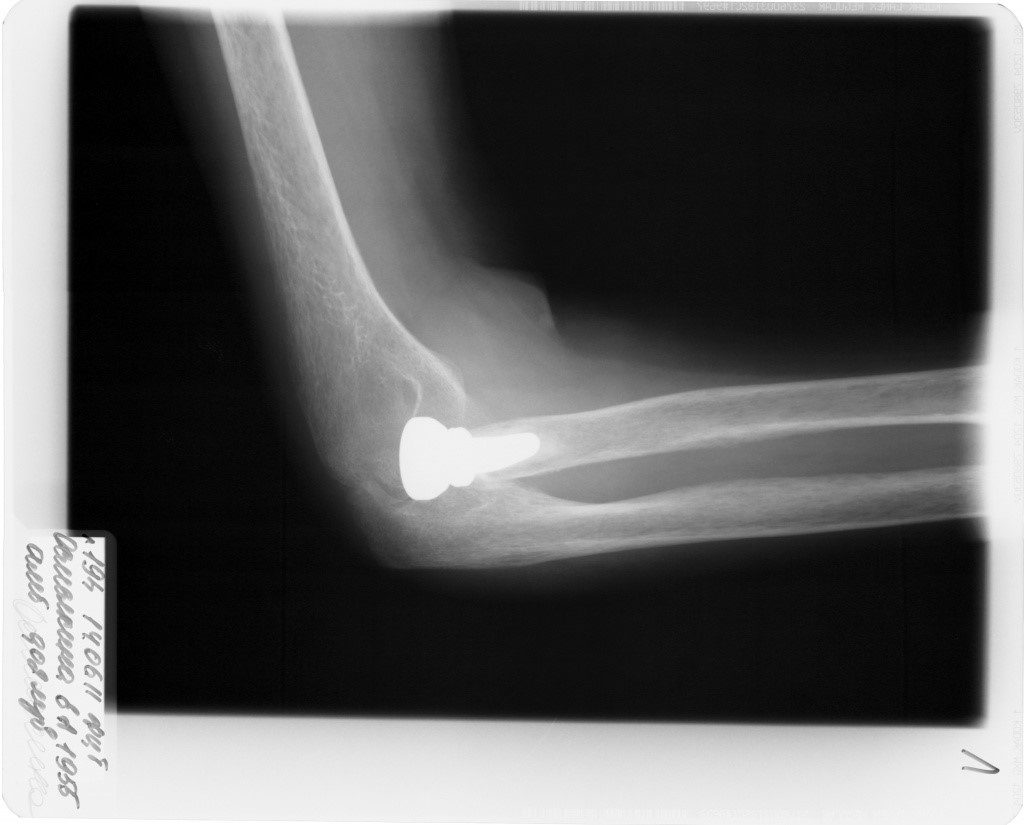
Рис.2. Р-граммы больной М., 73 лет. Выполнен остеосинтез проксимального диафиза локтевой кости, артропластика головки лучевой кости индивидуальной моделью эндопротеза
Клинический анализ отдаленных результатов оперативного лечения выполнялся по истечении 12 месяцев с момента операции в соответствии с оценочной шкалой MEPI (Mayo Elbow Perfomance Index), а также данные о ротационных движениях в плечелучевом суставе.
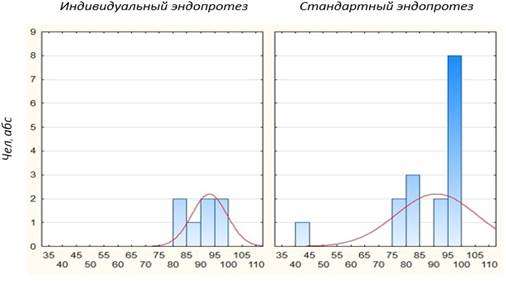
Результаты исследования. Сравнение отдаленных результатов оперативного лечения в группах больных с имплантированным индивидуальным эндопротезом головки лучевой кости и с применением стандартного моноблокового металлического имплантата показало схожие данные. Так, в группе пациентов, пролеченных с использованием индивидуальной модели, угол сгибания в локтевом суставе в 85,7 % случаев составил более 120º. Группа больных, прооперированная с применением стандартного эндопротеза головки лучевой кости, в отдаленном послеоперационном периоде в 75 % случаев показала угол сгибания более 125º. В остальных случаях в обеих группах больных угол сгибания составил 85–95º (рис. 3).

Рис.3. Сравнение угла сгибания в локтевом суставе у пациентов с применением индивидуальной и стандартной модели эндопротеза головки лучевой кости (p = 0,00…)
Сравнение отдаленных результатов эндопротезирования головки лучевой кости с применением индивидуальной и стандартной модели эндопротеза по объему ротационных движений в локтевом суставе показало одинаковые значения. В обоих случаях объем пронации составляет> 60º, а супинации >65º (Рис. 4).
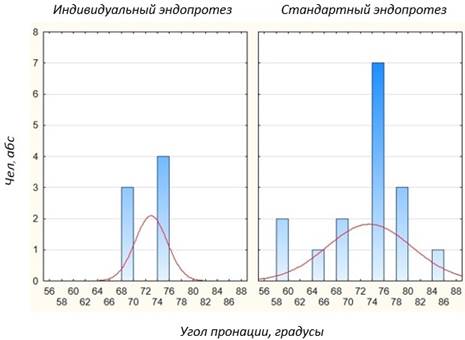
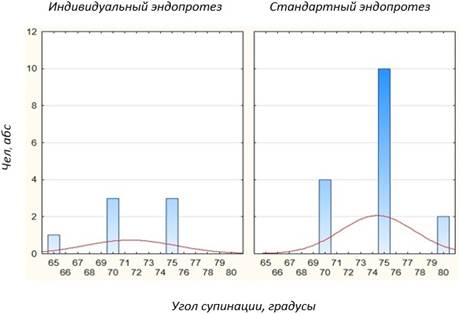
Рис. 4. Сравнение объема ротационных движений в локтевом суставе у пациентов с применением индивидуальной и стандартной модели эндопротеза головки лучевой кости (p = 0,00…)
Индекс MEPI, баллы
Рис. 5. Сравнение отдаленных результатов (баллы MEPI) эндопротезирования головки лучевой кости с применением индивидуальной и стандартной модели (p = 0,00…)
На протяжении 4-х лет наблюдений нами не было отмечено ни одного случая септической либо асептической нестабильности ножки эндопротеза. Анализ отдаленных результатов артропластики с использованием индивидуальной модели эндопротеза головки лучевой кости показал эффективность его применения в неотложной оперативной травматологии. Мы полагаем, что данный имплантат возможно использовать для восстановления вальгусной стабильности локтевого сустава как альтернативу стандартным эндопротезам у пожилых пациентов с невысоким уровнем физической активности.

Владельцы патента RU 2407484:
Изобретение относится к медицине. Имплантат состоит из двух стержней и муфты. Стержень с упорной костной резьбой на одном конце, на конце с метрической резьбой имеет соосное шестигранное отверстие под торцевой ключ и сквозное осевое отверстие под направляющую спицу, открывающееся в шестигранное отверстие. Второй стержень с конически суживающимся и заостренным концом и концом с метрической резьбой имеет продольные полукруглые канавки на боковой поверхности конически суживающегося и заостренного конца. Встречные концы с метрической резьбой стержней соединяются с помощью муфты. Изобретение обеспечивает замещение значительного дефекта дистального отдела лучевой кости с одновременным артродезом в лучезапястном суставе. 3 з.п. ф-лы, 1 ил.
Изобретение относится к медицине, а именно к травматологии и ортопедии, и предназначено для замещения значительного дефекта дистального отдела лучевой кости с одновременным артродезом в лучезапястном суставе.
Биомеханические принципы интрамедуллярного шинирования в 1940 году обосновал Kuntscher, внедривший методику остеосинтеза интрамедуллярным гвоздем - устройством, способным нести нагрузку, что позволяет несколько разгрузить область перелома [1].
Известно большое количество моделей интрамедуллярных фиксаторов, которые отличаются по форме, длине и конструктивным параметрам и изготавливаются из металлических сплавов. Это зависит от назначения фиксатора и роли, которая на него возлагается. По форме и назначению их можно разделить на фиксаторы в виде штифта или винта, компрессионные и не компрессионные. По форме сечения различают трехлопастные, круглые, трехгранные полые, штыковидные и уплощенные штифты [2].
Известен интрамедуллярный стержень для остеосинтеза переломов лучевой и локтевой костей предплечья [3]. Однако конструкция данного интрамедуллярного фиксатора позволяет применять его лишь в качестве фиксатора при диафизарных переломах. Использование его для замещения дефекта н/3 лучевой кости невозможно в силу конструктивных особенностей: отсутствует возможность одновременного введения в кости запястья и диафиз лучевой кости, невозможно получить стабильную фиксацию данным имплантантом в области костей запястья.
Наиболее близким к заявляемому имплантату является модульный протез [4] для частичного замещения длинной трубчатой кости, содержащий проксимальный или дистальный концевые компоненты, образующие один из компонентов протезируемого сустава, стержень и соединительную деталь для ввода в зацепление в резецированную кость. Протез содержит стержень и/или удлинитель стержня. Этот стержень и/или удлинитель стержня, соединительная деталь и дистальный или проксимальный концевые компоненты соединены друг с другом при помощи охватываемого и охватывающего конусов. Протез содержит кольцо для упора в резецированную кость. Устройство многофункциональное и может быть использовано для протезирования как утраченной части трубчатой кости (бедренной или плечевой), или дистального или проксимального ее концов, так и полного протезирования бедра, в связи с чем содержит значительное количество деталей различных типоразмеров. Кроме того, конусное сочленение составляющих компонентов протеза позволяет обеспечить необходимую длину фрагмента кости только методом подбора, что существенно усложняет работу хирурга и увеличивает время операции [4].
Сущность изобретения состоит в совокупности существенных признаков, достаточной для достижения искомого технического результата, заключающегося в разработке интрамедуллярного стержня, способного заместить значительный дефект эпиметафизарной части н/3 лучевой кости после ее резекции по поводу опухолевого процесса, с одновременным артродезом в лучезапястном суставе.
Сущность изобретения состоит в том, что имплантат для замещения значительного дефекта дистального конца лучевой кости состоит из двух стержней и муфты. Стержень с упорной костной резьбой на одном конце, на конце с метрической резьбой имеет соосное шестигранное отверстие под торцевой ключ и сквозное осевое отверстие под направляющую спицу, открывающееся в шестигранное отверстие. Второй стержень с конически суживающимся и заостренным концом имеет продольные полукруглые канавки на боковой поверхности конически суживающегося и заостренного конца и конец с метрической резьбой. Встречные концы с метрической резьбой стержней соединяются с помощью муфты.
Муфта снаружи снабжена прямоугольными пазами под гаечный ключ и контрится на стержне с помощью контргайки.
Имплантат изготовлен из наноструктурного чистого титана.
На все детали устройства нанесено кальцийфосфатное покрытие.
Изготовление имплантанта из двух частей с возможностью соединения их муфтой обеспечивает возможность малотравматичной установки его в место дефекта лучевой кости и оптимальный подбор его длины.
Продольные канавки на конической поверхности стержня препятствуют концентрации напряжений, что необходимо для предотвращения раскалывания кости, а также предотвращают ротационное смещение стержня и способствуют надежной его фиксации.
Метрическая резьба на встречных концах обоих стержней обеспечивает возможность соединения двух стержней резьбовой муфтой в единую конструкцию, а контргайка повышает надежность этого соединения.
Наличие канала для направляющей спицы во 2-м стержне позволяет произвести его установку в кости запястья соосно первому стержню.
Шестигранный паз по оси стержня, выполненный на конце с метрической резьбой, позволяет осуществить ввинчивание этого стержня с помощью шестигранного ключа в кости запястья по направляющей спице.
Прямоугольные пазы на корпусе муфты обеспечивают возможность перемещения муфты по резьбе свинчиваемых стержней.
Использование наноструктурного чистого титана исключает выход ионов алюминия и ванадия в окружающие ткани конечности, что обычно происходит при применении в таких изделиях сплавов ВТ 6 или ВТ 16. По своим механическим свойствам наноструктурный чистый титан не уступает этим сплавам.
Наличие кальцийфосфатного покрытия способствует остеоинтеграции и препятствует резорбции костной ткани, что обеспечивает более надежную фиксацию конструкции в кости.
На чертеже показан имплантат в собранном виде.
Имплантат состоит из двух стержней 1 и 2, встречные концы которых имеют метрическую резьбу 3 и 4 и соединяются с помощью муфты 5 с контргайкой 6. На одном конце стержня 1 нарезана упорная внутрикостная резьба 7, он имеет сквозное осевое отверстие 8 под направляющую спицу, открывающееся в соосное шестигранное отверстие 9 под торцевой ключ на конце с метрической резьбой 3. Свободный конец 10 стержня 2 выполнен конически суживающимся и заостренным, с продольными канавками 11 на боковой поверхности.
Резьбовая муфта снаружи снабжена прямоугольными пазами 12 под гаечный ключ и контрится на стержне с помощью контргайки.
Установка имплантата осуществляется следующим образом. Заведомо длинные титановые имплантаты различного сечения (6..8) мм - готовят до операции. В проксимальный костный отломок лучевой кости забивается стержень с коническим концом и продольными канавками, размера, соответствующего диаметру костномозгового канала лучевой кости, при этом соединительная муфта и контргайка должны быть навинчены на метрическую резьбу стержня. В кости запястья: ладьевидную, полулунную и головчатую по направляющей спице, после рассверливания полым сверлом, соосно с первым стержнем, - вводится стержень с внутрикостной резьбой. Спица удаляется, производится соединение двух стержней путем перемещения соединительной муфты с помощью гаечного клоча, по резьбе стержней, производят законтривание гайкой.
1. Мюллер M.E., Алльговер М., Шнейдер Р., Виллингер X. - Руководство по внутреннему остеосинтезу (Методика, рекомендованная группой АО (Швейцария), Издательство Ad Marqinem, Москва, 1996, с.291.
2. Мовшович И.А. Оперативная ортопедия. - М.: Медицина, 1994, стр.35-36.
3. Корнилов Н.В. и соавт. - Травматология и ортопедия. - CПб.: Гиппократ, 2005, том 2, стр.238-239.
4. Патент РФ №2269979 A61F 2/28, A61F 2/30, БИ №5, 2007 г.
1. Имплантат для замещения значительного дефекта дистального конца лучевой кости, отличающийся тем, что он состоит из двух стержней и муфты, стержень с упорной костной резьбой на одном конце, на конце с метрической резьбой имеет соосное шестигранное отверстие под торцевой ключ и сквозное осевое отверстие под направляющую спицу, открывающееся в шестигранное отверстие, второй стержень, с конически суживающимся и заостренным концом, и концом с метрической резьбой, имеет продольные полукруглые канавки на боковой поверхности конически суживающегося и заостренного конца, встречные концы с метрической резьбой стержней соединяются с помощью муфты.
2. Имплантат по п.1, отличающийся тем, что муфта снаружи снабжена прямоугольными пазами под гаечный ключ, и контрится на стержне с помощью контргайки.
3. Имплантат по п.1, отличающийся тем, что он изготовлен из наноструктурного чистого титана.
4. Имплантат по п.1, отличающийся тем, что на все детали устройства нанесено кальцийфосфатное покрытие.
Эндопротезирование – это операция, в результате которой сустав или его часть заменяется эндопротезом. Он изготавливается из материалов, которые максимально похожи на заменяемые натуральные части тела, чтобы организм максимально легко воспринял инородные частицы.
Чаще всего эндопротезирование прописывается для людей с проблемами коленного и тазобедренного сустава. Это неудивительно, поскольку данные суставы являются самыми большими в человеческом организме и на них осуществляется наиболее высокая нагрузка.
Однако суставы поменьше также могут страдать от определенных болезней или повреждаться в результате травм таким образом, чтобы пациенту требовалось эндопротезирование. В случае повреждения локтевого сустава, чаще всего проводится эндопротезирование головки лучевой кости.
Особенности эндопротезирования лучевой кости
Поскольку локтевой сустав является сравнительно небольшим, то он намного реже подвергается разнообразным болезням, которые характерны для хрящевой ткани. В абсолютно большинстве случаев эндопротезирование локтевого сустава происходит в результате бытовых, производственных или спортивных травм.
Перелом головки лучевой кости происходит в 33% случаев от всех переломов локтевого сустава. Чаще всего кость нормально срастается после повреждения, однако в особо тяжелых случаях может потребоваться эндопротезирование.
Если проигнорировать проблему повреждения головки лучевой кости, то в долгосрочной перспективе она может привести к таким негативным результатам:
- остеоартрозу и вальгусной нестабильности в локтевом суставе;
- образованию остеофитов;
- увеличению нагрузки и повреждению хрящевой ткани в локтевом суставе.
В результате этого чаще всего замена головки лучевой кости происходит из-за таких показаний:
- свежие и застарелые переломы;
- переломы, в результате которых лучевая кость неправильно срослась;
- рецидив в результате вывиха, который развился в перелом головки лучевой кости.
Как происходит эндопротезирование лучевой кости
Для начала при переломе или вывихе пациент обращается к ортопеду-травматологу, который проводит необходимые снимки поврежденной части тело и вместе с пациентом решает нужно ли в данном случае проводить эндопротезирование. После диагностирования проблемы и принятом решении об эндопротезировании необходимо выбрать протез головки лучевой кости.
Во время этого процесса следует обращать внимание на такие аспекты:
- возраст пациента;
- характер повреждения головки лучевой кости;
- наличие сопутствующих заболеваний (особенно это касается соматических заболеваний, воспалительных процессов в области локтевого сустава, а также повреждения мыщелка плечевой кости;
- характер работы пациента;
- активность образа жизни.
Таким образом пациент получает возможность выбирать имплант головки лучевой кости из нескольких моделей, каждая из которых может обладать различными характеристиками. Также выбор эндопротеза напрямую зависит от финансовых возможностей пациента.
Подготовка пациента к операции
После принятия решения об эндопротезировании, а также выбора соответствующего импланта пациент начинает готовиться к операции.
Для этого ему необходимо осуществить:
- прохождение полного клинического обследования;
- доведение до стадии ремиссии тяжелых заболеваний, например, сахарного диабета, язвы желудка и т. д.;
- добиться исчезновения воспалительных процессов в области проведения операции;
- проверить у стоматолога состояние зубов, если необходимо – вырвать один или несколько зубов и подождать две недели до того, как раны заживут;
- дождаться заживления повреждений кожи при наличии ссадин или трещин;
- за месяц до даты операции полностью прекратить курить.
Средний койка-день для каждого пациента после замены головки лучевой кости составляет 11 дней. Именно поэтому перед операцией необходимо подготовить необходимые принадлежности для пребывания в больнице:
- гигиенические принадлежности (зубная паста, щетка, туалетная бумага и т.д.);
- уличную и домашнюю обувь;
- домашнюю одежду;
- список лекарств;
- предметы для более увлекательного провождения времени – книги, смартфон, ноутбук и т.д.
Следует отметить, что более 70% пациентов, которым проводили эндопротезирование лучевой кости полностью возвращали утраченную подвижность своей руки за 7 месяцев. Остальным пациентам потребовалось немного больше времени на восстановление подвижности.
а) Показания для операции остеосинтеза пластиной при дистальном переломе лучевой кости:
- Плановые: переломы при сгибании, переломы тыльного или ладонного суставного края.
- Противопоказания: открытые переломы с повреждением мягких тканей.
- Альтернативные процедуры: внешняя фиксация.
б) Предоперационная подготовка. Предоперационное обследование: исключите повреждение сосудов и нервов (особенно срединного нерва!).
в) Специфические риски, информированное согласие пациента:
- Инфекция
- Повреждение сосудов и нервов
- Возможен забор и использование губчатой кости
- Нарушение репозиции (менее 10% случаев)
- Сниженная амплитуда движений
- Удаление фиксатора
г) Обезболивание. Блокада плечевого сплетения, общее обезболивание.
д) Положение пациента. Лежа на спине, подлокотник, турникет, электронно-оптический усилитель изображения.
е) Оперативный доступ. Ладонный разрез, в локтевую сторону от сухожилия лучевого сгибателя запястья.
ж) Этапы операции:
- Место перелома
- Разрез кожи
- Доступ
- Пересечение квадратного пронатора
- Идентификация места перелома
- Контурирование Т-образной пластины
- Восстановление мышцы
з) Анатомические особенности, серьезные риски, оперативные приемы:
- Предупреждение: избегайте интенсивных и повторных репозиционных действий: рефлекторная симпатическая дистрофия (синдром Зудека).
- Отведите лучевую артерию и сопровождающие ее вены радиально, оставляя срединный нерв и сухожилия сгибателя на локтевой стороне.
- Полностью отделите квадратный пронатор от места его прикрепления на лучевой кости.
- Если срединный нерв сдавлен, возможно пересечение поперечной запястной связки.
и) Меры при специфических осложнениях. Заполните дефекты в области раздробления метафиза губчатой костью.
к) Послеоперационный уход после операции при дистальном переломе лучевой кости:
- Медицинский уход: удалите активный дренаж на 2-й день; удалите пластину через 6-9 месяцев.
- Физиотерапия: ранние упражнения на амплитуду движений, если фиксация перелома устойчива.
- Период нетрудоспособности: 2-8 недель, в зависимости от рода деятельности и стороны повреждения.
л) Этапы и техника операции остеосинтеза пластиной при дистальном переломе лучевой кости:
1. Место перелома
2. Разрез кожи
3. Доступ
4. Пересечение квадратного пронатора
5. Идентификация места перелома
6. Контурирование Т-образной пластины
7. Восстановление мышцы
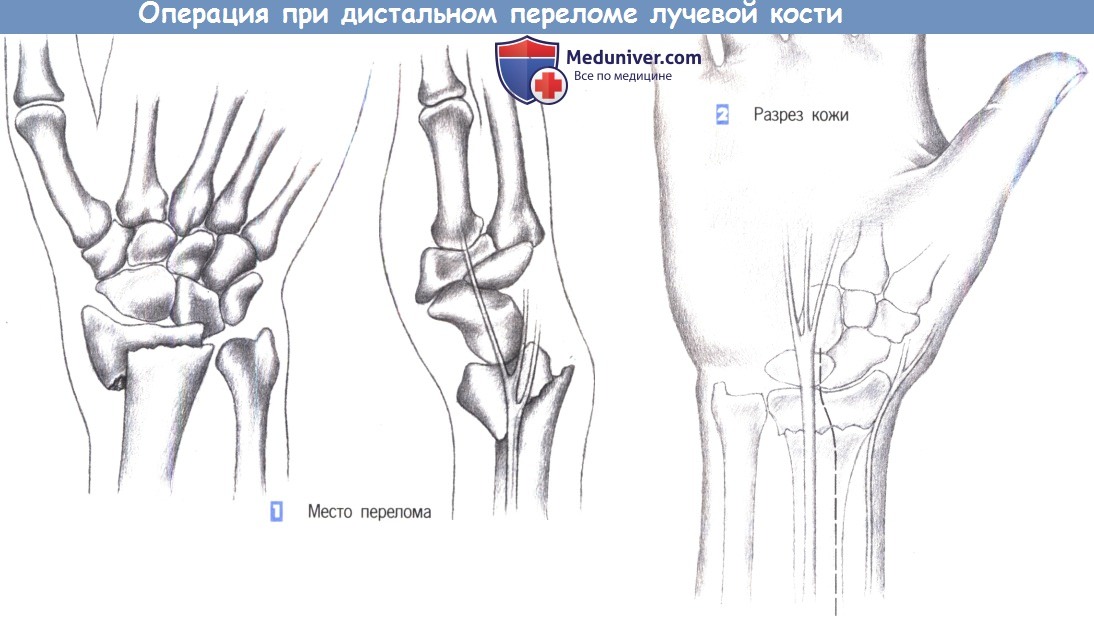
1. Место перелома. Показаниями к операции являются нестабильные переломы лучевой кости, возникающие обычно при избыточным сгибании. Близкое расположение поверхностной ветви лучевого нерва нередко приводит к нарушению чувствительности. Ладонный краевой перелом не поддается консервативному лечению. Эта ситуация - основное показание для фиксации перелома лучевой кости пластиной.
2. Разрез кожи. Разрез кожи для ладонного доступа должен быть ориентирован на ход срединного нерва, который находится в непосредственной близости от длинной ладонной мышцы, являющейся лучшей структурой для ориентации. Нерв проходит между длинной ладонной мышцей и лучевым сгибателем запястья. Разрез кожи немного отклоняется в лучевую сторону от пальпируемого сухожилия длинной ладонной мышцы и продолжается через более глубокие слои. Здесь необходимо избежать повреждения поверхностной ветви лучевого нерва.
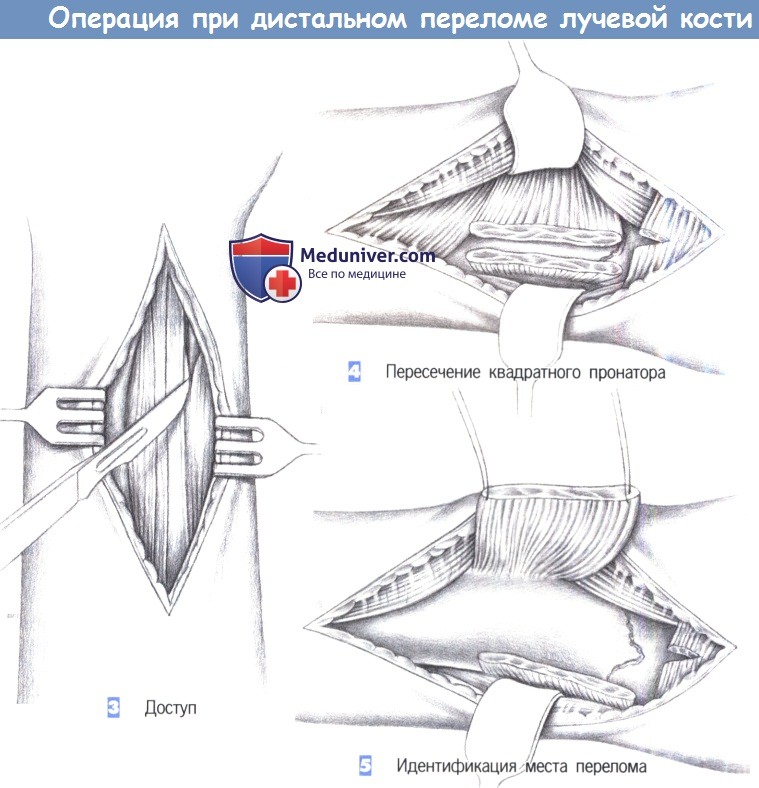
3. Доступ. Как только обнажается межмышечный промежуток, рекомендуется разработать слой между легко пальпируемым сухожилием лучевого сгибателя запястья с одной стороны и сухожилием длинной ладонной мышцы вместе со срединным нервом -другой. В зависимости от протяженности перелома разработка слоя может быть расширена до сухожильного растяжения сгибателя, чтобы полностью обнажить шиловидный отросток лучевой кости.
4. Пересечение квадратного пронатора. После обнаружения квадратный пронатор пересекается по лучевой кости. Срединный нерв и сгибатели пальцев отводятся тупым крючком в локтевую сторону, в то время как лучевая артерия и лучевой сгибатель запястья отводятся в лучевом направлении.
5. Идентификация места перелома. После полного отведения мышцы квадратного пронатора в глубине обнаруживается место перелома. С этой целью сухожильное растяжение сгибателя отделяется настолько дистально, насколько это возможно.
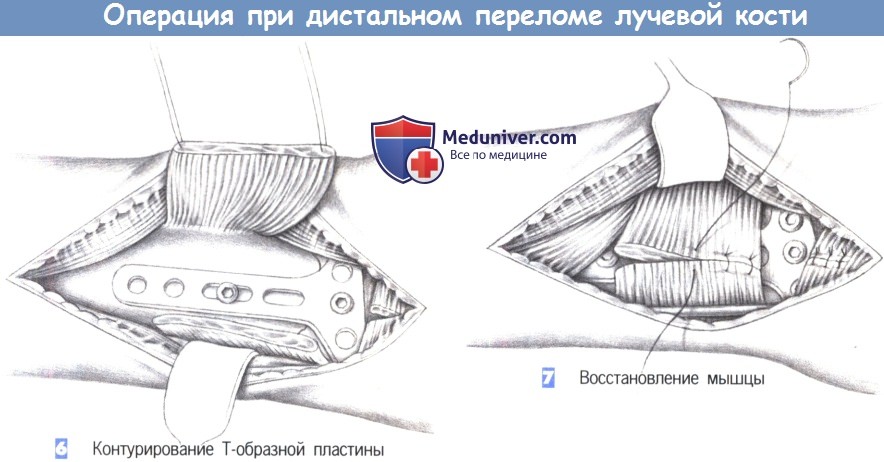
6. Контурирование Т-образной пластины. После обнажения перелома подгоняется Т-образная пластина небольшого размера. Пластина накладывается и устанавливается таким образом, чтобы удержать все фрагменты. После фиксации к шиловидному отростку лучевой кости положение пластины можно подправить с помощью овального отверстия и фиксировать ее в правильном положении остальными винтами.
7. Восстановление мышцы. После рентгенологического подтверждения положения пластины в двух плоскостях, квадратный пронатор восстанавливается отдельными швами (3-0 PGA). Затем устанавливается активный дренаж, и сухожилия возвращаются в их первоначальное положение. Это сопровождается восстановлением сухожильного растяжения сгибателя отдельными швами. Операция заканчивается подкожными и кожными швами, и наложением дорсальной шиной ниже локтя.
При значительном смещении отломков используется остеосинтез лучевой кости металлической пластиной, специально разработанной для данной области. После сопоставления отломков, пластина фиксируется винтами к поврежденной кости. После установки пластины, на кожу накладываются швы, также применяется гипсовая лонгета. После операции назначается лекарственная терапия: обезболивающие препараты, препараты кальция для стимуляции сращения кости, при необходимости – препараты местного действия для уменьшения отека. Средний срок пребывания в стационаре – 7 дней. Швы снимаются в спустя 2 недели, на контрольном приеме у травматолога, тогда же пациент отказывается и от гипсовой повязки. Рука находится в возвышенном положении на косыночной повязке. Необходимости в удалении пластины, как правило, нет.
Аппарат внешней фиксации
В некоторых случаях – в пожилом возрасте, при выраженном отеке кисти и лучезапястного сустава, делать доступ для установки пластины бывает нежелательно в силу различных факторов (отек, состояние кожи). В таких случаях устанавливают аппарат внешней фиксации – он фиксирует отломки с помощью спиц, которые проходят через кожу в кость. Аппарат выступает над кожей небольшим блоком (около 12 см длиной и 3 см высотой). Преимущество этого вида остеосинтеза в том, что нет необходимости делать большие разрезы кожи, однако за аппаратом нужно следить весь срок его ношения – делать перевязки, чтобы спицы не воспалились.
После операции рука 2 недели находится в гипсовой лонгете, затем пациент начинает разрабатывать лучезапястный сустав в аппарате, который этому не препятствует.
Аппарат внешней фиксации удаляется примерно через 6 недель, после проведения рентген-контроля, в условиях стационара. Перевязки необходимо проводить через день, в амбулаторном режиме. Рука носится в возвышенном положении на косыночной повязке.
Фиксация спицами или винтами
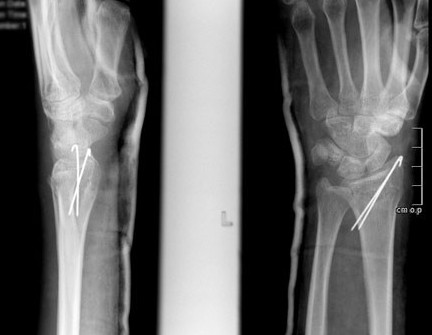
При незначительном смещении отломков лучевая кость фиксируется спицами или винтами через небольшие проколы кожи. По стандартному протоколу, на 2 недели накладывается гипсовая лонгета, затем пациент начинает разрабатывать руку. Спустя 6 недель спицы извлекаются.
В ряде случаев возможно применение саморассасывающихся имплантатов (винтов, спиц), удалять которые не нужно.
Застарелые, неправильно сросшиеся переломы лучевой кости
При застарелых неправильно сросшихся переломах, пациентов могут беспокоить болевые ощущения, присутствовать ограничения движения – тугоподвижность сустава, и другие неприятные последствия (онемение и отечность пальцев кисти). В подобных случаях рекомендовано оперативное лечение, чаще всего – с фиксацией пластиной. Кость разобщается, выставляется в правильное положение и фиксируется. Если есть зона дефекта кости – например, если кость срослась с укорочением, то он заполняется либо собственной костью человека: производится пересадка кости, которая берется, обычно, из гребня подвздошной (тазовой) кости, либо искусственной костью, которая примерно за 2 года перестраивается в собственную костную ткань.
Дальнейшее послеоперационное лечение при застарелых и неправильно сросшихся переломах лучевой кости аналогичны описанным ранее. Однако,может потребоваться более длительная реабилитация.
Анестезия при оперативном лечении перелома дистального метаэпифиза лучевой кости
Для проведения всех вышеописанных операций, как правило, используется проводниковая анестезия - раствор анестетика вводится в зону плечевого сплетения, где проходят нервы, которые отвечают за чувствительность и движения верхней конечности, и рука полностью немеет. Подобная анестезия достаточно легко переносится, длится 4-6 часов. Фактически это разновидность местной анестезии. Кроме того, делается премедикация – успокаивающий укол перед операцией, и во время операции человек спит своим сном. Возможно применение общей анестезии. Окончательный выбор метода анестезии определяется врачом-анестезиологом накануне операции при совместной беседе с пациентом.
Контакты: +7 (495) 155-19-61, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Читайте также: