Распад пуриновых нуклеотидов гиперурикемия и подагра
Обмен дезоксиуридиловых нуклеотидов
Дезоксиуридиловые нуклеотидыявляются промежуточными продуктами синтеза тимидиловых нуклеотидов.дУТФ легко узнается ДНК полимеразами и может быть использован для синтеза ДНК вместо дТТФ. При репликации урацила в структуре ДНК образует комплементарную пару с аденином, так что при этом не теряется информация, записанная на ДНК. Однако дУМФ может возникать в структуре ДНК путем спонтанного дезаминирования дЦМФ. В этом случае при репликации возникает мутация, поскольку комплементарное основание цитозина гуанин, а не аденин.
Для предупреждения встраивания уридиновых нуклеотидов в ДНК в клетках действует простой механизм. Фермент дУТФаза, превращает дУТФ (субстрат ДНК полимеразы) в дУМФ (не является субстратом ДНК полимеразы), который используется для синтеза тимидиловых нуклеотидов , поскольку дУМФ превращается вначале дТМФ, а затем и дТТФ.
Конечный продукт распада пуриновых нуклеотидов мочевая кислота характеризуется низкой растворимостью в воде, ее натриевая соль отличается более высокой растворимостью. Форма, в которой мочевая кислота находится в биологических жидкостях (кровь, моча, спиномозговая жидкость), зависит от рН этой жидкости. Величина рК для протона N9 составляет 5,75, а для протона N-l—10,3. Это означает, что в физиологических условиях, т е. при нормальном рН физиологических жидкостей, можно обнаружить как саму мочевую кислоту, так и ее мононатриевую соль (урат натрия). В жидкостяхс рН ниже 5,75 основной молекулярной формой является мочевая кислота. При рН 5,75 кислота и ее соль присутствуют в эквимолярных количествах. При рН выше 5,75 доминирующая форма - натриевая соль мочевой кислоты.
Нарушения пуринового обмена включают гиперурикемию, гипоурикемию и болезни иммунодефицита.
Очень высокая концентрация мочевой кислоты в крови ведет к довольно распространенной группе болезней, называемых подагрой. Частота подагры зависит от страны и составляет около 3/1000. Подагра - группа патологических состояний, связанных с заметно повышенными уровнями урата в крови (в норме 3-7 мг/100 мл). Гиперурикемия не всегда проявляется какими-либо симптомами но, у некоторых людей, способствует осаждению кристаллов урата натрия в суставах и тканях. В дополнение к выраженной боли сопровождающей обострение, повторные приступы приводят к деструкции тканей и тяжелых артритоподобных нарушений. Термин подагра должен быть ограничен гиперурикемией с присутствием таких подагрических отложений.
Ниже приводится таблица, указывающая на возможные причины нарушения обмена пуриновых нуклеотидов
| Нарушения обмена пуриновых нуклеотидов. | |||
| Болезнь | Дефект | Природа дефекта | коментарий |
| Подагра | ФРПФ синтетаза | Увеличение активности фермента из-за повышенный Vmax | Повышенное образование Гиперурикемия |
| Подагра | ФРПФ синтетаза | Фермент устойчив к торможению продуктами | Гиперурикемия |
| Подагра | ФРПФ синтетаза | Фермент имеет высокое сродство к рибоза-5-фосфату (снижение Km) | Гиперурикемия |
| Подагра | ФРПФ синтетаза | Потеря способности к торможению по типу обратной связи | Гиперурикемия |
| Подагра | ГГФРТ a | Частично дефектный фермент | Гиперурикемия |
| Синдром Леша-Нихана | ГГФРТ | Отсутствие фермента | См. выше |
| ТКИД | АДА b | Отсутствие фермента | См. выше |
| Иммунодефицит | ПНФ c | Отсутствие фермента | См. выше |
| Почечно каменная болезнь | АФРТ d | Отсутствие фермента | 2,8-дигидроксиадениловый почечный литиаз |
| Ксантинурия | Ксантиноксидаза | Отсутствие фермента | Гипоурикемия и ксантиновый почечный литиаз |
| Боллезнь Гирке | Глюкозо-6-фосфатаза | Отсутствие фермента | См. выше |
| а Гипоксантин-гуанин фосфорибозилтрансфераза; b аденозин дезаминаза; c пуриновая нуклеотидфосфорилаза; d aденозин фосфорибозил трансфераза ТКИД- тяжелый комбинированный иммунодефицит |
Причинамиповышения могут быть нарушения функции трех основных ферментов обмена пуринов рис
Рис.9-25.Основные ферменты метаболизма пуринов, нарушение функции которых ведет к повышению уровня мочевой кислоты.
ФРПФ амидотрансферазы - Дефекты в структуре ФРПФ амидотрансферазы могут приводить к потере чувствительности к торможению по типу обратной связи пуриновыми нуклеотидами, что приводит к повышенному синтезу пуриновых нуклеотидов, мочевой кислоты, и развитию подагры.
Гипоксантин-гуанин фосфорибозилтрансферазы (ГГФРТ). ГГФРТ обеспечивает повторное использование пуринов (для аденинa –аденин фосфорибозилтрансфераза АФРТ). Отношения между дефектом этого фермента и подагрой неясны. Это может быть связано с тем, что субстратом ГГФРТ является ФРПФ. Активность фермента у больных подагрой значительно снижена. Полное отсутствие активности фермента обнаруживается у больных синдромом Леша-Найхана.
Подагра может также быть вызвана нарушениями выделения мочевой кислоты (связанными с неспособностью почечных канальцев выделить мочевую кислоту).
У больных со злокачественными опухолями подагра может возникнуть в результате химиотерапии, при которой происходит гибель клеток, что приводит к повышению образования пуринов за счет нуклеиновых кислот гибнущих клеток
В водных растворах мочевая кислота (протонированная форма урата) в семнадцать раз менее растворима, чем ее натриевая соль. Моча прирН 5 становится насыщенной уратами при концентрации 15 мг%. Поскольку рН мочи здоровых людей в норме ниже рК мочевой кислоты (5,75), ураты в моче представлены в основном мочевой кислотой. Если рН мочи достигает 7, то в ней может раствориться 150—200 мг уратов на 100 мл.
Мочевая кислота становится основной формой уратов при рН мочи ниже рН 5,75. Такое значение рН характерно для дистальных канальцев и собирательных трубочек почек. Если кристаллы этого конечного продукта катаболизма пуринов образуются в системе выведения мочи, т.e. в зоне, проксимальной от области закисления мочи, это будут кристаллы урата натрия; в самой же области закисления окажутся кристаллы мочевой кислоты. Поэтому большинство камней, образующихся в мочевыводящих путях, состоят из мочевой кислоты. Интенсивность образования камней мочевой кислоты можно в значительной мере уменьшить, смещаярН мочи в щелочном направлении (при этом будет доминировать более растворимая форма—урат натрия).
Синдром Леша—Найхана (полное отсутствие ГГФРТ) наследуется как сцепленный с X-хромосомой рецессивный признак. Болезнь характеризуется корковым параличом, сопровождающимся хореоатетозом, судоргами, стремлением к члено-вредительству и тяжелой гиперурикемией. В моче наблюдается образование камней мочевой кислоты. Матери больных детей гетерозиготны и мозаичны в отношении ГГФРТазной недостаточности, у них часто обнаруживается гиперурикемия, но без неврологических симптомов. Частичная недостаточность ГГФРТазы, вызванная мутациями соответствующего гена, встречается и у мужчин. Для таких больных характерна тажелая гиперурикемия, не сопровождающаяся существенными неврологическимими нарушениями
Избыточное образование пуринов у пациентов с недостаточностью ГГФРТ связано с увеличенной внутриклеточной концентрацией ФРПФ, что, по-видимому, является результатом уменьшения потребления ФРПФ на. пути регенерации пуриновых нуклеотидов. Биохимическая основа некрологических отклонений при синдроме Леша—Найхана неизвестна.
Избыточное образование пуринов и гиперурикемия приболезни Гирке—явление вторичное. Оно обусловлено повышением активности гексозомоно-фосфатного шунта и увеличением образования рибозо-5-фосфата, из которого синтезируетисяФРПФ.
Для больных с недостаточностыо глюкозо--6-фосфатазы характерен хронический молочнокислый ацидоз, приводящий к повышению порога секреции уратов почками, что способствует накоплению уратов в организме.
Все известные дефекты ферментных систем (за исключением глюкозо-6-фосфатазной недостаточности, для которой соответствующих данных не получено приводит к повышению внутриклеточной концентрации ФРПФ). Избыточная продукция пуринов при глюкозо--б-фосфатазной недостаточности, вероятно также обусловлена этим обстоятельством. Вполне возможно, что и другие нарушения обмена пуринов, приводящие к гиперурикемии , в конечном счете связаны с повышением внутриклеточного уровня ФРПФ.
Гипоурикемия обусловлена либо усилением экскреции либо снижением скорости образования уратов. У человека она связана чаще всего с нарушением реабсорбции мочевой кислоты из клубочкового фильтрата, что может приводить к выделению уратов и мочевой кислоты в количествах, которые является неадекватно большимотношению к содержанию уратов в плазме.
Недостаточность ксантиноксидазы, вызванная либо генетнческим дефектом, либо тяжелым поражением печени, приводит к гипоурикемии и увеличение экскреции оксипуринов — гипоксантина и ксантина. При тяжелой недостаточности ксантиноксидазы у пациентов часто развиваетсяксантннурияи образование ксантиновых камней.
У больных со злокачественными опухолями подагра может возникнуть как осложнение химиотерапии, вызывающей гибель клеток и, как следствие, повышение образования пуринов за счет нуклеиновых кислот гибнущих клеток.
В лечении подагры нашел широкое применение аллопуринол, химическое соединение структурно подобное гипоксантину. Это хороший ингибитор ксантиноксидазы. Его применение приводит к накоплению гипоксантина и ксантина, которые лучше растворимы в воде и легче выделяются, чем мочевая кислота.
Самым частым нарушением обмена пуринов является повышенное образование мочевой кислоты с развитием гиперурикемии. Особенностью является то, что растворимость солей мочевой кислоты (уратов) в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой.
В зависимости от длительности и тяжести гиперурикемия проявляется:
- Появление тофусов (греч. tophus – пористый камень, туф) – отложение уратных кристаллов в коже и подкожных слоях, в мелких суставах ног и рук, в сухожилиях, хрящах, костях и мышцах.
- Нефропатии в результате кристаллизации мочевой кислоты с поражением почечных канальцев и мочекаменная болезнь .
- Подагра – поражение мелких суставов.
Для диагностики нарушений используют определение концентрации мочевой кислоты в крови и моче.
Нарушения обмена пуринов
Когда гиперурикемия принимает хронический характер, говорят о развитии подагры (греч. poclos – нога, agra – захват, дословно – "нога в капкане").
В крови мочевая кислота находится в форме ее солей – уратов натрия. Из-за низкой растворимости ураты способны оседать в зонах с пониженной температурой, например, в мелких суставах стоп и пальцев ног. Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции – развивается подагрический артрит . В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног.
Длительное время подагру считали "болезнью гурманов", однако затем внимание исследователей переместилось к наследственному изменению активности ферментов метаболизма пуринов:
- увеличение активности ФРДФ-синтетазы – приводит к избыточному синтезу пуринов,
- уменьшение активности гипоксантин-гуанин-фосфорибозил-трансферазы – из-за этого ФРДФ не используется для реутилизации пуриновых оснований, а участвует в первой реакции их синтеза. В результате возрастает количество разрушающихся пуринов и одновременно повышается их образование.
Оба ферментативных нарушения рецессивны и сцеплены с X-хромосомой. Подагрой страдает 0,3-1,7% взрослого населения земного шара, соотношение заболевших мужчин и женщин составляет 20 : 1.
Диета – снижение поступления предшественников мочевой кислоты с пищей и уменьшение ее образования в организме. Для этого из рациона исключаются продукты, содержащих много пуриновых оснований – пиво, кофе, чай, шоколад, мясные продукты, печень, красное вино. Предпочтение отдается вегетарианской диете с количеством чистой воды не менее 2 л в сутки.
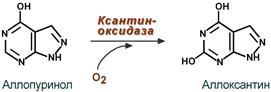
К лекарственным средствам лечения подагры относят аллопуринол , по структуре схожий с гипоксантином. Ксантиноксидаза окисляет аллопуринол в аллоксантин, и последний остается прочно связанным с активным центром фермента и ингибирует его. Фермент осуществляет, образно говоря, самоубийственный катализ. Как следствие, ксантин не превращается в мочевую кислоту, и поскольку гипоксантин и ксантин лучше растворимы в воде, то они более легко выводятся из организма с мочой.
Мочекаменная болезнь заключается в образовании солевых кристаллов (камней) разной природы в мочевыводящих путях. Непосредственно образование мочекислых камней составляет около 15% от всех случаев этой болезни. Мочекислые камни в мочевыводящих путях откладываются примерно у половины больных подагрой.
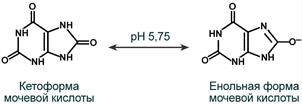
Наиболее часто такие камни представлены в дистальных канальцах и собирательных трубочках. Причиной отложения кристаллов мочевой кислоты является гиперурикемия и повышенное выведение уратов натрия с мочой. Главным провоцирующим фактором кристаллизации является увеличение кислотности мочи . При понижении рН мочи ниже 5,75 ураты (енольная форма) переходят в менее растворимую кетоформу и кристаллизуются в почечных канальцах.
Так же, как при подагре, лечение сводится к беспуриновой диете и использованию аллопуринола . В дополнение рекомендуется растительная диета, приводящая к защелачиванию мочи, что увеличивает в моче долю более растворимой в воде енольной формы мочевой кислоты. Вместе с этим, уже имеющиеся кристаллы мочевой кислоты (а также кристаллы оксалатов) способны растворяться при подщелачивании мочи.
Лекарственное лечение непременно должно сопровождаться соблюдением беспуриновой диеты с большим количеством чистой воды, в противном случае неизбежно появление ксантиновых кристаллов в тканях и ксантиновых камней в почках.
Болезнь Леша-Нихана (частота 1:300000) – это полное врожденное отсутствие активности гипоксантин-гуанин-фосфорибозил-трансферазы , фермента, отвечающего за реутилизацию пуриновых оснований. Признак рецессивный и сцеплен с Х-хромосомой. Впервые его описали в 1964 г в США студент-медик Майкл Леш и педиатр Уильям Нихан.
Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживаются отклонения в развитии, а именно – отставание физического развития (с трудом держит голову), повышенная возбудимость, рвота, периодическое повышение температуры. Выделение мочевой кислоты можно обнаружить еще раньше по оранжевой окраске пеленок. К концу первого года жизни симптомы нарастают, развивается нарушение координации движений, хореоатетоз, корковый паралич, спазм мышц ног. Наиболее характерный признак заболевания проявляется на 2-3-м году жизни – аутоагрессия или самокалечение – неодолимое стремление детей кусать себе губы, язык, суставы пальцев на руках и ногах. Агрессия больных распространяется также на неживые предметы и окружающих людей. Нарушения интеллекта выражены, его снижение может быть до IQ≈60.
Лечение основано на беспуриновой диете с большим количеством чистой воды и с использованием аллопуринола. Производится контроль деятельности пациента с помощью физических ограничений и психологической терапии.
Распад пуриновых нуклеотидов.
Аденозин и гуанозин, которые образуются при гидролизе пуриновых нуклеотидов, подвергаются ферментативному распаду с образованием конечного продукта – мочевой кислоты, которая выводится с мочой из организма.
Распад пиримидиновых нуклеотидов.
Начальные этапы этого процесса катализируются специфическими ферментами. Конечные продукты: СО2, NН3, мочевина, β-аланин, β-аминоизомасляная кислота. β-аланин используется для синтеза дипептидов мышц – карнозина и ансерина или выделяется с мочой.

Биосинтез пуриновых, пиримидиновых нуклеотидов в тканях.
Биосинтез пуриновых мононуклеотидов.
Первоначальным соединением синтеза служит Д-рибозо-5-фосфат, который является продуктом пентозофосфатного цикла и на который переносится пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофосфат (ФРПФ) взаимодействует с глутамином, который является донором NН2-группы в результате чего образуется β-5-фосфорибозил-амин. Эта стадия становится ключевой в синтезе пуринов. Затем присоединяется молекула глицина к свободной NН2-группе β-5-фосфорибозил-амина с образованием глицинамидрибонуклеотида. Еще через несколько стадий образуется первый пуриновый нуклеотид инозинмонофосфат (ИМФ), из которого затем синтезируются остальные нуклеозидфосфаты.

Биосинтез пиримидиновых нуклеотидов
Первоначальными соединениями этого процесса являются карбамоилфосфат и аспарагиновая кислота. Из них через длинную цепь реакций образуется уридинмонофосфат (УМФ) и остальные пиримидиновые нуклеотиды.

2.4. Заболевания, связанные с нарушением обмена нуклеотидов: подагра, синдром Леша-Нихена.
Гиперурикемия – повышение в плазме крови концентрации мочевой кислоты. Вследствие гиперурикемии может развиться подагра.
Подагра – заболевание, вызванное нарушением обмена нуклеиновых кислот. В хрящах, сухожилиях, в суставных сумках, иногда в почках, коже, мышцах откладываются кристаллы мочевой кислоты и уратов. Вокруг этих отложений образуется воспаление и грануляционный вал, который окружает омертвевшую ткань, при этом образуются подагрические узлы - тофусы (в суставах пальцев рук, ног, в хрящах ушной раковины), что сопровождается деформацией и болезненностью пораженных суставов. К характерным признакам подагры относятся повторяющиеся приступы острого воспаления суставов (чаще всего мелких) – острого подагрического артрита. Обычно больные склонны к атеросклерозу и гипертонии. В их крови наблюдается большая концентрация мочевой кислоты – гиперурикемия. В течение нескольких дней перед приступом подагры увеличивается выделение воды и хлорида натрия с мочой, т.е. сдвигается водно-солевой баланс. Вследствие этого возрастает концентрация мочевой кислоты в крови и отложение ее в тканях. Как правило, подагра генетически детерминирована и носит семейный характер. Она вызвана нарушениями в работе фосфорибозилдифосфата (ФРДФ) синтетазы или гипоксантингуанин- или аденинфосфорибозилтрансфераз. К другим характерным проявлениям относят нефропатию, при которой наблюдают образование уратных камней в мочевыводящих путях.
Синдром Леша-Нихена – тяжелая форма гиперурикемии, которая наследуется как рецессивный признак, сцепленный с Х-хромосомой. Проявляется только у мальчиков. Кроме симптомов подагры наблюдаются церебральные параличи, нарушение интеллекта, попытки наносить себе раны (укусы губ, пальцев). Связана болезнь с дефектом фермента гипоксантин-гуанин-фосфорибозилтрансферазы, которая катализирует превращение гипоксантина и гуанина в гуанинимонофосфат (ГМФ), поэтому они превращаются в мочевую кислоту. В первые месяцы жизни неврологические расстройства не обнаруживаются, но на пеленках отмечают розовые пятна, вызванные присутствием в моче кристаллов мочевой кислоты. При отсутствии лечения больные погибают в возрасте до 10 лет из-за нарушения функции почек.
Основной препарат для лечения гиперурикемии – аллопуринол (структурный аналог гипоксантина).
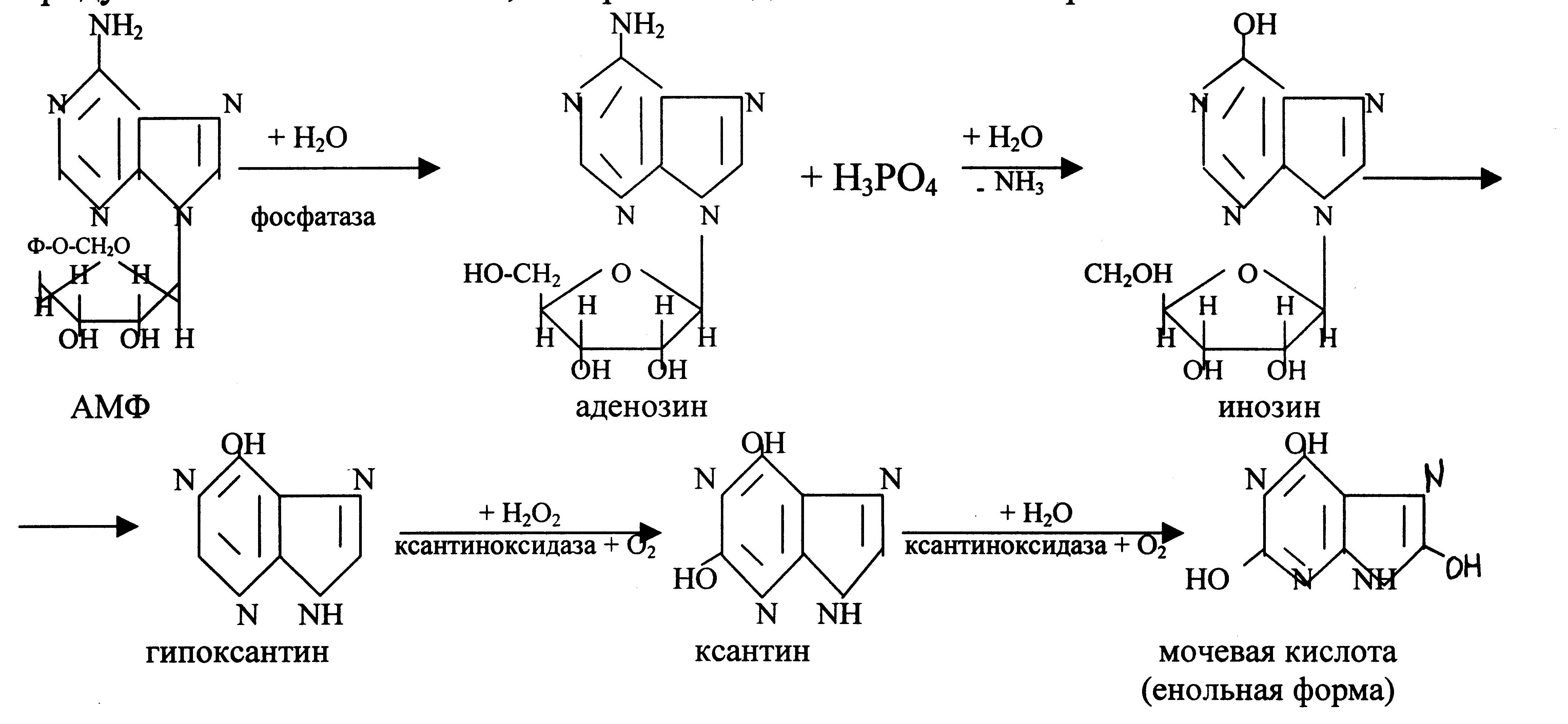
Вначале нуклеиновые кислоты при участии соответствующих ферментов (ДНК- и РНК-азы) деполимеризуются с образованием пуриновых и пиримидиновых нуклеотидов. Нуклеотиды под действием нуклеотидаз гидролитически распадаются до нуклеозидов. Процесс распада пуриновых мононуклеозидов (аденозина и гуанозина) активно протекает в печени, почках, слизистой кишечника животного. Рассмотрим распад АМФ.
АМФ переходит в аденозин — нуклеозид, включающий аде- нин и рибозу. Аденозин претерпевает гидролитическое дезаминирование при участии адениндезаминазы, образуя инозин:

Инозин передает рибозу на фосфорную кислоту с образованием рибозофосфата и гипоксантина: 
Гипоксантин при участии Мо- и Fe-содержащего фермента ксантиноксидазы с простетической группой ФАД окисляется в ксантин:

Данная реакция — пример сокращенного пути биологического окисления, когда атомы водорода от субстрата с участием ксантиноксидазы передаются прямо на молекулярный кислород, образуя перекись водорода, но не молекулу воды, как в случае при классическом биологическом окислении.
Под влиянием этого же фермента (ксантиноксидазы) ксантин окисляется в мочевую кислоту:

Ксантиноксидаза играет важнейшую роль, особенно в почках и печени птиц, которые экскретируют мочевую кислоту как основной конечный азотсодержащий продукт метаболизма пуринов. Ксантиноксидаза в больших количествах присутствует в печени, слизистой кишечника и в молоке. Мочевая кислота у человека, птиц является также основным продуктом азотистого обмена, соответствуя мочевине у других видов животных.
У птиц избыток аминного азота идет на синтез пуринов, которые расщепляются затем до мочевой кислоты, очень плохо растворимой в воде. Такой обходной путь выведения азота сохраняет гомеостаз воды в организме птицы. Кислая моча птиц представляет собой суспензию кристаллов мочевой кислоты, которые экскретируются из организма с минимальным количеством воды. Мочевая кислота составляет основу сухого вещества мочи птиц (70-80%). Поэтому в промышленных целях мочевую кислоту получают из экскрементов морских птиц.
У млекопитающих (крупный и мелкий рогатый скот, свиньи, лошади, собаки) при участии фермента уриказы мочевая кислота превращается в аллантоин, конечный продукт распада пуриновых оснований:

У рыб фермент аллантоиназа осуществляет разрыв имидазольного цикла аллантоина, что приводит к получению аллан- тоиновой кислоты:

У хрящевых рыб (акулы и скаты) и амфибий аллантоиновая кислота далее распадается при участии фермента аллантоиназы и воды на две молекулы мочевины и глиоксиловую кислоту:

Большинство морских беспозвоночных (и ракообразных) с участием фермента уреазы разлагают мочевину на воду и С02:

Другой пурин — гуанин — по аналогичной схеме под действием фермента гуаназы превращается в ксантин и далее в точности повторяется катаболический путь ксантина.
Одним из характерных нарушений нуклеинового обмена является подагра (поражения суставов и почек) — болезнь, сопровождающаяся резким повышением концентрации мочевой кислоты в сыворотке крови. Воспаление суставов связано с осаждением в них кристаллов натриевой соли мочевой кислоты. Вероятно, подагра — результат различных врожденных нарушений метаболизма с избыточным синтезом уратов. Такое состояние возможно при нарушении механизмов выведения кислоты через почки и при условии ее усиленного синтеза. Подагра характеризуется отложением в суставах, слизистых сумках, почках, коже, мышцах узелков кристаллов мочевой кислоты и ее натриевой соли.
Икра рыб (богата нуклеиновыми кислотами) в рационе человека может обострять болезнь. Для снижения синтеза мочевой кислоты в организме используют аллопуринол — аналог гипоксантина, который является ингибитором ксантиноксида-

зы. Гипоксантин и ксантин не аккумулируются в больших концентрациях, так как они более растворимы и легко экскрети- руются из организма.
Понятие о нуклеопротеидах, их превращения в желудочно-кишечном тракте. Строение, биологическая роль, особенности обмена мононуклеотидов в организме человека.
Нуклеопротеиды – это сложные белки, небелковой частью которых являются нуклеиновые кислоты
Белковую часть составляют гистоны специализированные основные белки

Нуклеиновые кислоты - гетерополимеры, мономерами которых являются мононуклеотиды
Мононуклеотид состоит из азотистого основания, рибозы у РНК (или дезоксирибоза у ДНК) - вместе они составляют нуклеозид, и остатка фосфорной кислоты
В составе нуклеиновых кислот мононуклеотиды связаны 3’,5’-диэфирными связями между рибозами соседних мононуклеотидов через остаток фосфорной кислоты
Биологическая роль мононуклеотидов
Из мононуклеотидов построены:
/простетические группы ферментов/
/Мононуклеотиды содержат макроэргические связи - являются аккумуляторами энергии
- АТФ - это универсальный аккумулятор энергии./
/Мононуклеотиды - аллостерические эффекторы многих ключевых ферментов
цАМФ и цГМФ являются посредниками в передаче гормонального сигнала/
2.Биосинтез пуриновых нуклеотидов. Источники атомов пуринового кольца, реакции синтеза, роль витаминов В9 и В12.
Формировании пуринового кольца принимают участие аминокислоты Аспартат, Глицин, Глутамин, СО2 и два одноуглеродных производных тетрагидрофолата: метенил-Н4-фолат и формил-Н4-фолат.

3.Биосинтез пиримидиновых нуклеотидов. Источники атомов пиримидинового кольца, реакции синтеза, роль витаминов В9 и В12.


Распад пуриновых и пиримидиновых нуклеотидов. Особенности и реакции процесса распада, конечные метаболиты. Нарушения обмена пуриновых нуклеотидов при подагре.
Катаболизм пуриновых нуклеотидов
У человека основным продуктом катаболизма пуриновых нуклеотидов является мочевая кислота (рис.5.). Её образование идет путем гидролитического отщепления фосфатного остатка от нуклеотидов с помощью нуклеотидаз или фосфатаз, фосфоролиза N-гликозидной связи нуклеотидов пуриннуклеозидфосфорилазой, последующего дезаминирования азотисных оснований.
От АМФ и аденозина аминогруппа удаляется гидролитически аденозиндезаминазой с образованием ИМФ или инозина. ИМФ и ГМФ превращяются в соответствующие нуклеозиды: инозин и гуанозин под действием 5’-нуклеотидазы. Пуриннуклеозидфосфорилаза катализирует расщепление N-гликозидной связи в инозине и гуанозине с образованием рибозо-1-фосфата и азотистых оснований : гуанина и гипоксантина. Гуанин дезаминируется и превращяется в ксантин, а гипоксантин окисляется в ксантин с помощью ксантиноксидазы, которая катализирует и дальнейшее окисление ксантина в мочевую кислоту.
/Ксантиноксидаза – аэробная оксидоредуктаза, простетическая группа которой включает ион молибдена, железа (Fе3+) и ФАД+./
Катаболизм пиримидиновых нуклеотидов
Уже отмечалось, что цитидиловые нуклеотиды могут гидролитически терять аминогруппу и превращяться в УМФ. Когда от УМФ при участии нуклетидазы или ( фосфатазы ) и уридинфосфарилазы отщепляется неорганический фосфат и рибоза, то остается азотистое основание – урацил. Аналогично распределяются дезоксирибонуклеотиды, и из dЦМФ образуется урацил, а из dТМФ – тимин.
Пиримидиновые основания при участии дигидропиримидиндегидрогеназы присоединяют 2 атома водорода по двойной связи кольца с образованием дигидроурацила или дигидротимина. Оба гетероцикла могут взаимодействовать с водой в реакции, катализируемой дигидропиримидинциклогидролазой, и дигидроурацил превращяется в β-уреидоизопропионовую кислоту, а дигидротимин - в β- уреидоизомасляную кислоту. Оба β-уреидопроизводных под действием общего для них фермента уреидопропионазы расщепляются с образованием СО2, NH4+ и β-аланина или β-аминоизомасляной кислоты.соответственно.
/Мочевая кислота выводится из организма с мочой Однако в почках происходит ее интенсивная реабсорбция и концентрация мочевой кислоты в крови поддерживается на постоянном уровне 0.12-0.30 ммоль/л/
Функции мочевой кислоты:
- Является мощным стимулятором ЦНС - ингибирует фосфодиэстеразу цАМФ (внутриклеточный мессенджер адреналина и норадреналина), пролонгируя действие этих гормонов
- Обладает антиоксидантными свойствами
За сутки в организме образуется около 1 грамма мочевой кислоты
- Мочевая кислота и ее соли - ураты (натриевые соли мочевой кислоты) плохо растворимы в воде и могут выпадать в осадок и откладываться в сосудах
- Осадок уратов фагоцитируется макрофагами, которые погибая, освобождают гидролитические ферменты. Действие этих ферментов на окружающие ткани приводит к воспалению.
Даже незначительное повышение концентрации уратов или мочевой кислоты приводит к образованию осадков = Это ведет к развитию заболеваний - МОЧЕКАМЕННОЙ БОЛЕЗНИ (при отложении кристаллов в почечной лоханке или в мочевом пузыре) и ПОДАГРЫ (при отложении солей мочевой кислоты в суставах).
Строение ДНК и РНК. Химические связи, участвующие в формировании их структуры. Функции нуклеиновых кислот. Виды переноса генетической информации. Биологическая роль комплементарности азотистых оснований.
РНК (рибонуклеиновые кислоты) — нуклеиновые кислоты, линейные полимеры нуклеотидов, в состав которых входят остаток ортофосфорной кислоты(3), рибоза (в отличие от ДНК, содержащей дезоксирибозу) и азотистые основания — аденин, цитозин, гуанин и урацил (в отличие от ДНК, содержащей вместо урацила тимин).
В составе нуклеиновых кислот мононуклеотиды связаны 3’,5’-диэфирными связями между рибозами соседних мононуклеотидов через остаток фосфорной кислоты
Биологическая роль нуклеиновых кислот
- ДНК: /хранение генетической информации/
/хранение генетической информации у некоторых вирусов/
/реализация генетической информации: и-РНК (м-РНК) - информационная (матричная), т-РНК (транспортная), р-РНК (рибосомальная)/
Биологическое значение комплементарности – обеспечение передачи генетической информации по матричному типу
/Дочерний полинуклеотид комплементарен материнской полинуклеотидной цепочке/
Виды переноса генетической информации
=/ДНК → ДНК – репликация/
=/ДНК → иРНК, рРНК, тРНК – транскрипция/
=/РНК → белок – трансляция/
=/РНК → ДНК обратная транскрипция ( у РНК-содержащих вирусов)/
Читайте также:


