Остеоартроз коленного сустава диссертация
На правах рукописи
Меньшикова Ирина Вадимовна
СОВРЕМЕННЫЕ ПОДХОДЫ
К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ОСТЕОАРТРОЗА
КОЛЕННОГО СУСТАВА
14.01.04 – внутренние болезни
диссертации на соискание ученой степени
доктора медицинских наук
Работа выполнена в ГОУ ВПО Московская медицинская академия
Научные консультанты:
Доктор медицинских наук, профессор Сулимов Виталий Андреевич
Доктор медицинских наук, профессор,
Академик РАМН Насонов Евгений Львович
Официальные оппоненты:
Доктор медицинских наук, профессор,
Академик РАМН Сторожаков Геннадий Иванович
Доктор медицинских наук, профессор Ершов Владимир Игоревич
Доктор медицинских наук, профессор Бадокин Владимир Васильевич
Ведущая организация: ГОУ ВПО Московский государственный медико-стоматологический университет
С диссертацией можно ознакомиться в библиотеке Московской медицинской академии им. И.М.Сеченова по адресу: 117998, г. Москва, Нахимовский проспект, д.49.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Волчкова Елена Васильевна
Остеоартроз - самое распространенное заболевание суставов, являющееся одной из основных причин инвалидности у людей старшего возраста. По данным разных авторов частота встречаемости ОА в популяции составляет от 3 до 10% [Плаксина Т.В., 2005, Цветкова Е.С., 1997, Sun Y. Et al., 1997]. В нашей стране согласно эпидемиологическому исследованию Л.И.Беневоленской и Бржезовского М.М. (1988) она составляет 6,43%. При этом частота заболевания нарастает с возрастом: среди лиц старше 50 лет – достигает 27,1%, а старше 60 лет – 97%. В целом число пациентов с ОА составляет в России 10-12% населения, примерно треть из них имеет ту или иную степень нетрудоспособности [Миронов С.П. и соавт., 2001, Цветкова Е.С., 1997].
Наиболее часто и рано поражается коленный сустав, что обусловлено его положением, как опорного сустава, на который падает основная осевая нагрузка [Коваленко В.Н., Борткевич О.П., 2003]. Недавний отчет ВОЗ по глобальной распространенности болезни показал, что ОА коленного сустава находится на 4 месте среди основных причин нетрудоспособности у женщин и на 8 месте у мужчин (EULAR, 2003).
Эти данные свидетельствуют об актуальности проблемы лечения ОА, поскольку он не только ухудшает качество жизни пожилых людей, но и поражает значительную часть населения трудоспособного возраста.
Несмотря на значительный прогресс в понимании патогенетических механизмов дегенерации суставного хряща, достигнутый за последнее десятилетие, до настоящего времени не вполне изучена роль механических факторов и повреждения внутрисуставных структур в развитии и прогрессировании хондропатии, а также возникновении и поддержании воспалительной реакции синовиальной оболочки коленного сустава при ОА. Появление новых методов визуализации хрящевой ткани, в частности УЗИ и МРТ, расширяет возможности ранней диагностики ОА [Dunn T.C. et al., 2004, Gandy S.J. et al., 2002, Laasanen M.S. et al., 2002], однако не изучены корреляционные взаимосвязи этих методов, не разработаны четкие показания к их применению у различных групп больных ОА.
Традиционно лечение ОА было комплексным, включало медикаментозные и немедикаментозные методы, однако место и значение каждого из них до настоящего времени остается неопределенным. Наиболее широко используемые нестероидные противовоспалительные препараты (НПВП) оказывают симптоматическое действие, уменьшая болевой синдром и проявление воспаления в суставах. Основным недостатком НПВП является частое развитие побочных эффектов, особенно со стороны желудочно-кишечного тракта и сердечно-сосудистой системы [Плаксина Т.В., 2005]. Более того, некоторые из них отрицательно влияют на метаболизм суставного хряща. [Лучихина Л.В., 1998].
Применяемые для лечения ОА хорошо известные нестероидные противовоспалительные средства, анальгетики, физиотерапевтические методы имеют ряд ограничений и побочных действий, затрудняющих их использование у пациентов с полиморбидными состояниями.
Эффективность хондроитина сульфата и глюкозамина у пациентов с ОА была доказана в нескольких многоцентровых двойных слепых плацебо-контролируемых исследованиях, в результате чего было отмечено влияние препаратов на болевой синдром, позволявшее уменьшить потребность в НПВП [Eugenio-Sarmiento R.M. et al., 1999, Leeb B.F. et al., 1999, Rovati L.C., 1997]. Кроме того, было выявлено их стабилизирующее действие на ширину суставной щели [Pavelka K. et al., 2002, Register J.-Y. et al., 2002] и метаболические процессы в субхондральной кости и хряще [Michel B.A. et al., 2002].
Некоторые авторы считают оптимальной локальную терапию, поскольку при внутрисуставном введении эффект препаратов максимален [Ayral X. Et al., 1993].
С развитием и применением новых методов диагностики и лечения, в частности применения гиалуроновой кислоты, алфлутопа, ряда немедикаментозных методов, начали меняться взгляды на причины и механизмы развития болевых синдромов и дегенерации суставного хряща, а также возможности их консервативного лечения [Лила А.М., 2005, Сулим Н.И., 1992]. Поэтому необходимость разработки оптимальных сочетаний медикаментозной и немедикаментозной терапии у различных групп больных ОА коленного сустава в зависимости от длительности и выраженности болевого синдрома, степени структурных нарушений, выявляемых с помощью неинвазивных, а в ряде случаев и инвазивных методов диагностики представляется весьма актуальной.
ЦЕЛЬ ИССЛЕДОВАНИЯ. Совершенствование диагностики и улучшение результатов лечения больных остеоартрозом коленного сустава с помощью индивидуализированного подхода к выбору комплекса диагностических и лечебных методов.
- Оценить значимость современных инструментальных методов (рентгенографии, ультразвукового исследования, магнитно-резонансной томографии и артроскопии) в диагностике ОА коленного сустава.
- Изучить частоту встречаемости и роль повреждения внутрисуставных структур и синовита в развитии и прогрессировании ОА коленного сустава.
- Оценить эффективность методов физиотерапевтического воздействия (магнитотерпии, лазеротерапии и их комбинации) при ОА коленного сустава.
- Определить место и эффективность различных видов локальной внутрисуставной терапии (препараты гиалуроновой кислоты, алфлутоп) при ОА коленного сустава.
- Сравнить эффективность локальной внутрисуставной терапии, физиотерапевтических методов и их комплексного применения при ОА коленного сустава.
- Изучить динамику функционального состояния коленного сустава у больных ОА на фоне индивидуально подобранного комплекса лечебных процедур.
Впервые на основании клинического и инструментального обследования большого количества больных остеоартрозом проведено сравнение диагностической ценности рентгенографии, ультразвукового исследования, магнитно-резонансной томографии и артроскопии для выяснения причины болевого синдрома в коленном суставе. Определена чувствительность и специфичность каждого из указанных методов для выявления поражения суставного хряща, синовита и разрывов менисков при использовании в качестве эталона артроскопии как метода прямой визуализации тканей коленного сустава.
Обоснована необходимость использования малоинвазивного метода диагностической артроскопии коленного сустава у больных остеоартрозом при длительно существующем болевом синдроме и синовите для своевременной диагностики внутрисуставных повреждений.
С помощью комплексного применения современных инструментальных диагностических методов изучена и оценена роль повреждения внутрисуставных структур и синовита в развитии и прогрессировании дегенерации суставного хряща.
Впервые в России проведена оценка динамики артрологического статуса (в соответствии с рекомендациями EULAR) больных остеоартрозом коленного сустава на фоне применения методов физиотерапевтического воздействия и локальной инъекционной терапии, а также их сочетания.
Впервые проведено сравнение эффективности внутрисуставного введения хондропротектора алфлутопа и препаратов гиалуроновой кислоты в коленный сустав, а также таких физиотерапевтических методов, как магнитотерапия, лазеротерапия и их сочетание.
Проведена оценка устойчивости положительного влияния изученных методов локальной терапии при длительном наблюдении (в течение 12 месяцев) на болевой синдром, функциональные возможности и степень тяжести гонартроза по результатам опросников артрологического статуса, а также их структурно-модифицирующего действия по динамике ширины рентгеновской суставной щели и ультразвуковой толщины суставного хряща.
Разработана программа индивидуализированного подхода к выбору методов лечения остеоартроза в зависимости от выраженности и длительности болевого синдрома и степени функциональных нарушений.
На основании результатов подробного клинического и инструментального обследования автором разработан и внедрен в практику алгоритм дифференциальной диагностики причины болевого синдрома у больных остеоартрозом коленного сустава.
Уточнены диагностические возможности и показания для проведения ультразвукового исследования, магнитно-резонансной томографии и артроскопии коленного сустава при остеоартрозе.
Разработаны рекомендации по выбору метода локальной терапии, физиотерапевтического лечения и их комплексного применения в различных группах больных остеоартрозом в зависимости от выраженности и длительности болевого синдрома, степени функциональных нарушений.
Предложена схема расчета прогностических показателей для определения эффективности планируемого вида локальной терапии. Даны рекомендации по перспективному прогнозированию средних величин показателей артрологического статуса (через год после курса лечения), исходя из возраста и индекса массы тела пациента, длительности заболевания, ширины рентгеновской суставной щели и уровня болевого синдрома.
ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ:
Апробация проведена 17 ноября 2009 г. на заседании кафедры факультетской терапии № 1 лечебного факультета Московской медицинской академии им. И.М.Сеченова.
Публикации. По теме диссертации опубликована 31 печатная работа, из них 8 статей в рецензируемых журналах, 1 клиническое руководство.
Структура и объем диссертации. Диссертационная работа изложена на 215 страницах машинописного текста, иллюстрирована 45 рисунками и 51 таблицами. Диссертация состоит из введения, обзора литературы, материалов и методов исследования, 5 глав собственных результатов, обсуждения, заключения, выводов, практических рекомендаций и библиографического указателя, включающего 284 источника (84 отечественных и 200 зарубежных).
Материалы и методы исследования.
Обследовано 300 пациентов с ОА коленного сустава: 55 мужчин и 245 женщин в возрасте 35-90 лет (средний возраст 64,1 ± 6,7 лет), находившихся на лечении в Факультетской терапевтической клинике им. В.Н.Виноградова Московской медицинской академии им. И.М.Сеченова в 2000-2007 гг. Продолжительность заболевания составила - от 2 мес. до 40 лет (в среднем 9,1 ± 0,58 года). Все больные были разделены на 3 возрастные группы: 35-50 лет, 51-70 лет, старше 70 лет.
Критерии включения в исследование:
- ОА коленного сустава (согласно критериям Американской Коллегии Ревматологии),
- Уровень боли по ВАШ не менее 40 мм,
- Индекс тяжести гонартроза (индекс Лекена) не менее 5 баллов (средняя тяжесть и более),
- Рентгенологическая стадия гонартроза 1 – 4 (по Kellgren-Lawrence).
Критерии исключения из исследования:
- Воспалительные заболевания суставов,
- Резко выраженные функциональные нарушения сустава (неспособность к самостоятельному передвижению,
- Диффузные заболевания соединительной ткани,
- Системная и внутрисуставная терапия кортикостероидами (в исследуемый сустав) на протяжении последних 6 месяцев,
- Острые коронарные синдромы, ОНМК в течение последнего года,
- Язвенная болезнь желудка и/или двенадцатиперстной кишки в фазе обострения,
- Выраженные нарушения функции печени и почек,
- Тяжелые гематологические нарушения,
- Онкологические заболевания.
Все больные к моменту включения в исследование не менее 3 мес. получали пероральные хондропротекторы по общепринятым схемам: хондроитина сульфат (Структум) – 112 человек, глюкозамина сульфат (Дона) – 79 человек, комбинацию хондроитина сульфата и глюкозамина сульфата (Артра) – 239 человек. Большинство больных (80%) принимало нестероидные противовоспалительные препараты в стандартных среднесуточных дозах:
Отмечены следующие факторы риска развития гонартроза:
Актуальность проблемы. Жизнь человека – это непрерывное движение. Но именно движение представляет для суставов наибольшую опасность, которая заключается в возможности возникновения травм и перегрузок, исходом которых является развитие одного из тяжелых заболеваний опорно-двигательного аппарата – артроза [1,4,6,9].
Травмы – одна из частых причин развития артроза. Даже незначительное повреждение может вызывать нарушение трофики и иннервации сустава, что провоцирует дегенеративные процессы и развитие артроза [6,9].
По данным статистики, наибольшему травматизму подвержены мужчины в возрасте 20–50 лет, женщины в возрасте 30–60 лет. Травмы возникают в быту, на производстве, на улице, в результате дорожно-транспортного происшествия и т.д. Особенно актуальна это проблема для спортсменов и людей, ведущих активный образ жизни [1,6,8].
В структуре травм ведущее место занимают травмы коленного и тазобедренного сустава, реже встречаются травмы голеностопного, локтевого и плечевого суставов.
Наиболее частыми и тяжелыми осложнениями таких травм являются развитие деформирующего артроза и стойких контрактур коленного сустава по причине, в большинстве случаев, неустраненных смещений отломков мыщелков большеберцовой кости. Немаловажное значение имеет тяжесть самой травмы – значительные разрушения опорной суставной поверхности большеберцовой кости могут также стать причиной развития деформирующего артроза коленного сустава [8,9].
Патогенез посттравматического и других вторичных артрозов на конечных стадиях развития схож. Хрящ теряет свою упругость, эластичность, становится шероховатым, в нем появляются трещины с обнажением кости. Отсутствие амортизации при давлении на суставные поверхности костей приводит к их уплотнению (субхондральный остеосклероз) с образованием участков ишемии, склероза, кист. Одновременно с этим, по краям суставных поверхностей эпифизов костей суставной хрящ компенсаторно разрастается с последующим окостенением, с образованием краевых остеофитов и деформацией суставных поверхностей.
Лечение посттравматического артроза – сложный и длительный процесс. Существующие на сегодняшний день способы лечения посттравматического артроза (ПТА) направлены на реализацию одной цели – остановить, или замедлить дегенеративные процессы, происходящие в поврежденном суставе, и включают как консервативные, так и хирургические методы (показаны при тяжелой степени заболевания) [1,5,6,10].
Консервативные методы (медикаментозные: прием НПВС, ангиопротекторов, в/суставное введение ингибиторов протеолиза, препаратов гиалуроновой кислоты и хондропротекторов; немедикаментозные: разгрузка и покой сустава, ЛФК, массаж, физиотерапевтические методы, иглорефлексотерапия, оксигенобаротерапия, бальнеологическое лечение) – наиболее распространенны и направлены на купирование боли, устранение мышечной и артрогенной контрактуры, улучшение функции сустава, коррекцию внутрисуставных нарушений, стимуляцию метаболизма в организме в целом [1, 6-9].
Необходимо отметить, что существующие методы консервативного лечения, посттравматических артрозов, особенно внутрисуставные инъекции хондропротекторов, имеют ряд недостатков, к которым относятся аллергические реакции и дороговизна препаратов, длительный курс лечения, что вызывает дополнительную травму и инфицирование, и, к сожалению, нестойкий результат – около 3-х месяцев.
Пристальный интерес к аутоплазме связан с содержанием в тромбоцитах многочисленных факторов роста и цитокинов, которые способствуют регенерации поврежденных тканей. Свыше 30 ростовых факторов выявлено в α-гранулах тромбоцитов. Они влияют на процессы восстановления всех тканей сустава одновременно. Наибольшее значение имеют: тромбоцитарный фактор роста (PDGF) – стимулирует хемотаксис, митогенез фибробластов, синтез коллагена; фактор роста эндотелия сосудов (PDEGF) – оказывает стимулирующее действие на эндотелиальные клетки; трансформирующий фактор роста (TGF-ß) последний представляет собой большую группу белков, некоторые из них и морфогенные белки модулируют клеточную пролиферацию и дифференцировку малодифференцированных клеток в остеобласты, увеличивают синтез внеклеточного матрикса кости и ингибируют его деградацию и др. факторы роста [2-5;10].
Материалы и методы исследования
Материалы исследования составили 35 пациентов в возрасте 35–70 лет с тяжелыми деформирующими артрозами коленного сустава различной этиологии. Все пациенты ранее проходили курсы консервативной реабилитационной терапии. У подавляющего большинства пациентов сколько-нибудь значительного улучшения не отмечено. При этом относительное большинство пациентов были с посттравматическими деформирующими артрозами. Из всех пациентов больных с посттравматическими артрозами коленного сустава было 24, у 11 пациентов имели место идиопатические артрозы коленного и тазобедренного суставов на фоне остеохондроза поясничного отдела позвоночника. Всем пациентам применено внутрисуставное введение тромбоцитарной аутоплазмы.
Лечение пациентов с применением инъекционной тромбоцитарной аутоплазмы
Рис.1. Пробирка Plasmolifting™ (содержит антикоагулянт)

Результаты исследования показали, что применение инъекционной тромбоцитарной аутоплазмы значительно улучшают качество жизни пациентов с деформирующими артрозами, что подтверждалось как субъективной оценкой самих обследуемых, которые отмечали значительное снижение болевого синдрома, восстановление функции сустава, уменьшение и даже полное отсутствие скованности сустава, так и достоверной динамикой показателей шкалы Womac (рис. 3).
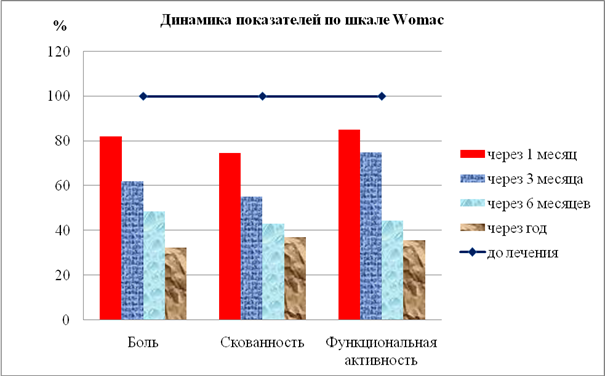
Рис. 3. Показатели шкалы Womac в динамике лечения с применением инъекционной тромбоцитарной аутоплазмы (показатели до лечения учитывались как 100 %)
Данные биомеханического исследования опорной, динамической функции нижних конечностей, сенсорного баланса в вертикальной стойке подтвердили клинические данные функциональной реабилитации.
Клинический пример. Пациент Л., 1959 г.р. обратился с жалобами на сильные боли, ограничение функции обоих в коленных суставах. Болен в течение 10 лет, консервативная терапия неэффективна. На основании клинико-рентгенологических данных установлен диагноз: двусторонний деформирующий артроз III стадии. Проведен курс плазмотерапии, который составлял по три внутрисуставных блокады с интервалом 1 неделя. После второй блокады отмечено значительное улучшение, уменьшение интенсивности болей, улучшение функции суставов. Контрольные исследования на сроках 2 месяца и год после лечения также показали значительное улучшение функции коленных суставов и нижних конечностей.
Таким образом, применение инъекционной тромбоцитарной аутоплазмы в комплексной терапии посттравматических артрозов крупных суставов способствует восстановлению функции сустава, уменьшению дегенеративных явлений, что сопровождается увеличением объема движений в суставе, улучшением опорно-двигательной функции нижних конечностей, а также удлинением периода ремиссии заболевания.
Версия: Клинические рекомендации РФ (Россия) 2013-2017
Общая информация
Федеральные клинические рекомендации по диагностике и лечению остеоартроза
Клинические рекомендации "Остеоартрит" прошли общественную экспертизу, согласованны и утверждены 5 октября 2013 г., на заседании Пленума правления АРР, проведенного совместно с профильной комиссией МЗ РФ по специальности "ревматология". (Президент АРР, академик РАН - Е.Л.Насонов)
ОА - гетерогеннаягруппа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц.
МКБ-10: М15–М19 Артрозы
Аббревиатура: ОА - остеоартроз


Классификация
Выделяют две основные формы остеоартроза: первичный (идиопатический) и вторичный, возникающий на фоне различных заболеваний.
| Первичный (идиопатический) | Локализованный (поражение менее 3 суставов) - Суставы кистей - Суставы стоп - Коленные суставы - Тазобедренные суставы - Позвоночник - Другие суставы Генерализованный (поражение 3 групп суставов и более) - Эрозивный |
| Вторичный | - Посттравматический - Врождённые, приобретённые, эндемические заболевания (болезнь Пертеса, синдром гипермобильности и др.) |
Диагностика
Диагностика
Диагноз ОА устанавливается на основании жалоб и анамнестических данных больного, клинико-инструментального исследования и исключения других заболеваний. Важным фактором диагностики является тщательный сбор анамнеза, позволяющий выделить определенные причины (факторы риска) развития ОА.
Факторы риска, связанные с развитием ОА
| Факторы | Описание |
| Системные | Возраст |
| Пол | |
| Раса | |
| Гормональный статус | |
| Генетические факторы | |
| Минеральная плотность кости | |
| Витамин Д | |
| Локальные | Предшествующее повреждение сустава |
| Слабость мышц | |
| Неправильная ось сустава | |
| Гипермобильность | |
| Внешние факторы | Ожирение |
| Избыточная нагрузка суставов | |
| Спортивная физическая нагрузка | |
| Профессиональные факторы |
Клиническая картина
Чаще в процесс вовлекаются суставы, подвергающиеся большой нагрузке (коленные, тазобедренные), мелкие суставы кистей (дистальные и проксимальные межфаланговые суставы, первый пястно-запястный сустав) и позвоночник. Большое значение имеет поражение тазобедренных и коленных суставов, являющееся основной причиной снижения качества жизни и инвалидизации больных, страдающих ОА.
Клиническая картина ОА включает три основных симптома: боль, крепитацию и увеличение объёмов суставов.
Ведущий клинический признак ОА - боль в суставах, продолжающаяся большинство дней предыдущего месяца. Причины суставных болей многочисленны. Они не связаны с поражением собственно хряща (он лишён нервных окончаний), а определяются изменениями в:
- субхондральной кости – усиление костной резорбции на ранних стадиях заболевания, отек костного мозга, рост остеофитов;
- синовиальной оболочке, связанными с воспалением;
- околосуставных тканях - повреждение связок, мышечный спазм, бурсит, растяжение капсулы сустава;
- психоэмоциональной сфере и др.
В отличие от воспалительных заболеваний суставов внесуставные проявления при ОА не наблюдают.
Патогномоничных для ОА лабораторных признаков не существует. Тем не менее, лабораторные исследования следует проводить в целях:
- Дифференциального диагноза (при ОА отсутствуют воспалительные изменения в клиническом анализе крови, не обнаруживают РФ, концентрация мочевой кислоты в сыворотке крови соответствует норме).
- Перед началом лечения (общий анализ крови и мочи, креатинин сыворотки крови, сывороточные трансаминазы) с целью выявления возможных противопоказаний для назначения ЛС.
- Для выявления воспаления необходимо исследовать СОЭ и С-реактивный протеин. Умеренное повышение характерно для вторичного синовита на фоне ОА. Выраженное повышение свидетельствует о другом заболевании.
- Исследование синовиальной жидкости следует проводить только при наличии синовита в целях дифференциального диагноза. Для ОА характерен невоспалительный характер синовиальной жидкости: прозрачная или слегка мутная, вязкая, с концентрацией лейкоцитов менее 2000/мм3.
Инструментальные исследования
Рентгенологическое исследование — наиболее достоверный метод диагностики ОА, который выявляет сужение суставной щели, краевые остеофиты и заострение мыщелков большеберцовой кости, субхондральный склероз.
При подозрении на ОА коленных суставов рентгеновский снимок делается в передне-задней и боковой проекциях в положении стоя, для исследования пателло-феморального сустава – снимок в боковой проекции при сгибании (В).
При подозрении на ОА тазобедренного сустава необходимо проводить рентгенологическое исследование костей таза с захватом обоих тазобедренных суставов (уровень С).
Классификация рентгенологических изменений при остеоартрите Келлгрена и Лоуренса (1957)
0 | Изменения отсутствуют |
| I | Сомнительные рентгенологические признаки |
| II | Минимальные изменения (небольшое сужение суставной щели, единичные остеофиты) |
| III | Умеренные проявления (умеренное сужение суставной щели, множественные остеофиты) |
| IV | Выраженные изменения (суставная щель почти не прослеживается, выявляются грубые остеофиты) |
Показания к проведению рентгенографического исследования коленных суставов при первом обращении пациента
‒ Молодой возраст
‒ Травма, предшествовавшая появлению боли в суставе (для исключения перелома)
‒ Значительный выпот с выраженной дефигурацией сустава, особенно при поражении одного сустава
‒ Выраженное уменьшение объема движений в суставе
‒ Интенсивная боль в суставе, даже в случае, если диагноз ОА ранее был установлен
‒ Планируемая консультация ортопеда
‒ Неэффективность адекватной консервативной терапии
Повторное рентгенологическое исследование суставов при ОА должно использоваться только в клинических целях. Повторное рентгенологическое исследование суставов при ОА проводится при подозрении на присоединение новой патологии или планируемое хирургическое вмешательство на суставе(при направлении на консультацию к ортопеду).
Диагностические критерии
Таблица . Классификационные критерии остеоартроза (Альтман и др., 1991)
| Клинические | Клинические, лабораторные, рентгенологические |
| Коленные суставы | |
| 1. Боль | 1. Боль |
| и | и |
| 2а. Крепитация | 2. Остеофиты |
| 2б. Утренняя скованность | или |
| 2в. Возраст | 3а. Синовиальная жидкость, характерная для ОА (или возраст |
| или | |
| 3а. Крепитация | 3б. Утренняя скованность |
| 3б. Утренняя скованность | 3в. Крепитация |
| 3в. Костные разрастания | |
| или | |
| 4а. Отсутствие крепитации | |
| 4б. Костные разрастания | |
| Чувствительность 89% | Чувствительность 94% |
| Специфичность 88% | Специфичность 88% |
| Тазобедренные суставы | |
| 1. Боль | 1. Боль |
| и | и не менее 2-х из 3 критериев |
| 2а. Внутренняя ротация | 2а. СОЭ |
| 2б. СОЭ 115°) | 2б. Остеофиты |
| или | 2в. Сужение суставной щели |
| 3а. Внутренняя ротация 50 лет 3г. Боль при внутренней ротации | |
| Чувствительность 86% | Чувствительность 89% |
| Специфичность 75% | Специфичность 91% |
| Суставы кистей | |
| 1. Боль продолжительная или скованность 2. Костные разрастания 2-х и более суставов из 10 оцениваемых* 3. Менее 2 припухших пястно-фаланговых суставов 4а. Костные разрастания, включающие 2 и более дистальных межфаланговых сустава** (2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а) | |
| или | |
| 4б. Деформация одного и более суставов из 10 оцениваемых* | |
| Чувствительность 93% Специфичность 91% | |
Примечания. * — 2-й и 3-й дистальные межфаланговые суставы; 2-й и 3-й проксимальные межфаланговые суставы; 1-й запястно-пястный сустав обеих кистей. ** — 2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а
Дифференциальный диагноз
Диагностика ОА с учётом диагностических критериев трудностей не вызывает. Тем не менее, каждую клиническую ситуацию необходимо проанализировать с точки зрения возможности вторичного происхождения ОА.
Заболевания, с которыми необходимо проводить дифференциальную диагностику ОА
| Анкилозирующий спондилоартрит | Псевдоподагра |
| Реактивный артрит | Псориатический артрит |
| Подагра | Ревматоидный артрит |
| Инфекционный артрит | Фибромиалгия |
| Ревматическая полимиалгия | Диабетическая артропатия |
| Посттравматический синовит | Паранеопластическая артропатия |
| Врождённая гипоплазия головки бедра |
Лечение
Лечение ОА
Цели лечения
· Обеспечить понимание больным своего заболевания и умение управлять им: изменение образа жизни, применение физических упражнений, поддерживающих функцию суставов, защита суставов
· Улучшить функциональное состояние суставов и предотвратить развитие деформации суставов и инвалидизации больного
· Улучшить качество жизни больных
· Предотвратить дальнейшее разрушение суставного хряща
· Избежать побочных эффектов фармакотерапии и обострения сопутствующих заболеваний
При лечении ОА надо учитывать
· Факторы риска ОА
· Интенсивность боли и степень нарушения функций сустава
· Локализацию и выраженность структурных нарушений
· Пожелания и ожидания больного
Лечение ОА должно быть комплексным и включать нефармакологические, фармакологические и хирургические методы.
Нефармакологические методы
Физические упражнения при ОА снижают боль и сохраняют функцию суставов , особенно при сочетании с образовательными программами. Упражнения для укрепления силы четырёхглавой мышцы бедра достоверно уменьшают боль и сопоставимы по эффективности с НПВП. При ОА тазобедренных суставов силовые физические упражнения (изометрические, упражнения с противодействием) уменьшают боль в суставах. Необходимо учитывать противопоказания для занятий лечебной физкультурой у больных ОА, как абсолютные (неконтролируемая аритмия, блокада 3 степени, недавние изменения на ЭКГ, нестабильная стенокардия), так и относительные (кардиомиопатия, пороки сердца, плохо контролируемая артериальная гипертензия).
При ОА коленных суставов необходимы регулярные физические упражнения для укрепления силы четырехглавой мышцы бедра и увеличения объема движений, аэробные нагрузки (А). При ОА тазобедренных суставов тоже требуется выполнение лечебной физкультуры, особенно силовых упражнений (С).
Медикаментозное лечение
Симптоматические лекарственные средства быстрого действия
| Результаты исследований | Рекомендации | |
| Анальгетики | Парацетамол показан при слабых или умеренных болях при ОА без признаков воспаления. В дозе 3,0 г/сут. доказана безопасность применения парацетамола при ОА в течение 2 лет. Высокие дозы сопровождаются развитием осложнений со стороны ЖКТ, почек и вызывают повышение артериального давления у мужчин и женщин. Препарат не следует назначать больным с поражениями печени и хроническим алкоголизмом. | При слабых или умеренных болях в суставах применяется парацетамол в минимальной эффективной дозе, но не выше 3,0 г/сут. (максимальная разовая доза должна не превышать 350 мг) (А). Парацетамол можно применять длительно (А). |
| Нестероидные противовоспалительные препараты | Применяют только в период усиления болей, для купирования болей назначаются минимальные эффективные дозы и по возможности не длительно. Больные должны быть детально информированы о достоинствах и недостатках НПВП, включая безрецептурные препараты. Все НПВП в эквивалентных дозах обладают сходной эффективностью, выбор НПВП определяется прежде всего его безопасностью в конкретных клинических условиях. Осложнения со стороны ЖКТ — одни из наиболее серьёзных побочных эффектов НПВП. Относительный риск их возникновения варьирует у различных НПВП и дозозависим. Наименьшим риском развития желудочно-кишечного кровотечения обладают селективные ингибиторы ЦОГ2. Их следует назначать при наличии следующих факторов риска развития нежелательных явлений: возраст старше 65 лет, наличие в анамнезе язвенной болезни или желудочно-кишечного кровотечения, одновременный приём ГКС или антикоагулянтов, наличии тяжёлых сопутствующих заболеваний. |
Внутрисуставное введение глюкокортикоидов (ГЛК) показано при ОА коленных суставов с симптомами воспаления (А).
Симптоматические лекарственные средства медленного действия
Препараты, содержащие хондроитин сульфат и глюкозамин сульфат рекомендуются при ОА для уменьшения боли, улучшения функции суставов; эффект сохраняется в течение нескольких месяцев после их отмены, хорошо переносятся больными (А).
Производные гиалуроната применяют для внутрисуставного введения при ОА для уменьшения боли (А).
Хирургическое лечение
Уменьшает боль, улучшает двигательную функцию и улучшает качество жизни при ОА тазобедренных суставов. Продолжительность эффекта составляет около 10 лет, частота инфекционных осложнений и повторных операций — 0,2–2,0% ежегодно. Наилучшие результаты эндопротезирования отмечены у больных в возрасте 45–75 лет, с массой тела
Эндопротезирование коленных суставов приводит к уменьшению боли и улучшению двигательной функции.
Показано при ОА с выраженным болевым синдромом, не поддающимся консервативному лечению, при наличии серьёзного нарушения функций сустава (до развития значительных деформаций, нестабильности сустава, контрактур и мышечной атрофии) (А).
Алгоритм ведения больных ОА коленных и тазобедренных суставов


Информация
- Федеральные клинические рекомендации по ревматологии 2013 г. с дополнениями от 2016 г.
Методология
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются систематические обзоры в последней доступной версии The Cochrane Library, базы данных Medline (систематические обзоры (мета-анализы), рандомизированные клинические испытания, когортные исследования или исследования случай-контроль, статьи обзорного характера. Глубина поиска 10 лет.
Методы, использованные для оценки качества и силы доказательств
· Конценсус экспертов
· Оценка значимости в соответствии с рейтинговой схемой
Уровни доказательности, принятые при разработке данных рекомендаций
| A | · высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью систематической ошибки, результаты которого могут быть распространены на соответствующую российскую популяцию. |
| B | · высококачественный (++) обзор или систематический обзор когортных исследований или исследований случай-контроль или · высококачественное (++) когортное исследование или исследование случай контроль с очень низким уровнем систематической ошибки или · РКИ с невысоким (+) риском систематической ошибки, результаты которого могут быть распространены на соответствующую российскую популяцию. |
| C | · когортное исследование или исследование случай контроль или контролируемое исследование без рандомизации с невысоким уровнем систематической ошибки (+), результаты которого могут быть распространены на соответствующую российскую популяцию или · РКИ с очень низким или невысоким (+) риском систематической ошибки, результаты которого не могут быть непосредственно распространены на соответствующую российскую популяцию. |
| D | · описание серии случаев или · неконтролируемое исследование или · мнение экспертов |
Индикаторы доброкачественной практики (Good Practice Points – GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций
Экономический анализ:
Экономический анализ не проводился и публикации по фармакоэкономике не анализировались
Метод валидизации рекомендаций:
· Внешняя экспертная оценка
· Внутренняя экспертная оценка
Читайте также:


