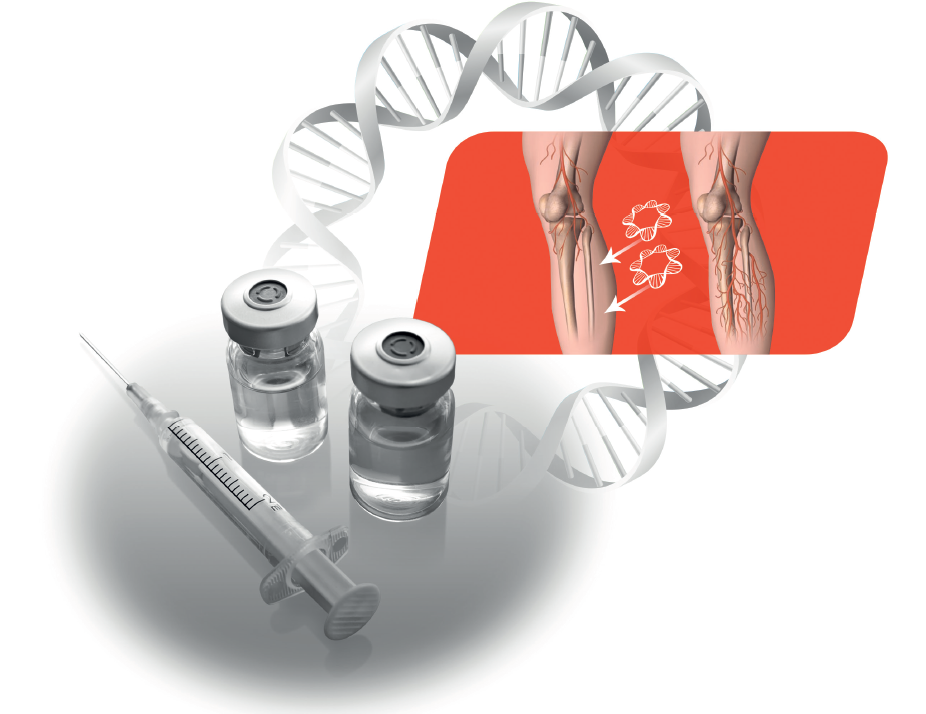
Неоваскулген для лечения ишемии нижних конечностей
Неоваскулген ® прошел все необходимые доклинические и клинические исследования, и на основании их результатов 28 сентября 2011 г. был включен в государственный реестр лекарственных средств для медицинского применения РФ. Регистрационное удостоверение на препарат получено Компанией 7 декабря 2011 г. (РУ № ЛП-000671).
Сертификация первых серий Неоваскулгена ® завершилась в конце сентября 2012 г., и препарат поступил на российский рынок в качестве рецептурного готового лекарственного средства (лиофилизат для приготовления раствора, курс – 2 инъекции /2 упаковки/) через сеть дистрибьюторов.
В последующем возможно включение препарата в федеральные и региональные программы финансирования лекарственной помощи населению. После успешного осуществления программы продвижения, доходы от реализации Неоваскулгена ® должны занять значительное место в структуре выручки Компании.
Производство Неоваскулгена ® ведётся на базе Гематологического научного центра (ФГБУ ГНЦ) МЗ РФ.
В дальнейшем Неоваскулген ® планируется вывести на рынки СНГ, а также на рынок США и Китая. В феврале 2013 года регистрационное удостоверение на Неоваскулген ® получено в Украине.
Инновационный препарат Неоваскулген® предназначен для лечения пациентов с хронической ишемией нижних конечностей (ХИНК). Заболевание обусловлено клиническими проявлениями атеросклеротического поражения сосудов ног (сужение просвета сосудов и уменьшение их проходимости). В России им страдают около 1,5 млн. человек. Ежегодно у 145 тысяч человек заболевание выявляется в тяжелой форме, грозящей необходимостью ампутации и в 25% случаев завершающейся летальным исходом – так называемая критическая ишемия нижних конечностей (КИНК). Ампутация конечности выполняется каждый год 35-40 тысячам пациентов. Часть пациентов с КИНК - неоперабельные, и для них применение Неоваскулгена ® может стать основным методом лечения, который позволил бы существенно улучшить качество жизни, а также, по возможности, в дальнейшем избежать ампутации.
Препарат представляет собой кольцевую ДНК (плазмиду), несущую человеческий ген VEGF 165, кодирующий синтез фактора роста эндотелия сосудов (VEGF - Vascular Endothelial Growth Factor). Стимулируя образование и рост коллатеральных сосудов, Неоваскулген ® призван оказать длительный лечебный эффект и улучшить качество жизни пациентов. Развитие микроциркуляторного русла в ишемизированной ткани нижней конечности способствует насыщению тканей кислородом, заживлению язв, увеличивает дистанцию безболевой ходьбы*.
Предполагается, что механизм действия препарата может обеспечить более длительный эффект – наблюдения за пациентами с ХИНК/КИНК, участвовавшими в клинических исследованиях и прошедшими курс лечения Неоваскулгеном ® , будут продолжаться и далее.
* Информация предназначена для медицинских и фармацевтических работников. Перед назначением препарата необходимо ознакомиться с текстом полной инструкции.
В связи с тем, что действие Неоваскулгена ® нацелено на лечение ишемии тканей с помощью стимуляции ангиогенеза, у препарата существует потенциальная возможность для лечения других состояний, где требуется развитие коллатерального кровообращения. Поэтому ИСКЧ ставит своей задачей расширение показаний к применению препарата. Компания планирует работать в области терапии ишемической болезни сердца (ИБС), а также рассматривает возможность применения Неоваскулгена ® для лечения синдрома диабетической стопы (СДС) и травматических повреждений периферических нервов. Помимо этого, ведется работа по созданию тканеинженерных продуктов с использованием Неоваскулгена ® .
Также Компания планирует работать в направлении создания новых геннотерапевтических препаратов, базирующихся на других конструкциях и генах, поддерживая статус лидера в области разработки и продвижения генной терапии на фармацевтическом рынке.

Фильм: механизм действия Неоваскулгена®
Геннотерапевтический препарат Неовакулген® был разработан ИСКЧ для лечения ишемии нижних конечностей атеросклеротичского генеза (хроническая ишемия нижних конечностей /ХИНК/, включая критическую /КИНК/). У пациентов с названным заболеванием Неоваскулген® увеличивает в ишемизированных тканях капиллярную сеть, тем самым улучшая кровоснабжение пораженных конечностей. Согласно результатам исследований можно констатировать, что применение препарата ведет к статистически значимому уменьшению числа ампутаций.
Неоваскулген® прошел все необходимые доклинические и клинические исследования, и на основании их результатов 28 сентября 2011 г. был включен в государственный реестр лекарственных средств для медицинского применения РФ. Регистрационное удостоверение на препарат получено Компанией 7 декабря 2011 г. (РУ № ЛП-000671).
Сертификация первых серий Неоваскулгена® завершилась в конце сентября 2012 г., и препарат поступил на российский рынок в качестве рецептурного готового лекарственного средства (лиофилизат для приготовления раствора, курс – 2 инъекции /2 упаковки/ с интервалом в 14 дней) через сеть дистрибьюторов. Производство Неоваcкулген® ведется на базе Гематологического научного центра (ФГБУ ГНЦ) МЗ РФ.
Для облегчения доступа пациентов к инновационному препарату Неоваскулген® ИСКЧ ведет активную работу по взаимодействию с профессиональным медицинским сообществом, а также с регуляторными органами – с целью включения препарата в федеральные и региональные программы финансирования лекарственной помощи населению.
В июне 2013 года Неоваскулген® был включен в Национальные рекомендации по ведению пациентов с заболеваниями артерий нижних конечностей.
По распоряжению Правительства РФ № 2724-р. от 26 декабря 2015 г. Неоваскулген® вошел в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП)*, что обеспечивает возможность увеличения госпитальных закупок.
После успешного осуществления программы продвижения доходы от реализации Неоваскулгена® должны занять значительное место в структуре выручки Компании.
Помимо рынка Российской Федерации, ИСКЧ осуществляет работу по выводу препарата на зарубежные рынки.
В феврале 2013 года регистрационное удостоверение на Неоваскулген® получено в Украине.
В настоящее время планируется экспорт препарата, произведенного в РФ, на рынки развивающихся стран, а также начинается процесс девелопмента препарата-кандидата на основе интеллектуальной собственности, связанной с российским Неоваскулгеном®, в США.
Ишемия нижних конечностей — заболевание, для лечения которого предназначен инновационный препарат Неоваскулген® — является тяжелым и инвалидизирующим. По распространённости оно занимает среди заболеваний сердечно-сосудистой системы третье место в мире (после ишемической болезни сердца и инсульта). Заболевание обусловлено клиническими проявлениями атеросклеротического поражения сосудов ног (сужение просвета сосудов и уменьшение их проходимости).
В мире хронической ишемией нижних конечностей (ХИНК) страдает около 202 миллионов человек. В России число пациентов с ХИНК составляет 5 миллионов — ежегодно заболевание диагностируется у более чем 300 тысяч человек, из них критическая форма заболевания (КИНК) каждый год регистрируется у порядка 145 тысяч человек. У 35-40 тысяч таких пациентов производится ампутация конечности, а у 25% наблюдается летальный исход. Часть пациентов с КИНК — неоперабельные, и для них применение Неоваскулгена® может быть единственным эффективным методом лечения, который позволил бы существенно улучшить качество жизни, а также, по возможности, в дальнейшем избежать ампутации.
Препарат представляет собой кольцевую ДНК (плазмиду), несущую человеческий ген VEGF 165, кодирующий синтез фактора роста эндотелия сосудов (VEGF — Vascular Endothelial Growth Factor). Стимулируя образование и рост коллатеральных сосудов, Неоваскулген® призван оказать длительный лечебный эффект и улучшить качество жизни пациентов. Развитие микроциркуляторного русла в ишемизированной ткани нижней конечности способствует насыщению тканей кислородом, заживлению язв, увеличивает дистанцию безболевой ходьбы.
Неоваскулген® может применяться как у неоперабельных, так и у операбельных пациентов (для улучшения результатов реконструктивных операций), и оказывает эффект как при хронической форме заболевания (ХИНК), так и при криической (КИНК) — охватывает 2а, 2б и 3 стадии заболевания по классификации Покровского-Фонтейна.
Обладая длительным лечебным эффектом (3-5 лет**- по сравнению с 6-8 мес. при стандартной консервативной терапии), который, прежде всего, выражается в весомом увеличении дистанции безболевой ходьбы, препарат значительно улушает качество жизни пациентов.
Исследования по фармакоэкономике препарата продемонстрировали его существенный эффект и в данной области.***
Deev R.V., Kalinin R.E., Chervyakov Y.V., Gryaznov S.G., Mzhavanadze N.D., Kiselev S.L., Isaev A.A., Schwalb P.G., Staroverov I.N., Nersessian E.G.
The results of the delayed clinical surveillance inoperable patients with chronic lower limb ischemia (IIa-III degree A.V. Pokrovsky-Fontaine), included in a phase 1-2a clinical trials of the drug on the basis of plasmid gene vascular endothelial growth factor, conducted 1 year after receiving the drug. The study evaluated the clinical and instrumental data, which included the length of treadmill test, ankle-brachial index (ABI), TcO2, linear velocity of blood flow. It is shown that obtained immediately after treatment, the therapeutic effect is not only stable, but during the year registered an increase. ABI score testified to the hemodynamic success of therapy.
Keywords: atherosclerosis, chronic ischemia of lower extremities, Neova-skulgen, vascular endothelial growth factor.
Резюме
В статье приведены результаты отсроченного клинического наблюдения за неоперабельными пациентами с хронической ишемией нижних конечностей (IIa-III ст. по А.В. Покровскому-Фонтейну), включенных в 1-2а фазу клинических исследований плазмидного препарата на основе гена эндотелиального сосудистого фактора роста, проведенного через 1 год после получения препарата. В ходе исследования оценивали клинические и инструментальные данные, включавшие длину безболевой ходьбы, ло-дыжечно-плечевой индекс, чрескожно определяемое напряжение кислорода, линейную скорость кровотока. Показано, что полученный сразу после лечения терапевтический эффект является не только устойчивым, но и в течение года демонстрирует рост; оценка ЛПИ свидетельствовала в пользу гемодинамического успеха терапии.
Ключевые слова: атеросклероз, хроническая ишемия нижних конечностей, Неоваскулген, эндотелиальный сосудистый фактор роста.
Введение
Проблема своевременного и эффективного лечения пациентов с хроническими облитерирующими заболеваниями артерий нижних конечностей (ХОЗАНК) остается актуальной для современного здравоохранения. На основе скринингового определения лодыжечно-плечевого индекса (ЛПИ) считается установленным, что в среднем ХОЗАНК страдают от 3 до 10% взрослого населения (старше 40 лет), причем у лиц старше 70 лет этот показатель может достигать 20% [9, 11, 13]. На сегодняшний день, несмотря на наличие ряда препаратов, воздействующих на липидный обмен, состояние периферического сосудистого русла, реологические свойства крови признать фармакотерапию хронической ишемии нижних конечностей эффективной невозможно [4, 11]. Необходимость хирургического лечения данной патологии возникает у 20-24% всех пациентов, но она ограничивается как объективными (непроходимость дистального артериального русла, тяжелый общесоматический статус), так и субъективными факторами (доступность квалифицированной и специализированной ангиохирургической помощи). В этой связи определенные надежды возлагаются на новый класс лекарственных средств - гентерапевтические препараты [2, 4, 11]. Накопленный к сегодняшнему дню опыт их применения в клинической практике у данной категории пациентов пока позволяет констатировать ихбезопасность и эффективность (класс доказательности 11б) [4, 11], следовательно, они еще нуждаются в пристальном изучении.
В последующем, при проведении 2б-3 фазы клинических исследований показано статистически значимое увеличение контролируемых показателей эффективности (дистанции безболевой ходьбы, чрескожно определяемого напряжения кислорода, линейной скорости кровотока) по сравнению с пациентами контрольной группы, получавших лишь стандартную консервативную терапию [3, 10]; причем изменение указанных параметров, по-видимому, напрямую связано с развитием микроциркуляторного и коллатерального русла в ишемизированной конечности как результат использования генного препарата, индуцирующего рост сосудов в ответ на оптимизированный синтез эндотелиального сосудистого фактора роста.
Цель исследования
Материал и методы
В исследование было включено 44 пациента. Все пациенты страдали неоперабельным поражением дисталь-ного артериального русла или анатомо-функциональной недостаточностью коллатеральных путей кровотока. Распределение по полу: мужчин 37 (84%), женщин 7 (16%). Средний возраст составил 59,9±7,8 лет.
По степеням хронической ишемии (классификация А.В. Покровского-Фонтейна) пациенты распределились следующим образом: IIA ст. - 7 (16%), 11Б ст. - 24 (54,5%), III ст. - 13 (29,5%).
До участия в исследовании пациенты получали курсы стандартной консервативной терапии с назначением инфузионных форм дезагрегантов, препаратов метаболической коррекции, физиотерапевтическое лечение (внутривенная лазеротерапия, магнитотерапия на голени). Восемь пациентов ранее были оперированы путём выполнения реконструктивных хирургических вмешательств, трём пациентам до включения в исследование (не в текущую госпитализацию) была выполнена ампутация на уровне бедра. Во время участия в исследовании пациенты в РязГМУ получали в стационаре Рефортан 250,0 в/в кап. № 7, Актовегин 10-20% р-р в/в кап. № 10; во время амбулаторного периода наблюдения пациентам назначался Пентоксифиллин в суточной дозе 200 мг, Ацетилсалициловая кислота в дозе 100 мг. Пациенты ЯОКБ получали в стационаре Гепарин 2,5 тыс. п/к 4 раза в сутки, Тикло 250 мг 2 раза в день, Тромбо-асс 100 мг 1 раз в день, Пентоксифиллин 200 мг в/в, Никотиновая кислота 4,0 мг в/м 2 раза в день, Галидор 2 мл 2% в/м 2 раза в день, физиотерапевтическое лечение; во время амбулаторного периода наблюдения пациентам назначался Пентоксифиллин в суточной дозе 800-1200 мг, Ацетилсалициловая кислота в дозе 100 мг или Кло-пидогрел 75 мг/сут.
Через год после включения в протокол пациенты были приглашены в клинику, им проведено стандартное обследование с регистрацией результатов тредмил-теста, определением лодыжечно-плечевого индекса (ЛПИ), линейной скорости кровотока (ЛСК, только для пациентов ЯОКБ, n=20), тканевого напряжения кислорода в пораженном сегменте (TcPO2). В дальнейшем осуществляли статистическую обработку полученных данных, согласно требованиям, предъявляемым к статистическому аппарату медицинских исследований.
Всего через год удалось обследовать 41 пациента (РязГМУ - 21; ЯОКБ - 20), получить данные для статистического анализа - у 39 пациентов.
Результаты
Выживаемость пациентов на всех клинических базах составила 100%. Развития опухолевых, офтальмологических заболеваний, фатальных сердечно-сосудистых событий не зафиксировано. Ампутации в связи с острым тромбозом в течение года выполнены 4 пациентам (9%) (по 2 больным на каждой клинической базе), причем 3 пациента исходно имели III степень хронической артериальной ишемии конечности, один - ПБ степень. У одного пациента (РязГМУ) произведена тромбэндартерэктомия из бедренных артерий с обеих сторон по поводу тромбоза артерий бедренно-подколенного сегмента. Один пациент(ЯОКБ) перенес эпизод острого нарушения мозгового кровообращения.
Остальные пациенты за прошедший год в отделения сердечно-сосудистой хирургии не госпитализировались. Прогрессирование клинической симптоматики по показателю ДБХ в течение выполнения протокола (90 сут.) отмечено у 2 пациентов (4,5%); в течение года - у 3 (6,8%). Не ответили на терапию (нонреспондеры) - через 90 сут. - 2 пациента (4,5%). Таким образом, признать лечение неуспешным в течение срока, предусмотренного протоколом, (90 сут.) следует у 4 пациентов (9%), в течение года - у 9 пациентов (20,5%).
Клиническое наблюдение за пациентами и проведенные общеклинические и биохимические тесты крови и мочи свидетельствовали об отсутствии нежелательных метаболических сдвигов и подтвердили безопасность применения препарата. Показатели эффективности, определенные совокупно для всей группы включенных пациентов, позволяют сделать вывод об успешности консервативной терапии. Так, среди ответивших на терапию показатели ДБХ, ЛПИ и ТсРО2 существенно увеличились. Через 90 сут. выявлены такие пациенты, у которых безболезненно преодолеваемое расстояние с уровня 40-150 м увеличивалось до 1500-2000 м (до 3900% - в отдельных наблюдениях). Средний показатель при этом через 90 сут. достиг величины 302±223 м, обусловленный средним приростом в 140,4% (табл. 1). Как показало дальнейшее наблюдение на этом ДБХ не стабилизировалась, а прогрессивно увеличивалась, достигнув к годовой отметке уровня 551±432 м, что равнозначно 338,7% прироста (см. табл. 1).
Аннотация научной статьи по клинической медицине, автор научной работы — Швальб П. Г., Гавриленко А. В., Калинин Р. Е., Червяков Ю. В., Воронов Д. А.
Похожие темы научных работ по клинической медицине , автор научной работы — Швальб П. Г., Гавриленко А. В., Калинин Р. Е., Червяков Ю. В., Воронов Д. А.
П.Г. Швальб 1, А.В. Гавриленко 2, Р.Е. Калинин1, Ю.В. Червяков 3, Д.А. Воронов 2, И.Н. Староверов 3, С.В. Гоязнов 1, Н.Д. Мжаванадзе 1, Е.Г. Нерсесян 3, СЛ. Киселев 4, А.А. Исаев 4, Р.В. Деев 4
1 Рязанский государственный медицинский университет им. акад. И.П. Павлова, Рязань
2 Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
3 Ярославская государственная медицинская академия, Ярославль
4 Институт стволовых клеток человека, Москва
P.G. Shvalb 1, A.V. Gavrilenko2, R.E. Kalinin 1, Yu.V. Chervyakov3, D.A. Voronov2,1.N. Staroverov3,
S.V. Gryaznov1, N.D. Mzavanadze 1, E.G. Nersesyan 3, S.L. Kiselev4, A.A. Isaev4, R.V. Deev4 11.P. Pavlov Ryazan State Medical University, Ryazan
2 B.V. Petrovsky Russian Scientific Center of Surgery, Moscow
3 Yaroslavl State Medical Academy, Yaroslavl
4 Human Stem Cells Institute, Moscow
(Р = 0,000); ТКНК — прирост 11,38% (Р = 0,000); ЛСК — прирост 55,12% (Р = 0,000). Ангиографически определялось усиление контрастирования микроциркуляторного русла за счет новообразованных коллатеральных сосудов по сравнению с исходной картиной. У пациентов клинической группы установлено статистически значимое улучшение физического компонента здоровья (Р = 0,000) и наблюдалась тенденция к улучшению психологического компонента здоровья (Р = 0,241). При интегральной оценке результатов лечения показано, что частота успешных исходов за период 6 мес. в клинической группе (94,0%) была значимо больше, чем в контрольной — 37,5% (Р = 0,000). Нежелательных явлений и осложнений применения препарата не выявлено.
Ключевые слова: хроническая ишемия нижних конечностей, генная терапия, Неоваскулген
Лечение пациентов, страдающих облитерирую-щим атеросклерозом артерий нижних конечностей, является крайне актуальной задачей в современной хирургии как в России, так и за рубежом. По данным разных авторов, этой формой атеросклероза страдает от 5 до 15% населения промышленно развитых стран мира [1—3]. Большинство пациентов обращается за медицинской помощью в специализированный стационар, когда клиническая симптоматика становится весьма выраженной, то есть имея уже средние и тяжелые стадии заболевания (II6 и выше по классификации А.В. Покровского — Фонтейна), следовательно, они нуждаются в хирургическом лечении. К сожалению, оперативное пособие может быть выполнено им не всегда, что связано с различными причинами, среди которых основными являются отсутствие анатомически удовлетворительного периферического русла или тяжелые сопутствующие заболевания. Проблема восстановления кровообращения в дистальных сегментах сегодня рассматривается не только с хирургических позиций (протезирование и шунтирование сосудов), но и точки зрения концепции коррекции артериальной недостаточности нижних конечностей путем стимуляции ангиогенеза.
Механизм действия препарата основан на проникновении в клетку плазмидной конструкции. Далее она, не интегрируясь в геном, обеспечивает временный синтез фактора роста VEGF165, который выступает в качестве ауто- и паракринного регулятора роста сосудов in situ.
Однако, для подтверждения гипотезы об эффективности препарата и механизмах реализации клинической результативности необходимо было провести клиническое исследование на большей группе больных.
Key words: chronic lower limb ischemia, gene therapy, neovasculgen
Материал и методы
Общий дизайн исследования: проспективное,
Критерии включения в исследование: мужчины или женщины старше 40 лет; наличие клиники ишемии конечности (не менее 3 мес.) (IIa—III ст.); полная проходимость проксимального артериального русла исходно или после операции (более 3 мес.); наличие неоперабельного дистального поражения или анатомо-функциональная недостаточность коллатеральных путей кровотока; подписание Информированного согласия; способность пациентов понять суть исследования, выполнить требования протокола.
Критерии исключения из исследования: повышенная чувствительность к любым компонентам, входящим в состав препарата; беременность, лактация; наличие алкогольной или наркотической зависимости; неспособность пациента понять суть исследования; участие в других клинических исследованиях; декомпенсация заболеваний сердечно-сосудистой системы, почек, печени; наличие язвенно-некротических изменений стопы и голени; инфекционные заболевания, ВИЧ-инфекция; сепсис; наличие онкологического анамнеза в течение последних 5 лет; наличие клинически значимых изменений лабораторных показателей, свидетельствующих о недиагностированном заболевании и требующих дополнительного обследования.
В клиническую группу (получавших препарат) было включено 75 пациентов, в группу контроля — 25. Распределение пациентов по клиническим базам следующее (клиническая группа / группа контроля):
Схема консервативной терапии. Пациенты обеих групп, проходивших лечение в РязГМУ, получали стандартное консервативное лечение: Рефортан
250,0 в/в кап. № 7, Актовегин 10—20% р-р в/в кап. № 10. Во время амбулаторного периода наблюдения пациентам назначался пентоксифиллин в суточной дозе 200 мг, ацетилсалициловая кислота в дозе 100 мг. Во время участия в исследовании пациенты ЯОКБ и РНЦХ получали в стационаре Гепарин 2,5 тыс. п/к 4 раза в сутки, Тикло 250 мг 2 раза в день Тромбо-асс 100 мг 1 раз в день, Пентоксифиллин 100 мг в/в, Никотиновую кислоту 4,0 мг в/м 2 раза в день, Папаверин 2 мл 2% в/м 2 раза в день, физиотерапевтическое лечение; во время амбулаторного периода наблюдения пациентам назначался Пентоксифиллин в суточной дозе 1200 мг, Ацетилсалициловая кислота в дозе 1 00 мг или Клопидо-грель 75 мг/сут.
Оценка эффективности. На основании градации методов диагностики при поражении периферических артерий в качестве основного критерия эффективности выбрана длина безболевой ходьбы (ДБХ, м.) [1, 3]. Дополнительным обоснованием этому служит и то, что в исследование включены пациенты, чье состояние характеризуется с использованием классификации А.В. Покровского — Фонтейна, основным критерием в которой является именно ДБХ. Показатель определяли в ходе тредмил-теста (ходьбе по ровной дорожке (угол 0°) со скоростью движения дорожки 1 км/ч).
Помимо этого регистрировали и оценивали вторичные критерии эффективности, к которым были отнесены: лодыжечно-плечевой индекс (ЛПИ);
чрезкожно (транскутанно) определяемое парциальное давление (напряжение) кислорода (ТКНК, мм рт. ст.); средние значения линейной скорости кровотока (ЛСК) по данным ультразвукового дуплексного сканирования задней большеберцовой артерии (ЗББА); динамика ангиографической картины дистального сосудистого русла.
Оценка безопасности и переносимости препарата проводилась на протяжении всего исследования, на основании динамического клинического наблюдения за субъективными и объективными данными состояния пациентов (жалобы, осмотр, t °С тела, АД, ЧСС, ЧД, ЭКГ, лабораторные показатели крови и мочи) и регистрации любых нежелательных явлений (НЯ), вне зависимости от их связи с исследуемым препаратом. Фиксирование НЯ начиналось с момента подписания пациентом Информированного согласия на участие в исследовании.
Методы статистического анализа. В ходе статистического анализа изучались следующие научные вопросы: как меняются ДБХ, ЛПИ, ТКНК, ЛСК в группах и различия в их динамике между группами?; какова частота благоприятных исходов лечения?
Распределения совокупностей абсолютных значений каждого из изучаемых признаков (ДБХ, ЛПИ, ТКНК, ЛСК) отличалось от нормального распределения, поэтому для проверки гипотез использовались непараметрические тесты: для оценки статистической достоверности изменений абсолютного значения показателя ДБХ, ТКНК, ЛПИ и ЛСК в каждой группе использован метод сравнения парных случаев Вилкоксона (W) и тест Sign (S); для оценки различий центральных тенденций между группами; для оценки значимости различий абсолютных значений основных и косвенных признаков ишемии (ДБХ, ЛПИ, ТКНК, ЛСК) между группами в каждый из анализируемых визитов; для оценки достоверности различий в приросте (в период между 1-м и 4-м визитами) абсолютного значения основных и косвенных признаков ишемии между группами использован метод сравнения непарных случаев Манна — Уитни (MW); для оценки различий непараметрических данных использован точный критерий Фишера.
Результаты и обсуждение
Все больные, включенные в клиническую группу хорошо переносили внутримышечные инъекции препарата. Нежелательных явлений, побочных реакций
* Границы ст. тяжести (по ДБХ): 2а — более 200 м.; 2б — более 25 м., но менее 200 м.; 3 — менее 25 м. или наличие болей в покое.
и осложнений зафиксировано не было. Самочувствие пациентов клинической группы во время введения препарата и в последующем оставалось удовлетворительным; местных реакций не зарегистрировано. Введение препарата безболезненно, хорошо переносится и не требует обезболивания.
Уровни анализируемых общеклинических, биохимических показателей (включая уровень глюкозы) и показателей коагулограммы не имели достоверных изменений в динамике лечения исследуемым препаратом и существенно не отличались от контрольной группы.
В процессе проведения исследования (между У3 (90 сут.) и У4 (180 сут.) у двух пациентов клинической группы развились состояния, не позволившие им продолжать исследование: острое нарушение мозгового кровообращения с благополучным исходом и острый инфаркт миокарда с летальным исходом. Причинно-следственная связь с применением препарата выявлена не была. Всего статистической обработке подлежали данные 70 пациентов из клинической и 24 пациентов из контрольной групп.
Изменение локального статуса. В клинической группе на фоне проведенного лечения как через 3, так и через 6 мес. наблюдения отмечено значимое уменьшение числа пациентов, предъявлявших жалобы на онемение (Р = 0,000), похолодание конечности (Р = 0,000) и у которых была отмечена гипотрофия мышц конечности (Р = 0,007). В контрольной группе существенного изменения локального статуса не наблюдалось.
Сравнение исходных клинико-инструментальных показателей в группах. При первом (нулевом) визите средний путь, пройденный пациентами клинической группы, составил 135,26±102,37 м (от 15 до 600 м.; медиана = 102,5 м); в контрольной группе этот показатель составил —114,25±55,76 м (медиана =
105.00 м) (Р = 0,558), т.о. статистически значимой разницы по первичному критерию оценки ишемии между пациентами в группах исходно не было.
Средний показатель ТКНК составил у пациентов клинической группы 76,69±9,96 мм рт. ст. (медиана = 78,00), контрольной группы — 76,89±5,76 мм рт. ст. (медиана = 78,00) (Р = 0,921). Средние значения индекса ЛПИ на целевой нижней конечности (наиболее ишимизированной ноге, в мышцы которой выполнялось введение препарата) у пациентов клинической и контрольной групп составили 0,513±0,182 и 0,458±0,182, и медианы 0,50 и 0,50, соответственно (Р = 0,248). Средние значения признака ЛСК у пациентов клинической и контрольной групп составили 14,95±10,19 и 17,60±6,60, и медианы
15.00 и 20,00, соответственно (Р = 0,547). Таким образом, и по вторичным критериям оценки ишемии нижней конечности группы не имели статистически значимых различий, следовательно, клиническая и контрольная группы сопоставимы по тяжести своего состояния.
личения этого параметра между первым и третьим визитами, между третьим и четвертым визитами и между первым и четвертым визитами. За весь период исследования у 62 пациентов был отмечен рост показателя, у 3 — снижение, у 1 он остался без динамики.
В контрольной группе за весь период исследования у 9 пациентов был отмечен рост показателя, у 12 — снижение, у 2 — отсутствие динамики. Зафиксированная тенденция изменений значения признака в группе за период исследования была статистически недостоверной. Прирост среднего значения пути, который пациент мог пройти без боли, в исследуемой группе составил 149,47 м, значение медианы увеличилось на 127,5 м, различия были статистически достоверны (Р = 0,006).
В контрольной группе среднее расстояние, проходимое пациентом, уменьшилось на 1,42 м, значение медианы увеличилось на 35,00 м, различие между показателями оказалось статистически недостоверным. Различия в динамике показателя между группами ( + 150,89 по среднему значению и +92,5 по значению медианы) были статистически достоверны (Р = 0,000).
значения показателя с 76,89±55,76 мм рт. ст. до 75,37±61,57 мм рт. ст. за аналогичный период наблюдения. Отмеченные различия между значениями признаков в клинической группе были достоверны, а в контрольной группе статистически недостоверны (Р = 0,096), т.е. показатель у данных больных практически не претерпел изменений в ходе стандартного лечения.
Сравнение групп в первый визит не выявило достоверного различия между группами (Р = 0,921), но показало статистически достоверные различия в последующие визиты. Зафиксированные различия в приросте среднего значения показателя ТКНК между группами ( + 10,25) и медианы ( + 8,00) были значимы (0,000). Относительный прирост показателя в группах составил: в клинической группе + 12,40±17,69%, и в контрольной — 2,12±4,38% (Р = 0,000).
Разница между приростом среднего значения ЛПИ между группами составила +0,077 (медиана +0,065), отмеченные различия были статистически достоверны.
У пациентов контрольной группы значения показателя увеличилось на 1,30 см/с (от 1 7,60±6,60 см/с. В начале исследования, до 18,90±6,77 см/с — через полгода), значение медианы осталось без изменения, на уровне 20,0 см/с. В ходе всего исследования различия в значениях показателя между группами были статистически достоверны (Р = 0,005).
Прирост показателя в клинической группе был больше, чем в контрольной по значению среднего ( + 6,94 см/с) и медианы ( + 5,00 см/с), эти различия были статистически достоверны (Р = 0,005).
Совокупно, данные клинико-инструментальных методов обследования представлены в табл. 1.
Сравнение исходов лечения в клинической и контрольной группах. В данном контексте под исходами подразумевали изменение состояние пациентов и тяжести заболевания на момент окончания срока наблюдения, предусмотренного протоколом клинического исследования, т.е. через 180 сут. от момента
включения. Интегральная оценка результатов лечения на основании анализа совокупности первичных и вторичных критериев эффективности терапии согласно введенным критериям (см. материалы и методы) позволила сравнить исходы лечения в обеих группах. Так, в клинической группе доля пациентов, у которых лечение было расценено как успешное составила 94,0%, в контрольной группе — 37,5% (рис. 2), различия являются статистически достоверными (точный критерий Фишера; Р = 0,000).
Изменение степени ишемии (стадии заболевания) в ходе лечения наглядно демонстрирует результаты лечения через 180 сут. (по основному критерию классификации А.В. Покровского — Фонтейна). Так, в клинической группе, количество больных с Иб стадией ишемии уменьшилось на 28% за счет перехода в На стадию, а также, у 10 (13,3%) пациентов из 12 (16%), изначально имевших III стадию ишемии, на последнем визите регистрировалась Иб стадия, у пациента, изначально имевшего На стадию ишемии, на последнем визите регистрировалась I стадия. В то же время, в группе сравнения (контроля) только у одного пациента (4%) состояние улучшилось (переход из Иб во На ст.) (рис. 3).
Характеристика качества жизни. Результаты анализа опросника SF-36 были сгруппированы в виде оценок в баллах также по 8 шкалам. Количественно оценивались следующие показатели: физическое функционирование — клиническое улучшение состояния кровообращения в нижних конечностях оказало существенное влияние на качество жизни пациентов клинической группы ( + 11,0), в динамике наблюдалось значительное улучшение данного параметра (Р = 0,003), по сравнению с пациентами контрольной группы ( + 4); ролевое функционирование, обусловленное физическим состоянием — у пациентов клинической группы отмечается существенное улучшение показателя ( + 16.), в то время, как у пациентов контрольной группы наблюдается регресс показателя (-2,5) (Р = 0,000); интенсивность боли и ее влияние на способность заниматься повседневной деятельностью на фоне лечения в обеих группах остались на низком уровне, что вполне оправдано, с учетом того, что шкала оценивает интенсивность ощущений, но не частоту развития болевых приступов (Р = 0,635);
Таблица 1. Динамика клинико-инструментальных данных у пациентов клинической и контрольной групп
Показатель Группа V1, 0 сут., исходно V4, 180 сут. Прирост, абс. р(В)*/ (^** Прирост, %
ДБХ, м клиническая 135,3±102,37 284,7±242,02 149,47 0,000 110,5
контрольная 114,3±55,76 112,8±61,57 -1,42 0,614/0,664 -1,2
ТКНК, клиническая 76,69±9,96 85,42±10,87 + 8,73 0,000 11,38
мм. рт. ст. контрольная 76,89±55,76 75,37±61,57 -1,52 0,081/0,096 -1,98
ЛПИ клиническая 0,513±0,182 0,57±0,185 0,057 0,000 11,11
контрольная 0,458±0,182 0,438±0,187 -0,02 0,012/0,167 -4,37
ЛСК, см/с клиническая 14,95±10,19 23,19±12,71 8,24 0,000 55,12
контрольная 17,16±6,60 18,9±6,77 1,30 0,154/0,070 10,14
Рис. 2. Соотношение успешных (синий цвет) и не успешных (красный цвет) исходов лечения в контрольной (А) и клинической группах (Б)
Читайте также: