Эндопротез коленного сустава саркома
Онкологическое эндопротезирование единственная возможность сохранить хорошее качество жизни после удаления злокачественной опухоли костей. Остеосаркомой, саркомой Юинга, хондросаркомой болеют преимущественно подростки и лица молодого возраста. Имплантация эндопротеза позволяет им вести нормальную жизнь после выздоровления.
Установка импланта никак не влияет на эффективность противоопухолевого лечения.
Органосохраняющие операции как золотой стандарт
Хирургические вмешательства в онкоортопедии начали применять еще в 80-90х годах. Тогда врачи сохраняли нижнюю конечность по строгим показаниям. Эффективность противоопухолевого лечения довольно высока (пятилетняя выживаемость составляет 75-85%).
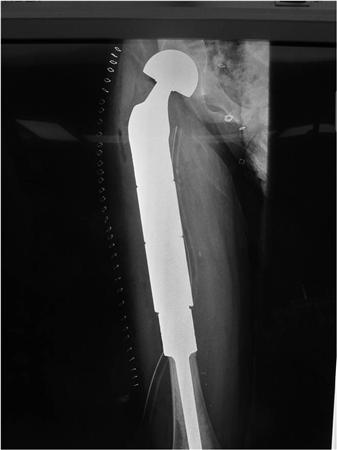
Онкологический имплант бедренной кости.
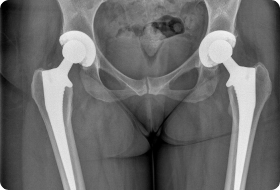
Эндопротезы устанавливают после удаления опухоли любого крупного сустава (коленного, тазобедренного, голеностопного, плечевого, локтевого). Пациентам со злокачественными новообразованиями плечевых, бедренных, большеберцовых костей выполняют их тотальное или диафизарное эндопротезирование — заменяя не сустав, а часть трубчатой кости.
Суть онкологического эндопротезирования заключается в замене удаленных частей сустава искусственными имплантами. Это восстанавливает функции нижней конечности. Операция спасает в 85-90% случаев.
Противопоказания к хирургии
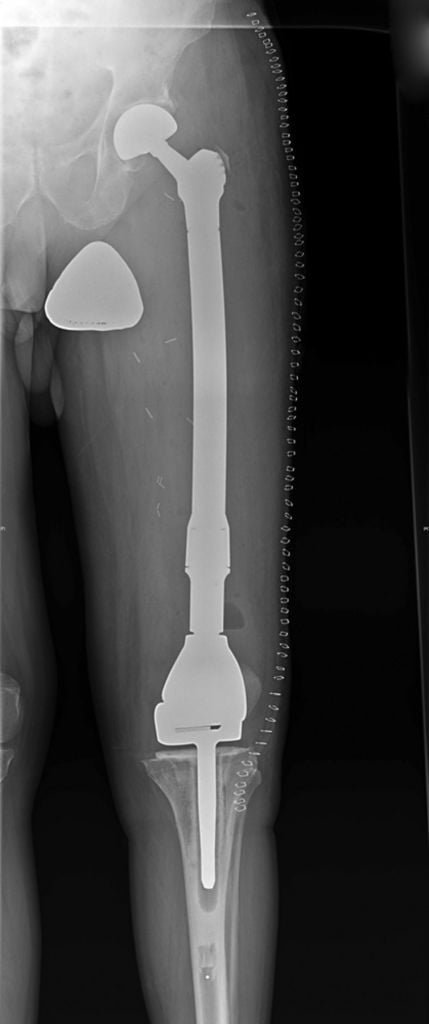
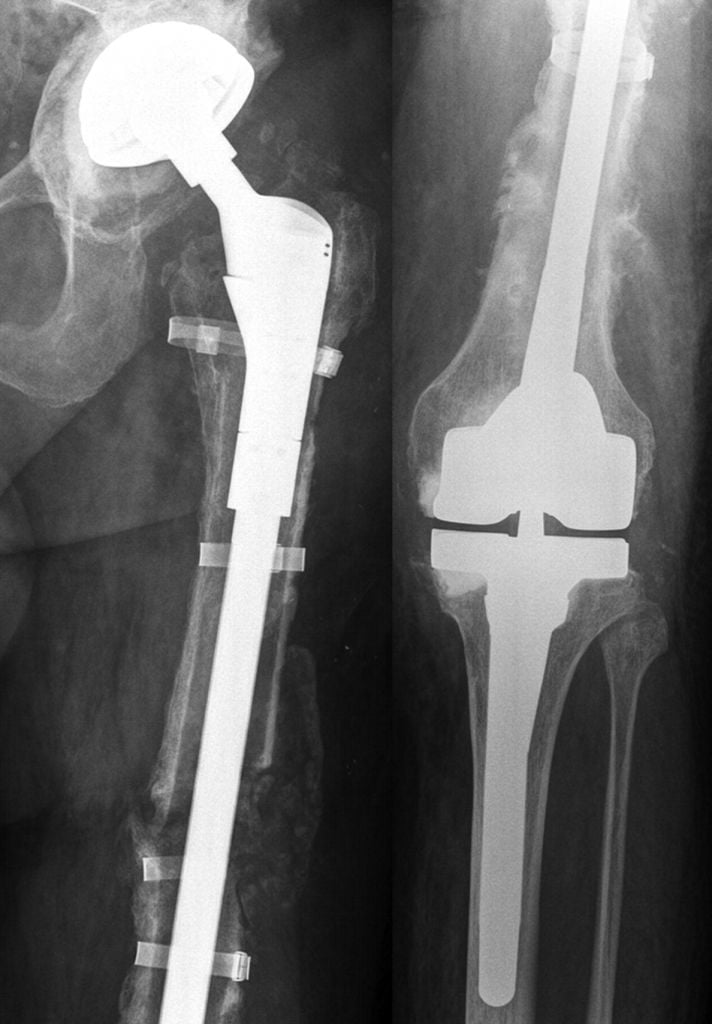
Операция по полной замене бедренной кости с имплантом коленного сустава.
Существует ряд ситуаций, когда ампутация ноги необходима. Иногда отказ от органосохраняющей операции спасает жизнь человека, а попытка сохранить нижнюю конечность приводит к его скорой гибели.
Абсолютные показания к ампутации:
- распад злокачественного новообразования;
- диссеминация (распространение) опухолевых клеток вследствие некачественно выполненной биопсии;
- поражения магистральных сосудов или нервов конечности.
Зачастую врачи рекомендуют ампутацию больным с патологическими переломами, осложнениями химиотерапии и тяжелыми поражениями жизненно важных органов, сопровождающимися декомпенсацией их функций. В этих случаях удаление нижней конечности дает человеку намного больше шансов.
Противопоказанием является невозможность сформировать мышечный футляр для импланта. Это ставит под угрозу приживление протеза и дает риск развития инфекционных осложнений.
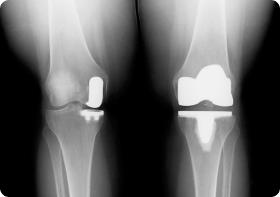
Особенности онкологического эндопротезирования
Если при обычной замене сустава врачи выполняют стандартную резекцию, то при злокачественных опухолях объем удаления костной ткани увеличивается. Врачам нужно подбирать особый имплант каждому больному. Онкологические эндопротезы имеют гораздо больший размер, чем ортопедические.
Таблица 1. Основные различия между онкологическим и обычным эндопротезированием.
| Традиционное | Онкологическое | |
| Предоперационная подготовка | Общеклинические и визуализирующие методы исследования. | Объемное обследование, включающее биопсию, ангиографию, сцинтиграфию, КТ, МРТ и другие нужные методы. |
| Особенности устанавливаемых эндопротезов | Стандартные моноблочные или модульные протезы с цементной или бесцементной фиксацией. | Модульные эндопротезы, форму и размер которых можно отрегулировать в ходе операции. Подобные мегапротезы могут полностью заместить удаленную фрагменты костей. |
| Ход операции | Больному удаляют деструктивно измененные части сустава, а на их место устанавливают эндопротез. | После полноценного обследования пациенту удаляют опухоль вместе с прилегающими тканями. Кости и сустав замещают протезом. Выполняют пластику мягких тканей нижней конечности. |
| Ожидаемые результаты | Полное восстановление функции сустава. Возможны осложнения, устранить которые можно консервативным или хирургическим путем. | Пятилетняя выживаемость после органосохраняющей операции составляет 80%. Онкологическое эндопротезирование позволяет восстановить функции сустава. Риск осложнений в этом случае выше, чем при выполнении обычной ортопедической операции. |
Обследование перед операцией
Перед началом лечения пациента тщательно обследуют. Это помогает выявить злокачественное новообразование, установить его локализацию и размеры.
- Рентгенография. Позволяет подтвердить наличие опухоли и ориентировочно оценить ее размеры. Не дает представления о состоянии магистральных сосудов, нервов, мягких тканей конечности.
- Сцинтиграфия костей скелета. Необходима для выявления метастазов злокачественного новообразования. Обнаруживает опухоли костей любой локализации.
- Биопсия. Наиболее точные результаты дает трепанационная и открытая биопсия. Пункционная и аспирационная менее информативны, поскольку в полученном в их ходе материале не всегда содержатся опухолевые клетки.
- КТ/МРТ. Детальный анализ структуры кости, оценить степень ее разрушения и состояние мягких тканей нижней конечности. Это помогает наиболее точно определить объем резекции и спрогнозировать результаты операции.
- Ангиография. Выявляет дефекты и опухолевые повреждения магистральных сосудов.
- Общеклинические исследования (общий анализ крови и мочи, биохимический анализ крови, ЭКТ, флюорография, УЗИ органов брюшной полости). Необходимы для оценки общего состояния пациента и выявления тяжелых сопутствующих заболеваний.
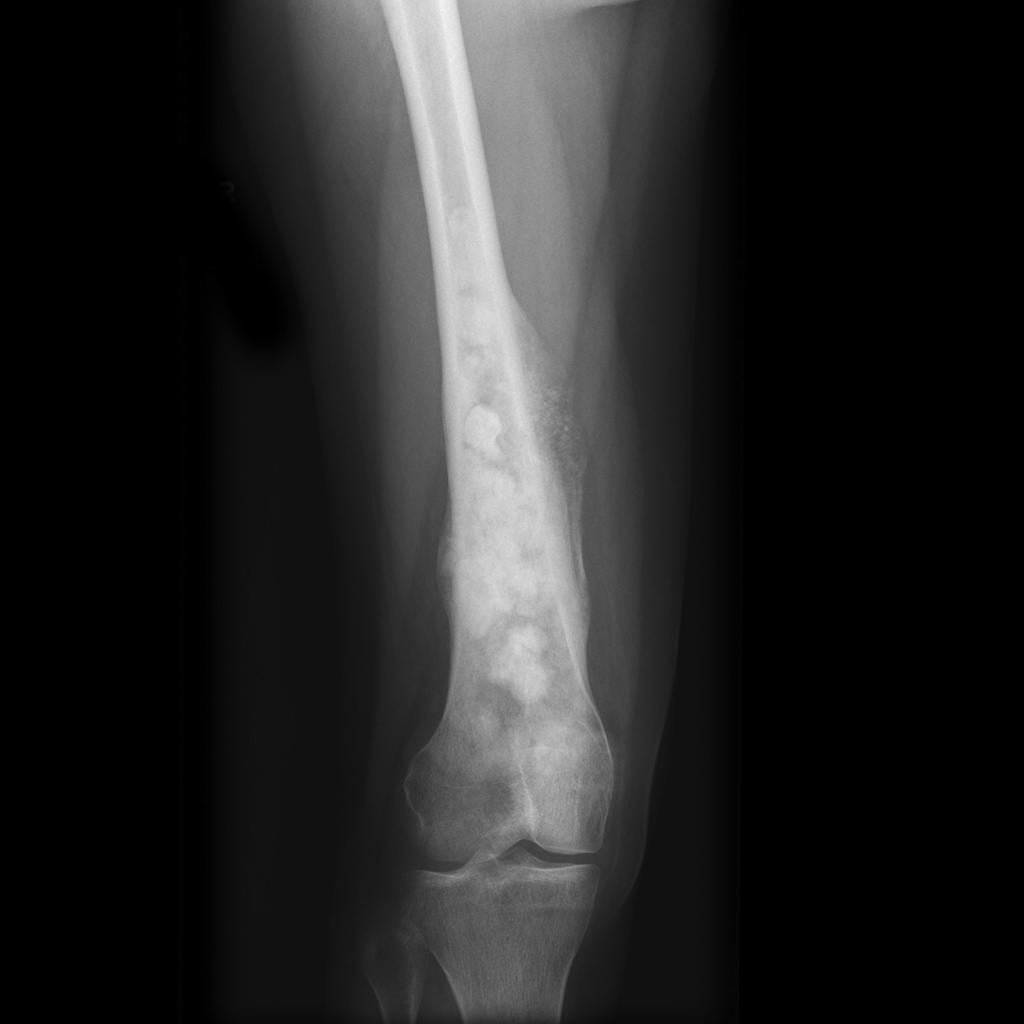
Остеосаркома на рентгене.
Комбинированное лечение опухоли
Для борьбы с опухолями костей используют химиотерапию, лучевую терапию и хирургическое лечение. Их умелое сочетание позволяет проводить органосохраняющие операции даже в тех ситуациях, в которых ранее ампутировали конечность. Химиотерапия позволяет нивелировать последствия перелома или неудачной биопсии.
Онкологические эндопротезы
Импланты, которые используются в онкоортопедии, обычно имеют гораздо больший размер. Это необходимо для замещения удаленных костных тканей. Логично, что мегапротезы нарушают биомеханику сустава, что приводит к нестабильности импланта. При опухолях нижней конечности пациентам могут замещать не только суставы, но и кости. Вид импланта зависит от локализации и размера злокачественного новообразования.
Виды онкологических протезов нижней конечности:
- заменяющие ТБС и часть бедренной кости;
- заменяющие коленный сустав и часть бедренной или большеберцовой кости;
- полностью замещающие бедренную кость;
- спейсеры – замкнутые эндопротезы коленного сустава;
- частично заменяющие и удлиняющие бедренную кость.

Основное отличие онкологических имплантов заключается в их массивности и сложности конструкции.
Производством онкологических протезов занимается несколько компаний: Stryker, ImplantCast, Biomet. Фирмы выпускают модульные эндопротезы, которые можно фиксировать цементным или бесцементным способом.
Особенностью модульных протезов является возможность собрать их во время операции. Это позволяет реконструировать дефекты костей любого размера. Применение модульных эндопротезов дает возможность избежать изготовления индивидуального импланта.
Неожиданные интраоперационные находки в онкологии нередки. Они вынуждают врачей удалять больше костной ткани, чем планировалось. Применение модульных протезов позволяет справиться с этой проблемой с минимальным ущербом для пациента. Чтобы заместить дефект, достаточно всего лишь раздвинуть эндопротез до нужного размера.
Любопытно! В онкоортопедии становятся все популярней эндопротезы с серебряным покрытием. Содержащиеся в нем ионы серебра оказывают антибактериальное действие и снижают риск развития инфекции.
Выполнение операции
Удаление костной ткани и установка протеза при злокачественных новообразованиях происходит совсем не так, как при обычном эндопротезировании. Во время хирургического вмешательства врачи придерживаются целого ряда правил.
Основные правила онкологического эндопротезирования:
- Соблюдение принципа футлярности. Злокачественную опухоль удаляют вместе с окружающими ее фрагментами здоровой костной ткани. Резекцию кости выполняют на расстоянии 5-6 см от новообразования. Вместе с опухолью удаляют зону предшествующей биопсии и все очаги возможной диссеминации.
- Соблюдение правил абластики и асептики. Во время хирургического вмешательства врачи тщательно следят за тем, чтобы опухолевые клетки не проникли в здоровые ткани. Чтобы избежать диссеминации, вначале перевязывают артерии и вены, а лишь затем иссекают опухоль. Параллельно с этим медработники проводят тщательную профилактику инфицирования операционной раны.
- Восстановление двигательной функции конечности. После установки протез прикрывают мышечными лоскутами и делают необходимую пластику. Это позволяет избежать развития инфекционных осложнений и некроза тканей в будущем.
- Адекватное послеоперационное ведение больных. Качественная реабилитация и правильное поведение пациента в послеоперационном периоде помогает восстановить функцию сустава и снизить риск возникновения непредвиденных осложнений.
Массивный онкологический эндопротез ТБС.
Факт! Результаты органосохраняющей операции зависят от размера опухоли, степени ее злокачественности, поражения мягких тканей, сосудов и нервов конечности. Немалую роль в успехе лечения играет и внимательность, добросовестность и опытность врачей.


Начинается рассматриваемая патология незаметно. Это свойственно всем онкологическим болезням. Изначально болеющий ощущает боли, которые проявляются в зоне соединения. Они характеризуются, как зудящие. Обычно такому признаку люди, врачи не придают должного внимания.
Различие саркомы
Особенностью остеогенной саркомы считается формирование раковых клеток из костной ткани. Именно в них вырабатываются клетки-мутанты. Различие опухолей заключается в доминирующих компонентах тканей:
- Фибробластические;
- хондробластические.
Специалисты разделяют рассматриваемую патологию на следующие формы:
- Остеопластическая;
- остеолитическая;
- скрещенная.
Злокачественная саркома в коленях
Остеогенная саркома коленного сочленения считается чрезвычайно злокачественной. Ей свойственно бурное течение, раннее формирование метастазов.

Обнаруживают патологию у пациентов разного возраста. Согласно статистике, около 65% зафиксированных случаев припадает на возраст в пределах 10 – 30 лет. Чаще наблюдаются поражения костей на конец полового созревания. Патологии характерно проявление чаще у мужчин. Ее диагностируют у девушек вдвое реже, чем у парней.
В основном поражение локализовано на длинные кости, цилиндрической формы. Лишь около 1/5 случаев припадает на остальные кости меньшего размера. Примерно в пять, шесть раз интенсивнее онкология обнаруживается в костях коленного сустава. Из них 80% припадает на долю коленного соединения.
Саркома Юинга в коленном суставе
Саркома Юинга считается злокачественным новообразованием. Зачастую фиксируется ее формирование в тканях костей. В более редких случаях ее обнаруживают внутри кожи, подкожной клетчатки, мускулах и компактных параллельных пучков коллагеновых волокон, внутри тканей выделяемых частью нервной системы. Патологию назвали в честь Джеймса Юинга. Он занимался изучением злокачественных новообразований. Житель Нью-Йорка описал в первый раз рассматриваемую патологию в начале 20 века.
Выделяют разновидности саркомы Юинга. Оно включает нижеприведенные патологии:
- Злокачественная опухоль костного скелета;
- высоко злокачественная саркома.
Рассматриваемую патологию относят к весьма стремительным. Отсутствие своевременно терапии опасно летальным исходом.
Эту патологию у детей фиксируют редко. Ею страдают дети, подростки от 10 до 20 лет. Также возможно формирование новообразования у грудников, детей младшего возраста. Саркома Юинга способна проявляться и у пожилых людей.
Причины возникновения саркомы в коленном суставе
Довольно часто рассматриваемую патологию диагностируют у детей. Причин, вызывающих мутацию нормальных клеток костей в младшем возрасте много. Укажем наиболее распространенные причины развития рака костей колена у детей:
- Радиоактивное облучение. Обычно, лучевую терапию используют в лечении определенных болезней. Одной из таких патологий считается рак молочной железы;
- воздействие химических веществ. К провокаторам болезни можно отнести древесные консерванты, асбест;
- генетические сбои. Существует вероятность развития саркомы у детей с генетической предрасположенностью к формированию злокачественной трансформации клеток. Ребенок, обладающий мутацией RB1-гена, с огромной вероятностью может получить развитие опухоли. У таких ребят формируется саркома внутри кожи, подкожной клетчатки и мускулатуры.
- Повреждение костной ткани предшествуют развитию болезни костей. Многие болезни способны перерасти в злокачественные формы. К клеткам, способным преобразовываться относят далее приведенные: хрящевые новообразования, хрящевые опухоли. Они переходят в раковые изменения хряща в суставе. Такие патологии, как болезнь Педжета, инфаркт кости способны переходить в агрессивную злокачественную опухоль, остеогенную саркому.
Характерные симптомы саркомы в коленях
Определить начало болезни обычно сложно. Болеющего беспокоят боли тупого характера. Они локализуются около пораженного соединения (чаще всего около отдела трубчатой кости). Болезненность соединения ощущается без скопления биологической жидкости на этом участке. Развитие участка и размера опухоли, задействование новых тканей, расположенных рядом, провоцируют усиление болевого синдрома.
Укажем признаки саркомы колена. Развитие патологии сопровождается следующими изменениями:
- Утолщение метадиафизарного отдела кости;
- проявление венозной сетки кожных покровов;
- выраженная пастозность тканей.
К сожалению, на первичные признаки саркомы коленного сустава врачи, пациенты редко обращают внимание. На ранних стадиях болезни врачи могут предполагать невралгию, последствия травмы, миозит. При этом теряется время, а прогноз ухудшается. Поэтому, если долгое время беспокоят боли костей, стоит обратиться к онкологу. Он поможет своевременно обнаружить опухоль, назначит ее адекватное лечение.
С развитием опухолевого процесса, распространения на соседние ткани саркома коленного сустава симптомы вызывает нижеприведенные:
- Припухлость. Ее фиксируют над опухолью;
- отечность;
- венозная сетка;
- ограничение движений из-за сильных болей;
- патологические переломы.
Чтобы своевременно обнаружить опасную патологию, следует изучить фото болезни. Также необходимо изучение всех признаков поражения сочленения колена опухолью.



Со временем возникает хромота из-за контрактуры сочленения. Пальпация пораженной зоны сопровождается резкой болью. Больного постоянно беспокоят ночные боли. Они настолько сильные, что анальгетики неспособны с ними справиться. Болезненность не проходит даже после фиксации конечностей посредством гипса.
Саркома колена симптомы вызывает нижеприведенные:
- Нарушение сна;
- анемия;
- утомляемость;
- повышение температуры;
- потеря веса.
Новообразованию свойственно мгновенное развитие и расширение на новые ткани. Она очень стремительно заполняет полости кости, заходит внутрь мышечных волокон.
Диагностика саркомы в коленном суставе
У ребенка при рассматриваемой патологии наблюдается игольчатый периостит. В результате остеобласты формируют костные ткани по ходу кровеносных сосудов (перпендикулярно кортикальному слою). При этом формируются спикулы.
Чтобы точно установить саркому, врачам понадобится дифференциальная диагностика с нижеприведенными патологиями:
- Костное или хрящевое разрастание неопухолевого типа;
- раковую опухоль;
- опухоль, характеризующаяся наличием гигантских многоядерных клеток;
- разрастание ретикуло-гранулематозной ткани.
Первой помощью при подозрении на саркому больного направляют на рентген. Когда уже обнаружена опухоль, назначают биопсию. После нее выполняют микроскопическое исследование.
Также понадобятся нижеприведенные диагностические методы:
- КТ. С ее помощью врачи точно изучают образование (внутрикостный компонент, внекостный компонент, представленный распространением патологии внутрь жировых, мышечных тканей, окружающих зону поражения.
- МРТ. Она предоставляет полную информацию о течении патологии. С ее помощью врачи получают данные о костномозговой полости больного участка кости. С помощью МРТ специалисты определяют наличие метастазов, проникших внутрь центральной нервной системы.
- ПЭТ. Процедура предполагает введение в организм слабого радиоактивного вещества. Его используют в безопасных дозах. Это вещество больше скапливается внутри опухолевых клеток. После введения вещества выполняются снимки. Таким образом, врачи способны рассмотреть основную опухоль. Также этот метод дает возможность обнаружить метастазы по разным частям тела.
- Рентгенография, КТ грудного отдела. Эти диагностические методы позволяют обнаружить метастазы в легких.
- Остеосцинтиграфия. Позволяет врачам обнаружить метастазы внутри других костей. Также указанный метод дает возможность обнаружить многоочаговую форму патологии.
- Биохимический анализ крови. Используется указанный метод диагностики для оценки общего состояния пациента. Этот показатель способен косвенно определить степень агрессивности онкологии.
- Биопсия. Предложенный диагностический метод принято считать наиболее точным. Его используют практически во всех случаях, даже, когда врачи точно знают, что пациента рак костей. Благодаря биопсии специалисты ставят точный диагноз. Они способны отличить саркому от других видов опухолей, уточнить степень злокачественности новообразования. Забор тканей выполняется через разрез или посредством иглы.
Эффективные методы терапии саркомы
Незаменимым этапом терапии рассматриваемой патологии считается операция, которая предполагает удаление опухоли хирургическим методом.
Обычно синовиальная саркома коленного сустава изначально требует проведение предоперационного курса (неоадъювантный) химиотерапии. Длительность такого курса в среднем составляет около 10 недель. Специалисты обычно назначают комбинацию из нескольких медпрепаратов. Такой подход позволяет усилить терапевтический эффект. Целью указанного типа химиотерапии считается уничтожение метастаз, уменьшение новообразования со злокачественным характером. Предоперационная химиотерапия позволяет существенно повысить выживаемость пациентов.
После проведенной химиотерапии врачи назначают хирургическое лечение. Раньше единственным способом борьбы с онкологией костей конечности считалась ее ампутация (удаление части тканей кости, сочленения). Теперь при рассматриваемом виде онкологии оперативное вмешательство стало белее щадящим.
Обязательно во время реабилитации врачи назначают курс химиотерапии. Этот вид лечения называют адъювантным. Его цель в удалении злокачественных клеток, которые возможно присутствуют после оперативного вмешательства. Длительность такого курса химиотерапии занимает около 18 недель. Бывает случаи, что необходимо увеличить продолжительность химиотерапии.
Что стоит предпринять при рецидиве остеосаркомы? Обычно схема терапии патологии такая же, как и при первичной онкологии. Синовиальная саркома коленного сустава предполагает проведение следующих мероприятий:
- Оперативное лечение;
- курс химиотерапии.
Единственным отличием рецидива от первичной онкологии считается прогноз. Он будет для пациента намного хуже, чем после лечения опухоли в первый раз. Но все же есть шанс на выздоровление.
Осложнения
После проведения химиотерапии пациенты должны быть готовы к определенным последствиям. Химические медпрепараты считаются весьма токсичными. Их воздействие на организм сопровождается множеством ярко выраженных побочных эффектов:
- Рвоты;
- ощущение тошноты практически постоянно;
- выпадение волос;
- сбои функционирования систем организма.
Прогноз в лечении саркомы в коленном суставе
Для пациентов с саркомой коленного сустава прогноз составляется на основе специального показателя. Этот показатель показывает процент пациентов с диагнозом остеосаркома, которые выжили на протяжении 5 лет после установления медиками безошибочного заключения. Конечно, много случаев, когда болеющие живут меньше или дольше. Но в качестве условного рубежа врачи рассматривают именно 5 лет. По прошествии указанного периода есть высокие шансы на то, что пациент все-таки выздоровел.
Informo, ergo sum!

Московского
Онкологического
Общества
СПЕЦИАЛИЗИРОВАННЫЕ КЛИНИКИ ВЫПОЛНЯЮТ ОРГАНОСОХРАНЯЮЩИЕ ОПЕРАЦИИ В 85-90% СЛУЧАЕВ. ПРИ ЭТОМ 5-ЛЕТНЯЯ ПРОДОЛЖИТЕЛЬНОСТЬ ЖИЗНИ ДОСТИГАЕТ 75% У ВЗРОСЛЫХ
И 85% – У ДЕТЕЙ
| №4 (577) 2011 АПРЕЛЬ |
ЗАСЕДАНИЕ 577
состоится в четверг 28 апреля 2011 г. в 17:00
в конференц-зале клиники Российского онкологического
научного центра им. Н.Н. Блохина
Председатели: проф. А.И. Пачес, академик РАМН, проф. М.Д. Алиев, проф. А.Н. Махсон
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЭНДОПРОТЕЗИРОВАНИЯ
БОЛЬНЫХ ОПУХОЛЯМИ КОСТЕЙ И СУСТАВОВ
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ МЕГАПРОТЕЗОВ В ХИРУРГИИ ОПУХОЛЕЙ КОСТЕЙ И СУСТАВОВ
Алиев М.Д. 1;2 , Соколовский В.А. 1 , Дзампаев А.З. 2 ,
Нисиченко Д.В. 1;2 , Сергеев П.С. 1 , Хестанов Д.Б. 2
(Российский онкологический научный центр им. Н.Н. Блохина –
1 отделение общей онкологии НИИ клинической онкологии РОНЦ;
2 отделение опухолей опорно-двигательного аппарата НИИ детской онкологии и гематологии РОНЦ)
ЭНДОПРОТЕЗИРОВАНИЕ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ И СУСТАВОВ ПРИ ДЕФИЦИТЕ МЯГКИХ ТКАНЕЙ
Тепляков В.В., Карпенко В.Ю., Шаталов А.М., Бухаров А.В., Державин В.А., Мысливцев И.В., Урлова А.Н., Собченко Л.А.
(Московский научно-исследовательский онкологический институт им. П.А. Герцена – хирургическое отделение онкологической ортопедии)
СОСТОЯНИЕ И ПЕРСПЕКТИВЫ ЭНДОПРОТЕЗИРОВАНИЯ В ХИРУРГИИ ОПУХОЛЕЙ КОСТЕЙ И СУСТАВОВ
Фиксированные выступления в прениях.
Махсон А.Н. (Московская онкологическая больница №62), Балберкин А.В. (ЦНИИ травматологии и ортопедии им. Н.Н. Приорова)
КОНСПЕКТ СОСТОЯНИЯ ПРОБЛЕМЫ
ОРГАНОСОХРАНЯЮЩИЕ ОПЕРАЦИИ
В ХИРУРГИИ ОПУХОЛЕЙ КОСТЕЙ И СУСТАВОВ
Органосохраняющие операции активно применяются в хирургии опухолей костей и суставов с 1980-1990-х гг. Сохранение пораженной конечности достигается эндопротезированием – замещением пораженного фрагмента искусственными конструкциями, которые закрепляются к сохраненным костным основам В современной онкоортопедии эндопротезирование возможно при поражении практически любого крупного сустава (плечевого, локтевого, лучезапястного; тазобедренного, коленного, голеностопного), выполняются тотальные эндопротезирования плеча, бедра, голени, диафизов плечевых, бедренных, большеберцовых костей. Подробности этих разработок отражены в исследованиях J. Eckardt, A. Ferruzzi, R. Kotz, W. Winkelman, C.Т. Зацепина, А.С. Имамалиева, Н.Н. Приорова, К.М. Сиваша, Н.Н. Трапезникова.
Создание модульных протезов привело к революционным изменениям в органосохраняющем лечении. Модульные системы позволяют реконструировать значительные дефекты в области суставов, безотлагательно проводить хирургическое лечение (модульный эндопротез собирается во время операции), фиксировать ножки эндопротеза в костномозговом канале цементным или бесцементным способом, вносить в конструкцию протеза изменения, связанные с неожиданными интраоперационными находками и др.
Модульный протез состоит из суставного компонента, тела и ножек. Пористое покрытие дает возможность бесцементной фиксации эндопротеза. В некоторых случаях это позволяет снизить нагрузку на стержень и обеспечить более физиологичное распределение давления на корковый слой кости. Для замещения больших костных дефектов эндопротезы онкологическим больным создаются б о льших размеров, чем в ортопедии. Такие мегапротезы, однако, изменяют биомеханику сустава, что снижает стабильность.
При эндопротезировании костей и суставов необходимо соблюдать основные принципы онкохирургии – футлярность и абластичность: резецировать кость на достаточном (5-6 см) отдалении от опухоли, удалять en bloc зону биопсии, предшествовавшей эндопротезированию, и все очаги потенциальной диссеминации; выполнять адекватную мышечную пластику, укрывая протез мягкими тканями для снижения риска инфицирования. Основными местными осложнениями эндопротезирования являются инфекционные (в ложе эндопротеза), а также нестабильность и перелом протеза. Частота осложнений, по данным ряда обзоров, достигает 40-50%.
Улучшение результатов в онкоортопедии связывается с неуклонным соблюдением абластики, асептики, совершенствованием конструктивных параметров эндопротезов, техники их применения, организационной работы, включая разъяснение пациентам необходимости соблюдения требований, направленых на профилактику повреждений протезов в раннем послеоперационном и реабилитационном периодах.
Заключение. Успехи онкохирургии, противоопухолевой химиотерапии, совершенствование ортопедической техники улучшили отдаленные результаты. Если в 1960-е гг. 5-летняя выживаемость оперированных соответствовала 20%, то к 2010-м гг., 5-летняя продолжительность жизни возросла до 75% у взрослых и 85% у детей (Алиев М.Д. с соавт.; 2008-2010 *). При этом существенно расширились показания к органосохраняющим операциям. Эндопротезирование, не снижая радикализма операции, позволяет улучшить функциональные и психологические результаты противоопухолевого лечения, изменить качество жизни пациентов.
(По материалам аспиранта П.С. Сергеева)
- Первичные злокачественные опухоли костей / Под редакцией М.Д.Алиева/ – М.: Издательская группа РОНЦ, 2008. – 408 с.: ил. // ISBN 5-98811-056-8.
В руководстве, написанном сотрудниками РОНЦ им. Н.Н. Блохина – ведущего онкологического учреждения страны – обобщен обширный клинический материал по первичным злокачественным опухолям костей. Отдельные главы посвящены классификации, патологической анатомии и стадированию данной группы опухолей. Представлены современные возможности диагностики и взгляды на лечение. Подробно изложены принципы хирургического лечения. Отражены последние достижения и перспективы лекарственной терапии сарком костей. Отдельная глава посвящена вопросам диагностики и лечения опухолей костей в детском возрасте. Руководство рассчитано на онкологов, хирургов, ортопедов и студентов медицинских ВУЗов. - Sokolovskiy V.A., Nisichenko D.V., Orekhov M.N, Saravanan S.A., Sokolovskiy A.V., Aliev M.D. The use of megaprostheses at total replacement of the femur at oncological patients. The 23-rd Annual meeting of the European Musculo-Skeletal Oncology Society (EMSOS 2010). – Abstract book. Birmingham, 2010.
PROCEEDINGS OF THE MOSCOW CANCER SOCIETY №577
(April 28, 2011)
THE RESULTS OF ENDOPROSTHESIS SURGERY
FOR TUMORS OF BONES AND JOINTS
Report-1: REMOTE RESULTS OF ENDOPROSTHESIS SURGERY FOR TUMORS OF BONES AND JOINTS.
By Prof. M.Aliev 1; 2 , Prof. V.Sokolovsky 2 , Prof. A.Dsampaev 2 , et al. ( 1 The N.N. Blokhin Cancer Research Center’ Department of General Oncology. 2 The N.N. Blokhin Cancer Research Center’ Department of Bones fnd Soft Tissues’ Tumors from Research Institute of Oncology and Haemotology of Childhood)
Report-2: THE USE OF ENDOPROSTHESES FOR TUMORS OF BONES AND JOINTS IN CASES WITH SOFT TISSUES’ DEFICIENCY.
Prof. V. Tepliakov et al. (The P.A. Hertzen Moscow Research Institute of Oncology’ Department of Onco-Orthopaedics)
Discussion: CURRENT STATUS AND THE PERSPECTIVES OF ENDOPROSTHESES.
By Prof. A. Mahson et al. (Moscow Cancer Hospital #62), Prof. A. Balberkin et al. (Central Research Institute for Traumathology and Ortopaedics)
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ МЕГАПРОТЕЗОВ
В ХИРУРГИИ ОПУХОЛЕЙ КОСТЕЙ И СУСТАВОВ
Алиев М.Д. 1;2 , Соколовский В.А. 1 , Дзампаев А.З. 2 ,
Нисиченко Д.В. 1;2 , Сергеев П.С. 1 , Хестанов Д.Б. 2
(Российский онкологический научный центр им. Н.Н. Блохина –
1 отделение общей онкологии НИИ клинической онкологии РОНЦ;
2 отделение опухолей опорно-двигательного аппарата
НИИ детской онкологии и гематологии РОНЦ)
За период с 1979 по 2009 гг. в отделении общей онкологии НИИ КО РОНЦ выполнено 956 органосохраняющих операций в объеме сегментарной резекции или тотального удаления длинной трубчатой кости с последующим эндо- или реэндопротезированием; в 794 случаях выполнены первичные, в 162 – повторные операции. Поражение кости были обусловлены первичными опухолями у 92% пациентов, метастатическими – у 8%. Средний возраст больных составил 28±14 лет (от 10 до 80 лет), мужчин было 53,5%, женщин – 46,5%. Преобладали остеосаркомы (46%); в остальных случаях диагностированы хондросаркомы (10%), саркомы Юинга (5%), гигантоклеточные опухоли (14%), другие морфологические формы составили 25%.

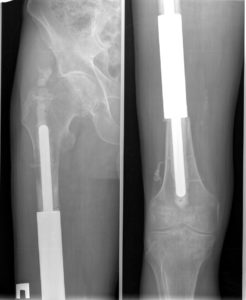
Рис. 1. Больной 18 лет. Диагноз: состояние после комбинированного лечения по поводу остеосаркомы нижней трети бедренной кости. Операция выполнена в объеме дистальной резекции бедренной кости с замещением дефекта эндопротезом коленного сустава. Рентгенограммы проксимального и дистального отделов эндопротеза. Оценка MSTS составила 87%; срок наблюдения – 54 мес.
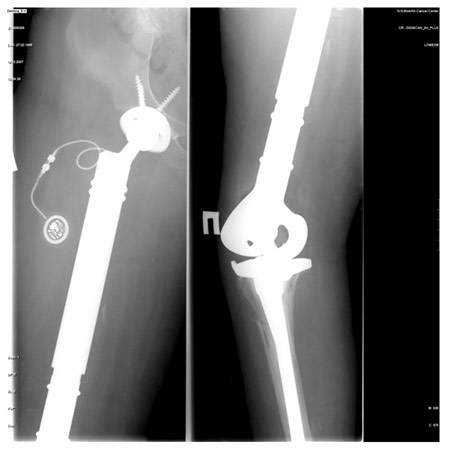
Рис. 2. Больная 17 лет. Диагноз: состояние после комбинированного лечения по поводу остеосаркомы правой бедренной кости. Укорочение ноги составило 12 см. Операция в объеме тотального реэндопротезирования бедренной кости с замещением дефекта модульным раздвижным эндопротезом. Рентгенограммы проксимального и дистального отделов эндопротеза. Оценка MSTS – 72%; срок наблюдения – 42 мес.
Результаты. Органосохраняющее лечение выполнено более 85% пациентам, госпитализированным в клинику общей онкологии НИИ КО РОНЦ. Частота рецидивов составила 12%. Среди осложнений отмечены инфекции (11%), нестабильность эндопротеза (13,7%). Функциональная оценка по шкале MSTS составила 70% для операций по эндопротезированию плечевого сустава, 80% – для тазобедренного. Показатели MSTSпосле эндопротезирования бедренной кости соответствовали 58% – при ее тотальном замещении и 92% – резекции дистального отдела; оценка после резекции проксимального отдела большеберцовой кости – 75%.
Таким образом, эндопротезирование костей и суставов в клинической онкологии является эффективным методом, обеспечивающим достижение клинического выздоровления и благоприятного функционального результата. Органо-сохраняющие операции – это золотой стандарт современной онкоортопедии (рис. 1-2).

Рис. 3. Больной 13 лет. Диагноз: состояние после комбинированного лечения по поводу остеосаркомы верхней трети бедренной кости. Операция выполнена в объеме тотального эндопротезирования бедренной кости с последующей двуэтапной дистракцией (3 см) замещением дефекта коленного сустава. Рентгенограммы до и после лечения. Оценка MSTS составила 60%; срок наблюдения – 36 мес.

Местные рецидивы после органосохраняющих операций выявлены в 6% случаев. Из неонкологических осложнений, чаще отмечено инфицирование ложа эндопротеза (18%). Функциональная оценка осуществлялась по шкале MSTS и составила: 90% после резекций дистального отдела бедренной кости с замещением дефекта эндопротезом коленного сустава, 80% – после эндопротезирования голеностопного и тазобедренного суставов; 72% – после резекций проксимального отдела большеберцовой кости; 70% – после эндопротезирования локтевого и плечевого суставов; 55% – после тотального замещения бедренной и плечевой костей.
Таким образом, неинвазивные эдопротезы целесообразно применять у детей младшего возраста, когда предполагается многократная поэтапная коррекция длины оперированной конечности. У детей старшего возраста оправдано применение развижных эндопротезов механического типа, а также эндопротезов модульной конструкции.
ЭНДОПРОТЕЗИРОВАНИЕ ДЛИННЫХ ТРУБЧАТЫХ КОСТЕЙ И СУСТАВОВ ПРИ ДЕФИЦИТЕ МЯГКИХ ТКАНЕЙ
Тепляков В.В., Карпенко В.Ю., Шаталов А.М., Бухаров А.В., Державин В.А., Мысливцев И.В., Урлова А.Н., Собченко Л.А.
(Московский научно-исследовательский онкологический институт им. П.А. Герцена – хирургическое отделение онкологической ортопедии)
Эндопротезирование больных первичными и метастатическими опухолями длинных трубчатых костей сопряжено с трудностями при дефиците мягких тканей, необходимых для укрытия протеза. Расширение показаний к эндопротезированию этих пациентов возможно благодаря разработке пластических этапов операций.
С октября 2005 по февраль 2011 г. в МНИОИ оперированы 100 пациентов с опухолевым поражением длинных трубчатых костей, в объеме сегментарной резекции или экстирпации кости с последующим эндопротезированием. Соотношение мужчин и женщин составило 1:1; возраст больных составлял от 16 до 72 лет и в среднем соответствовал 29 годам. Преобладали (74) первичные опухоли – хондросаркомы (32), остеосаркомы (23), гигантоклеточные опухоли (17), злокачественные фиброзные гистиоцитомы кости (3), саркома Юинга (1), а также враставшие в кости мягкотканые опухоли (5). Среди 16 метастатических опухолей диагностированы наблюдения рака молочной железы и почки (по 5), легкого (3), саркомы Юинга, злокачественной фиброзной гистиоцитомы и меланомы кожи. Кроме того, эндопротезирование проведено больным В-крупноклеточной лимфомой, фибромой-десмоидом и фиброзной дисплазией кости.
При обращении у 18 пациентов был диагностирован патологический перелом длительностью от 7 суток до 5 месяцев. Наиболее часто объем опухоли соответствовал 200-300 см 3 (от 42 до 592см 3 ). Средняя протяженность резекции кости составила 15 см (максимально – 24 см).
Выполнено эндопротезирование коленного сустава (52 – в том числе при поражениях дистального отдела бедренной (37) и проксимального отдела большеберцовой кости (15). Также проведено протезирование тазобедренного (14), плечевого (20), локтевого суставов (5). Кроме того выполнены тотальное эндопротезирование бедренной кости (3), эндопротезирование диафизов бедренной (3) и большеберцовой костей (1), резекция дистального отдела большеберцовой кости и эндопротезирование голеностопного сустава (1), эндопротезирование лучезапястного сустава (1).
Следует отметить, что у 33 пациентов после установки импланта не представлялось возможным сформировать адекватный мышечный футляр для укрытия эндопротеза, что требовало проведения дополнительного пластического этапа операции. В качестве пластического материала у 32 больных использованы перемещенные васкуляризированные лоскуты, у 1 – свободный мышечный лоскут на микрососудистых анастомозах. Применялись мышечные лоскуты сформированные из медиальной части икроножной мышцы (18), медиальной части широкой мышцы бедра (4), медиальных частей двуглавой и четырехглавой мышц бедра, др. После сегментарной резекции проксимального отдела бедренной кости с эндопротезированием тазобедренного сустава в качестве пластического материала использована портняжная мышца 1) ; при эндопротезировании локтевого сустава (4) – лоскут из лучевого сгибателя кисти 2) ; после сегментарной резекции проксимального отдела плечевой кости с эндопротезированием плечевого сустава – перемещенный торакодорзальный лоскут; при эндопротезировании локтевого сустава – свободный лоскут из прямой мышцы живота на микрососудистых анастомозах.
Онкологические результаты: Отдаленные результаты прослежены у всех пациентов. Средний срок наблюдения составил 23,2 мес. При этом у 13 больных диагностировано прогрессирование заболевания, включая 3 рецидива (в том числе у пациента, которому выполнялся пластический компонент операции); 11 больных умерли от прогрессирования заболевания в сроки от 9 до 40 мес.
Осложнения. Частота осложнений составила 18%. Инфекционные развились у 4 больных (в том числе у 1 – после дополнительного пластического этапа операции); ятрогенные – у 5 (в том числе: вывих в тазобедренном суставе (3), перелом диафиза бедренной кости (2); механические – у 7 (включая нестабильность ножки эндопротеза в костном канале, обусловленную остеопорозом (3), износ вкладыша коленного сустава (2), перелом ножки и перелом бедренного компонента эндопротеза (по 1). По поводу развившихся осложнений выполнено 14 хирургических вмешательств: открытое вправление вывиха эндопротеза в тазобедренном суставе (3), чрескожная остеопластика при нестабильности ножки эндопротеза 3) , замена вкладыша узла эндопротеза (2), удаление эндопротеза с установкой цементного спейсера (2), реэндопротезирование посеребренным эндопротезом (1), реимплантация бедренного компонента (1), замена чашки тазобедренного эндопротеза (1), ампутация конечности (1).
Ортопедическая оценка функции конечности после эндопротезирования проведена по MSTS. Она составила (в среднем): для коленного сустава 79-73% (соответственно – при опухолях дистального отдела бедренной и проксимального отдела большеберцовой кости); для тазобедренного сустава 74%. При тотальном эндопротезировании бедренной кости, диафизов костей и голеностопного сустава – 68; 80; 82% соответственно.
1) Патент РФ № 2395239 С. Авторы: Тепляков В.В., Карпенко В.Ю., Шаталов А.М.
2) Патент РФ № 2329769 С1. Авторы: Тепляков В.В., Агзамов Д.С., Карпенко В.Ю.
3) Приоритетная справка № 2010127787.
Читайте также:



