Дифференциальный диагноз подагры и остеоартроза
Ревматоидный артрит (РА) – часто встречающаяся патология (8-10 случаев из 1000). Однако существует ряд других системных соединительнотканных болезней, которые имеют сходные симптомы с РА. Процесс выявления заболевания из группы подобных называется дифференциальной диагностикой.
Болезни со сходной симптоматикой
Группа аутоиммунных заболеваний соединительной ткани, с которыми проводится дифференциальный диагноз при ревматоидном артрите, включает:
- деформирующий остеоартроз с реактивным синовиитом;
- ревматизм;
- подагра;
- системная красная волчанка;
- псориатический артрит;
- инфекционные (вирусные) артриты;
- системная склеродермия;
- анкилозирующий спондилоартрит;
- реактивные артриты.
Эти патологические процессы, как и тот, с которыми необходимо их дифференцировать, в одну из своих фаз характеризуются острым воспалением суставных и околосуставных тканей, поэтому между ними проводится дифференциальная диагностика артритов.
Диагностика

Для подтверждения или опровержения диагноза следует учитывать следующие критерии:
- поражение костных сочленений симметрично: если страдают суставы левой руки, страдают аналогичные правой руки;
- изменения необратимы: измененная в результате разрастания пануса форма суставов остается такой пожизненно;
- утренняя скованность в суставах составляет более получаса;
- характерно поражение:
- ІІ и ІІІ пальцев обеих рук в области проксимальных межфаланговых и пястно-фаланговых сочленений;
- запястий и колен;
- голеностопных суставов и локтей.
- наличие внесуставных проявлений:
- ревматоидные узелки;
- лимфаденопатия;
- висцериты.
- в анализе крови:
- наличие изменений, характерных для любых воспалительных процессов в организме;
- положительная реакция на ревматоидный фактор (HLA-B27).
- на рентген-снимке:
- эпифизарный остеопороз;
- эрозивный артрит;
- сужение суставных щелей.
На основе этих признаков проводится дифференциальная диагностика ревматоидного артрита с другими болезнями из его группы.
Описание артритов для дифференцированного диагноза с ревматоидным артритом

Для ревматизма характерно не прогрессирующее развитие артрита, а очень частые рецидивы с межприступными паузами различной длительности. Сочленения верхних конечностей поражаются несимметрично; возможен как моно- (один), так и олиго- (несколько) артрит. Околосуставные ткани припухлые, кожа над ними синюшного оттенка. Суставные изменения обратимы и исчезают в течение 2-3 дней, вместе с окончанием периода обострения.
Поражены мелкие суставы; все деформации обратимы. На фоне других симптомов:
Артритические проявления отходят на второй план.
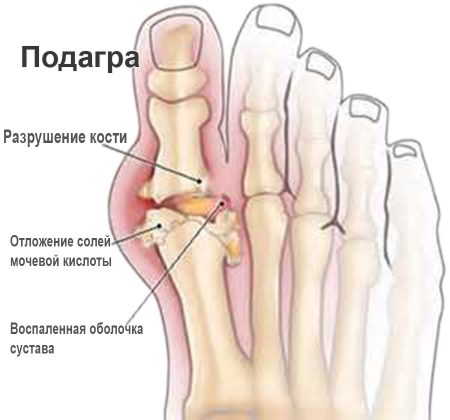
Характерная локализация для подагры – плюснефаланговый сустав І пальца. Кожа над ним раскрасневшаяся, при движении боль усиливается. Если не начать лечение своевременно, вскоре вовлекаются в патологический процесс другие суставы — симметрично или асимметрично. В суставных сумках могут прощупываться тофусы (узелки) различной величины.
В крови повышена концентрация мочевой кислоты. При отсутствии адекватного лечения и изменения образа жизни вскоре нарушается функция почек. Изменения обратимы: первоначальное функционирование и форма суставов возвращаются с выведением уратов.
За счет отека суставы приобретают форму веретена, а кожа над ними становится малинового или синюшно-багрового цвета. Помимо суставных проявлений при ПА на коже появляются псориатические бляшки, страдают производные кожи: слоятся ногти, появляется перхоть, могут выпадать волосы. Положителен анализ крови на ревматоидный фактор, присутствует рентгенологически-выраженная деструкция костной ткани.
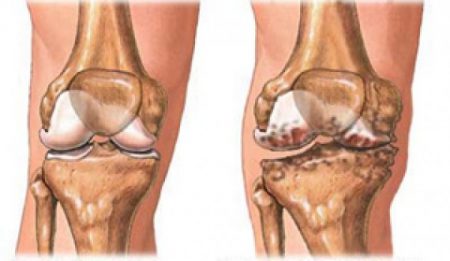
Нарушается форма дистальных межфаланговых суставов кистей, а также мелких и крупных костных соединений нижних конечностей. Боль механического типа: не проявляется в покое и усиливается с увеличением интенсивности движений. Но при этом отсутствуют значительные нарушения их функций, за исключением тазобедренного сочленения.
Висцеропатии не характерны. Данные анализа крови соответствуют наличию в организме слабой воспалительной реакции, а то и вовсе норме. На рентгенологическом снимке – субхондральный (подхрящевой) остеосклероз, а также значительные костные выросты – проявления остеофитоза.
Имеется временная связь с перенесенным инфекционным заболеванием мочеполовой системы или кишечника – либо недолеченным, либо вообще невыявленным (вариант не составит труда установить по совокупности анализов крови, мочи, соскоба из уретры и копрограммы). Артрит возникает в течение полугода после занесения инфекции. Ревматический фактор положительный. Изменения в суставах обратимы.
Проявляется мышечно-суставным синдромом: возникает симметричный полиартрит и периартрит, в результате наблюдаются сгибательные контрактуры. Все это сопровождается миозитом и псориатическим поражением кожи – плотным отеком лица и кистей, затрудняющим движения, в том числе и мимических мышц (возникает симптом маскообразного лица). Такие же фиброзные изменения происходят во внутренних органах: ЖК тракта, почках, кровеносных сосудах и др. В крови повышено содержание гамма-глобулина.
Поражение суставов асимметрично, в основном страдают мелкие сочленения. Воспаляются суставные связки, околосуставные ткани. Лечение основного заболевания – антибактериальная или противовирусная терапия – быстро устраняет суставные проявления.
Методы исследования, которые необходимо провести для подтверждения или опровержения диагноза:
- общий анализ крови (на выявление воспалительных явлений: повышения количества лейкоцитов и сдвига лейкоцитарной формулы);
- биохимический анализ крови (на наличие ревматического фактора HLA-B27);
- анализ мочи и копрограмма (на выявление инфекции или ее последствий);
- рентгенологический снимок беспокоящих костных соединений (для выявления наличия/отсутствия выростов, фиброзных процессов, остеопороза и др.).
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
ГУ Институт ревматологии РАМН, Москва
П одагра – системное тофусное заболевание, развивающееся в связи с воспалением в органах и системах в местах отложения кристаллов моноурата натрия у людей с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами (В.А. Насонова, В.Г. Барскова, 2003). Подагрический артрит был хорошо известен еще врачам античного периода, наиболее яркое описание симптоматики острого подагрического приступа принадлежит английскому врачу Сиденгаму. Окончательно выделил подагру как самостоятельную болезнь другой клиницист – Гарро, который отделил хронический подагрический артрит от ревматоидного.
Перед тем как обсуждать дифференциальную диагностику подагры, хотелось бы еще раз напомнить и перечислить те объективные трудности, которые хорошо известны ревматологам, имеющим опыт по наблюдению за такими пациентами. Во–первых, это особенности течения болезни. Так, артрит при подагре достаточно долго имеет доброкачественный характер даже без лечения. Единичные атаки, хотя и болезненные, быстро купируются нестероидными противовоспалительными препаратами (НПВП) или анальгетиками. Обычно при расспросе больных выясняется, что единожды прописанный врачом препарат принимается при каждом обострении до тех пор, пока не перестает быть эффективным, либо частые обострения артрита нарушают трудоспособность, либо возникающие побочные эффекты препаратов лимитируют дальнейший их прием и т.д. Во–вторых, имеют значение характерологические особенности больных, которые демонстрируют крайне низкий уровень послушания врачу и приверженности систематическому лечению. Очевидно, это обусловлено половым диморфизмом болезни: подагрой страдают в основном мужчины социально активного возраста (45–50 лет). Наконец, излишняя алкоголизация этих больных общеизвестна и указывается не только как причина усугубления гиперурикемии, но и как причина неэффективности аллопуринола: этанол затрудняет метаболизм аллопуринола в активные формы.
Говоря о проведении дифференциального диагноза подагры, нельзя не остановиться на современных классификационных критериях подагры, рекомендованных для использования ВОЗ в 2000 году (табл. 1). Классификационные критерии состоят как бы из двух частей – достоверных критериев подагры как болезни и клинико–лабораторно–рентгенологических признаков, способствующих раскрытию подагрического характера артрита. Таким образом, критерии помогают устанавливать не только достоверный диагноз подагры как тофусной болезни, но одновременно распознавать острый подагрический артрит в самом начале болезни.
Следующим в дифференциальном поиске стоит септический артрит, который напоминает подагрический, характеризуясь практически обязательным развитием гиперемии, гипертермии, выраженной отечности, боли и нарушением функции. Септический артрит сопровождается лихорадкой, что может отмечаться и при подагрическом артрите, однако при последнем редко отмечается повышение СОЭ и увеличение количества лейкоцитов крови, исключительно при позднем полиартикулярном хроническом течении. Септическое поражение суставов чаще отмечается именно в практике ревматолога. Можно выделить две основные причины возникновения септического артрита, которые на практике тесно друг с другом связаны. С одной стороны, септический артрит может быть следствием неоднократных внутрисуставных введений лекарственных препаратов при ревматоидном артрите и остеоартрозе, чаще в коленные суставы (хотя гематогенный вариант инфицирования сустава также известен и не ассоциируется с непосредственным терапевтическим воздействием на сустав, а в этом случае может поражать любой сустав). С другой стороны, он является вторичным осложнением при аутоиммунных процессах, связанных с иммуносупрессивной терапией. Необходимо представлять, что данные виды артритов – травматический и септический – дифференцируются с подагрическим исключительно по выраженности воспалительных явлений, но не по частоте встречаемости в практике ревматолога.
Проведение дифференциальной диагностики с другой микрокристаллической артропатией, пирофосфатной артропатией (ПАП) обусловлено тем, что в том и другом случаях поражаются люди среднего и пожилого возраста, однако чаще ПАП – удел женского пола. Описано обнаружение обоих видов кристаллов у одного и того же больного. Провоцирующим фактором также может явиться травма. В 90% случаев ПАП наиболее поражаемыми суставами являются коленные, плечевые и мелкие суставы кистей. Если с подагрой ассоциируется артрит ПФС первого пальца, то с ПАП – артрит коленного сустава. Примечательно, но начало подагры с артрита коленных суставов не является казуистикой, особенно при наличии предыдущих травм, и, наоборот, псевдоподагра (вовлечение ПФС при ПАП) встречается у 2 из 50 больных. Вовлечение мелких суставов кистей при подагре наблюдается чаще на поздней стадии болезни. Плечевые же суставы при подагре можно считать суставами исключения даже на поздних стадиях болезни.
Воспалительные эпизоды в суставах, в меньшей степени напоминающие подагру, но также вовлекающие в процесс ПФС первого пальца могут отмечаться при остром кальцифицирующем периартрите. Депозиты аморфных гидроксиаппатитов, формирующиеся в острой стадии в связках или суставной капсуле, могут в дальнейшем исчезать. Атаки артрита тем не менее могут повторяться. Чаще кальцифицирующий периартрит встречается у женщин либо у пациентов с уремией, находящихся на гемодиализе. Наиболее часто поражаемые суставы в основном крупные: плечевые, тазобедренные, коленные.
Проведение дифференциального диагноза с ревматоидным артритом актуально в двух случаях. В случае моноартикулярного начала ревматоидного артрита изолированное поражение коленного и локтевого сустава может потребовать проведения дифференциального диагноза с подагрой. Как правило, больших трудностей эта клиническая ситуация не представляет. Во–первых, получение значительного количества синовиальной жидкости из крупного сустава позволит выполнить не только поляризационную микроскопию в целях поиска кристаллов, но и полноценного анализа, включающего ревматоидный фактор. Дополнительным критерием при недоступности анализа синовиальной жидкости может явиться критерий ex juvantibus: назначение НПВП или глюкокортикоидов внутрисуставно полностью купирует подагрический артрита (в отличие от ревматоидного).
Дегенеративные болезни суставов и подагра чаще сочетаются у одного больного (особенно пожилого), что требует проведения дифференциальной диагностики. Узлы Бушара или Гебердена не столько симулируют тофусное поражение пальцев, сколько вовлекаются в микрокристаллическое воспаление у пожилых больных. При изолированном остеоартрозе осмотр и исследование синовиальной жидкости выявляют минимальные воспалительные явления. Синовиальная жидкость может содержать отличные от моноурата натрия кристаллы – жидкие кристаллы липидов и пирофосфаты.
Достаточно актуальным является дифференциальный диагноз подагры с анкилозирующим спондилоартритом (АС). Наличие таких признаков, как мужской пол, частое вовлечение суставов нижних конечностей, моноартикулярное поражение, внезапность возникновения артрита, может симулировать подагру. Однако признаки, отличающие подагру от АС, являются достаточно яркими, хорошо описываются больными и делают клиническую картину АС хорошо узнаваемой: боли в позвоночнике со скованностью и ограничением движения, уменьшение экскурсии грудной клетки, ночные боли в нижней части спины с иррадиацией в ягодичные мышцы. Рентгенологическое исследование при этом выявляет картину сакроилеита. Почти у 90% больных определяется HLA–B27. Признаком, отличающим артрит при АС от подагрического, является его большая длительность (от нескольких недель, до нескольких месяцев) и не такой яркий терапевтический эффект НПВП, как при подагре.
Дифференциальный диагноз с синдромом Рейтера также обусловлен поражением в основном лиц мужского пола, вовлечением суставов нижних конечностей, преимущественно крупных, хотя могут вовлекаться и мелкие суставы стопы, симулируя острый подагрический артрит. Другие признаки из триады симптомокомплекса Рейтера – уретрит и конъюнктивит, предшествующие артриту – легко выявляются анамнестически. Опять–таки течение артрита склонно к более затяжному варианту, чем при подагре.
В любом случае данные анамнеза, особенно правильная их трактовка (табл. 3 и 4), и исследование синовиальной жидкости могут значительно облегчить проведение дифференциального диагноза.
Острый приступ подагрического артрита (особенно в начале заболевания) не представляет терапевтических трудностей, так как может купироваться даже самостоятельно. В начале болезни ответ на противовоспалительную терапию может считаться, как мы уже упоминали ранее, признаком ex juvantibus. Ранее быстрый эффект от колхицина так и считался дополнительным диагностическим признаком, однако таковой отмечается в случае назначения его в первые сутки и даже первые часы после развития приступа. Стандартный метод применения колхицина состоит в назначении 0,5 мг препарата каждый час, лечение проводят до наступления эффекта, обычно до развития побочных реакций (рвота, диарея, понос) или достижения максимальной дозы (не более 6 мг за 12 часов). В литературе последних лет распространенный алгоритм лечения колхицином до наступления диареи подвергается критике и поднимается вопрос о более осторожном его назначении в стандартных дозах в связи с тем, что жизнеугрожающая интоксикация может отмечаться у пациентов с поражением почек даже при применении режима низких доз. Для того чтобы негативный эффект колхицина не превысил его лечебный эффект, доктору не рекомендуется назначать колхицин пациенту, которого он видит впервые и не успел исследовать функцию почек (в частности, клиренс креатинина), тем более если перед ним пожилой пациент.
В настоящее время нестероидные противовоспалительные препараты (НПВП) являются наиболее широко применяемой группой выбора, пришедшей на смену колхицину, в терапии острого приступа подагры. Для успешного и безопасного применения неселективных НПВП необходимо помнить, что, помимо влияния на желудочно–кишечный тракт (НПВП–гастропатия), они могут быть причиной функциональных повреждений почек, а также вызывать нежелательные подъемы артериального давления, что приобретает особое значение у больных подагрой, заведомо скомпрометированных высокой частотой гипертензии и нефропатии. В длительных наблюдениях за больными подагрой было показано, что именно НПВП, наряду с такими факторами, как артериальная гипертензия и сахарный диабет, имеют значение в формировании хронической почечной недостаточности.
Диклофенак натрия и индометацин в дозах до 200 мг в сутки достаточно длительное время являются наиболее часто применяемыми препаратами. В последнее время появились данные о высокой эффективности диклофенака калиевой соли (Раптен рапид) при подагрическом артрите. По данным Шостак Н.А., препарат показал высокую эффективность и переносимость в терапевтических дозах, побочные эффекты не были отмечены ни у одного больного, что свидетельствует о хорошей переносимости терапевтических доз Раптена рапида. К концу недели приема Раптена рапида значительное снижение интенсивности болевого синдрома отмечалось у 80% обследованных больных. Удовлетворительные показатели индекса функциональной недостаточности наблюдались к концу 7–дневного курса лечения у 86% больных.
Особые надежды в последнее время возлагаются на селективные ингибиторы ЦОГ–2. Получены данные, говорящие о высокой эффективности и безопасности нимесулида в виде растворимой гранулированной формы в саше в общепринятой дозе – 200 мг (100 мг два раза в день).
Хороший эффект применения глюкокортикоидов (ГК) при остром приступе известен давно, считается безопасным методом и показан при невозможности применения НПВП или колхицина из–за непереносимости препаратов, наличия почечной недостаточности, язвенного поражения ЖКТ. ГК применяются различными способами: наиболее популярно – внутрисуставное введение их, однако частота парентерального применения также неуклонно увеличивается. Эффект от их введения бывает быстрым и стойким, даже при применении единичных внутримышечных доз или внутривенном введении. Но, безусловно, по нашим наблюдениям, ГК являются препаратами выбора при полиартикулярном хроническом подагрическом артрите. В этих случаях можно рекомендовать внутривенное введение метипреда в дозах 250–500 мг однократно или двукратно в зависимости от количества вовлеченных в процесс суставов. Такая тактика обеспечивает быстрый и стойкий противовоспалительный ответ, сочетающийся с урикозурическим эффектом и хорошей переносимостью.
Подводя итог, хотелось бы подчеркнуть, что тщательный сбор анамнеза, внимательный осмотр больного при знании диагностических критериев не только подагры, но и вообще основных ревматических болезней, сопровождающихся поражением суставов, диагноз подагры в подавляющем большинстве случаев не вызывает затруднений. Что касается лечения приступа подагрического артрита, то знание особенностей препаратов выбора и их противопоказаний обеспечивает быстрое и безопасное его купирование.
Аннотация научной статьи по клинической медицине, автор научной работы — Погожева Елена Юрьевна, Амирджанова Вера Николаевна, Каратеев Андрей Евгеньевич
В статье представлены дифференциальная диагностика подагры и остеоартрита, особенности клинической картины, данных лабораторного, инструментального обследования. Продемонстрированы алгоритм ведения пациентов с остеоартритом и обновленные рекомендации Европейской лиги против ревматизма (European League Against Rheumatism, EULAR) по лечению подагры . Обсуждаются цели и основные принципы терапии подагры и остеоартрита. Представлены данные об особенностях механизма действия, клинической эффективности и безопасности диацереина (ингибитор интерлейкина-1). Приведены данные клинических исследований препарата фебуксостат (селективный ингибитор ксантиноксидазы), показаны его эффективность в отношении контроля уровня мочевой кислоты, возможность назначения пациентам с хронической почечной недостаточностью, резистентностью к терапии аллопуринолом и аллергическими реакциями на него.
Похожие темы научных работ по клинической медицине , автор научной работы — Погожева Елена Юрьевна, Амирджанова Вера Николаевна, Каратеев Андрей Евгеньевич
Дифференциальная диагностика остеоартрита и подагры: основные подходы к терапии
Е.Ю.Погожеваи, В.Н.Амирджанова, А.Е.Каратеев
В статье представлены дифференциальная диагностика подагры и остеоартрита, особенности клинической картины, данных лабораторного, инструментального обследования. Продемонстрированы алгоритм ведения пациентов с остеоартритом и обновленные рекомендации Европейской лиги против ревматизма (European League Against Rheumatism, EULAR) по лечению подагры. Обсуждаются цели и основные принципы терапии подагры и остеоартрита. Представлены данные об особенностях механизма действия, клинической эффективности и безопасности диацереина (ингибитор интерлейкина-1). Приведены данные клинических исследований препарата фебуксостат (селективный ингибитор ксантиноксидазы), показаны его эффективность в отношении контроля уровня мочевой кислоты, возможность назначения пациентам с хронической почечной недостаточностью, резистентностью к терапии аллопуринолом и аллергическими реакциями на него.
Ключевые слова: остеоартрит, подагра, дифференциальная диагностика, эффективность и безопасность, диацереин, фебуксостат. Для цитирования: Погожева Е.Ю., Амирджанова В.Н., Каратеев А.Е. Дифференциальная диагностика остеоартрита и подагры: основные подходы к терапии. Consilium Medicum. 2018; 20 (12): 122-125. DOI: 10.26442/20751753.2018.12.180108
Osteoarthritis and gout differential diagnosis: main treatment approaches
E.Yu.Pogozheva^, V.N.Amirdzhanova, A.E.Karateev
V.A.Nasonova Research Institute of Rheumatology. 115522, Russian Federation, Moscow, Kashirskoe sh., d. 34A elifequality@yandex.ru
The article presents differential diagnosis of osteoarthritis and gout, aspects of clinical presentation, laboratory and instrumental studies results. Algorithm on osteoarthritis management and renewed European League Against Rheumatism (EULAR) guidelines on gout treatment are presented. Aims and main principles of gout and osteoarthritis therapy are discussed. Data on mechanism of action, characteristics, clinical effectiveness and safety of diacerein (in-terleukine-1 inhibitor) are presented. Results of clinical studies of febuxostat (selective inhibitor of xanthinoxidase) are presented, its effectiveness in uric acid level control, possibilities of use in patients with chronic kidney disease, non-responsive or allergic to allopurinol therapy, are shown. Key words: osteoarthritis, gout, differential diagnosis, effectiveness and safety, diacerein, febuxostat.
For citation: Pogozheva E.Yu., Amirdzhanova V.N., Karateev A.E. Osteoarthritis and gout differential diagnosis: main treatment approaches. Consilium Medicum. 2018; 20 (12): 122-125. DOI: 10.26442/20751753.2018.12.180108
Боли в суставах различной локализации являются одной из наиболее частых причин обращения пациентов к врачам различных специальностей (терапевтам, ревматологам, неврологам, травматологам-ортопедам, физиотерапевтам), основной причиной снижения качества жизни, потери трудоспособности, фактором, снижающим продолжительность жизни, и становятся серьезным финансовым бременем для пациентов и государства.
Дифференциальная диагностика суставного синдрома способна представлять значительные трудности, особенно на ранней стадии. Это может быть связано с многообразием заболеваний, при которых возникают боли в суставах, сочетанием этих заболеваний, схожей клинической картиной, моносиндромным течением на протяжении длительного времени, поражением околосуставных мягких тканей, симулирующим патологию суставов. Понимание особенностей поражения суставов при различных нозологиях облегчает диагностику и способствует назначению адекватной фармакотерапии, в частности, таких патологий, как подагра и остеоартрит (ОА).
Особенности поражения суставов при ОА
ОА - гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы и периартикулярных мышц [1]. В патологический процесс наиболее часто во-
влекаются коленные, тазобедренные, суставы кистей и позвоночника.
При лабораторном исследовании отмечается отсутствие воспалительных изменений в клиническом анализе крови, ревматоидный фактор отрицательный, концентрация мочевой кислоты (МК) в пределах нормы. При анализе синовиальная жидкость прозрачная, вязкая, лейкоцитоз менее 2000/мм3. При рентгенологическом исследовании выявляется сужение суставных щелей, остеосклероз, краевые остеофиты.
Особенности поражения суставов при подагре
Подагра - системное тофусное заболевание, характеризующееся отложением в различных тканях моноурата натрия (МУН) и развивающимся в связи с этим воспалением у лиц с гиперурикемией, обусловленной внешнесредовы-ми и/или генетическими факторами. К особенностям клинической картины следует отнести рецидивирующие ата-
Дифференциальная диагностика подагры и ОА
Характеристика признака Подагра Первичный ОА
Факторы, провоцирующие обострение Погрешности в диете, прием алкоголя, травма, хирургические процедуры, обострение сопутствующих заболеваний, локальное воспаление (например, при ОА) Повышенная физическая нагрузка, переохлаждение, стресс
Характер болей Острое начало, максимальные в первые сутки и продолжаются в среднем 14 дней, гиперемия кожи над пораженным суставом Постепенное начало, возникает при движении, в начале движения, усиление к вечеру, в положении стоя или при нагрузке, утренняя скованность менее 30 мин
Преимущественная локализация поражений I плюснефаланговый, голеностопный, суставы стопы, кисти, локтевой, коленный суставы, ушная раковина; односторонняя Дистальные межфаланговые, коленные, межпозвоночные, плечевые, тазобедренные суставы; симметричная
Деформация суставов Тофусы (узел с наличием отделяемого или мело-образный под прозрачной кожей), возможность деформаций, свойственных вторичному ОА Узелки Гебердена, Бушара, варусная деформация нижних конечностей, кифоз, сколиоз
Синовиальная жидкость Кристаллы МУН (методом поляризационной микроскопии) Прозрачная, вязкая, лейкоцитоз менее 2000/мм3
Анализы крови В межприступный период - гиперурикемия, в период острого приступа -лейкоцитоз, нейтро-филез, ускорение СОЭ Нормальная картина или слабовыраженная воспалительная реакция. Ревматоидный фактор отсутствует, концентрация МК в пределах нормы
ки острого артрита (воспаление сустава достигает максимума в 1-й день болезни, разрешение симптомов 14 дней и менее, полная регрессия симптомов между эпизодами, моноартрит, гиперемия кожи над пораженным суставом, наиболее частая локализация - I плюснефаланговый сустав, суставы средней части стопы, голеностопный сустав, суставы кистей) и подозрение на тофусы (узел с наличием отделяемого или мелообразный под прозрачной кожей, локализующийся в типичных местах: суставы, уши, бурса локтевого отростка, подушечки пальцев, сухожилия).
Принципы терапии ОА
Основная цель терапии ОА - устранение боли, улучшение функции суставов и, по возможности, замедление или предотвращение прогрессирования болезни.
Хронический болевой синдром вынуждает пациентов с ОА длительно принимать анальгетические и противовоспалительные препараты. Известно, что терапия нестероидными противовоспалительными препаратами (НПВП) при ОА непростая задача, в основном из-за часто встречающейся у людей среднего и пожилого возраста комор-бидной патологии. Наиболее распространенные побочные эффекты НПВП напрямую связаны с основным механизмом действия препаратов данной группы, а именно с подавлением ЦОГ-1-зависимого синтеза простагландинов, т.е. являются класс-специфическими [2]. К этим побочным эффектам относятся поражение желудочно-кишечного тракта, нарушение агрегации тромбоцитов, функции
почек, негативное влияние на систему кровообращения. В связи с чем большой интерес вызывает применение симптоматических препаратов замедленного действия, обладающих высокой безопасностью и потенциальным структурно-модифицирующим действием, к которым относится диацереин (Диартрин®).
Данные препараты внесены в рекомендации Европейской лиги против ревматизма (European League Against Rheumatism, EULAR) [3], обновленные рекомендации Американского общества по изучению ОА (OARSI) 2010 г. по лечению ОА коленных и тазобедренных суставов [4], в алгоритм ведения больных ОА коленных суставов в реальной клинической практике, предложенный Европейским обществом по клиническим и экономическим аспектам остеопороза и ОА (European Society for Clinical and Economic Aspects of Osteoporosis, ESCEO) в 2014 г. [5], а также в клинические рекомендации Минздрава России, составленные при участии Ассоциации ревматологов России от 2016 г. [6] (см. рисунок). В них подчеркивается важность сочетания медикаментозных и немедикаментозных методов лечения. Большое значение придается образовательным программам, которые ориентируют пациентов прежде всего на изменение образа жизни, снижение избыточной массы тела (разгрузку суставов), занятие лечебной физкультурой, а также способствуют пониманию больным природы заболевания и механизмов различных методов лечения.
Назначение симптоматических препаратов замедленного действия рекомендовано всем больным сразу после установления диагноза первичного ОА. Так как эффект данной группы препаратов развивается не сразу, для купирования болевого синдрома рекомендуют применение симптоматических препаратов быстрого действия (парацетамол, местный или пероральный прием НПВП, внутрисуставное введение глюкокортикоидов). На последнем этапе консервативного лечения показано назначение слабых опиоидов или дулоксетина, при неэффективности которых решается вопрос о хирургическом лечении (эндо-протезирование сустава или отдельных его частей).
По современным представлениям, основной причиной прогрессирования ОА считается субклиническая воспалительная реакция, ключевым звеном которой является выработка макрофагами и фибробластами интерлейкина
Алгоритм ведения пациентов с ОА [6].
(ИЛ)-1а, стимулирующего синтез провоспалительных ци-токинов (ИЛ-6, фактор некроза опухоли а и др.), металло-протеиназ, простагландинов, окиси азота и активных форм кислорода. В многочисленных исследованиях была доказана способность диацереина ингибировать активность ИЛ-1, чем и объясняется его лечебный эффект при ОА.
Клиническая эффективность диацереина при ОА была показана в нескольких крупных исследованиях с высоким уровнем доказательности. Так, в двух работах при сравнении диацереина с плацебо О.РеПеИег и соавт. и К. Рауе1ка и соавт.) во всех группах активной терапии было достигнуто достоверное улучшение по сравнению с контролем, что позволило снизить потребность в анальгетической терапии [7, 8]. При сравнении диацереина с НПВП (пироксикам, диклофенак), было показано, что оба препарата обеспечили значимое снижение выраженности боли, однако эффект диацереина сохранялся и после отмены препарата [9, 10].
Высокая клиническая эффективность диацереина была отмечена и в реальной клинической практике (исследование DOK). Так, через 4 недели терапии боль по ВАШ снизилась в среднем на 21,8%, а к 12-й неделе - на 59,9% [11]. При этом, отмечалась довольно хорошая переносимость препарата - какие-либо НЯ были выявлены только у 5,4% пациентов. Структурно-модифицирующее действие диацереина было продемонстрировано в 3-летнем исследовании ECHODIAH [12]. Число больных с сужением суставной щели >0,5 мм было достоверно меньшим в группе активной терапии (50,7% и 60,4%, р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
10. Zheng W, Tang F, Li J et al. Evaluation of efficacy and safety of diacerein in knee osteo-arthritis in Chinese patients. Chin Med Sci J 2006; 21 (2): 75-80.
11. Sharma A, Rathod R, Baliga VP. An open prospective study on postmarketing evaluation of the efficacy and tolerability of diacerein in osteoarthritis of the knee (DOK). J Indian Med Assoc 2008; 106 (1): 54-6, 58.
12. Dougados M, Nguyen M, Berdah L et al. ECHODIAH Investigators Study Group. Evaluation of the structure-modifying effects of diacerein in hip osteoarthritis: ECHODIAH, a three-year, placebo-controlled trial. Evaluation of the chondromodulating effect of diacerein in oa of the hip. Arthritis Rheum 2001; 44 (11): 2539-47.
13. Assessment report for diacerein containing medicinal products. 28 August 2014 EMA/527347/2014.
14. Richette P, Doherty M, Pascual E et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017; 76: 29-42.
15. Shibagaki Y, Ohno I, Hosoya T, Kimura K. Safety, efficacy and renal effect of febuxostat in patients with moderate-to-severe kidney dysfunction. Hypertens Res 2014; 37 (10): 919-25.
16. Whelton A, MacDonald PA, Chefo S, Gunawardhana L. Preservation of renal function during gout treatment with febuxostat: a quantitative study. Postgrad Med 2013; 125 (1): 106-14.
17. Becker MA, Schumacher HR, Wortmann RL et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005; 353 (23): 2450-61.
18. Schumacher HR, Becker MA, Wortmann RL et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial. Arthritis Rheum 2008; 59 (11): 1540-8.
19. Wortmann RL, Becker MA, Schumacher HR et al. Effect of febuxostat or allopurinol on the clinical manifestations of gout: reduction in gout flares and tophus size over time in the EXCEL trial. ACR/ARHP Annual Scientific Meeting, 2006.
20. Becker MA, Schumacher HR, Espinoza LR et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial. Arthritis Res Ther 2010; 12 (2): R63.
21. Schumacher HR, Becker MA, Wortmann RL et al. The FOCUS trial 48-month interim analysis: long-term clinical outcomes of treatment with febuxostat in subjects with gout in an ongoing phase 2, openlabel extension study [abstract no. OP0130]. Ann Rheum Dis 2006; 65 (Suppl. II): 93.
Читайте также:


