Замещение связочных дефектов суставных поверхностей
- Артроскопия плечевого сустава
- Артроскопия коленного сустава
- Операции на голеностопном суставе
- Операции на стопе
- Артроскопия ключично-акромиального сочленения
- Артроскопия тазобедренного сустава
- Эндопротезирование крупных суставов
- Операции при переломах
Лечение дефектов хряща
Уважаемый пациент, в нашей Клинике мы освоили и широко применяем методику замещения поврежденного хряща костно – хрящевыми ауто (собственными) трансплантатами.
Эта операция показана в случаях выявления грубых дефектов хрящевого покрытия сустава, отсекающего остеохондрита нагружаемой суставной поверхности коленного сустава.
Дефекты хряща образуются в результате частой травматизации сустава, разрушением хрящевого покрытия разорванными частями менисков, внутрисуставными телами, в том числе на фоне нестабильности сустава, вследствие разрывов крестообразных, боковых связок. Причиной отсекающего остеохондрита является нарушение кровоснабжения участка кости, порытого хрящом, это микро переломы не диагностируемые рентгенологическим исследованием или образованием тромбов в питающих костную ткань артериях. К сожалению, предотвратить развитие этой патологии, в настоящее время, практически не представляется возможным. Ортопед, вооруженный рентгенологическим и МРТ исследованием, обнаруживает уже развернутую картину заболевания и определяет показания к операции костно – хрящевой аутопластике.
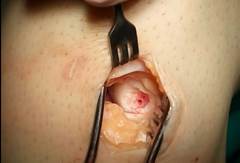
Артроскопический вид грубого дефекта хряща мыщелка бедренной кости, нагружаемой поверхности. Нижние слои хрящевого покрытия и прилежащей к нему кости хорошо иннервируется, поэтому каждый шаг пациента вызывает боль.

Схема операции: в не нагружаемой зоне сустава забираем трансплантат и устанавливаем его на место дефекта хряща.

Через разрезы длиной до 1,5 см под контролем артроскопа выполняем забор трансплантата фрезой, удаляем поврежденный участок.

Артроскопический вид места введения трансплантата

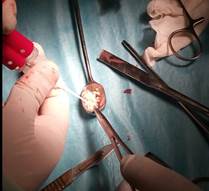
Вид костно – хрящевого транспланта

Два трансплантата введены в подготовленные каналы (на место участка повреждения хряща)

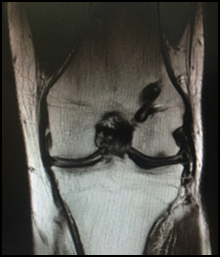
Результат операции через три года. Верхний снимок слева - дефект хряща. Нижний снимок справа – приживление трансплантата.
Пациент не нуждается в наблюдении и лечении травматологом – ортопедом, передвигается без боли.

Целью послеоперационного периода является создание условий, в которых трансплантат срастется с рецибиентным местом (местом пересадки). Для этого рекомендуем:
- ходить опорой на костыли, без нагрузки на оперированную ногу до шести недель;
- фиксировать сустав шарнирным брейсом до шести недель, первые две недели полное обездвиживание сустава, далее дозированные движения с использованием регулятора шарнира ортеза;
- прием пациентом препаратов: антикоагулянтов, дезагрегантов, венотоников
- проведение курсов физиотерапии
- регулярные, до пяти – шести раз в сутки занятия пациентом лечебной физкультурой.
Средние сроки нетрудоспособности: восемь – десять недель.

Повреждения хряща коленного сустава встречаются очень часто и не заживают самостоятельно. Считается, что у более половины пациентов, которым выполнялась артроскопия коленного сустава по поводу его повреждения, обнаруживается патология хряща разной степени выраженности, а повреждения 4 ст. по Оутербриджу встречаются у каждого 20 пациента младше 40 лет с травмой коленного сустава. Современные исследования позволяют констатировать факт увеличения площади хрящевых дефектов у пациентов с повреждением хряща и развития тяжелого артроза с течением времени. Конечно, эндопротезирование решает проблему полностью, но применимость метода у молодых пациентов вызывает споры в связи с недостаточно высокой выживаемостью современных конструкций. Так как сама возможность органотипичного восстановления суставного хряща на современном этапе развития медицины остается недоказанной, актуальность и значимость разработки и внедрения любых методов восполнения полнослойных дефектов хряща для возможности отсрочки эндопротезирования, не вызывают сомнений. Известно, что гиалиновый хрящ, локализуясь в хрящах носа, гортани, трахеи и бронхов, в реберных хрящах имеет схожее строение и отличается лишь соотношением хондроцитов и коллагеновых волокон [6,7,8].
Исходя из этого, мы предложили забирать хрящевой трансплантант из ребра в достаточном объёме с целью восполнения травматических дефектов хряща крупных суставов.
Цель исследования
Повышение эффективности лечения больных с посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствия дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, – к хрящевой части ребер.
Клинический материал и методы
В работе представлены результаты оперативного лечения 15 пациентов, в возрасте от 18 до 43 лет, мужчин 13, женщин 2, проходивших лечение в отделении травматологии и ортопедии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского в период с 2015 по 2016 год включительно. Основными жалобами были боль и нарушение функции коленного сустава.
Все пациенты имели травматический костно-хрящевой дефект III-IV степени по Оутербридж размерами от 2 до 3,5 см², локализовавшийся на одном из мыщелков бедра. Давность травмы составляла от 2 нед. до 6 мес. Диагноз устанавливался на основании МРТ и артроскопии.
В качестве оперативного лечения был применен разработанный нами новый способ замещения дефектов хрящевой ткани. На суставных поверхностях артроскопически визуализировали дефект, шейвером формировали границы дефекта, осуществляли дебриджмент. Следующим этапом выполняли забор реберного хряща. Для этого в реберной части на уровне 9 ребра продольным разрезом осуществляли доступ к перихондриуму, последний рассекался вдоль и распатором отводился в стороны. При помощи тонкого костного долота шириной 1 см производился забор хряща на всю толщину, размером 2 см. Перихондриум ушивали без установки дренажей. Далее выполняли миниартротомию, для открытого доступа к зоне дефекта хряща.
Полученный хрящ измельчали скальпелем в крошку до 0,1*0,1 мм. Заливали крошку фибриновым клеем Tissucol и погружали полученную смесь в зону дефекта, плотно прижимая импактором и удерживая до полного застывания. Для замещения дефекта необходима соответствующая консистенция клеево-хрящевой смеси, близкая по своим свойствам к пластилиновой массе. Для этого нами определены оптимально объёмные соотношения фибринового клея и хрящевой крошки. Она составляет 20-40% объёма клея и от 80-60% объёма хрящевой крошки соответственно. Смесь с соотношением меньшего, чем 20%, объёма клея является в конечном итоге непрочной структурой, так как частицы хрящевой крошки недостаточно связаны между собой, если объем клея составляет более 40%, смесь является слишком жидкой для замещения дефектов. Так как надежность фиксации аутотранспланта в ложе не вызывала сомнений, послеоперационную иммобилизацию конечности проводили не более 2 нед. Затем рекомендовали функциональное лечение, включающее пассивные и активные движения в суставе. Полную осевую нагрузку разрешали через 6 нед.
Результаты и обсуждение
Результаты оперативного лечения оценивались на основании данных МРТ и шкалы оценки KOOS в сроки от 3 до 11 мес. с момента операции. Всем пациенты проходили тест KOOS самостоятельно до и после проведенного лечения. Из исследования были исключены 3 пациента как недоступные для оценки результата в послеоперационном периоде. Таким образом были обработаны данные МРТ и шкалы оценки у 12 пациентов.
На контрольных МРТ у всех обследованных пациентов были признаки заполнения хрящевого дефекта и восстановления субхондральной кости.
До операции оценка по шкале KOOS составила по разделам: симптомы 42 %, боль 70.5 %, ограничение активности в повседневной жизни от 52 %, функционирование сустава при занятиях спортом и активном отдыхе от 5 %, общее качество жизни от 18.75 %, общий итог 40 %.
После оперативного лечения по предложенной методике: симптомы от 75% до 100%, боль от 58% до 97%, ограничение активности в повседневной жизни от 82% до 100%, функционирование сустава при занятиях спортом от 30 % до 90%, общее качество жизни от 43,75% до 87,5%, общий итог от 66% до 97%.
Пациент Х. (31 год) поступил с жалобами на боль, ощущение нестабильности в левом коленном суставе, ограничивающее повседневную активность Со слов пациента производственная травма во время соревнований по пятиборью спасателей. Диагностирован разрыв передней крестообразной связки левого коленного сустава, повреждение хряща. Протокол МРТ: разрыв передней крестообразной связки левого коленного сустава. Травматическая отслойка хряща суставной поверхности медиального мыщелка бедра. Большое количество жидкости в полости сустава
Выполнена артроскопическая пластика передней крестообразной связки материалом из сухожилий изящной и полусухожильной мышц.
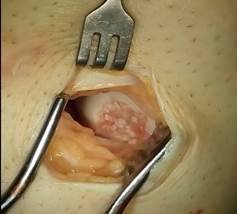
Осуществили с помощью предлагаемого способа замещение дефекта хряща медиального мыщелка бедренной кости (фиг. 1,3) измельченным аутохрящом ребра смешанным с фибриновым клеем (фиг. 2), пропорции смеси для замещения дефекта составили 35 % фибринового клея и 65% хрящевой крошки, объем смеси составил 3 см³.
Через 4,5 месяца после операции – протокол МРТ: структура и интенсивность мр-сигнала от хрящевой поверхности, покрывающей суставную поверхность мыщелков, незначительно нарушена, равномерной толщины. Зона отслойки хряща полностью восстановлена (Фиг.4). Пациент передвигается с полной нагрузкой на оперированную конечность, объём движений в оперированном суставе полный, боли нет.
Таким образом, результаты наблюдений показали, что данный способ позволяет успешно и малотравматично восстанавливать поврежденную хрящевую ткань.
фиг. 1
фиг. 2
фиг.3
фиг.4
В результате травм или заболеваний повреждается суставной хрящ, но он обладает очень ограниченной способностью к регенерации. В этой зоне отсутствует васкуляризация и, как следствие, клетки крови и костного мозга, а также хондроциты не могут мигрировать в место дефекта. Поэтому в случае изолированного поражения хряща регенерация выражена слабо. При остеохондральных дефектах происходит повреждение суставного хряща и подлежащей субхондральной кости, вызывающее разрыв кровеносных сосудов и создающее сообщение дефекта с костным мозгом. В этом случае запускается процесс регенерации, начинающийся с образования гематомы, формирующейся из поврежденных кровеносных сосудов или костного мозга. Фибриновая сеть гематомы задерживает тромбоциты, выделяющие, различные биоактивные факторы, стимулирующие в свою очередь, сосудистую инвазию и миграцию недифференцированных мезенхимальных клеток в гематому, постепенно преобразующуюся в фибриновый сгусток. В течение нескольких дней после травмы мезенхимальные клетки размножаются и могут дифференцироваться в хондроциты, синтезирующие коллагеновый матрикс. Получающийся регенерат плохо организован и содержит преимущественно коллаген первого типа [1,7,8].
Независимо от генеза, при отсутствии лечения повреждённого гиалинового хряща, обладающего ограниченной способностью к регенерации, в коленном суставе могут возникать распространённые дегенеративные изменения [7].
Множественные дискуссии и усилия хирургов в сфере восстановления суставного хряща приводят к внедрению широкого спектра хирургических вмешательств. В настоящее время существует три парадигмы пластики хрящевых дефектов. Первая подразумевает стимуляцию развития волокнистой соединительной ткани на месте дефекта в результате вскрытия костных каналов и миграции фибробластов. Вторая предполагает трансплантатацию ауто- или аллогенного хряща с субхондральной костной платиной и подлежащей костью из ненагружаемых участков коленного сустава или от трупа (мозаичная хондропластика). В третьем подходе используются аутокультуры хондроцитов, которые фиксируются к месту дефекта различными коллагеновыми мембранами и гидрогелями. Предложены модификации первого способа, при которых применяются синтетические спейсеры дефекта, в которые из вскрытых костных каналов мигрируют полипотентные клетки (ChondroGuide). Cтруктура и состав спейсеров способствует их дифференциации в хондроциты [3,4,5].
Установлено, что при артропластике в случае наличия дефектов суставных поверхностей воспалительного, травматического или дегенеративного происхождения необходимо их закрывать материалами, изолирующими обнаженную (лишенную хрящевого покрова) кость от полости сустава таким образом, чтобы были возможны свободные движения и скольжение сочленяющихся суставных концов, что лучше всего обеспечивается свойствами нативного гиалинового хряща или способствующими его восстановлению прокладками интерпозиционной артропластикой [2,3]. Предложено более 50 видов прокладок для интерпозиционной артропластики, но ни одна из них не дает искомого результата.
Положительный результат предложенного нами способа достигается тем, что для замещения дефектов хрящевой ткани используется имплантация измельченного аутологичного хряща, смешанного с фибриновым клеем. Трансплантат забирается с хрящевой части ребра практически в любом требуемом объеме, а пропорции смеси для замещения дефекта составляют 20-40 % фибринового клея и 60-80% хрящевой крошки, что позволяет обеспечить нужную консистенцию и прочность фиксации.
Заключение
Таким образом, предлагаемый способ замещения дефектов хрящевой ткани позволяет рассматриваться как эффективный метод оперативного лечения больных с деструктивно-дистрофическими и посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствие дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, – к хрящевой части ребер.
Регенерация хрящевой ткани возможна лишь в очень незначительных пределах, и в настоящее время ученые и медики активно работают над этой проблемой. Сейчас пациентам с патологиями хряща могут предложить такие методы лечения, как туннелизация, хондропластика, артропластика и микрофрактурирование. К последним разработкам относится замещение разрушенных участков хряща собственными хондроцитами. Если ведущиеся сегодня разработки окажутся успешными, то в будущем количество операций эндопротезирования суставов может значительно сократиться.
Вырастить хрящевую ткань отдельно от организма, а затем трансплантировать ее – это достаточно дорогое мероприятие. Такого рода проблемами занимается генная и тканевая инженерия. Кстати, пересадка хряща сегодня благодаря артроскопии возможна без значительной травматизации сустава и окружающих тканей.
Традиционное хирургическое лечение
Еще до недавнего времени работоспособность возвращали с помощью лаважа (промывание) и более продуктивного дебридмента (санация и обработка) поверхности сустава. Как только артроскопы внедрили в широкую хирургическую практику, эти два метода активно помогали избавляться от свободных тел и других патологических тканей внутри коленных, локтевых и других суставов. Эти процедуры были весьма эффективны, улучшения после их применения отмечали примерно 2/3 пациентов; однако через три года многие из прооперированных пациентов начинали жаловаться на прежние проблемы. Некоторые болезни с помощью дебридмента и лаважа лечить вообще невозможно (например, остеохондроз с полным обнажением кости).
Позднее поврежденную патологическими процессами хрящевую ткань предложили замещать фибрином. Для этого оставшуюся хрящевую ткань счищали, затем следовала туннелизация и микрофрактурирование костной ткани. Кость сверлили артроскопическим буром, пока не появлялось петехиальное кровотечение. Таких отверстий делалось множество. Из них на поверхность выходил костный мозг, из которого формировался фиброзный сгусток. Ту же операцию проводили и другим образом, рассверливая кость микроперфоратором до появления микропереломов. В итоге поверхность кости покрывал волокнистый хрящ либо фиброзная ткань.
Недостатком данного метода является тот факт, что фиброзная ткань не была такой же прочной, как гиалиновый хрящ, поэтому она быстро изнашивалась. Кроме этого, у многих больных сохранялись болевые ощущения. Приемлемые результаты наблюдались преимущественно у молодых больных, которые постоянно занимались разработкой коленного сустава.
Биологические методы, которые задействуют собственные ресурсы организма
С начала 90-ых годов XX столетия специалисты стали пересаживать в коленный сустав хрящ из реберной области. Трансплантат фиксировался фибриновым клеем. Контрольные тесты через год показали, что дефект закрывался почти полностью, больные переставали жаловаться на дискомфорт. Но долговременные исследования позволили установить, что такой пересаженный хрящ может подвергаться энхондральной оссификации.
Взятие трансплантата из районов с интактным хрящом. В этом случае хрящевая ткань бралась из мыщелка бедренной кости. Такая методика хорошо зарекомендовала себя в тех случаях, когда размер трансплантата не превышал 2 сантиметров. Но долговременных исследований результатов такого рода операций не проводилось.
Трансплантация собственных хондроцитов. Этот метод придумали еще в конце 80-х годов, он применяется только на коленном суставе. Нужно изъять неповрежденный хрящ из мыщелка бедра, количество биоптата невелико: всего 200 - 300 миллиграммов. Затем полученная ткань в течение двух или трех недель культивируется в специальных лабораторных условиях. Спустя это время количество хондроцитов вырастает в 10 -12 раз. Чтобы пересадить их в проблемную область, потребуется повторная артротомия. Перед этим хрящевой дефект следует подготовить, то есть убрать все лишнее и обнажить субхондральную кость.
Затем из области голени изымается небольшой фрагмент большеберцовой кости, и эту надкостницу пришивают к поврежденному хрящу. Шов закрывается фибриновым клеем, в нем остается лишь небольшое отверстие, куда вставят катетер. По нему вводят хондроциты в район дефекта, после чего катетер изымают и отверстие заливают фибриновым клеем.

Внутри коленного сустава есть хрящи. Они покрывают суставные поверхности костей: бедренной и большеберцовой. Хрящи смягчают трение. Они обеспечивают сохранность внутрисуставных структур даже на фоне интенсивных физических нагрузок. К сожалению, в силу различных заболеваний возможно истончение или механическое повреждение хрящей. В этом случае пациенту требуется лечение.

Принципы лечения
Подходы к лечению зависят от того, по какой именно причине истончился хрящ. Это может произойти в результате:
- воспалительных заболеваний;
- дегенеративных процессов;
- травм;
- проведенных хирургических операций.
Лечение может быть направлено на устранение симптомов, замедление дегенеративных процессов, купирование воспаления, усиление регенераторных способностей хрящевой ткани. Иногда требуется хирургическое вмешательство. Оно позволяет выполнить замещение дефектов хрящевой поверхности.
Консервативные методы
Если гиалиновый хрящ коленного сустава истончен, лечение начинают консервативными методами. Применяются такие способы терапевтического воздействия:
- Коррекция образа жизни.
- Физиотерапевтическое лечение и массаж.
- Лечебная физкультура.
- Медикаментозная терапия.
Коррекция образа жизни
Изначально необходимо устранить все факторы, которые могут провоцировать истончение хряща коленного сустава. Лечение начинают с того, что пациенту рекомендуют отказаться от тяжелой физической работы, спорта. Потому что при продолжающемся механическом раздражении хряща он будет повреждаться, а полноценное восстановление хрящевой ткани невозможно по причине его слабого кровоснабжения.
Пациенту необходимо:
- снижение массы тела, если ИМТ превышает 25 кг/м2;
- уменьшение нагрузки на больную ногу;
- применение ортопедических приспособлений (ортезов, стелек);
- использование трости или костылей.
Физиотерапия
Физиотерапевтическое лечение применяется с целью уменьшения отека, боли. Оно позволяет улучшить кровообращение в той зоне тела, которая находится в непосредственной близости к поврежденным коленным хрящам. В результате улучшается трофика тканей, уменьшаются явления гипоксии, ускоряются регенераторные процессы.
Применяются такие виды физиолечения:
- электрофорез;
- гальванизация;
- фонофорез;
- электростимуляция;
- магнитотерапия;
- лазеротерапия;
- вибромассаж и другие.
Физиотерапия часто сочетается с медикаментозным лечением. Местные препараты наносятся на кожу. Затем проводится электрофорез или фонофорез для их лучшего проникновения внутрь суставной полости.

Лечебная физкультура
Физические тренировки помогают укрепить мышцы, разгрузить коленный сустав. Они также способствуют восстановлению хряща за счет улучшения кровообращения. При нагрузке к мышце приливает кровь. Расширяются сосуды. Поэтому кровоснабжение суставной капсулы возрастает. Улучшается и кровенаполнение тех частей хряща, которые прилегают к капсуле.
Медикаментозная терапия
Применение препаратов остается одним из главных способов лечения. В данный момент не существует лекарственных средств, которые гарантированно восстанавливают хрящи или хотя бы предотвращают их дальнейшее разрушение. Однако ряд лекарственных средств позволяют добиться неплохих результатов за счет усиления регенераторных процессов, снижения воспаления, защиты хряща от сильных механических воздействий.
Препараты могут использоваться такими способами:
- применяются внутрь;
- вводятся внутримышечно или внутривенно;
- наносятся на кожу над коленным суставом;
- вводятся инъекционно внутрь сустава.
Так как в большинстве случаев происходит постепенное разрушение хряща коленного сустава, лечение проводится таблетированными формами препаратов. Они удобнее в использовании и не требуют постоянного участия медицинского персонала в лечебном процессе.
Часто применяются и внутрисуставные инъекции. Они хороши тем, что позволяют после нескольких введений лекарств получить устойчивый длительный результат. Он сохраняется полгода или год. Применение уколов в колено позволяет снизить потребность в медицинских препаратах, которые применяются перорально. Соответственно, уменьшается медикаментозная нагрузка и риск побочных эффектов.
Кремы и гели – это вспомогательное лечение. Оно исключительно симптоматическое. Используется для уменьшения боли, устранения отека. Нет местных препаратов, которые могли бы восстановить суставные хрящи колена или хотя бы замедлить их дегенерацию.

НПВС. Эти препараты не могут восстановить хрящи. Но они способны в некоторых случаях замедлить их дегенерацию за счет устранения воспалительного процесса. Кроме того, нестероидные противовоспалительные средства принимаются с целью снижения болевого синдрома, который неизбежно развивается в случае истончения хрящей из-за сильного трения суставных поверхностей во время выполнения любых движений в коленном суставе.
Хондропротекторы. Это препараты хондроитина и глюкозамина. Их получают из хрящей животных. Хондропротекторы вводятся внутрь сустава, инъекционно внутримышечно, наносят на кожу или принимают внутрь.
Только последний способ применения имеет смысл с точки зрения доказательной медицины. Нанесение хондропротекторов на кожу в виде геля не имеет доказанной эффективности. Введение в сустав или внутримышечно приносит пользу, но лечение нужно длительное (от 6 месяцев), а при таком способе введения переносимость терапии значительно ухудшается.
Несмотря на то, что врачи очень часто назначают хондропротекторы внутрь в капсулах, нет доказательств, что они восстанавливают суставной хрящ. Исследования лишь показывают, что при артрозе коленного сустава длительное применение хондроитина в комбинации с глюкозамином позволяет уменьшить симптомы заболевания.
Гиалуронат. Вводится внутрь коленного сустава. Подобные препараты также выпускаются в лекарственных формах для наружного использования или для применения внутрь. Однако такие способы лечения не имеют убедительных доказательств эффективности. Поэтому гиалуронат в таблетках в основном продается как биологически-активные добавки, а не препараты.
Введение гиалуроновой кислоты внутрь сустава позволяет повысить её концентрацию в синовиальной жидкости. Уменьшается трение хрящей, предотвращается их дистрофия. Симптомы уменьшаются или уходят на несколько месяцев. После этого инъекцию гиалуроната можно выполнить повторно.
PRP. Этой аббревиатурой обозначают богатую тромбоцитами плазму. Её получают из собственной крови пациента, центрифугируют, а затем вводят в сустав. Это один из самых эффективных способов усиления регенерации хрящей. Тромбоциты выделяют большое количество факторов роста. В результате репарация хрящевой ткани усиливается. Но восстановление хрящей колена возможно только в случае ранней стадии артроза или при незначительном их травматическом повреждении.

Хирургические методы
При значительных дефектах суставной поверхности восстановление хрящевой ткани возможно только хирургическими методами. Для этого используется множество различных методов. Некоторые из них очень дорого стоят и доступны только за границей (Германия, Швейцария, США). Одни способы появились недавно, другие применяются уже более 50 лет.
Наибольшую эффективность хирургические методы восстановления хряща имеют при:
- рассекающем остеохондрите;
- травматическом повреждении колена;
- остеоартрозе до 2 степени.
При других заболеваниях, а также в случае выраженного гонартроза полноценно восстановить хрящевые поверхности часто не удается.
Основные хирургические методы восстановления гиалинового хряща коленного сустава:
Субхондральная туннелизация. Врач просверливает в нескольких местах хрящ и субхондральную костную ткань. Открывается кровотечение. Результатом становится образование на месте искусственно нанесенной травмы волокнистого хряща.
Микрофрактурирование. Усовершенствованная методика, которая постепенно вытесняет туннелизацию. Механизм воздействия аналогичный. Формируются множественные микропереломы субхондральной кости с сохранением её каркаса. Методика более безопасна, потому что исключаются ожоговые повреждения хрящей, неизбежные при сверлении.
Аутотрансплантация хряща. Применяется для закрытия тех дефектов суставной поверхности, которые подвергаются максимальным механическим нагрузкам. Здесь хрящи имеют наибольшую толщину. Для аутотрансплантации берутся хрящи с другого участка тела пациента и подсаживаются в коленный сустав. Недостатками метода является дополнительная травматизация донорских участков и недостаток материала при обширных хрящевых дефектах.
Имплантация аутологичных хондроцитов. Берут маленький фрагмент хряща, затем культивируют. Фактически, для пациента выращивается новый хрящ. Его закрепляют на матрице, придавая нужную форму, и имплантируют в сустав. Метод максимально эффективен у пациентов до 55 лет, при дефекте хрящевой поверхности до 10 квадратных сантиметров. Недостатки: высокая стоимость и необходимость проведения двух операций (для забора хряща, а затем для его имплантации в колено).
При появлении признаков повреждения суставных хрящей человек должен обращаться к врачу как можно быстрее. Есть немало способов восстановления суставных поверхностей колена, однако большинство из них становятся малоэффективными в запущенных клинических случаях.
Читайте также:


