Воспалительный процесс при грыжах диска

Позвоночный столб поддерживает равновесие всего тела при ходьбе, поэтому он должен быть прочным, но вместе с тем гибким и подвижным. В движении участвуют 24 позвоночных сегмента, между ними 23 хрящевые прослойки — межпозвоночные диски. Межпозвоночный диск — своего рода подушка безопасности для позвонков. Он нужен, чтобы плотно скреплять позвонки между собой, обеспечивать их подвижность и амортизацию (смягчать удары, гасить колебания). Межпозвоночный диск можно представить в виде плоской капсулы с гелеобразным содержимым. Он состоит из нескольких элементов.
- Пульпозное ядро студенистой консистенции, состоящее из молекул гликозаминогликанов (легко отдают и забирают воду). Отвечает за амортизацию.
- Фиброзное кольцо вокруг ядра удерживает гель внутри и плотно сращивается с соседними позвонками.
- Гиалиновые пластинки покрывают диск сверху и снизу, участвуют в диффузном транспорте воды, питательных веществ и выведении продуктов обмена.
- Замыкательные пластинки жестко срастаются с телами соседних позвонков.
Грыжа межпозвоночного диска — это выпячивание пульпозного ядра за пределы межпозвонкового дискового пространства. Она возникает, когда фиброзное кольцо вокруг ядра разрушается
Организм — целостная система, в нём ничего не происходит само собой. Межпозвонковая грыжа возникает по ряду серьезных причин:
- Нарушение питания тканей диска (дистрофия). Поскольку питание диска происходит диффузно, немаловажную роль в этом процессе играет двигательная активность человека. Если ее нет, диск страдает.
- Врожденный дефект диска (дисплазия).
- Травматическое воздействие.
- Возрастная дегенерация (старение).
- Мышечный дисбаланс.
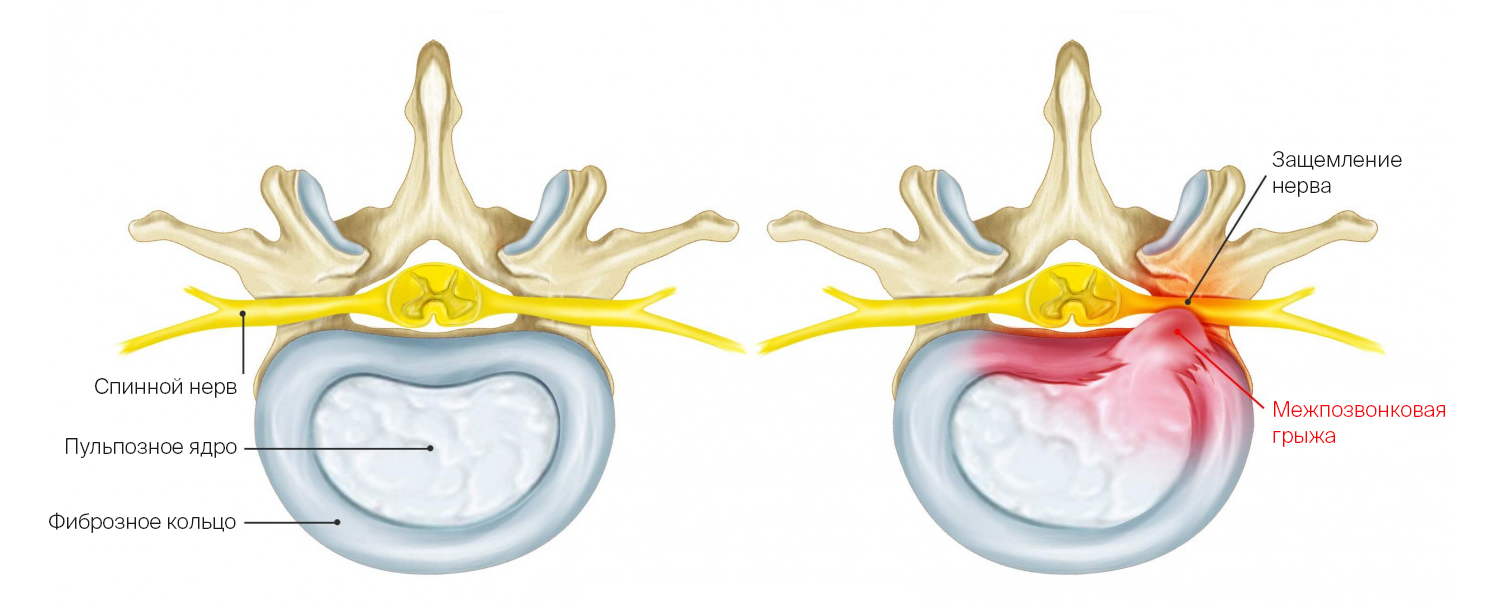
Здоровый межпозвоночный диск и диск с грыжей
Классификация грыжи межпозвонкового диска основана на анатомическом расположении. В ней используются сокращенные латинские названия отделов позвоночного столба и порядковый номер позвонка в этом отделе:
- Шейный отдел (Pars cervicalis): позвонки CI — CVII. Частая причина боли в шее, плечах, верхних конечностей.
- Грудной отдел (Pars thoracalis): позвонки TI — TXII. Грыжа диска в данной локализации достаточно редка, что связано с меньшей подвижностью, а соответственно меньшим износом межпозвонковых дисков.
- Поясничный отдел (Pars lumbalis): позвонки LI — LV. Поясница — наиболее перегруженный отдел с позиции не только общей вертикальной нагрузки, но и наклонных движений. Здесь наиболее часты грыжи дисков.
- Крестцовый отдел (Os sacrum): позвонки SI — SV. Наиболее часто встречаются грыжи на границе поясничного и крестцового отделов позвоночника.
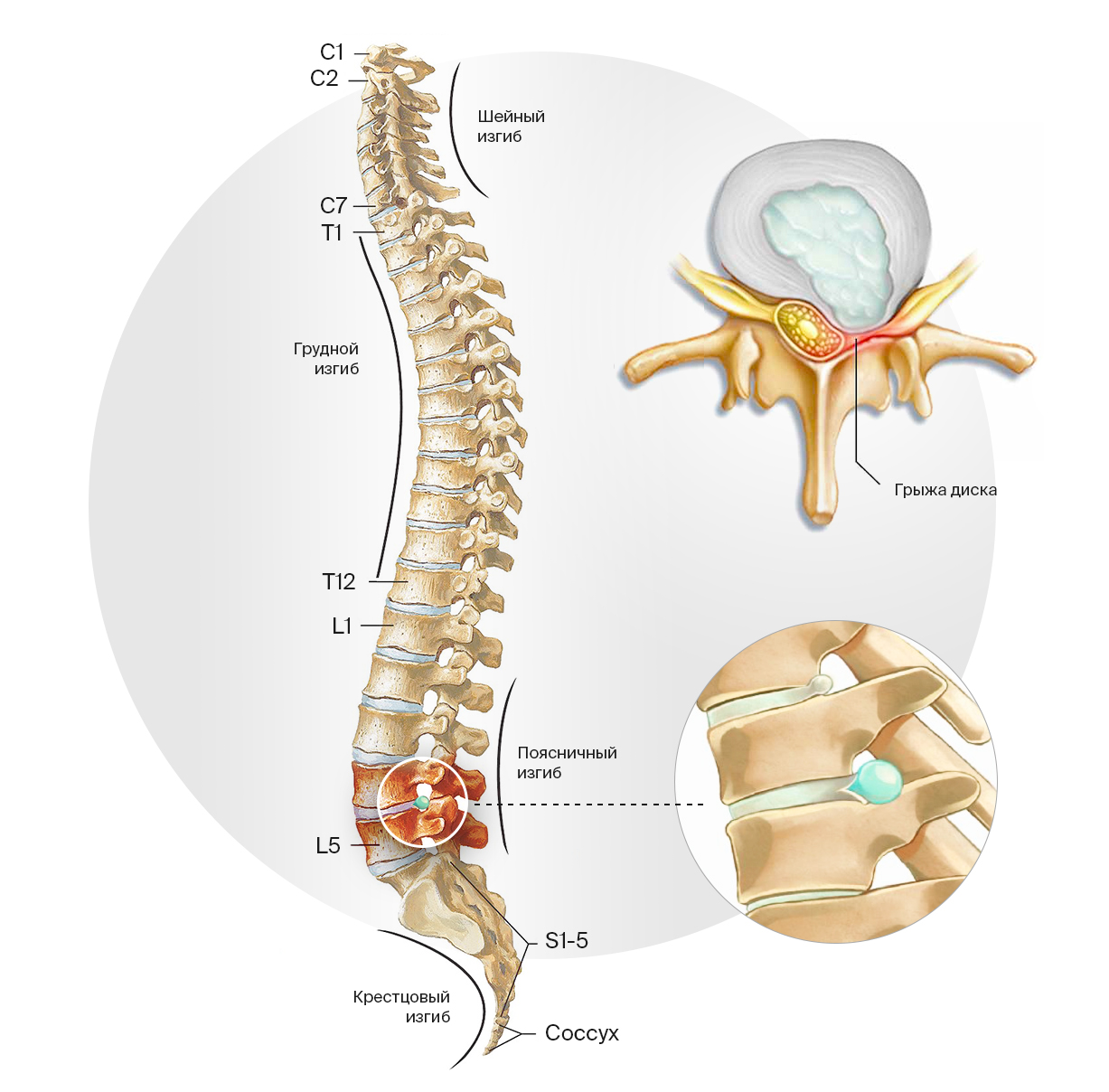
Локализация грыж межпозвонкового диска. Наиболее часто они возникают в позвонках LI — LV
Для визуализации патологических тканей в случае с грыжей позвоночника используют два основных метода — компьютерную томографию и магнитно-резонансную томографию. Компьютерная томография (КТ). В данном методе также используется принцип рентгенографии, но с помощью компьютерной обработки можно получить серию снимков продольных и поперечных срезов, на которых можно увидеть костную и хрящевую ткани. Разглядеть нервные волокна и мягкие ткани не получится.
Миелография. Для повышения информативности КТ в спинномозговой канал вводится контрастное вещество. Позволяет увидеть на срезах то, что не различимо при классической компьютерной томографии.
Контрастная дискография. Контрастное вещество, в отличие от миелографии, вводится непосредственно в межпозвоночный диск.
Электронейромиография. Это исследование может быть назначено в качестве дополнительного, для измерения проводимости импульса в нервных волокнах.

Все диагностические методы не имеют ценности без осмотра пациента специалистом. Важен не только снимок, но и опрос пациента, поскольку грыжа может быть значительных размеров, а дискомфорта не вызывать. Или, наоборот, очень маленькая грыжа межпозвонкового диска вызывать сильный болевой синдром.
Врачи клиники Ткачева-Епифанова проводят очные и дистанционные консультации. Они оценивают снимки МРТ и опрашивают пациента. Предварительная консультация — бесплатная.


Лечение грыжи позвоночника — сложный и долгий процесс. Патология развивалась длительное время, невозможно все обратить вспять за одно посещение врача. Все варианты лечения межпозвонковых грыж можно свести к двум: безоперационному и хирургическому. Начнём с безоперационного. Ученые давно подметили, что в большом количестве случаев грыжа позвоночника с течением времени уменьшается вплоть до полного исчезновения. Этот процесс называется спонтанной резорбцией, то есть рассасыванием грыжи межпозвонкового диска. Рассасывание грыжи происходит благодаря воспалению. Иммунные клетки крови макрофаги поглощают пораженные участки межпозвонкового диска и после этого приступают к ликвидации очага воспаления. Процесс резорбции еще не изучен до конца. Но врачам известно, как создать благоприятные условия для самовосстановления тканей диска позвоночника. Это позволяет лечиться без операций.

Резорбция — это естественное рассасывание грыжи межпозвонкового диска, которое происходит благодаря воспалительному процессу. Один из способов запуска резорбции — метод Ткачева-Епифанова.
Физиотерапия — это обобщенное понятие. Лечение основано на естественных и искусственно воссозданных физических факторах (холод, тепло, электрический ток, магнитное излучение, лазер и др.). Проводят такое лечение врачи и младший медицинский персонал разных специальностей: мануальный терапевт, остеопат, массажист, иглорефлексотерапевт, инструктор ЛФК и др. В физиолечении могут использоваться специальные аппараты, приспособления, ручные методики.
Кинезитерапия (терапия движением): активная (ЛФК) и пассивная (массаж, вытяжение). Терапия движением подбирается с учетом индивидуальных особенностей пациента и призвана укрепить мышечный каркас спины. Вытяжение позволяет снять боль и напряжение мышц.
Мануальная терапия и массаж — методы воздействия на мягкие ткани, суставы с целью восстановления равновесия в теле и синхронизации процессов. Возвращают подвижность и устраняют боль.
Тейпирование, кинезитейпирование — метод установления специальных пластырей на кожу в местах, где необходимо воздействовать на рецепторы растяжения и сжатия мышц. Способ расслабления или усиления тонуса мышц.
Лазеротерапия (лечение светом) — биологическая активация процессов регенерации.
Плазмотерапия (prp-терапия) — инъекции собственной очищенной плазмы, богатой тромбоцитами, факторами роста, гормонами. Повышается местный иммунитет, запускаются процессы регенерации.
Рефлексотерапия, Иглорефлексотерапия, акупунктура (лечение биологической энергией) — стимуляция специальными иглами нервных окончаний. Таким способом возможно введение микродоз лекарственных препаратов. Улучшается обмен веществ пораженных участков, пациент избавляется от боли.
Ударно-волновая терапия использует крайне высокочастотные волны, что вызывает резонанс. Позволяет запустить процессы самовосстановления.
Также используются ортопедические приспособления: стельки, ортезы. Они способны частично компенсировать нагрузку на позвоночник.
В любом лечении принципиальное значение имеет специалист. Важен опыт и интуиция, ведь каждый случай индивидуален: подход к лечению одного пациента может не подойти и даже навредить другому. Одна из клиник, где работают врачи с большим опытом лечения межпозвонковых грыж, — клиника Ткачева-Епифанова.В клинике применяется уникальный метод лечения грыжи. Это составной курс, который стимулирует резорбцию грыжи и приводит к полному избавлению от боли и дискомфортных ощущений. В клинике прошли лечение более 1200 пациентов. О результатах можно узнать из разделов Клинические случаи и Отзывы пациентов. Здесь приведём отзыв врача общей практики Филиппа Кузьменко, ведущего популярные группы о здоровье в социальных сетях.

В настоящее время грыжа позвоночника поясничного отдела диагностируется даже у молодых людей в возрасте 20 – 25 лет. Это связано с тем, что молодое поколение ведет малоподвижный образ жизни с отсутствием регулярных физических нагрузок на поясничные мышцы. Межпозвоночная грыжа поясничного отдела является осложнением длительно протекающего пояснично-крестцового остеохондроза. Это дегенеративное дистрофическое заболевание начинается в возрасте 18 – 20 лет и постепенно приводит к тому, что фиброзное кольцо диска полностью разрушается. Находящееся внутри него пульпозное ядро выходит наружу. Это и есть грыжа диска поясничного отдела позвоночника, которая провоцирует постоянное воспаление, раздражение окружающих тканей, развитие ишемии корешковых нервов и кровеносных сосудов.
Все эти дегенеративные дистрофические изменения приводят к тому, что постепенно начинает разрушаться соседний диск. Компрессия корешковых нервов и их ответвлений провоцирует нарушение иннервации внутренних органов полости малого таза и живота. Начинаются запоры, диареи, гиперфункция мочевого пузыря, эректильная дисфункция у мужчин, бесплодие или ранний климакс у женщин, варикозное расширение вен нижних конечностей, геморрой и т.д. Все эти осложнения запущенного остеохондроза, при котором сформировалась грыжа межпозвоночного диска поясничного отдела, можно исключить, если проводить раннее комплексное лечение.
В настоящее время разработаны методики, позволяющие лечить грыжу диска без хирургической операции. Это мануальная терапия в сочетании с лечебной гимнастикой, кинезиотерапией, тракционным вытяжением позвоночного столба, иглоукалыванием и т.д. Единственная ситуация, когда невозможно помочь пациенту без хирургической операции – это секвестрирование грыжевого выпячивания – отрыв части пульпозного ядра или полный его выход из фиброзного кольца и скольжение вдоль позвоночного столба. При таком состоянии облегчить состояние пациента сможет только хирургическая операция.
Своевременное обращение к врачу при развитии позвоночной грыжи позволяет проводить лечение консервативными методами. При появлении боли в области поясницы не игнорируйте её, обратитесь к врачу и пройдите полноценное обследование. С помощью рентгенографического снимка и МРТ обследования можно поставить точный диагноз.
Причины межпозвонковой грыжи поясничного отдела позвоночника
Межпозвонковая грыжа поясничного отдела является осложнением остеохондроза. Это дегенеративное дистрофическое заболевание постепенно разрушает фиброзное кольцо межпозвоночного диска. Оно утрачивает свою эластичность и прочность, обезвоживается. Затем на его поверхности начинают появляться отложения солей кальция. Это препятствует нормальному процессу диффузного питания межпозвоночного диска. Следующая стадия остеохондроза – это протрузия. При неё фиброзное кольцо забирает часть жидкости из пульпозного ядра, которое расположено внутри него. Пульпозное ядро утрачивает свою массу и амортизационную способность. При этом межпозвоночный диск утрачивает свою физиологическую высоту и увеличивается по площади. Начинается компрессионное давление на окружающие мягкие ткани. Начинается процесс компрессии корешковых нервов и их ответвлений. Это негативно сказывается на иннервации некоторых частей тела. Могут страдать функции внутренних органов брюшной полости и малого таза.
Следующий этап развития дегенеративного дистрофического заболевания позвоночного столба – экструзия. На этом этапе фиброзное кольцо уже полностью обезвожено. Оно трескается и на его поверхности формируются остеофиты. При значительной физической нагрузке, например, при подъеме тяжести или скручивании туловища происходит нарушение целостности фиброзного кольца. Образуется сквозная трещина, но в таком месте, где выход пульпозного ядра сдерживается расположенной рядом продольной или короткой желтой связкой.
Межпозвонковая грыжа поясничного отдела позвоночника формируется под влиянием следующих патогенных причин:
- ведение малоподвижного образа жизни с отсутствием регулярных физических нагрузок на мышечный корсет спины и преимущественно сидячей работой;
- наличие избыточного веса, связанного с недостатком физической активности или алиментарный тип ожирения;
- тяжелый физический труд с большими нагрузками на спину (грузчики, строители, маляры, отделочники, штукатуры, спортсмены тяжелоатлеты);
- травмы спины, такие как компрессионный перелом тела позвонка, трещина остистого отростка, вывих или подвывих, растяжение или разрыв связочного и сухожильного аппарата, ушибы с образованием гематом и т.д.;
- инфекционные поражения тканей позвоночника и расположенных рядом мышц (туберкулёз, сифилис, полиомиелит);
- нарушение процессов кровоснабжения, например, на фоне острой или хронической сердечно-сосудистой недостаточности;
- неправильная постановка стопы с последующим искривлением голеней и бедер, что влечет за собой неравномерное распределение амортизационной нагрузки по позвоночному столбу;
- деформирующий остеоартроз тазобедренного, коленного или голеностопного сустава;
- дистрофия мышечного волокна в области ягодиц, бедра, голени и поясницы;
- разрушение крестцово-подвздошных сочленений костей и симфизит у женщин;
- нарушение осанки (сутулость, сглаживание естественных кифозов и лордозов, сколиоз);
- болезнь Бехтерева, системная красная волчанка, склеродермия и другие ревматоидные процессы;
- нарушение правил эргономики рабочего пространства и спальной зоны (такое расположение тела в статическом напряжении, при котором нарушается процесс диффузного питания межпозвоночных дисков);
- врожденные патологии;
- дисплазия хрящевой ткани системного характера;
- недостаточность в рационе питания некоторых нутриентов и микроэлементов;
- остеомаляция и остеопороз, особенно развивающиеся на фоне гормональной дисфункции в период климактерической менопаузы у женщин.
Это далеко не полный перечень причин развития межпозвоночной грыжи диска в пояснично-крестцовом отделе позвоночника. В ряде случаев остеохондроз является идиопатическим заболеванием с неуточненной причиной. В половине случаев виной становятся возрастные дегенеративные процессы в организме человека.
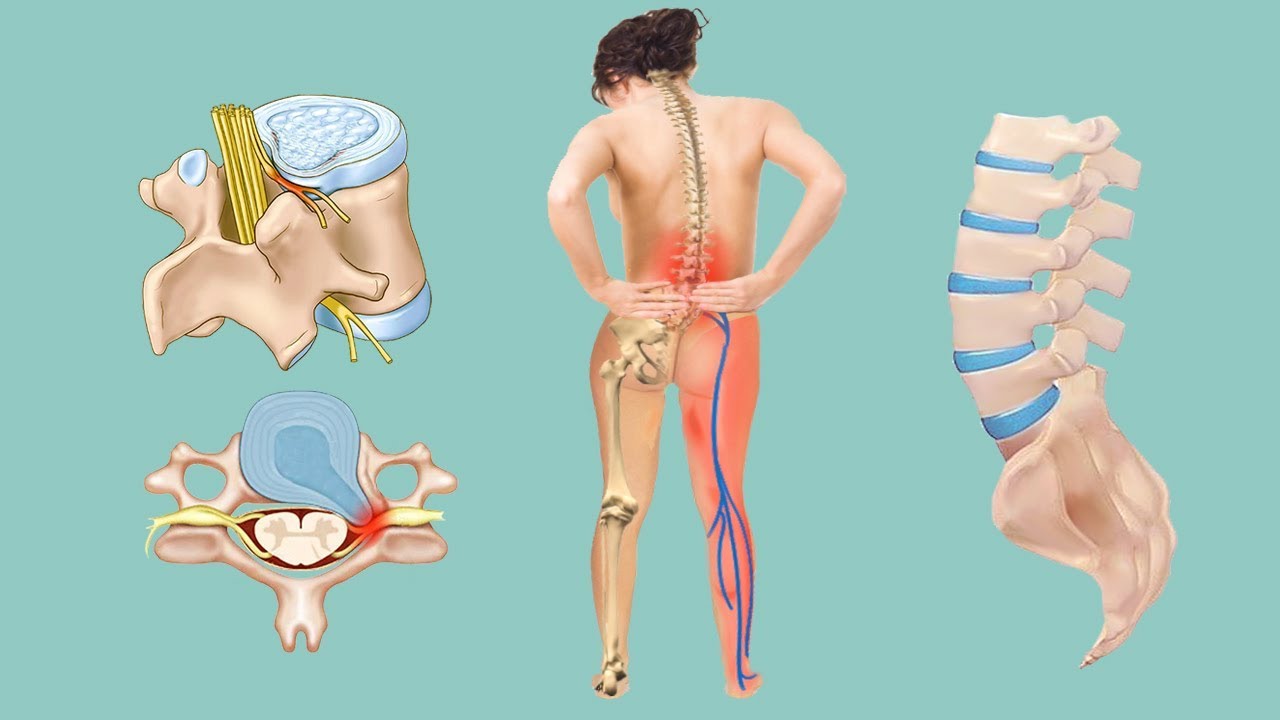
Клинические симптомы межпозвоночной грыжи поясничного отдела
Первые симптомы грыжи поясничного отдела распознать совсем не сложно. Обычно она появляется у пациентов с хроническим дегенеративным дистрофическим заболеванием позвоночного столба (остеохондрозом). У них присутствуют постоянные тупые или тянущие боли в области поясницы.
Симптомы грыжи поясничного отдела позвоночника возникают остро в момент её появления:
- резкая, пронизывающая боль, которая в буквальном смысле этого слова сковывает движения, парализует;
- тут же появляется выраженная мышечная слабость в ногах;
- мышцы в области поясницы сильно напряжены, болезненны при пальпации;
- человек не может самостоятельно нагнуться, разогнуть спину, повернуться на другой бок в положении лежа.
Это первые клинические признаки, при которых необходимо срочно лечь на спину на твёрдую поверхность и попытаться расслабить чрезмерно напряженные мышцы. К врачу следует обратиться в ближайшие часы. Если грыжевое выпячивание ущемлено связочным, сухожильным или мышечным аппаратом, то может начаться ишемия и вторичный некроз тканей.
Спустя несколько часов развиваются неврологические симптомы межпозвоночной грыжи поясничного отдела:
- онемение по ходу пораженного корешкового нерва;
- резкая стреляющая боль по всей ноге на стороне поражения;
- нарушение работы кишечника, вырождающееся в отсутствии перистальтики, запоре;
- нарушение функции мочевого пузыря (учащенное мочеиспускание или его задержка);
- нарушение кровоснабжения мягких тканей нижней конечности (проявляется в виде похолодания и бледности кожных покровов);
- снижение чувствительности и появление парестезий (покалывания, ощущения ползающих мурашек и т.д.).
Появление неврологических признаков – это повод для экстренного обращения к неврологу. Если своевременно не оказать пациенту медицинскую помощь, то могут развиваться различные осложнения.
Для диагностики используется рентгенографический снимок, который позволяет исключить вероятность повреждения костной ткани. Также назначается МРТ обследование – оно позволяет увидеть локализацию грыжевого выпячивания пульпозного ядра и размеры.
Чем опасна позвоночная грыжа поясничного отдела
Позвоночная грыжа поясничного отдела без своевременного лечения опасна для здоровья и жизни пациента. Самое часто осложнение – стеноз спинномозгового канала. На фоне этого состояния могут возникать парезы и параличи нижних конечностей.
Очень часто при поясничной грыже у человека формируется ряд сосудистых патологий:
- варикозное расширение вен нижних конечностей;
- геморроидальные узлы в прямой кишке и в области анального отверстия;
- атеросклероз нижних конечностей;
- облитерирующий эндартериит и т.д.
Могут нарушаться функции кишечника. При полной компрессии корешкового нерва возникает паралич толстого или тонкого кишечника. Это состояние может привести к летальному исходу.
У мужчин поясничная грыжа часто становится причиной эректильной дисфункции, а у женщин вызывает опущение матки, нестабильность менструального цикла, ранний климакс и т.д.
Как лечить грыжу позвоночника поясничного отдела без операции
Перед тем, как лечить грыжу поясничного отдела, нужно провести комплексное обследование. Диагностику и лечение грыжи позвоночника поясничного отдела без операции проводит врач невролог или вертебролог.
Официальная медицина для лечения грыжи поясничного отдела позвоночника без операции использует ряд фармакологических препаратов:
- нестероидные противовоспалительные средства позволяют устранить процесс воспаления, спровоцированный раздражающим действием вещества пульпозного ядра;
- хондропротекторы призваны восстановить нарушенную целостность фиброзного кольца, однако они бесполезны, поскольку при отсутствии полноценного диффузного обмена между хрящевыми тканями межпозвоночного диска и окружающими мышечными волокнами эти вещества просто не попадают в место назначения;
- витамины группы B – способны поддерживать работоспособность нервного волокна при длительной компрессии и ишемии;
- никотиновая кислота – усиливает местный кровоток в мелких капиллярах;
- миорелаксанты – необходимы для устранения спазма мышц и восстановления кровоснабжения пораженной области.
В большинстве случаев подобное лечение грыжи диска поясничного отдела носит исключительно симптоматическое лечение. Устраняется боль и воспаление и пациент выписывается к труду. На самом деле позвоночный диск продолжает разрушаться.
Но существует и более эффективная методика того, как лечить грыжу позвоночника поясничного отдела – это мануальная терапия в сочетании с лечебной гимнастикой и кинезиотерапией. О том, как это происходит, поговорим далее в статье.
Лечение позвоночной грыжи поясничного отдела
Лечение грыжи поясничного отдела с помощью методов мануальной терапии начинается с проведения процедуры тракционного вытяжения позвоночного столба. при этом увеличиваются межпозвоночные промежутки, создаются условия для восстановления целостности фиброзного кольца.
Далее для лечения грыжи позвоночника поясничного отдела разрабатывается индивидуальный курс терапии для каждого пациента. Он может включать в себя следующие методики лечения межпозвоночной грыжи поясничного отдела:
- массаж и остеопатию – для улучшения эластичности мягких тканей и усиления микроциркуляции крови и лимфатической жидкости в очаге поражения;
- кинезиотерапию – для купирования спазма мышц и повышения их тонуса, восстановления физиологического кровоснабжения;
- лечебную гимнастику для активации процесса диффузного питания хрящевых тканей позвоночника;
- физиотерапию и лазерное воздействие для ускорения процесса выздоровления;
- иглоукалывание – для активации процесса регенерации тканей за счет использования скрытых резервов организма.
Лечение позвоночной грыжи поясничного отдела с помощью методов мануальной терапии всегда проводится индивидуально. Поэтому нужно искать в своем городе опытного мануального терапевта и обращаться за помощью к нему.
Имеются противопоказания, необходима консультация специалиста.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Высокая распространенность боли в спине, преимущественно в поясничном отделе позвоночника, обусловленной наличием межпозвонковых грыж в этом отделе, диктует необходимость глубокого изучения механизмов патогенеза данного заболевания с целью оптимизации профилактических и лечебных мероприятий. Грыжи поясничного отдела позвоночника и воспалительная реакция взаимосвязаны. На сегодняшний день считается, что воспаление обусловлено неблагоприятными симптомами, вызванными стимулированием нервных волокон, что приводит к появлению болевых ощущений. Однако воспаление также рассматривают как один из основных факторов регресса грыж поясничного отдела позвоночника. В статье рассмотрены молекулярные и клеточные механизмы, участвующие в регрессе грыж поясничного отдела позвоночника, в т. ч. ремоделирование матрикса и неоваскуляризация. Особое внимание уделяется воспалительной реакции, наблюдаемой при грыжах поясничного отдела позвоночника, в частности роли моноцитов/макрофагов. Изучение вклада цитокинов и клеток иммунной системы в процесс дегенерации межпозвонковых дисков, воспалительной реакции и ноцицепции может помочь обнаружить потенциальные терапевтические мишени у пациентов с симптоматическим поражением межпозвонковых дисков, что, в свою очередь, позволит улучшить качество жизни данной категории больных.
Ключевые слова: грыжа поясничного отдела позвоночника, межпозвонковый диск, воспаление, макрофаги, моноциты.
Для цитирования: Ткачев А.М., Епифанов А.В., Акарачкова Е.С. и др. Роль воспаления в спонтанном регрессе грыж межпозвонковых дисков. РМЖ. Медицинское обозрение. 2019;7:30-33.
Inflammation contributes to the spontaneous regression of spinal disc herniation
A.M. Tkachev 1,2 , A.V. Epifanov 3 , E.S. Akarachkova 4 , A.V. Smirnova 1 , A.V. Iljushin 1 , D.S. Archakov 2
1 Sergey Berezin Medical Institute, Volgograd
2 Tkachev Medical Clinic, Volgograd
3 Doctor Epifanov Clinic, Samara
4 International Society for Stress “Stress under control”, Moscow
High prevalence of low back pain (predominantly, lumbar backache) resulting from herniated discs requires careful study of the pathogenesis of this disorder to improve preventive and therapeutic interventions. Lumbar disc herniation is associated with inflammation. Currently, inflammation is considered to be associated with unfavorable symptoms resulting from nerve ending stimulation which leads to pain. However, inflammation is also regarded as one of the key factors of the regression of lumbar disc herniation. The paper discusses molecular and cellular mechanisms involved in the regression of lumbar disc herniation including matrix remodeling and neovascularization. Inflammatory response in lumbar disc herniation and, in particular, the role of monocytes and macrophages are highlighted. Investigati on of cytokine and immune cell contribution to intervertebral disc degeneration, inflammation, and nociception may provide potential therapeutic targets in patients with symptomatic disc herniation. As a result, their quality of life will be improved.
Keywords: lumbar disc herniation, intervertebral disc, inflammation, macrophages, monocytes.
For citation: Tkachev A.M., Epifanov A.V., Akarachkova E.S. et al. Inflammation contributes to the spontaneous regression of spinal disc herniation. RMJ. Medical Review. 2019;7:30–33.
В статье рассмотрены молекулярные и клеточные механизмы, участвующие в регрессе грыж поясничного отдела позвоночника, в т. ч. ремоделирование матрикса и неоваскуляризация. Особое внимание уделяется воспалительной реакции, наблюдаемой при грыжах поясничного отдела позвоночника.
Введение
Основной причиной боли в поясничном отделе позвоночника являются грыжи межпозвонковых дисков (МПД), которые наблюдаются примерно у 9% людей во всем мире [1]. При проведении диагностических нейровизуализационных исследований бессимптомные межпозвонковые грыжи (МПГ) обнаруживаются у 30–40% населения [2]. Грыжи поясничного отдела позвоночника обычно связывают с разрывом фиброзного кольца (ФК), выпадением студенистого ядра (СЯ) и стимуляцией нервных волокон, что приводит к появлению болевых ощущений. Однако в своем недавнем исследовании S. Rajasekaran et al. (2013) предположили, что МПГ чаще всего являются результатом повреждения замыкательных пластинок, а не разрыва ФК [3].
Предполагают, что основным молекулярным механизмом грыжи МПД является аномальное образование провоспалительных молекул, секретируемых СЯ и ФК, а также макрофагами, Т-лимфоцитами и нейтрофилами [4, 5]. Эти цитокины запускают спектр патологических клеточных реакций, включая аутофагию, старение и апоптоз [6, 7]. Регистрируется секреция таких провоспалительных медиаторов, как фактор некроза опухоли-альфа (TNF-α), ИЛ-1α/β, ИЛ-6, ИЛ-17, ИЛ-8, ИЛ-2, ИЛ-4, ИЛ-10, интерферон-гамма (IFN-γ), хемокины, простагландин E2 (PGE2) [8]. Показана роль TNF-α в образовании грыжи дисков, раздражении и прорастании нервных окончаний [9, 10], кроме того, TNF-α и ИЛ-1β вызывают активацию генов, кодирующих ферменты, разрушающие внеклеточный матрикс [11]. Продемонстрировано увеличение экспрессии ИЛ-1β и ИЛ-1R в ткани диска, подвергшегося дегенерации. В процессе дегенерации отмечается значительное увеличение уровня матриксных металлопротеиназ (MMP)-1, -3, -7, -9 и -13 и ADAM-протеаз (ADAMTS) -1, -4, -5, -9 и -15 в СЯ, что ставит вопрос о роли регуляции этих протеолитических ферментов в процессе заболевания [12].
Методы лечения МПГ и дегенеративного заболевания МПД в целом можно разделить на две группы: консервативные и хирургические. Лечение пациентов с секвестрированным видом МПГ на начальном этапе может проводиться консервативно в связи с более высокой вероятностью и скоростью рассасывания грыжи [13, 14]. Пациенты с некупируемой болью, неврологическими расстройствами или нарушениями функции кишечника либо мочевого пузыря являются кандидатами на проведение раннего хирургического вмешательства. Однако пока еще трудно прогнозировать, какие пациенты получат пользу от консервативного лечения [15] и у кого выше вероятность спонтанного регресса МПГ.
Механизмы спонтанного регресса МПГ
В настоящее время существует три теории, объясняющие резорбцию грыжевого материала. Согласно первой фрагменты грыжевого диска уменьшаются в размере из-за постепенного обезвоживания и сжатия, что может объяснить уменьшение интенсивности сигнала на МРТ [18]. По другой гипотезе напряжение, влияющее на заднюю продольную связку, приводит к ретракции фрагмента диска обратно в межпозвонковое пространство. Этот механизм может объяснить те случаи, когда ФК грыжевого диска остается нетронутым, но это не объясняет варианты с полным пролапсом МПД или миграцией фрагментов диска [14]. Третья теория заключается в том, что постепенная резорбция грыжи через деградацию ферментов и фагоцитоз индуцируется реакцией воспаления и неоваскуляризацией [19, 20]. Такая воспалительная реакция предположительно запускается, когда содержимое МПД попадает в эпидуральное пространство и организм воспринимает его как нечто чужеродное. Относительно каждого отдельного клинического состояния есть вероятность, что один конкретный механизм или комбинация трех механизмов приводит к спонтанному регрессу грыжевой ткани МПД.
Неприкосновенный иммунитет МПД. МПД — это самый большой аваскулярный орган в теле человека, который считается иммунологически привилегированным [21]. СЯ особенно сильно изолировано от иммунной системы, учитывая его расположение между двумя хрящевыми замыкательными пластинками и внутри плотной коллагеновой фиброзной структуры ФК. Кроме этого физиологического барьера, клетки МПД также активно противостоят вторжению иммунных клеток за счет экспрессии Fas-лиганда (FasL) [22]. FasL принадлежит семейству TNF, и известно, что он индуцирует апоптоз, связываясь со своим рецептором Fas. Хотя Fas экспрессируется в самых разных клетках, экспрессия FasL ограничена поверхностью цитотоксических Т-лимфоцитов, естественных NK-клеток, опухолевых клеток и стволовых клеток некоторых иммунологически привилегированных областей. Иммунологически привилегированная область клеток студенистого ядра — это основа теории о воспалительной реакции, способствующей резорбции МПГ. По данной теории экструзия СЯ в эпидуральное пространство запускает аутоиммунную реакцию, что приводит к инфильтрации иммунными клетками, которые вступают во взаимодействие с клетками МПД и вырабатывают разные молекулы, инициируя процесс резорбции грыжи [23].
Факторы нейрональной сенситизации могут включать рекрутмент цитокинов в области воспаления иммуномодулирующими клетками, в т. ч. сателлитные клетки глии или шванновские клетки, а также резидентные макрофаги [24]. В связи с тем, что в процессе эмбриогенеза с момента образования ткани СЯ отделены от кровотока [25] и не взаимодействуют с иммунной системой, при возникновении грыжи активируется иммунологически опосредованная воспалительная реакция [26]. Предполагается участие различных модуляторов и/или каскадов иммунологически опосредованного воспаления. В пользу этого свидетельствует клиническая эффективность иммуносупрессантов широкого спектра, таких как стероиды, а также результаты исследований, указывающих на более эффективное облегчение болевого синдрома при применении доксициклина, влияющего на экспрессию нескольких цитокинов, по сравнению с блокадой специфическими провоспалительными цитокинами [27].
Макрофаги как ключевые участники регресса МПГ. Макрофаги считаются самыми важными участниками процесса резорбции МПГ [28, 29]. Эти клетки обладают способностью активно фагоцитировать грыжевую ткань в лизосомы, заполненные коллаген-деградирующими ферментами. Макрофаги также выделяют ферменты лизосом посредством экзоцитоза, после чего они расщепляют межклеточные вещества, такие как компоненты матрикса диска (протеогликаны и коллагены) [30].
Рекрутинг моноцитов в ткань МПД. Точный механизм рекрутинга моноцитов в МПД остается пока неясным [31], однако известно, что МПД включает в себя клетки, подобные воспалительным (например, клетки с фагоцитарной способностью), и они способны продуцировать медиаторы воспаления [31], которые могут инициировать рекрутинг других иммунных клеток в область, пораженную грыжей. В частности, моноцитарный хемоаттрактантный белок-1 (MCP-1), хемокин подсемейства CC, способствует активизации и рекрутингу моноцитов [32, 33]. Инфильтрирующие макрофаги моноцитарного происхождения также продуцируют MCP-1, усиливая рекрутинг моноцитов в МПД. Кроме макрофагов в резорбции МПГ также участвуют плазмоцитоидные дендритные клетки [34]. Дендритные клетки преобладают над макрофагами при секвестрации транслигаментозного типа, что указывает на то, что они могут участвовать в инициации иммунной реакции [34].
Воспалительные каскады в МПГ. В ходе многочисленных исследований проводился анализ медиаторов иммунного ответа при МПГ, особое внимание уделяли роли макрофагов, участвующих в регрессе МПГ. Так, M.F. Shamji et al. [29] продемонстрировали высокий уровень продуктов макрофагов (IL-4, IL-6, IL-12 и IFN-γ) в тканях МПД, пораженных грыжей. Результаты других исследований показали, что ткани МПД также могут спонтанно продуцировать другие молекулы, например хемокины IL-8 и MCP-1, основная функция которых заключается в хемотаксисе макрофагов и ангиогенезе [32]. Более того, J.D. Kang et al. [35] выявили, что диск, пораженный грыжей, выделяет в большом количестве матриксную металлопротеиназу, оксид азота, IL-6 и PGE2. Продукция IL-6 индуцируется, когда происходит сокультивирование клеток МПД и макрофагов [36]. В недавнем исследовании T. Takada et al. [37] показали, что сокультивирование клеток МПД и макрофагов повышает активность IL-8, PGE2 и циклооксигеназы 2. По результатам обоих исследований, вышеупомянутые биохимические медиаторы продуцируются преимущественно макрофагами.
Аутоиммунная реакция — это намного более сложный процесс, чем рекрутинг макрофагов и неоваскуляризация. В ткани МПД при грыжах присутствуют не только макрофаги, но и другие иммунные клетки. Исследования in vivo на животных моделях способствовали более полному пониманию иммунного ответа, связанного с регрессом МПГ. Спонтанный регресс МПГ был продемонстрирован на моделях крыс с поврежденным позвоночником [38–41]. В этом исследовании МПГ были индуцированы уколом иглы. Выяснилось, что размер образованной грыжи пропорционален калибру используемой иглы. Грыжи значительно уменьшились в объеме через 2–6 нед. после повреждения. Также было выявлено, что количество CD68+ макрофагов, а также апоптоз в ткани грыжи были пропорциональны ее объему. В другом исследовании животным вводили иглу, проникающую через заднюю продольную связку, и искусственно создавали МПГ в эпидуральное пространство. МПГ постепенно, в течение 12 нед. после операции, спонтанно уменьшились в размере. Клеточный инфильтрат, состоявший преимущественно из макрофагов, наблюдался на 3-й день. Иммуногистохимический анализ показал, что клетки МПД с грыжей продуцировали TNF-α и IL-1β на 1-й день и MCP-1 на 3-й день.
Подтверждено наличие T- и B-лимфоцитов в изолированных МПД человека, пораженных грыжей [39]. В грыжевых тканях МПД человека при секвестрированных грыжах было обнаружено в 3 раза больше лимфоцитов, чем при экструзии диска, при которой не наблюдалось никаких других воспалительных клеток, кроме макрофагов [40–43]. В другом исследовании воспалительный инфильтрат характеризовался иммунным окрашиванием тех областей дисков с грыжей, на которых была проведена операция [41–44].
Роль неоваскуляризации в резорбции МПГ. Проведенные к настоящему моменту исследования доказывают, что механизм резорбции МПГ связан с каскадом воспаления, ремоделированием матрикса и ангиогенезом. Однако исследований, посвященных роли неоваскуляризации, проведено недостаточно. Обычно в МПД взрослого человека содержится мало кровеносных сосудов. Однако главным, определяющим фактором спонтанного регресса МПГ считается рост новых сосудов, который наблюдается на внешнем крае грыжевой ткани [42]. Было выдвинуто предположение, что в неоваскуляризации МПГ участвуют несколько молекулярных медиаторов, в т. ч. TNF-α, фактор роста эндотелия сосудов (VEGF) и основной фактор роста фибробластов (bFGF). Как упоминалось ранее, TNF-α может способствовать экспрессии VEGF, который играет важнейшую роль в образовании новых кровеносных сосудов, и некоторые исследования подтверждают присутствие VEGF и его рецепторов в тканях МПД, пораженных грыжей [43, 44]. Взаимодействие между макрофагами и тканями диска приводит к генерации воспалительных цитокинов, а как известно, эти цитокины участвуют в индукции ангиогенеза. Результаты этих исследований подчеркивают важность взаимовлияния ангиогенеза и воспаления, что в конечном итоге приводит к регрессу МПГ.
Патогенез болевого синдрома при дегенерации МПД
Возникновение дискогенной боли связано с врастанием нервных волокон в ткани, не имеющие иннервации [45–47]. Этот процесс может регулироваться взаимодействием провоспалительных цитокинов и нейтрофилов, продуцируемых клетками диска и инфильтрирующими ткань иммунными клетками, а также рецепторами нейротрофинов и их модуляторов. В здоровом состоянии врастанию нервных волокон препятствует барьерная функция тканей диска, определяющаяся высокой концентрацией хондроитинсульфатного компонента аггрекана и других матриксных молекул, которые подавляют рост нервных окончаний. Следует отметить, что в процессе дегенерации отмечается увеличение отношения кератана сульфата к хондроитина сульфату. Протеолитическое расщепление аггрекана под воздействием цитокин-зависимой активности ADAMTS4/5 может способствовать прорастанию нервных волокон в ткани диска [48]. Кроме того, в норме во внешних слоях ФК отмечается высокий уровень экспрессии Sema3A (белка семейства семафорина 3 класса), который подавляет рост аксонов. У пациентов с дискогенной болью отмечается снижение уровня экспрессии этого белка, наряду с увеличением степени дегенерации, что позволяет предположить, что Sema3A может подавлять врастание нервных волокон в ткань диска.
Продемонстрирована прямая взаимосвязь врастания нервных волокон и кровеносных сосудов в ткани МПД, это позволило предположить, что для выживания нейронов и врастания их в ткань диска необходим фактор роста нервов (NGF), вырабатываемый эндотелиальными клетками [47]. Следует отметить, что СЯ и ФК характеризуются низким уровнем экспрессии NGF и нейротрофического фактора мозга (BDNF), а также рецепторов нейротрофина TrkA, TrkB и p75NGFR [49]. Кроме того, отмечается увеличение экспрессии нейротрофина в МПД при болевом синдроме и в стадии дегенерации [49, 50]. Таким образом, NGF в тканях МПД может не только участвовать во врастании нервных волокон, но и напрямую влиять на межпозвоночные ганглии и активировать экспрессию кислоточувствительных ионных каналов (ASIC3), pH-чувствительного Na + -канала, связанного с ишемическим и воспалительным болевым синдромом [31, 51]. Цитокины также могут влиять на межпозвоночный ганглий, способствовать апоптозу [52], а также усиливать экспрессию TrpV1, ноцицептивного катионного канала [53]. Следует отметить, что нервные волокна, иннервирующие МПД, относятся к ноцицептивным и происходят из межпозвоночного ганглия: они экспрессируют ацетилхолинэстеразу, белок PGP 9.5, субстанцию P, BDNF, TrpV1, пептид, кодируемый геном кальцитонина (CGRP), белок нейрофиламентов (NFP) [54, 55]. Имеющиеся данные указывают на прямую связь уровней провоспалительных цитокинов, нейротрофинов и ноцицепции.
Выводы
Дегенерация МПД — широко распространенное состояние во взрослой популяции, связанное со значительными социально-экономическими потерями. Необходимо пробовать разные нехирургические способы лечения, прежде чем назначать хирургическое вмешательство на острой стадии МПГ. Это не касается случаев, когда консервативное лечение противопоказано, например при неврологических расстройствах и боли, неутихающей несмотря на прием медицинских препаратов.
Очевидно, что воспалительная реакция, которая возникает в связи с образованием МПГ, играет немаловажную роль в ее спонтанной резорбции. Таким образом, воспаление в данном конкретном клиническом контексте является положительным прогностическим фактором, и мы не должны препятствовать этому процессу. Хирурги, проводящие операции на позвоночнике, признают этот феномен, и многие считают его полезным для консервативного лечения МПГ. Несмотря на сказанное, именно воспалительная реакция оказывает негативное влияние на прилегающие нервные корешки, вызывая боль. Контроль воспалительной реакции в этих условиях — это важная и сложная задача при лечении пациентов с МПГ. Нужны знания о биологических механизмах, лежащих в основе резорбции МПГ, и персонализированный подход, чтобы назначать оптимальное лечение каждому отдельному пациенту. Такой подход в конечном итоге может приводить к значительной экономии социально-экономических ресурсов.
Только для зарегистрированных пользователей
Читайте также:


