Термодинамика гальванического элемента шпора
студентам и школьникам
- Ветеринария
- Военные дисциплины
- Дизайн
- Приборостроение
- Гидравлика и пневматика
- Лёгкая промышленность
- Транспорт
- Туризм
- Химия
- Психология
- Маркетинг и PR
- Философия
- Сельское хозяйство
- Педагогика
- Медицина
- Математические дисциплины
- Машиностроение и материалообработка
- Электротехника и энергетика
Шпаргалки по электрохимии. Часть 2 - Гальванические элементы
Гальванические элементы. ЭДС. Термодинамика гальванического элемента. Измерение ЭДС.
При прохождении электрического тока через электролит на поверхности электродов протекают электрохимические реакции. Протекание электрохимических реакций может порождаться внешним источником тока. Возможно и обратное явление: электрохимические реакции, протекающие на двух электродах, опущенных в электролит, порождают электрический ток, причем реакции идут только при замкнутой цепи (при прохождении тока).
Электрохимическим (или гальваническим) элементом называется устройство для получения электрического тока за счет электрохимических реакций. Простейший электрохимический элемент состоит из двух металлических электродов (проводников первого рода), погруженных в электролит (проводник второго рода) и соединенных между собой металлическим контактом. Несколько электрохимических элементов, соединенных последовательно, образуют электрохимическую цепь.
Важнейшей количественной характеристикой электрохимического элемента является электродвижущая сила (ЭДС, Е), которая равна разности потенциалов правильно разомкнутого элемента (такого, у которого к конечным электродам элемента присоединены проводники первого рода из одного и того же материала).
Если при прохождении электрического тока в разных направлениях на поверхности электрода протекает одна и та же реакция, но в противоположных направлениях, то такие электроды, а также элемент или цепь, составленные из них, называются обратимыми. ЭДС обратимых элементов является их термодинамическим свойством, то есть зависит только от Т, р, природы веществ, составляющих электроды и растворы, и концентрации этих растворов. Пример обратимого элемента - элемент Даниэля – Якоби :
( - ) Cu ç Zn ç ZnSO 4 ç ç CuSO 4 ç Cu (+) ,
в котором каждый электрод обратим. При работе элемента идут следующие реакции: Zn ® Zn 2+ + 2 e , Cu 2+ + 2 e ® Cu . При пропускании тока бесконечно малой силы от внешнего источника на электродах протекают обратные реакции.
Пример необратимого элемента - элемент Вольта :
При работе элемента протекают реакции Zn ® Zn 2+ + 2 e , 2 H + + 2 e ® H 2 . При пропускании тока от внешнего источника электродными реакциями будут 2 H + + 2 e ® H 2 , Cu ® Cu 2+ + 2 e .
ЭДС электрохимического элемента является величиной положительной, так как она соответствует определенному самопроизвольно протекающему процессу, дающему положительную работу. Обратному процессу, который не может протекать самостоятельно, отвечала бы отрицательная ЭДС.
При составлении цепи электрохимических элементов процесс в одном из элементов можно направить так, чтобы он сопровождался затратой работы извне (несамопроизвольный процесс), используя для этого работу другого элемента цепи, в котором идет самопроизвольный процесс. Суммарная ЭДС любой цепи равна алгебраической сумме положительных и отрицательных величин. Поэтому очень важно при записи схемы цепи учитывать знаки ЭДС, пользуясь принятыми правилами.
ЭДС электрохимической цепи считается положительной , если при записи цепи правый электрод заряжен положительно относительно левого (катионы при работе цепи проходят в растворе от электрода, записанного слева, по направлению к электроду, записанному справа, и в этом же направлении движутся во внешней цепи электроны).
Термодинамика гальванического элемента
Пусть в электрохимической системе обратимо и изотермически протекает реакция
Электрическая энергия, вырабатываемая элементом, равна полезной работе А ¢ суммарного процесса. Полезная работа А ¢ обратимого процесса максимальна и при р,Т = const равна убыли изобарного потенциала системы
Итак, измерив ЭДС элемента и ее температурный коэффициент, можно найти величины D G и D S для суммарного процесса, протекающего в гальваническом элементе. Этот процесс является самопроизвольным, следовательно, D G 0.
По уравнениям Гиббса – Гельмгольца можно вычислить изменение энтальпии процесса и изменение внутренней энергии
Из уравнений следует, что соотношение между электрической энергией, обратимо генерируемой или поглощаемой в электрохимической системе, и тепловым эффектом протекающей в ней реакции зависит от знака и величины температурного коэффициента ЭДС dE / dT :
Для расчета ЭДС уравнения можно переписать в виде
При использовании уравнений необходимо помнить, что они справедливы только для обратимых электрохимических систем , поэтому при изучении зависимости ЭДС от Т необходимо избегать применения электрохимических систем с жидкостными границами, так как возникающие на них диффузионные потенциалы не являются равновесными.
Свяжем ЭДС элемента с константой равновесия реакции, протекающей в элементе. Уравнение изотермы химической реакции имеет вид
Первый член правой части уравнения при заданных р, Т - величина постоянная, его можно обозначить через Ео . Ео - стандартная ЭДС элемента (электрохимической системы), то есть ЭДС при всех ai = 1.
Таким образом, ЭДС электрохимической системы является функцией активностей участников электрохимической реакции. Вышеприведенные уравнения дают возможность вычислить величины D G и К а по экспериментальным значениям Е и, наоборот, рассчитывать Е, зная термодинамические характеристики химической реакции.
Для измерения равновесной (обратимой) величины ЭДС электрохимического элемента необходимо, чтобы процесс совершался бесконечно медленно, то есть чтобы элемент работал при бесконечно малой силе тока. Это условие выполняется в компенсационном методе, который основан на том, что элемент включается последовательно против внешней разности потенциалов и последняя выбирается так, чтобы ток в цепи отсутствовал. Тогда внешняя разность потенциалов равна ЭДС цепи.
Пользуясь компенсационным методом, можно непосредственно измерить значение ЭДС, однако это довольно сложная операция, поэтому в лабораторной практике предпочитают сравнивать ЭДС изучаемого элемента с ЭДС так называемых стандартных (нормальных) элементов, которая тщательно измерена при разных температурах. Этот сравнительный метод также является компенсационным.
Основным нормальным элементом является насыщенный элемент Вестона.
Независимо от того, протекает ли реакция по химическому или электрохимическому пути, энергетические изменения в системе остаются одинаковыми. Электрохимические реакции, подобно химическим, рассматривают с позиций термодинамики и кинетики. Если химическую реакцию проводить в гальваническом элементе с очень малой скоростью, т.е. так, чтобы процесс практически не отклонялся от равновесного, то полезная работа электрического тока окажется равной максимальной работе реакции
где Q- количество протекающего электричества; Е - напряжение или ЭДС разомкнутого элемента в В.
При протекании химической реакции
Ox + Red 1 = Red + Ox 1 ,
в процессе окисления участвуют n электронов
где n - стехиометрический коэффициент;
n -число электронов, отданных или принятых 1 частицей.
При окислении-восстановлении n г-экв веществ будет протекать кулонов электричества nF = Q;
Чем больше величина изобарно-изотермического потенциала реакции, тем больше напряжение элемента. Следовательно, электродвижущая сила, как и изобарный потенциал, является мерой химического сродства реагирующих веществ. Вспомним уравнение изотермы Вант-Гоффа
подставив в него Е, получим
где E0 – ЭДС элемента, когда активности равны единице, называется стандартной ЭДС.
ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ ХИМИЧЕСКОЙ РЕАКЦИИ
Для изменения энтропии имеется формула
Зная изменение ЭДС от температуры, можно найти изменение энтропии реакции
Отсюда можно найти изменение энтальпии реакции (тепловой эффект)
где называется температурным коэффициентом ЭДС.
Таким образом, из измерения ЭДС гальванического элемента для ряда температур можно вычислить DG, DS и DH реакции, протекающей в элементе.
СКАЧКИ ПОТЕНЦИАЛА НА ГРАНИЦЕ РАЗДЕЛА ФАЗ
В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
При соприкосновении двух разнородных фаз их частицы могут вступать в взаимодействие. При этом на границе раздела происходит упорядоченное распределение положительных и отрицательных зарядов. Одна фаза приобретает избыток положительных зарядов, а другая - отрицательных. В результате образуется двойной слой электрических зарядов с определенным скачком электрического потенциала в нем, подобно тому, как это происходит при зарядке электрического конденсатора. Двойной электрический слой возникает вследствие:
1) перехода электронов, катионов или анионов из одной фазы в другую;
2) адсорбции дипольных молекул, катионов или анионов из одной фазы на другой фазе.
Рассмотрим, какие скачки потенциалов встречаются в гальванических элементах на примере элемента Даниэля- Якоби
Здесь имеются разделы фаз: 1) металл 1 - металл 2; 2) металл – раствор электролита; 3) раствор электролита 1 - раствор электролита 2.
1. Контактный скачок потенциала возникает на границе двух металлов вследствие неравенства их работы выхода электрона. Часть электронов зоны проводимости от металлов с меньшей работой выхода перейдет к металлу с большей работой выхода. При этом первый металл зарядится положительно, а второй отрицательно. Величина внутреннего контактного потенциала находится в пределах 1 В.
2. Скачок потенциала на границе металл-раствор возникает вследствие перехода катионов металла в раствор или из раствора в металл. Если же металл электрода инертный и не способен отдавать катионы в раствор и в растворе нет катионов данного металла, то скачок потенциала может возникнуть, если в растворе имеется окисленная или восстановленная форма какого-либо другого вещества или обе его формы.
Перешедшие в раствор катионы или оставшиеся в растворе избыточные анионы под влиянием электрического поля заряженного металла расположатся вблизи металла и создадут так называемый двойной электрический слой.
3. Диффузионный скачок потенциала на границе раствор-раствор возникает вследствие неодинаковой подвижности катионов и анионов и градиента их концентраций. Ионы с большей подвижностью диффундируют в сторону второго электролита быстрее и образуют в растворе фронт одноименно заряженных ионов. Ионы с меньшей подвижностью удерживаются у этого фронта, образуя второй слой. В результате возникает двойной электрический слой со скачком потенциала.
Диффузионный потенциал обычно не превышает 40 мв. При точных измерениях ЭДС его устраняют, помещая между двумя растворами более концентрированный третий раствор электролита, у которого подвижности катионов и анионов практически одинаковы (обычно растворы КСl или NH4NO3).
Способов измерения или расчета абсолютных значений электродных скачков потенциала пока не найдено. Однако ЭДС цепи, состоящей из двух или большего числа электродов, доступна прямому определению и равна алгебраической сумме всех межфазных скачков потенциала. В простейшем случае она равна разности двух электродных скачков потенциала, т.е. является мерой их относительных значений. Величина каждого из электродных скачков потенциала может быть принята за нулевую точку условной шкалы электродных потенциалов. Международным соглашением установлена шкала потенциалов, по которой скачок потенциала стандартного водородного электрода при всех температурах равен нулю.
Электродный скачок потенциала в условной шкале водородного электрода называется электродным потенциалом и обозначается j . Он равен ЭДС электрохимического элемента, состоящего из стандартного водородного и данного электродов. Запись такого элемента всегда начинается с водородного электрода, т.е. он считается левым. Форма записи и знак отдельного электрода определяются правилом, утвержденным конвенцией Международного союза по чистой и прикладной химии (Стокгольм,1953). По этому правилу слева записывается ионная форма реагирующего вещества, далее прочие фазы в той последовательности, в которой они соприкасаются друг с другом. Справа должен стоять символ молекулярной формы вещества, участвующего в электродной реакции, или химический символ металла. Фазы, нанесенные на поверхность металла, отделяются запятой, границы раздела жидких и твердых фаз отмечаются вертикальными черточками, если между ними нет диффузионного скачка потенциала. Активности веществ указываются в скобках.
Запись по данному правилу соответствует электродному скачку потенциала в направлении от раствора к металлу. Ему приписывается положительный знак и соответствует самопроизвольно протекающая восстановительная реакция. (Скачок потенциала в обратном направлении считается отрицательным, ему соответствует окислительная реакция). ЭДС элемента, состоящего из стандартного водородного электрода и электрода, в котором протекает реакция восстановления, будет, таким образом, положительной.
Согласно правилу водородный электрод запишется так:
Стандартный водородный электрод, потенциал которого принят равным нулю и который всегда должен быть левым относительно другого электрода, записывается следующим образом:
Цинковый электрод записывается в виде
а потенциал этого электрода определяется ЭДС элемента
Опыт показывает, что при работе элемента цинк окисляется:
Значит, потенциалу цинкового электрода, должен быть приписан отрицательный знак. Абсолютная величина потенциала цинкового электрода равна
В отличии от цинкового электрода медный электрод имеет положительный потенциал, соответствующий положительной ЭДС элемента:
Здесь в медном электроде самопроизвольно идет восстановительная реакция.
При активностях ионов меди и цинка, равных единице, ЭДС соответствующих элементов определяют стандартные потенциалы медного и цинкового электродов. Стандартные электродные потенциалы образуют ряд, который применительно к системам металл - ионы металла в водном растворе - соответствует расположению металлов по их химической активности, т.е. ряду напряжений.
Разность потенциалов двух электродов в водородной шкале равна ЭДС элемента, составленного из этих электродов, и включает два электродных скачка потенциала и скачок потенциала металл 1 –металл 2,если диффузионный потенциал раствор 1 - раствор 2 пренебрежимо мал.
Для водородной шкалы потенциалов уравнение Нернста будет иметь вид
В частном случае, для электрода металл - ионы металла
так как при Т =* 298 К aRed = aMe = 1.
В основу классификации электродов положено агрегатное состояние и растворимость окисленной и восстановленной формы веществ, участвующих в электродной реакции.
Электроды первого рода
Электродом первого рода называется металл или неметалл, погруженный в раствор, содержащий его ионы.
Примеры: медный электрод в растворе соли меди
Электроды второго рода
Электрод второго рода состоит из металла, покрытого слоем его малорастворимого соединения и погруженного в раствор растворимой соли, содержащий тот же анион.
Примером служат каломельный и хлорсеребряный электроды:
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Уравнение (7) позволяет вычислить тепловойэффект реакции, протекающей вгальваническом элементе, путем измерения ЭДС и температурного коэффициента. Для определения константы равновесия этой реакции используют уравнение
а E 0 - стандартная ЭДС при средних активностях всех ионов в растворе, равных единице. Из выражения (8) следует, что
Если активности ионов, участвующих в электрохимической реакции, не равны единице, то для оценки убыли энергии Гиббса вместо уравнения (8) применяют уравнение изотермы
Например, для реакции
Отсюда следует общее выражение для ЭДС гальванического элемента
где Е° — стандартная ЭДС цепи.
где φ1 и φ2 — стандартные потенциалы электродов.
На металлических электродах обычно протекают реакции типа M z + + ze - ↔M.
В соответствии с этой реакцией, а также с учетом того, что активность твердого вещества (металла) при данной температуре постоянна и равна единице, получают выражение для потенциала электрода, обратимого относительно катиона металла:
Если в токоопределяющем процессе участвуют анионы, то, согласно реакции A + ze - ↔A z - , получают выражение для потенциала отдельного электрода, обратимого относительно аниона:
(Активность окисленной формы аниона принимают за единицу.)
Выражение для потенциала электрода в общей форме
было выведено Нернстом. Это уравнение показывает, что потенциал электрода φ зависит от его природы (природа характеризуется величиной стандартного потенциала φ 0 ), температуры и активности ионов в данном растворе.
Стандартный потенциал φ 0 зависит от природы электрода и характеризует его электрохимическую активность. Для данного растворителя и заданной температуры величина стандартного потенциала постоянна. Абсолютное значение φ 0 определить невозможно, так как с помощью вольтметра измеряют только разность потенциалов двух электродов. Поэтому для измерения φ 0 составляют элемент из стандартного водородного электрода (СВЭ), потенциал которого условно принимают за нуль при любой температуре, и стандартного исследуемого электрода. СВЭ изображен на рис. 2. Он состоит из платиновой пластинки, опущенной в раствор кислоты с активностью ионов водорода, равной единице. Платиновая пластинка находится под током газообразного водорода, подаваемого под давлением 1,013-10 5 Па (1 атм) при постоянной температуре.
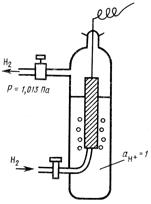
Рис. 2. Стандартный водородный электрод.
Физический смысл стандартного потенциала можно установить с помощью уравнения
Это значит, что стандартный потенциал электрода содержит контактный и неучтенный диффузионный потенциал, т. е. содержит неизмеримые величины и поэтому не является абсолютным. Однако он точно определяет при стандартных условиях стандартную энергию Гиббса той окислительно-восстановительной реакции, которая протекает на электроде. Таким образом, за стандартный потенциал (относительно СВЭ) принимают потенциал электрода с активностью ионов, равной единице, при стандартных условиях. Так как φконт входит в стандартный потенциал электрода, а φдифф сводят к минимуму с помощью солевого мостика, то выражение для ЭДС элемента принимает вид
Измерив при р=1,013•10 5 Па и Т=298 К ЭДС элемента из СВЭ и стандартного исследуемого электрода, получают φ 0 исследуемого электрода в водородной шкале.
Расположенные в определенном порядке стандартные потенциалы образуют ряд напряжений (водородную шкалу).
Если из полуэлементов, в которые входят два разных металла, составить гальванический элемент, то выше расположенный в ряду напряжений металл по сравнению с ниже расположенным будет иметь отрицательный потенциал. При вычитании из более положительного потенциала более отрицательного независимо от знаков потенциалов всегда получается положительная ЭДС.
Зная стандартные электродные потенциалы, можно вычислить потенциалы полуэлементов при любых активностях потенциалопределяющих ионов.
Обратимо работающие элементы — это такие элементы, в которых после размыкания цепи на каждом электроде устанавливается равновесие. В обратимом элементе реакцию можно прекратить, подсоединив к нему внешний источник тока с таким же значением ЭДС, но противоположного направления. Если увеличить ЭДС внешнего источника тока на малую величину, то реакция пойдет в обратном направлении. Если при прохождении электрического тока в разных направлениях на поверхности электрода протекает одна и та же реакция, но в противоположных направлениях, то такие электроды называются обратимыми. Примером обратимого элемента является рассмотренный ранее элемент Якоби — Даниэля, в котором при изменении направления тока реакция Zn+Cu 2+ =Zn 2+ +Cu меняет направление. Электрод Cu|CuSO4 является обратимым, так как при
перемене направления тока протекают реакции Cu 2+ +2e - →Cu 0 и Cu 0 -2e - →Cu 2+ .
Если после размыкания цепи процесс на электродах продолжается, а при изменении направления электрического тока протекают другие реакции, не обратные друг другу, то элемент является необратимым. Примером необратимой цепи является элемент Вольта
В котором при работе на аноде происходит процесс окисления цинка
а на катоде – процесс восстановления ионов водорода
Если приложить к такому элементу противоположно направленную ЭДС, хотя бы на бесконечно малую величину, превышающую ЭДС самого элемента, на электродах будут происходить совершенно другие процессы. Так на отрицательном электроде, который теперь при электролизе будет называться катодом, пойдет реакция восстановления Н + .
2Н + + 2 e ––– Н2, а на положительном (аноде при электролизе будет растворяться (и окисляться)) медь
По свойствам веществ, участвующих в потенциалопределяющих процессах, а также по устройству все обратимые электроды делят на следующие группы: электроды первого и второго рода, окислительно-восстановительные и ионообменные электроды.
1. Электроды первого рода. Водородный газовый электрод.
К электродам первого рода относят металлические электроды, обратимые относительно катионов, и металлоидные, обратимые относительно анионов. Обратимость электрода относительно тех или других ионов означает зависимость его потенциала от концентрации данных ионов. Примерами металлических электродов типа М | М z + являются рассмотренные ранее Zn° | Zn 2+ , Cu 0 | Сu 2+ , Аg° | Ag + и др. Электродный потенциал их определяется уравнением (10) и зависит только от концентрации (активности) одного вида ионов металла. Для электродов, обратимых относительно анионов, применимо уравнение (11). Примером металлоидного электрода, обратимого относительно аниона, может служить селеновый электрод Se | Se 2- .
К электродам первого рода относят также газовые электроды, которые могут быть обратимы по отношению к катиону или аниону. Их создают по схеме (металл) газ | раствор. Металл в газовых электродах необходим как переносчик электронов и для создания поверхности, на которой протекает реакция. Металл должен быть инертным по отношению к веществам, находящимся в растворе. Типичным примером газового электрода является водородный электрод (Рt) Н2 | Н + . Ранее (рис.2) был рассмотрен стандартный водородный электрод.
Потенциал водородного электрода зависит от температуры, концентрации ионов водорода в растворе и давления водорода на поверхности электрода. Если на электроде протекает реакция 2Н + + 2е - →Н2, то
Водородный электрод дает воспроизводимые значения потенциалов. Недостатком его является большая чувствительность к условиям работы: необходимы высокая степень чистоты водорода, активное состояние поверхности платины, отсутствие окислителей и восстановителей в исследуемом растворе.
Электрохимический метод широко применяется при исследовании термодинамических свойств различных химических процессов, на основе которых можно построить равновесные электрохимические цепи.
Кроме того, этот метод более прост, а также позволяет изучать процессы при высоких температурах, что свидетельствует о ряде преимуществ перед другими.
Измерение ЭДС позволяет определить такие термодинамические характеристики, как изобарный потенциал (DG), тепловой эффект реакции (DН), изменение энтропии (DS) и константу равновесия (Кр) окислительно-восстановительной реакции, которая протекает в гальваническом элементе.
Определение термодинамических характеристик
Токообразующей реакции
Токообразующей реакцией называется та окислительно-восстановительная реакция, которая самопроизвольно протекает в гальваническом элементе.
Например, в элементе Даниэля –Якоби:
Zn 0+ + Cu 2+ ® Zn 2+ + Cu 0 токообразующая реакция
C помощью электрохимического метода могут быть рассчитаны следующие термодинамические характеристики:
а) Расчет изменения потенциала (DG).
Из раздела термодинамики известно, что
Для электрохимической цепи максимальную электрическую работу характеризует величина
где z – количество электронов, принимающих участие в реакции;
F – число Фарадея.
Следовательно, DG = zFE (7.78)
Это уравнение служит основой расчета DG различных химических реакций. Часто электрохимический метод определения изобарного потенциала имеет существенные преимущества передтермохимическим методом.
б) Расчет константы равновесия (Кр).
При стандартных условиях
Из термодинамики также известно, что
Величина Кр характеризует полноту протекания химической реакции и вычисляется из уравнения:
в) Расчет изменения энтропии (DS).
Из раздела термодинамики известно, что
Используя уравнение (7.6.1)
изменяется ЭДС при изменении температуры на 1 градус.
г) Расчет теплового эффекта реакции (DH).
К гальванической цепи, как и ко всякой химической и электрохимической системе, находящейся при постоянном давлении применимы все основные уравнения химической термодинамики, в том числе и уравнения Гиббса – Гельмгольца:
где DH – изменение энтальпии в ходе химической реакции.
Используя уравнения (7.6.1) и (7.6.3), получим
Если все члены уравнения Гиббса – Гельмгольца разделить на zF и поменять знаки, то с учетом формулы
получим следующее выражение:
Как уже указывалось ранее
Таким образом, температурный коэффициент характеризует и изменение энтропии (DS) в ходе соответствующей химической реакции, а величина
определяет тепловой эффект при обратимом протекании химической реакции в электрохимической системе.
С другой стороны, DH характеризует тепловой эффект химической реакции при ее необратимом протекании в условиях постоянного давления.
Будем рассматривать только самопроизвольно протекающие химические реакции, для которых Е > 0.
Такого вида электрохимические реакции протекают в гальваничес-ких элементах.
На опыте наблюдаются все три случая зависимости ЭДС от температуры
т. е. только часть энергии, выделяющейся при химической реакции, превращается в электрическую работу, а другая часть (q) выделяется в виде теплоты и элемент нагревается.
т.е. электрическая работа больше энергии, выделяющейся при химической реакции на величину (q).
Дополнительная работа получается за счет теплоты, которую элемент отбирает от окружающей среды. Если система изолирована, то элемент охлаждается.
Таким образом, не имея разности температур, можно получить превращение теплоты в работу, т.е. протекает отрицательный процесс с уменьшением энтропии.
Электрохимические цепи, отвечающие таким необычным условиям, действительно можно реализовать.
Пример 1.
Рассмотрим следующую цепь:
в которой осуществляется реакция
Решение:
По формуле (6.4) найдем изменения энтальпии
Положительное значение DH указывает на эндотермический характер приведенной реакции. Аналогичные закономерности наблюдаются за счет возрастания энтропии системы.
Пример 2.
если ее ЭДС равен 0,536 В, а температурный коэффициент равен 0,45 . 10 –4 В/к. Написать уравнение реакции протекающий в цепи.
Решение:
Электрохимическая цепь состоит из двух электродов II рода
токообразующая реакция: Pb + Hg2Cl2 PbCl2 + 2Hg
Весьма интересным является вопрос о коэффициенте полезного действия (КПД) при работе элемента (h). Если просто сжигать топливо, а затем превращать часть теплоты в работу тепловой машины, то достигается небольшой КПД (до 0,3-0,4). Если же осуществлять химическую реакцию окисления топлива в электрическом элементе, то можно получить значительно больший КПД.
затем по известному значению Е 0 можно вычислить ЭДС для любых концентраций ионов в растворе. Например, для реакции
Так, многие стандартные потенциалы металлов, которые не могут быть определены экспериментально, вычислены на основании термодинамичес-ких данных. Например, для щелочных и щелочноземельных металлов, которые бурно реагируют с водой, для алюминия и магния, которые легко покрываются пленкой и т.д.
| Адсорбция на поверхности жидкости.doc | 627kb. | 02.11.2005 20:44 |  скачать |
| Адсорбция на поверхности твёрдого тела.doc | 125kb. | 02.11.2005 20:44 |  скачать |
| Внешняя массопередача.doc | 379kb. | 02.11.2005 20:44 |  скачать |
| Оптические свойства коллоидных систем.doc | 153kb. | 28.01.2006 09:41 |  скачать |
| Подвижность ионов.doc | 142kb. | 02.11.2005 20:44 |  скачать |
| Теория активных столкновений.doc | 595kb. | 02.11.2005 20:44 |  скачать |
| Теория диффузии.doc | 408kb. | 28.01.2006 10:01 |  скачать |
| Теоря электролитов.doc | 217kb. | 02.11.2005 20:44 |  скачать |
| Термодинамика электродных процессов.doc | 459kb. | 02.11.2005 20:44 |  скачать |
| Топохимические реакции.doc | 330kb. | 02.11.2005 20:44 |  скачать |
| Удельная электроповодность электролитов.doc | 148kb. | 02.11.2005 20:44 |  скачать |
| Флокуляция.doc | 27kb. | 02.11.2005 20:44 |  скачать |
| Электрические свойства коллоидных систем.doc | 174kb. | 28.01.2006 10:30 |  скачать |
| Электрохимическая кинетика.doc | 81kb. | 02.11.2005 20:44 |  скачать |
| Гомогенные химические реакции-2.doc | 268kb. | 02.11.2005 20:44 |  скачать |
| Гомогенные химические реакции.doc | 211kb. | 15.05.2007 02:15 |  скачать |
| Кинетика гетерогенных процессов.doc | 254kb. | 02.11.2005 20:44 |  скачать |
| Явление катализа и катализаторы.doc | 346kb. | 02.11.2005 20:44 |  скачать |
| Общие представления.doc | 173kb. | 10.04.2006 21:48 |  скачать |
| Равновсияв растворах.doc | 410kb. | 27.01.2006 19:54 |  скачать |
| Разбавленные растворы.doc | 349kb. | 19.04.2008 00:11 |  скачать |
| Реальные растворы..doc | 109kb. | 19.04.2008 01:15 |  скачать |
| Совершенные растворы.doc | 136kb. | 19.04.2008 01:08 |  скачать |
| 1 закон ТМ.doc | 253kb. | 18.04.2008 23:59 |  скачать |
| 2 закон ТМ.doc | 276kb. | 19.04.2008 00:03 |  скачать |
| Введение.doc | 21kb. | 20.03.2006 23:00 |  скачать |
| Третий закон термодинамики.doc | 279kb. | 06.04.2006 00:18 |  скачать |
| Химическое равновесие.doc | 374kb. | 19.04.2008 00:05 |  скачать |
Термодинамика электродных процессов.doc
8. Термодинамика электродных процессов
8.2 Электрохимическая ячейка и процессы, протекающие в ней.
Электрохимические процессы по механизму протекания отличаются от химических процессов тем, что процессы окисления и восстановления в них пространственно разделены друг от друга. Электрохимические процессы протекают в электрохимических ячейках, которые можно разделить на два типа: гальванический элемент или электрохимический источник тока и электролизёр или электролитическая ванна.
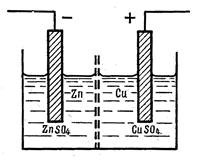
Гальваническим элементом называется электрохимическая ячейка, в которой энергия химической реакции превращается в электрическую. В качестве примера рассмотрим медно-цинковый гальванический элемент, принципиальное устройство которого приведено на рисунке 8.1.
Рисунок 8.1 Устройство медно-цинкового гальванического
1- цинковый электрод, 2-медный электрод, 3- раствор ZnSO4,
4-раствор CuSO4, 5 - потребитель электрческой энергии,.
6-элекролитческий ключ.
В медно-цинковом гальваническом элементе цинковый электрод заряжен отрицательно, а медный электрод заряжен положительно. В гальваническом элементе на отрицательно заряженном электроде всегда протекает реакция окисления
Zn - 2e = Zn 2+ . (8.1)
а на положительно заряженном электроде всегда протекает реакция восстановления
Сu 2+ + 2e = Cu. (8.2)
Реакции, протекающие на электродах, называются электродными реакциями. Сложение электродных реакций даёт химическую реакцию, которая протекает в гальваническом элементе:
Zn + Cu 2+ = Zn 2+ + Cu (8.3)
или
Zn + CuSO4 = ZnSO4 + Cu (8.4)
В электрохимической цепи гальванического элемента отрицательно заряженный электрод всегда записывается слева, а положительно заряженный электрод – справа:
(-) Zn/ ZnSO4//CuSO 4 /Cu (+)
Одна наклонная линия обозначает границу раздела фаз электрод-электролит, а две параллельные наклонные линии обозначают границу между двумя отличающимися чем-либо друг от друга растворов электролитов.
Электролизёром называется электрохимическая ячейка, в которой химическая реакция осуществляется за счёт потребляемой извне электрической энергии. В качестве примера рассмотрим принципиальную схему электролизёра для получения цинка (Рисуншк 8.2):
Рисунок 8.2 Схема электролизёра для получения цинка.
1 – цинковый электрод (катод), 2 – Раствор ZnSO4, 3 –свинцовый
электрод (анод), 4- внешний источник электрической энергии.
Отрицательно заряженный электрод в электролизёре называется катодом. На нём всегда протекает реакция восстановления:
Zn 2+ + 2e = Zn. (8.5)
Положительно заряженный электрод называется анодом. На нём всегда протекает акция окисления:
^ 8.2 Законы Фарадея.
Между количеством электричества, пропущенного через систему электрод– электролит, и количеством вещества, прореагировавшего на электроде, существует количественная связь, которая выражается законами Фарадея.
Согласно первому закону Фарадея количество вещества, прореагировавшее на электроде, пропорционально количеству электричества, прошедшего через электролит:
g = kq = kIt, (8.9)
где g – количество вещества, прореагировавшее на электроде, г;
q- количество электричества, пропущенное через электролит, Кл;
I - сила электрического тока, А;
t- время пропускания тока, с;
k – коэффициент пропорциональности.
Эi – химический эквивалент i-го вещества.
z – число электронов, принимающих участие в электродном процессе:
F – число Фарадея.
Сравнение (8.11) и (8.9) даёт:
Электрохимическим эквивалентом называется количество вещества, которое выделяется на электроде при пропускании единицы количества электричества. Очень часто в качестве единицы количества электричества используется 1 А∙ч.
Законы Фарадея принадлежат к наиболее точным законам природы. Однако на практике наблюдаются отклонения от этих законов. Эти отклонения связаны с побочными бесполезными явлениями и поэтому называются кажущимися. Причинами кажущихся отклонений могут быть:
- механические потери продуктов электролиза ;
- неустойчивость химического состава продуктов электролиза и др.
gпр.- фактически полученное количество вещества в процессе электролиза;
gтеор.- количество вещества. которое должно было получиться в
соответствии с законами Фарадея.
получение определённой массы вещества путём электролиза в
соответствии с законами Фарадея;
qпр. – количество электричества, фактически затраченное на получение
того же самого количества вещества.
Величина выхода по току всегда меньше единицы или 100%. Различают катодный и анодный выходы по току, которые могут отличаться друг от друга. Особенно большие отклонения от 100% наблюдаются при электролизе расплавленных солей.
^ 8.3 Возникновение разности потенциалов на границах раздела фаз. Двойной электрический слой.
При погружении металла в раствор его соли между металлом и раствором будет происходить обмен ионами металла. В результате на границе раздела фаз электрод-электролит произойдёт перераспределение электрического заряда таким образом, что на поверхности электрода образуется заряд, равный по величине и противоположный по знаку заряду, образующемуся в жидкостном слое в близи поверхности электрода. В результате на границе раздела фаз образуется двойной электрический слой и возникает межфазный скачок потенциал, который назвали электродным или термодинамическим потенциалом. В условиях установившегося равновесия в процессе обмена ионами между электродом и электролитом электрод характеризуется равновесным потенциалом. Скачки потенциалов подобного рода могут возникать также на границах следующих фаз:
- двух различных металлов (контактный потенциал);
- металл- газ (контактный потенциал второго рода);
- двух различных растворителей (фазовый жидкостный потенциал);
-двух электролитов одном и том же растворителе, различающимся по виду растворённого вещества или же его концентрации (диффузионный потенциал);
- если растворы, содержащие несколько различных ионов, разделены полупроницаемой перегородкой (мембраной), и если одни из них способны переходить через мембрану, а другие нет, то возникают мембранные потенциалы (потенциалы Доннана).
В простейшем случае двойной электрический слой можно представить как плоско-параллельный конденсатор, одна обкладка которого заряжена положительно, а другая отрицательно (Рисунок 8.3).
Рисунок 8.3 Простейшая модель строения двойного электрического слоя.
δ – толщина двойного электрического слоя .
Благодаря тепловому движению ионов и их электростатическому взаимодействию между собой происходит размытие жидкостной части двойного электрического слоя и строение его изменяется (Рисунок 8.4).
Рисунок 8.4 Строение двойного электрического слоя
δ – толщина плотной части слоя; α- толщина размытой (диффузной) части слоя; Δφ- падение потенциала в плотной части слоя; ψ – падение потенциала в размытой части слоя (диффузный потенциал); φ – термодинамический потенциал.
^ 8.4 Термодинамика гальванического элемента.
Гальванический элемент-это электрохимическая система, в которой химическая энергия окислительно-восстановительных реакций непосредственно превращается в электрическую. Условием работы гальванического элемента является разделение сопряженного окислительно-восстановительного процесса на два пространственно разделённых акта – окисления и восстановления. Любой гальванический элемент содержит по крайней мере два электрода, каждый из которых характеризуется электродным потенциалом. Разность потенциалов при разомкнутой внешней цепи называется электродвижущей силой гальванического элемента (э.д.с.). Электродвижущая сила всегда является положительной величиной и представляет собой разность между потенциалом положительно заряженного электрода и потенциалом отрицательно заряженного электрода:
E = φ+ - φ-, (8.15)
где Е – электродвижущая сила, В;
φ+ - потенциал положительно заряженного электрода, В;
φ- - потенциал отрицательно заряженного электрода, В.
Величина электродвижущей силы не зависит от конструкции элемента, а определяется только изменением энергии Гиббса для химической реакции, протекающей в элементе:
ΔG = - zFE, (8.16)
где ΔG – изменении е энергии Гиббса, Дж;
z – число электронов, участвующих в окислительно-
восстановительной реакции, протекающей в элементе;
F - число Фарадея,Кл
Е – электродвижущая сила, В.
Поскольку электродвижущая сила всегда является положительной величиной, то из уравнения (8.16) следует, что в гальваническом элементе всегда протекает самопроизвольная химическая реакция, для которой
ΔG 0 = - zFE 0 , (8.22)
где Е 0 - стандартная э.д.с. гальванического элемента.
^ 8.5 Электродный потенциал и его зависимость от концентрации потенциал образующих ионов
Каждый электрод в любой электрохимической системе характеризуется электродным потенциалом. Абсолютную величину электродного потенциала невозможно измерить и рассчитать теоретическим путем. Поэтому электродным потенциалом принято называть электродвижущую силу гальванического элемента, составленного из данного электрода и стандартного (нормального) водородного электрода. Стандартным (нормальным) водородным электродом называется электрод, обратимый относительно ионов водорода при концентрации (активности), равной единице, и давлении водорода, равном одной атмосфере. Потенциал стандартного водородного электрода условно принят равным нулю. Электродному потенциалу присваивается знак плюс, если поверхность электрода заряжена положительно относительно поверхности нормального водородного электрода, и знак минус, если поверхность электрода заряжена отрицательно относительно поверхности водородного нормального электрода.
Так потенциал цинкового электрода будет представлять собой электродвижущую силу гальванического элемента, составленного из цинкового и стандартного водородного электродов:
(-) Zn/Zn 2+ //H + /Pt, H2 (+)
В гальваническом элементе будет протекать следующая химическая реакция:
Zn + 2H + = Zn 2+ + H2 (8.26)
Изменение энергии Гиббса для химической реакции составит
Если потенциал образующим ионом является анион, например Сl - - ион, то потенциалом хлорного электрода является электродвижущая сила гальванического элемента:
(-) Н2,Рt/HCl/Pt,Cl2 (+),
в котором протекает химическая реакция
H2 + Cl2 = 2H + + 2Cl - , (8.33)
то рассуждая аналогичным способом, как и при выводе уравнения для потенциала цинкового электрода, получим:
где знак плюс относится к электродам, обратимым относительно катионов, а знак минус - к электродам, обратимым относительно анионов.
Если раствор электролита является идеальным, то уравнение (8.36) можно записать в виде:
где Сi – концентрация потенциал образующих ионов.
Уравнения (8.35) и (8.36) называют уравнениями Нернста. Они выражает зависимость величины потенциала электрода от концентрации (активности) потенциал образующих ионов.
Значения некоторых электродных потенциалов при 298 К приведены в таблице 8.1.
Таблица 8.1 - Стандартные электродные потенциалы для некоторых
электродных реакций в водной среде при 298 К.
^ 8.6 Классификация электродов
Классификация электродов производится по характеру процесса, протекающего на
электроде и химической природе веществ, участвующих в электродной реакции. По этим признакам различают:
8.6.1 Электроды первого рода.
К ним относятся электрохимические системы, состоящие из металла, погруженного в раствор собственных ионов и обратимые по отношению к этим ионам:
На электроде протекает электрохимическая реакция:
Ме z + + zе = Ме (8.37)
Потенциал электрода определяется уравнением:
8.6.2 Электроды второго рода
К ним относятся электрохимические системы, состоящие из металла, покрытого трудно растворимой солью (или оксидом) этого металла и опущенного в раствор хорошо растворимой соли, имеющей общий анион с трудно растворимой солью (для оксида-ионы ОН - ). Особенностью электродов второго рода является то, что в электрохимической реакции принимает участие трудно растворимая соль.
В качестве примеров рассмотрим электрохимические системы, которые получили широкое распространение, как электроды сравнения.
или для идеальных растворов
К окислительно-восстановительным электродам относятся электрохимические системы, состоящие из инертного металла (как правило, Pt), опущенного в раствор электролита, содержащего ионы вещества в окисленной и восстановленной формах. Электрохимическая цепь окислительно-восстановительного электрода может быть представлена следующим образом:
Ох,Red/Pt или Ох,Red,Pt
где Ox и Red – окислительная и восстановительная формы ионов.
Стандартным называется потенциал окислительно-восстановительного электрода, когда
8.7 ^ Классификация гальванических элементов
Все гальванические элементы различаются друг от друга по двум основным признакам:
1) По характеру процесса, лежащего в основе работы гальванического элемента. Таким процессом может быть химическая реакция или процесс выравнивания концентраций. По этому признаку все гальванические элементы делятся на химические и концентрационные.
2) По наличию или отсутствию диффузионного потенциала на границе двух электролитов, отличающихся друг от друга концентрацией или природой. При наличии диффузионного потенциала гальванические элементы называются элементами с переносом, а при отсутствии такового – элементами без переноса.
В зависимости от сочетания выше перечисленных признаков различают следующие гальванические элементы:
а) Химические элементы с переносом. Примером такого элемента может служить медно –цинковый гальванический элемент:
(-) Zn/ZnSO4//CuSO4/Cu (+)
В основе работы этого элемента лежит химическая реакция
Zn + CuSO4 = ZnSO4 + Cu, (8.70)
а на границе двух различных электролитов CuSO4 и ZnSO4 возникает диффузионный потенциал.
с) Концентрационный элемент без переноса. Примером такого элемента может служить электрохимическая система, состоящая из двух серебряных электродов, опущенных в растворы AgNO3 c различной концентрацией:
Читайте также:





