Состав синовиальной жидкости при остеоартрозе
Синовия – эластичная неньютоновская жидкость, которой принадлежит важная роль в поддержании множественных функций организма. Синовиальная жидкость (СЖ) выполняет амортизацию, защищая суставные хрящи от излишних нагрузок. Благодаря ей суставы подвергаются наименьшему коэффициенту трения. Замена патологической СЖ ее аналогами искусственного происхождения в современной ортопедии относится к базовым подходам терапевтической коррекции болезней суставов.

Трудности исследования синовиальной жидкости
Важно знать! Врачи в шоке: "Эффективное и доступное средство от боли в суставах существует. " Читать далее.
Возможно, суставная жидкость в настоящее время была бы более тщательно изучена, но образцы этого материала сложно добывать. Поскольку материал для исследования берут вследствие пункции, ученые утверждают, что получить СЖ путем прокола здоровых коленных суставов сложно. Во-первых, жидкости мало, во-вторых, сложность добавляет особенность ее консистенции – она вязкая.
Недостаточная изученность состава и свойств СЖ объясняется повышенной болезненностью процедуры, из-за которой многие люди отказываются проходить этот вид исследования.
Манипуляция проводится без предварительного обезболивания. Целесообразность такого решения объясняется тем, что атомы новокаина (именно он чаще всего применяется для местной анестезии) разрушают хроматин клеточных ядер.
Несмотря на отсутствие обезболивания, пункция проводится строго в условиях асептики.
Также СЖ берут в патологоанатомическом отделении. Однако в первые минуты после смерти человека содержимое его суставов подлежит стремительному обезвоживанию. Результаты исследования СЖ, взятой различными методиками, отличаются.
На основании изучения состава синовии удается выявить заболевания, однако уже на 2 стадии (чаще). Поскольку на 1 стадии явных жалоб на недостаточную двигательную способность суставов у пациента не возникает. Метаболические сдвиги минерального обмена указывают не только на наличие, но и на активное прогрессирование дегенеративно-воспалительных процессов внутри суставов. Остеохондроз развивается на фоне образования кристаллов в синовии.
Сразу после пункции, визуализируя состояние полученной жидкости, можно предварительно оценить, какой процесс проходит внутри суставов. Имеет значение цвет, наличие примесей и степень прозрачности СЖ. Среда бывает мутная, желтоватого цвета, что напрямую свидетельствует о воспалительном процессе.
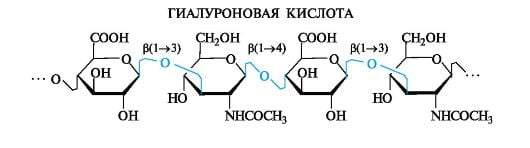
Во внутрисуставной жидкости содержится 25% гиалуроновой кислоты. 8 из 10 проведенных лабораторных исследований образцов синовии указали на то, что процессы деструктивного характера становятся причиной нарастания активности протеолитических ферментов и гликозаминогликангидролазы. Одновременно с этим сокращается уровень полимерности, а объем гиалуроновой кислоты снижается.
Указанные патологические явления говорят о реакции СЖ на полученное повреждение сустава и начавшееся воспаление. При воспалительном процессе повышается концентрация белков не только в крови, но и в синовии. Именно увеличение количества белых телец говорит об указанных выше изменениях. Пункция и последующий забор СЖ для исследования поможет своевременно выявить в суставе воспаление.
Проведенные учеными многократные исследования позволили понять, что для клинической практики самым информативным является установление данных по содержанию в синовии общего белка и уроновых кислот.
Взаимосвязь состава синовии и внутрисуставной патологии
Важная роль отводится изучению СЖ для выявления и дифференциации патологий строения и состояния суставов. Эта биологическая среда является органо-специфичным компонентом каждого сустава. Она передает изменения, охватившие сустав, все внутрисуставные реакции.
Качественный состав этой биологической среды изменяется в зависимости от:
- вида внутрисуставной патологии;
- стадии ее развития;
- уровня привычной двигательной активности человека;
- характера и объема принимаемых лекарственных препаратов.
Главные показатели синовии, изменения которых происходят в зависимости от перечисленных факторов, отражены в таблице.
Сравнительная характеристика состава синовиальной жидкости при разных суставных патологиях
В исследовании приняли участие 16 человек.
| Критерий оценки | Синовиальная жидкость больных с пателлофеморальным артрозом средней стадии | Синовиальная жидкость пациентов, страдающих двухсторонним гонартрозом начальной стадии |
| Количество общих липидов | При норме 0,70 ± 0,08 г/л составляет 2,73 ± 0,45 г/л | Составляет 1,66 ± 0,21 г/л |
| Концентрация общего белка | При норме 18,21 ± 4,03 г/л составляет 34,96 ± 1,56 г/л | Составляет 27,51 ± 0,53 г/л |
| Холестерин | При норме 0,46 ± 0,12 ммоль/л составляет 4,37 ± 2,50 ммоль/л | Составляет 1,30 ± 0,07 ммоль/л |
| Триглицериды | При норме 0,87 ± 0,20 ммоль/л составляет 0,31 ± 0,06 ммоль/л | Составляет 0,21 ± 0,03 ммоль/л |
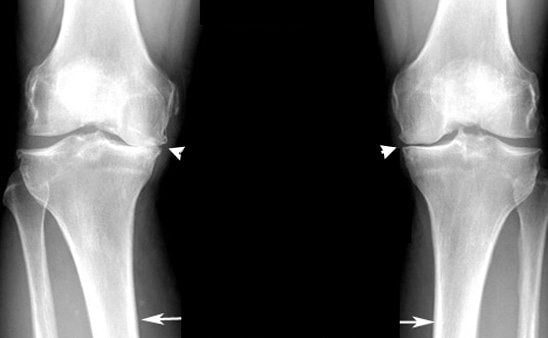
Результаты проведенного исследования отражают характер изменений липидного и белкового спектров, показатели пероксидации и уроновых кислот у лиц, страдающих пателлофеморальным артрозом и гонартрозом. Изменения обусловлены различием клинических стадий развития патологии.
Проведенный эксперимент указывает на значительный дисбаланс прооксидантных и антиоксидантных процессов в суставной жидкости, развитие окислительного стресса. Его интенсивность предопределяется степенью тяжести дегенеративно-воспалительного процесса, но не зависит от его первопричины. Концентрация липидов синовиальной жидкости влияет на приобретение ею различных консистенций под действием температур. Доказано, что липиды и триглицериды суставной жидкости влияют на ее физико-химические свойства.
Установлено, что составляющие внутрисуставную жидкость вещества влияют на микрорельеф хряща, предопределяют направление скольжения суставных поверхностей, снижая коэффициент трения в суставе.
Функции синовиальной жидкости и ее изменение при воспалении сустава
Даже "запущенные" проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим.
Синовия выполняет несколько физиологических функций: метаболическую (обменную), барьерную (защитную) и протекторную (биомеханическую). Нарушение хотя бы одной из них приводит к изменению состояния хряща. Он становится более уязвимым, а обеспечение некорректной нагрузки на эту анатомическую структуру может привести к повреждению или деформации.

Состояние и количество синовиальной жидкости позволяет визуализировать воспаление сустава на разных этапах его развития. Остеоартроз предполагает деструктивное изменение хряща. В результате патологии хрящевой матрикс теряет триаду окисленных мукополисахаридов. Они представлены гиалуроновой кислотой, хондроитинсульфатом, кератансульфатом. Спустя 3-4 месяца сустав частично теряет амортизационные свойства, эластичность и упругость.
По мере развития заболевания нефизиологическим образом перераспределяется физическая нагрузка. Из-за деструктивного поражения хряща давление возрастает на костную ткань, а в ее структуре могут возникнуть трабекулярные микротрещины или микропереломы.
Если ранее вы перенесли повреждения суставов или лечили воспаления этих структур, нужно сообщить об этом врачу на консультации.
Сосудистая сеть по физиологическим принципам питает кость, поэтому ее повреждение становится причиной внутрикостной гипертензии, на фоне которой нарастает очаговая гипоксия и ишемия кости. Частично теряя биомеханические способности хряща и одновременно испытывая резкий перепад нагрузки на субхондральную кость, в организме происходит уплотнение, склеротические изменения с последующим формированием остеофитов.
Патогенетическим механизмом считаются следующие аспекты:
- факт смещения динамического равновесия биосинтетической активности хондроцитов;
- развитие процесса деградации составляющих хрящ веществ;
- воздействие вредоносных факторов экзогенного и эндогенного типа.
Все большее значение придается медиаторам воспаления, обнаруживаемым при изучении состояния хряща, синовиальной оболочки и состава синовиальной жидкости.
Влияние препаратов на состояние синовиальной жидкости
Препарат Хондроитина Сульфат назначают для нормализации состояния хрящевой ткани.
Лекарственному средству присущи следующие особенности:
- характеризуется высокими адсорбционными свойствами при приеме внутрь;
- отличается высокой клинической эффективностью;
- практически не оказывает побочных эффектов;
- на 70% выводится печенью и на 25% выделяется с желчью;
- не оказывает пагубного воздействия на состояние печеночной паренхимы;
- лекарственное средство безопасно для состояния и функциональной деятельности сердечного миокарда.

Препарат обеспечивает высокое анальгезирующее, противовоспалительное воздействие, нормализует двигательную способность суставов. Участвует в структуризации главного компонента хрящевой и костной тканей.
Синовиальная жидкость в здоровом суставе человека содержит моноциты, лимфоциты, нейтрофилы, синовиальные клетки, макрофаги синовиального происхождения. Доказано существование прямой взаимосвязи между количеством составляющих компонентов синовии, степенью ее вязкости, содержанием в ней фагоцитов. Клеточный состав внутрисуставной среды, количество расхода клетками кислорода – определенные критерии функциональной способности сустава, как органа.
Хондроитина сульфат структурирует измененную синовиальную жидкость, стабилизируя и нормализуя в ней метаболические процессы. Одновременно с этим происходит и опосредованное подавление уровня активности гиалуронидазы. На это указывает выявленное спонтанное сокращение активности лизосомальных гидролаз во внутрисуставной жидкости пациентов на фоне их лечения Хондроитин сульфатом. Именно целенаправленное воздействие этого препарата на рассматриваемую биологическую среду служит причиной назначения данного лекарственного средства в терапии пациентов с артритом.
Как увеличить количество внутрисуставной жидкости?
Пациенты, не зная, как увеличить количество синовиальной жидкости, стремятся реализовать методы народной медицины. Они полагают, что компенсировать недостающую часть СЖ помогут отвары и фиточай. Но лекарственные растения не восстанавливают объем, не улучшают качество синовии. Они всего лишь создают благоприятные условия для ускорения ее выработки синовиальной оболочкой, задерживают воспалительный процесс, улучшают подпитку хрящей.
В этом плане помогут лопух и сабельник. Они обладают такими качествами:
- Оказывают противовоспалительное действие.
- Обеспечивают анальгезирующий эффект.
- Участвуют в эвакуации чрезмерного количества соли.
- Помогают формированию хрящевой ткани.

Но даже перечисленные положительные качества растений не должны послужить основанием для самолечения. Планируя реализовать метод народной медицины, нужно получить одобрение лечащего врача.
Существуют методики, одобренные официальной медициной:
Перечислены основные варианты повышения выработки суставного экссудата. Если реализовывать указанные способы по системе, утвержденной специалистом, проблем с суставами удастся избежать. Важно полностью пройти лечебный курс, не прерывая его при появлении первых признаков улучшения здоровья.
Заключение
Артроцентез относится к инвазивным процедурам, его травматичность для суставной среды неоспорима. Однако если избежать манипуляции невозможно, необходимо исследовать полученную синовию для диагностических целей исключительно с использованием информативных методик. Синовиальная жидкость — важная биологическая среда и неотъемлемый компонент суставов, без которого полноценная двигательная активность была бы невозможна.
Если инвазивность исследования синовии менее приоритетна, чем необходимость быстро выявить внутрисуставную патологию, прогноз относительно выздоровления благоприятный, поскольку анализ содержимого синовии позволяет понять действительную клиническую картину, назначить и начать лечение.
Медицинский эксперт статьи

В большинстве случаев у больных с остеоартрозом отсутствуют изменения в анализах крови и мочи, за исключением случаев синовита со значительным выпотом, когда могут возникнуть увеличение СОЭ, гипергаммаглобулинемия, повышение уровня показателей острой фазы - СРБ, фибриногена и др. При исследовании синовиальной жидкости значительных отличий от нормальных показателей не выявляют.
При остеоартрозе патологические изменения происходят главным образом в суставном хряще, а также в субхондральной кости, синовиальной оболочке, других мягких тканях сустава. Поскольку наши возможности непосредственно исследовать эти структуры ограничены, наиболее важными источниками для забора биологических маркеров являются кровь, моча и синовиальная жидкость.
Исследование мочи наиболее предпочтительно, поскольку не сопряжено с какими-либо инвазивными процедурами. На наш взгляд, идеальным материалом для исследования является суточная моча. Анализ утренней порции мочи был бы более целесообразным, однако возможность ее использования основывается лишь на том, что именно такой анализ используют для определения биологических маркеров костного метаболизма при остеопорозе: известно, что биологические маркеры подчиняются циркадным ритмам, а пик концентрации биологических маркеров костного метаболизма приходится на ночные часы. К настоящему времени в литературе отсутствуют сведения о циркадных ритмах биологических маркеров мягких тканей, хряща, поэтому окончательное решение о выборе адекватного анализа мочи будет принято после проведения соответствующих исследований.
Исследование крови относится к рутинным клиническим анализам. Некоторые биологические маркеры в крови определяют уже сегодня, например показатели острой фазы, другие, возможно, в ближайшем будущем войдут в стандартный перечень биохимических тестов. Для каждого биологического маркера необходимо уточнить, в каком компоненте крови его следует определять - в плазме или сыворотке. Результаты исследований свидетельствуют о том, что концентрация биологических маркеров в плазме крови значительно отличается от таковой в сыворотке. Обычно биологические маркеры определяют в сыворотке крови. По данным V. Rayan и соавторов (1998), концентрации биологических маркеров в крови, взятой из вены вблизи пораженного сустава и из более отдаленной вены, различны. Эти данные свидетельствуют о необходимости стандартизации забора крови для исследования биологических маркеров.
Поданным L.J. Attencia и соавторов (1989), хрящ синовиальных суставов взрослого человека составляет всего 10% от общей массы гиалинового хряща организма, включая межпозвоночные диски. Таким образом, определение биологических маркеров в крови и моче скорее отражает системный метаболизм, чем местные изменения в пораженном остеоартрозом суставе. Синовиальная жидкость находится ближе всего к патологическому очагу при остеоартрозе и, вероятно, наиболее точно отражает процессы, происходящие в пораженном суставе. Концентрация биологических маркеров в синовиальной жидкости может быть значительно выше, чем в крови, а значит, ее легче определить. Примерами могут служить эпитоп 846 аггрекана - в синовиальной жидкости его в 40 раз больше, чем в сыворотке крови, хрящевые олигомерные матриксные белки (ХОМБ) - в 10 раз больше, чем в сыворотке крови. Продукты деградации в синовиальной жидкости более точно отражают катаболические процессы в суставном хряще. Дренаж молекул из синовиальной жидкости через местную лимфатическую систему может привести к уменьшению их размеров и даже к их разрушению.
Несмотря на инвазивность методики забора синовиальной жидкости, сопряженной с рядом возможных осложнений, ценность определения биологических маркеров в ней очевидна. Для избежания проблем с так называемым сухим суставом непосредственно перед изъятием жидкости в сустав можно ввести 20 мл изотонического раствора NaCl. Тотчас после инъекции изотонического раствора пациент должен произвести 10 раз сгибание-разгибание конечности в суставе, за этим следует быстрая аспирация разведенной синовиальной жидкости. По мнению E.M.-J.A. Thonar (2000), такое разведение синовии влияет на метаболизм в суставном хряще. Однако результаты исследования F.C. Robion и соавторов (2001) свидетельствуют о том, что повторный лаваж коленных суставов лошадей не вызывает существенных изменений метаболизма хряща. Эти данные, безусловно, требуют подтверждения. Следовательно, для каждого биологического маркера на этапе преклинических исследований у животных необходимо определять влияние лаважа сустава на изменение его концентрации.
Следующим важным моментом является определение для каждого биологического маркера времени полужизни в синовиальной жидкости и в крови. Без таких данных интерпретация результатов анализов будет затруднена. Обычно время полужизни биологически активных веществ в крови меньше, чем в других жидких средах, в связи с эффективным клиренсом печенью и почками. Таким образом, для каждого биологического маркера также необходимо определять путь элиминации. Так, N-пропептид коллагена III типа выделяется печенью путем рецепторопосредованного эндоцитоза, а негликозилированные фрагменты коллагена выводятся главным образом смочойтакже, какостеокальцин. Наэндотелиальных клетках синусов печеночных долек имеются рецепторы к гликозаминогликанам, поэтому гиалуроновая кислота и протеогликаны элиминируются печенью. Время полужизни гиалуроновой кислоты в крови составляет 2-5 мин. Наличие синовита может ускорять клиренс биологических маркеров из суставов, хотя исследование у кроликов не обнаружило существенных различий клиренса протеогликанов при наличии и отсутствии синовита. Таким образом, необходимо исследовать влияние воспаления на изменения концентрации биологических маркеров в жидких средах организма.
Почки селективно фильтруют биологические маркеры. Так, гликозаминогликаны, несущие большой отрицательный заряд, могут не проникать через базальную мембрану почек, тогда как такие гликозаминогликаны, как хондроитин-6-сульфат и хондроитин-4-сульфат, определяются в моче.
Кроме патологии (в частности, остеоартроза) на концентрацию биологических маркеров в жидких средах организма могут влиять ряд факторов:
- Циркадные ритмы исследованы лишь для небольшого количества биологических маркеров. Для маркеров костного метаболизма они изучены. Так, пик концентрации остеокальцина приходится на ночные часы, а поперечных связей коллагена на утренние - на 8 ч. При ревматоидном артрите пик активности ИЛ-6 также приходится на ночные часы (около 2 ч), причем раньше, чем у остеокальцина. Эти данные представляют определенный интерес в отношении участия ИЛ-6 в воспалении и физиологии костной ткани. ФНО-а, напротив, не имеет циркадныхритмов. Однако рецепторы этого цитокина могут подчиняться им.
- Перистальтика. Гиалуроновая кислота синтезируется синовиальными клетками (а также многими другими клетками) и является потенциальным маркером синовита при остеоартрозе и ревматоидном артрите. Однако наиболее высокая концентрация гиалуроната обнаруживается в лимфатической системе кишечника. Не удивительно, что концентрация циркулирующей гиалуроновои кислоты может повышаться после еды. Таким образом, забор крови для определения биологических маркеров следует производить натощак или через 3 ч после еды. А влияние перистальтики на уровень биологических маркеров в крови требует изучения.
- Физическая активность утром после сна приводит к повышению концентрации гиалуроновои кислоты в крови, ММП-3 и эпитопа кератан-сульфата у здоровых лиц. Физическая нагрузка может изменять концентрацию некоторых маркеров как в синовиальной жидкости, так и в сыворотке крови. Такое повышение более выражено у больных с ревматоидным артритом, более того концентрация биологических маркеров коррелирует с клиническим состоянием этих больных.
- Болезни печени и почек. Цирроз печени вызывает значительное повышение уровня гиалуроновои кислоты в сыворотке крови и, вероятно, влияет на элиминацию протеогликанов. Известно, что болезни почек влияют на концентрацию остеокальцина. Данная проблема также требует более глубокого изучения.
- Возраст и пол. В процессе роста организма повышается активность клеток пластинки роста, что сопровождается повышением концентрации скелетных биологических маркеров в сыворотке крови. Примером может служить повышение концентрации фрагментов аггрекана и коллагена II типа в периферической крови и моче у растущих животных. Таким образом, интерпретация анализов биологических маркеров у детей и подростков с заболеваниями опорно-двигательного аппарата затруднена. Для многих биологических маркеров обнаружено повышение концентрации при старении. У мужчин концентрация биологических маркеров значительно превышает таковую у женщин в хрящевой и костной тканях. Кроме того, у женщин в менопаузальный и постменопаузальный периоды можно ожидать изменений концентрации биологических маркеров метаболизма хрящевой ткани подобно тому, что наблюдается в костной ткани.
- Хирургические операции также могут влиять на уровень биологических маркеров, более того, этот эффект может длиться несколько недель.
Основой концепции биологических маркеров остеоартроза является предположение, что они отражают определенные стороны метаболических процессов в тканях суставов. Однако взаимоотношения между концентрациями биологических маркеров в жидких средах организма и метаболизмом хрящевой, синовиальной и других тканей оказались очень сложными.
Так, например, концентрация маркеров деградации ВКМ суставного хряща в синовиальной жидкости может зависеть не только от степени деградации самого матрикса, но и от других факторов, таких, как степень элиминации фрагментов молекул из синовии, о чем уже было сказано выше, а также от количества хрящевой ткани, оставшейся в суставе.
Несмотря на вышеприведенные факты, концентрация биологических маркеров в синовиальной жидкости в общем коррелирует с метаболизмом молекул ВКМ суставного хряща. Так, например, изменения концентрации фрагментов аггрекана, эпитопа 846, ХОМБ и С-пропептида коллагена II в синовиальной жидкости после травмы сустава и при развитии остеоартроза согласуются с изменениями интенсивности метаболизма аггрекана, ХОМБ и коллагена II в экспериментальных моделях остеоартроза у животных/и vivo и в суставном хряще больных с остеоартрозом /и vitro.
Идентификация специфических источников молекулярных фрагментов - сложный процесс. Повышение степени высвобождения фрагментов молекул может происходить как за счет общего усиления процессов деградации, которые не компенсируются синтетическими процессами, так и за счет усиления деградации с одновременным повышением интенсивности синтеза тех же молекул ВКМ; в последнем случае концентрация молекул ВКМ не изменяется. Таким образом, необходим поиск маркеров, специфических для деградации и для синтеза. Примером первых могут быть фрагменты аггрекана, а вторых - С-пропептид коллагена 11.
Даже если биологический маркер связан с определенным аспектом метаболизма, необходимо учитывать специфические особенности этого процесса. Например, идентифицируемые фрагменты могут образовываться в результате деградации синтезированной de novo молекулы, которая еще не успела встроиться в функциональный ВКМ, молекулы, которая была только что встроена в ВКМ и, наконец, постоянной молекулы ВКМ, которая является важной функциональной частью зрелого матрикса. Проблемой также является определение специфической зоны матрикса (перицеллюлярный, территориальный и межтерриториальный матрикс), которая послужила источником биологических маркеров, обнаруженного в синовиальной жидкости, крови или моче. Исследования in vitro свидетельствуют о том, что интенсивность метаболизма в отдельных зонах ВКМ суставного хряща может быть различной. Исследование некоторых эпитопов, связанных с сульфатированием хондроитин сульфатов, могут способствовать идентификации популяции синтезированных de novo молекул аггрекана.
Можно предположить, что появление в суставной жидкости фрагментов молекул, в норме присутствующих в ВКМ хряща, связано с метаболизмом хрящевого матрикса. Однако это не всегда так, поскольку зависит от ряда факторов, в частности от того, насколько концентрация данной молекулы в суставном хряще превышает таковую в других тканях сустава и насколько интенсивность ее метаболизма в хряще превышает таковую в других тканях сустава. Так, общая масса аггрекана в суставном хряще значительно превышает таковую, например в менисках коленного сустава, при этом общая масса ХОМБ в менисках практически не отличается от таковой в суставном хряще. И хондроциты, и синовициты вырабатывают стромелизин-1, однако общее количество клеток в синовиальной оболочке превышает таковое в хряще, поэтому значительная часть обнаруженного в синовиальной жидкости стромелизина-1 скорее всего синовиального происхождения. Таким образом, идентификация специфического источника биологических маркеров чрезвычайно сложна и часто невозможна.
При исследовании биологических маркеров в сыворотке крови и моче появляется проблема определения возможного его внесуставного источника. Кроме того, при моноартикулярном поражении биологическими маркерами, выделяемые пораженным суставом, могут смешиваться с маркерами, выделяемыми интактными суставами, в том числе и контралатеральными. В состав суставного хряща входит менее чем 10% общей массы гиалинового хряща организма. Таким образом, определение биологических маркеров в крови и моче может быть обоснованным скорее при полиартикулярных, или системных, болезнях (применительно к остеоартрозу - при генерализованном остеоартрозе).
Требования к биологическим маркерам зависят оттого, с какой целью их применяют - в качестве диагностического, прогностического или оценочного теста. Например, диагностический тест определяет различия между здоровыми лицами и пациентами с остеоартрозом, что выражается понятием чувствительности и специфичности теста. Прогностический тест выявляет в когорте лиц, у которых наиболее вероятно быстрое прогрессирование болезни. И наконец, оценочный тест базируется на способности маркера мониторировать изменения во времени у отдельного пациента. Кроме того, биологические маркеры можно применять для определения чувствительности пациентов к тому или иному препарату.
Вначале предполагали, что биологические маркеры могут служить диагностическими тестами, которые помогут отличить пораженный остеоартрозом сустав от интактного, а также провести дифференциальную диагностику с другими болезнями суставов. Так, определение концентрации кератан сульфата в сыворотке крови рассматривали как диагностический тест для генерализованного остеоартроза. Однако последующие исследования показали, что данный биологический маркер может лишь отражать деградацию протеогликанов хряща в некоторых ситуациях. Оказалось, что концентрации биологических маркеров в сыворотке крови зависят от возраста и пола обследуемого лица.
Предполагаемые биологические маркеры метаболизма тканей суставов в синовиальной жидкости и сыворотке крови больных с остеоартрозом
Остеоартроз – заболевание, характеризующееся дегенеративными изменениями в суставах, которые могут приводить к значительному нарушению их функций.
Сустав – это подвижное соединение костей скелета. В норме движения в суставах осуществляются с минимальным трением суставных поверхностей в определенных направлениях с ограниченной амплитудой.
Суставы покрыты хрящевой тканью, которая имеет идеально гладкую поверхность. Также они окружены особой оболочкой – суставной сумкой. Внутренний слой суставной сумки – синовиальная оболочка продуцирует синовиальную жидкость, которая выполняет ряд важных функций: обеспечивает питание хрящей, смазывание суставных поверхностей для снижения трения при движениях.
Суставы укреплены связками, ограничивающими объем и направление движений.
При остеоартрозе нарушаются свойства суставных хрящей и они постепенно разрушаются. Это вызывает боль, ограничение подвижности, деформацию суставов.
По мнению исследователей, развитию заболевания способствует ряд факторов. Среди них выделяют следующие: возрастные дегенеративные изменения в суставных хрящах, избыточная масса тела, травмы суставов, генетическая предрасположенность, слабость мышечного аппарата, заболевания суставов (например, ревматоидный артрит), и др.
Остеоартроз широко распространен. Чаще характерные симптомы появляются в возрасте 40-50 лет. Рентгенологические признаки заболевания имеются более чем у 50 % людей старше 65 лет.
В большинстве случаев патологический процесс затрагивает крупные суставы, такие как бедренные, коленные, суставы позвоночника.
Лечение может быть консервативным и оперативным. Консервативная терапия направлена на уменьшение выраженности симптомов заболевания, замедление процессов дегенерации хрящевой ткани. Одним из направлений хирургического лечения является протезирование пораженных суставов.
Остеоартрит, деформирующий остеоартроз.
Osteoarthrosis, Osteoarthritis, Degenerative Joint Disease.
- Боль в пораженных суставах (усиливается при нагрузках и уменьшается после отдыха);
- скованность (особенно после длительного отсутствия двигательной активности, например утром после сна);
- ограничение объема движений в суставах;
- деформация пораженных суставов, припухлость;
- хруст, чувство трения при движениях;
- формирование костных выростов (узелков) на суставах кистей.
Общая информация о заболевании
Остеоартроз – дегенеративное заболевание суставов, которое может приводить к значительному нарушению их функций.
Он развивается в результате постепенного разрушения суставных хрящей. В норме хрящ имеет идеально гладкую поверхность и упругую структуру. Выделяемая синовиальной мембраной жидкость смазывает суставные поверхности, благодаря чему при движениях минимизируется трение в суставах. Амортизационные свойства хрящей смягчают толчки и удары, возникающие во время ходьбы, прыжков и других нагрузок.
Такие качества обеспечиваются особым строением хрящевой ткани. Она состоит из клеток – хондроцитов и синтезируемых ими компонентов межклеточного вещества: коллагена, углеводно-белковых компонентов (протеогликанов, гликозаминогликанов), гиалуроновой кислоты.
На начальных стадиях остеоартроза в хрящевой ткани появляются незначительные дефекты, и хондроциты начинают синтезировать повышенное количество протеогликанов для восстановления возникающих повреждений.
Со временем способность к синтезу протеогликанов снижается. Это вызывает уменьшение эластичности хряща и делает его более уязвимым при различных механических воздействиях. Постепенно толщина хряща уменьшается, в первую очередь это происходит в областях максимального давления на хрящевую ткань.
Наряду с процессами дегенерации хрящевой ткани запускаются механизмы восстановления. При этом вместо нормального хряща образуется грануляционная (рубцовая), фиброзно-хрящевая ткань. В подлежащем слое кости размножение клеток приводит к формированию выростов (остеофитов). Таким образом, постепенно хрящевая ткань утрачивает свои свойства, движения в суставах значительно затрудняются, возникает боль, которая усиливается при нагрузках на пораженные суставы.
Механизмы дегенерации хрящевой ткани при остеоартрозе одинаковы, вне зависимости от вызвавших ее причин. Среди факторов, которые способствуют развитию этого заболевания, выделяют следующие.
- Возрастные изменения в хрящевой ткани. С возрастом уменьшается ее эластичность, снижается способность к синтезу компонентов хряща, ухудшается его питание.
- Повышенная нагрузка на суставы. При остеоартрозе чаще поражаются суставы, испытывающие максимальное механическое воздействие. К ним относятся коленные, бедренные суставы, суставы позвоночника. Факторами риска могут быть избыточная масса тела или длительная повышенная нагрузка (например, при занятиях определенными видами спорта).
- Травмы, оперативные вмешательства на суставах.
- Генетическая предрасположенность.
- Врождённые нарушения структуры суставов могут впоследствии приводить к повреждению суставных хрящей.
- Слабость мышц. При ослабленном мышечном аппарате нагрузка на суставы возрастает.
- Различные заболевания, при которых изменяются структура и функции суставных хрящей (например, подагра).
В настоящее время не существует препаратов, которые способны остановить процесс разрушения хрящевой ткани или эффективно восстановить ее. При значительных нарушениях функции суставов применяется протезирование, после которого у большинства пациентов отмечаются хорошие результаты. В зависимости от уровня активности пациента, через 10-15 лет после этого может потребоваться повторное оперативное вмешательство.
Кто в группе риска?
К группе риска относятся:
- лица старшего возраста,
- перенесшие травмы суставов,
- имеющие избыточную массу тела,
- ведущие малоподвижный образ жизни,
- лица, образ жизни которых связан с постоянными нагрузками на определенные суставы (например, на коленные суставы при поднятии тяжестей),
- имеющие врождённые суставные дефекты,
- страдающие некоторыми заболеваниями, например сахарным диабетом, подагрой).
- Общий анализ крови. Позволяет определить основные параметры в крови: количество эритроцитов, гемоглобина, лейкоцитов, тромбоцитов в крови. При остеоартрозе показатели общего анализа крови в норме, в отличие от некоторых болезней суставов, при которых может повышаться уровень лейкоцитов (например, при ревматоидном артрите).
- Скорость оседания эритроцитов (СОЭ). Неспецифический показатель протекания различных патологических процессов в организме, в основном воспалительной природы. При остеоартрозе СОЭ может быть несколько повышена.
- С-реактивный белок, количественно (метод с нормальной чувствительностью). Один из наиболее чувствительных маркеров воспаления и повреждения тканей. Синтезируется в печени. Уровень данного белка повышен и коррелирует с активностью воспалительного процесса при различных заболеваниях суставов (при ревматоидном артрите). При остеоартрозе этот показатель находится в переделах нормы или повышен незначительно.
- Мочевая кислота в сыворотке. Конечный продукт распада пуриновых соединений, которые входят в состав всех клеток организма. В организме пурины появляются в результате естественной гибели клеток, а также часть поступает с пищей (с красным мясом, красным вином). При избыточном накоплении мочевой кислоты (вследствие повышенного ее образования или недостаточного выведения) развивается специфическое воспаление суставов – подагра. Анализ может быть использован для дифференциальной диагностики остеоартроза и подагры.
- Рентгенография. Позволяет выявить характерные изменения в суставах на разных стадиях заболевания (например, сужение суставной щели, формирование костных выростов – остеофитов).
- Магнитно-резонансная томография (МРТ). Принцип метода основан на воздействии на структуры организма сильного магнитного поля, затем полученная информация регистрируется и обрабатывается на компьютере. Послойные изображения суставов дают возможность оценить степень дегенеративных изменений с высокой точностью, что важно для определения дальнейшей тактики лечения.
- Артроцентез – пункция сустава. Производится с помощью специальной иглы со шприцом. На лабораторный анализ берется синовиальная жидкость. Исследование помогает отличить остеоартроз от других заболеваний суставов, которые могут вызывать похожие проявления.
Обратить изменения, которые уже произошли в пораженных суставах при остеоартрозе, нельзя. Целью консервативной терапии является уменьшение выраженности симптомов заболевания, замедление процессов дегенерации и разрушения суставных хрящей.
Применяются следующие основные группы препаратов:
- нестероидные противовоспалительные препараты – способствуют уменьшению воспаления и болей;
- кортикостероиды – препараты гормонов коры надпочечников, которые обладают противовоспалительным действием; при остеоартрозе используются в виде внутрисуставных инъекций;
- препараты, укрепляющие хрящевую ткань – группа лекарств, в состав которых входят компоненты хрящевой ткани (хондроитина сульфат, гиалуроновая кислота, глюкозаминогликаны); способствуют замедлению процессов дегенерации хрящевой ткани.
Из хирургических методов применяется остеотомия (рассечение костей с их последующей фиксацией), способствующая более выгодному положению кости для снижения нагрузки на сустав, протезирование.
Важную роль в лечении играет изменение образа жизни, выполнение комплексов физических упражнений для укрепления мышечно-связочного аппарата суставов.
- Сохранение нормальной массы тела.
- Выполнение физических упражнений, но без чрезмерной нагрузки на отдельные суставы.
- Избегание длительного пребывания в фиксированных позах.
Рекомендуемые анализы
Литература
- Dan L. Longo, Dennis L. Kasper,J. Larry Jameson, Anthony S. Fauci, Harrison's principles of internal medicine (18th ed.). New York: McGraw-Hill Medical Publishing Division, 2011.Chapter 332. Osteoarthritis.
Читайте также:


