Русский медицинский журнал остеоартроз
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Согласно современным представлениям остеоартроз (ОА) – это гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими и клиническими проявлениями, при которых в патологический процесс вовлекаются все структуры сустава: хрящ, субхондральная кость, связки, суставная капсула, синовиальная оболочка и периартикулярные мышцы [1].
По данным статистики, в Российской Федерации распространенность ОА за последние годы возросла на 48%, а ежегодная первичная заболеваемость – более чем на 20%, что связано с глобальным старением населения [2]. ОА встречается у каждого третьего пациента в возрасте от 45 до 64 лет и у 60–70% – старше 65 лет, при этом соотношение мужчин и женщин составляет 1:3, а при ОА тазобедренных суставов – 1:7 [3]. По данным ВОЗ, ОА коленных суставов находится на 4-м месте среди основных причин нетрудоспособности у женщин и на 8-м месте у мужчин.
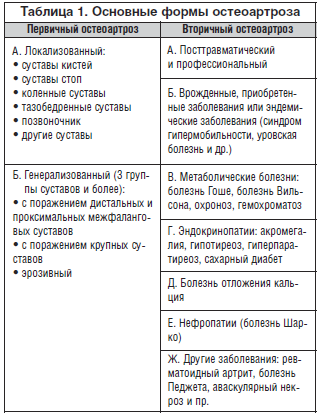
Различают первичный и вторичный ОА. Первичный, или идиопатический, ОА имеет 2 формы: локальную и генерализованную. Локальная форма характеризуется поражением 1-го или 2-х суставов (ОА суставов кистей, стоп, коленного, тазобедренного суставов, ОА позвоночника); для генерализованной формы (полиостеоартроз) характерно поражение 3-х и более суставов или группы суставов. Особые формы первичного генерализованного ОА – узловой и эрозивный ОА. Среди локальных форм наиболее часто встречаются ОА коленных (гонартроз) и тазобедренных (коксартроз) суставов.
Вторичный ОА развивается в результате травмы, врожденной дисплазии опорно-двигательного аппарата, эндокринных заболеваний (акромегалия, гиперпаратиреоз, сахарный диабет), метаболических нарушений (охроноз, гемохроматоз, подагра) и других заболеваний костей и суставов (ревматоидный артрит, инфекционные артриты, асептические некрозы костей).
В настоящее время ОА рассматривается как мультифакториальное заболевание, развитию которого способствуют генетические, приобретенные и внешнесредовые факторы риска (табл. 1).
Большое значение в развитии ОА придается метаболическим нарушениям. Установлено, что метаболический синдром независимо от индекса массы тела (ИМТ) повышает риск развития тяжелого гонартроза, но не коксартроза, а уровень адипокинов в крови прямо коррелирует с развитием ОА кистей [4].
В развитии ОА ключевую роль играют нарушения метаболизма хряща, воспаление и изменения субхондральной кости. Воспалительный процесс затрагивает практически все структуры сустава с формированием хондрита, синовита и остеита. Хронический воспалительный процесс в синовиальной оболочке способствует изменению метаболизма хондроцитов и нарушению баланса между анаболическими и катаболическими процессами с преобладанием последних.
В основе нарушения метаболизма хряща лежат количественные и качественные изменения протеогликанов – белково-полисахаридных комплексов, обеспечивающих стабильность структуры коллагеновой сети, которая является основой хрящевого матрикса. При ОА концентрация протеогликанов снижается. Имеют значение активация матричных протеиназ (коллагеназы, фосфолипазы А2), гиперэкспрессия провоспалительных цитокинов (интерлейкин (ИЛ) -1, фактор некроза опухоли-α) и дефицит противовоспалительных цитокинов, например, трансформирующего фактора роста-β и ингибитора плазминогена-1, которые усиливают катаболические процессы в пораженном хряще [5]. Кроме того, цитокины способны тормозить синтез ингибиторов энзимов, что приводит к увеличению активности протеаз. Избыточное накопление ферментов в матриксе хряща запускает лизосомальный путь клеточного повреждения, разрушение коллагеновых волокон II типа и деградацию протеогликановых макромолекул, что ведет к дальнейшей деградации матрикса хряща.
Один из механизмов деструктивных процессов в суставах связан с гиперэкспрессией изоформы синтетазы оксида азота (NO) – фермента, регулирующего образование NO под действием ИЛ-1. Повышение уровня NO приводит к развитию резистентности хондроцитов к действию факторов роста, что подавляет синтез компонентов хрящевого матрикса, а также индуцирует апоптоз хондроцитов. Однако в настоящее время уделяется большое внимание состоянию субхондральной кости как фактору риска и прогрессирования ОА. Большую роль в патогенезе ОА отводят супероксидным радикалам, уменьшению синтеза синовиоцитами гиалуроновой кислоты, а также гиперпродукции простагландина Е2, который стимулирует активность остеобластов и индуцирует фибропластическую дегенерацию хряща [6].
Как известно, при ОА наиболее выраженные патоморфологические изменения происходят в хрящевом матриксе. Хрящ из прочного и эластичного превращается в сухой и тусклый, с шероховатой поверхностью. Ранняя стадия ОА характеризуется набуханием и разволокнением коллагенового каркаса. Далее в хряще нарастают процессы деградации с разрушением протеогликанов протеазами, что приводит к истончению и размягчению хряща в местах максимальной нагрузки. На поздних стадиях происходит фрагментация хряща с образованием в нем вертикальных трещин. Местами хрящ обызвествляется. Растрескивание хряща приводит к его изъязвлению с обнажением подлежащей субхондральной кости и отделением фрагментов, которые поступают в полость сустава в виде детрита. При истонченном хрящевом покрове распределение давления между суставными поверхностями становится неравномерным. Это ведет к локальным перегрузкам, появлению участков остеосклероза, субхондральных кист и возникновению остеофитов [7].
Основные клинические проявления ОА – это боль, деформация и тугоподвижность суставов. Боль носит неоднородный характер и имеет разнообразные механизмы возникновения:
При наличии синовита, помимо боли в суставе, отмечаются утренняя скованность, припухлость сустава и гипертермия над ним. По мере прогрессирования заболевания рецидивы синовита учащаются. Постепенно развиваются деформация и тугоподвижность суставов за счет развития фиброзно-склеротических и гипотрофических изменений периартикулярных тканей. При прогрессировании заболевания на снижение объема движений влияют сухожильно-мышечные контрактуры, остеофиты и нарушение конгруэнтности суставных поверхностей.
К основным факторам риска прогрессирования гонартроза относят хроническую микротравматизацию хряща, возраст пациентов, ожирение, избыточную нагрузку на суставы, врожденные или приобретенные дефекты опорно-двигательного аппарата, наследственную предрасположенность (узелки Гебердена встречаются в 2 раза чаще у матерей и в 3 раза чаще у сестер больного ОА), выраженный болевой синдром, рецидивирующий синовит коленных суставов.
Диагностика ОА основывается на классификационных критериях Американской коллегии ревматологов и базируется на оценке клинических проявлений, лабораторных и рентгенологических признаков поражения суставов в зависимости от локализации процесса.
Классификационные критерии ОА суставов кистей [8]
Боль или скованность в суставах кистей при наличии не менее 3-х из 4-х критериев:
1) костные разрастания 2-х и более суставов из 10 оцениваемых*;
2) менее 2-х припухших пястно-фаланговых суставов;
3) костные разрастания, включающие 2 и более дистальных межфаланговых суставов;
4) деформация 1-го и более суставов кисти из 10-ти оцениваемых*.
Чувствительность – 94%, специфичность – 87%.
Классификационные критерии ОА тазобедренных
Боль в тазобедренном суставе в течение большинства дней предыдущего месяца и не менее 2-х из следующих 3-х критериев:
2) наличие остеофитов на рентгенограмме;
3) выявление сужения суставной щели на рентгенограмме.
Чувствительность – 89%, специфичность – 91%.
Классификационные критерии ОА коленных суставов
Боль в колене в течение большинства дней предыдущего месяца, наличие остеофитов на рентгенограмме плюс 1 из следующих 3-х критериев:
1) возраст >50 лет;
2) утренняя скованность Литература
- Клинические рекомендации. Ревматология / под ред. акад. Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2011. С. 326–345.
- Фоломеева О.М., Эрдес Ш.Ф. Распространенность и социальная значимость ревматических заболеваний в Российской Федерации // Доктор (ревматология). 2007. № 10. С. 3–12.
- Arden N., Nevitt M.C. Osteoarthritis: Epidemiology // Best Practice & Research Clinical Rheumatology. 2006. Vol. 20 (1). Р. 3–25.
- Yusuf E. Metabolic factors in osteoarthritis: obese people do not walk on their hands // Arthritis Research & Therapy. 2012. Vol. 14. Р. 123.
- Goldriring M.B. The role of the chondrocyte in osteoarthritis // Arthritis Rheum. 2000. Vol. 43 (9). Р. 1916–1926.
- Mastbergen S.C., Bijlsma J.W.J., Lafeber F.P.J.G. PROTEOGLYCAN SYNTHESIS AND RELEASE OF HUMAN ARTICULAR CARTILAGE DEPEND ON DIFFERENT PATHWAYS // Ann Rheum Dis. 2006. Vol. 65. Р. 120.
- Cустав: морфология, клиника, диагностика, лечение / под ред. В.Н. Павловой, Г.Г. Павлова, Н.А. Шостак, Л.И. Слуцкого. М.: Медицинское информационное агентство, 2011. С. 374–397.
- Altman R., Alarcon G., Appelrouth D. et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand // Arthritis Rheum. 1990. Vol. 33. Р. 1601–1610.
- Altman R., Alarcon G., Appelrouth D. et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip // Arthr. Rheum. 1991. Vol. 34. Р. 505–514.
- Zhang W., Doherty M., Peat G. et al. EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis // Ann Rheum Dis. 2010. Vol. 69 (3). Р. 483–489.
- Шостак Н.А. Остеоартроз-2013 – новые направления в лечении // Фарматека. 2013. № 7 (260). С. 17–22.
- Tan Pham, Cornea A., Blick K.E. et al. Oral Glucosamine in Doses Used to Treat Osteoarthritis Worsens Insulin Resistance // Am J Med Sci. 2007. Vol. 333 (6). Р. 333–339.
- Ronca F., Palmieri L., Panicucci P., Ronca G. Antiinflammatory activity of chondroitin sulfate // Osteoarthritis Cartilage. 1998. Vol. 6. Р. 14–21.
- Алексеева Л.И., Аникин С.Г., Зайцева Е.М. и др. Исследование эффективности, переносимости и безопасности препарата хондрогард у пациентов с остеоартрозом // Фарматека. 2013. № 7. С. 60–64.
- Пешехонова Л.К., Пешехонов Д.В. Современные тенденции патогенетической терапии остеоартроза // РМЖ. 2012. № 30. С. 1500–1503.
Только для зарегистрированных пользователей
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Остеоартроз (ОА) представляет собой одно из самых распространенных заболеваний опорно-двигательного аппарата с высокой вероятностью инвалидизации пациентов. Это гетерогенная группа заболеваний различной этиологии, со сходными морфологическими, биологическими и клиническими признаками, при которых в патологический процесс вовлекаются не только суставной хрящ, но и субхондральная кость, связки, суставная капсула, синовиальная мембрана и периартикулярные ткани. В патогенезе ОА важную роль играют также ремоделирование тканей сустава, определяемое провоспалительными медиаторами, вовлечение сосудистой сети с развитием внутрикостной гипертензии и очаговой гипоксии тканей.
В статье представлены современные подходы к терапии данного заболевания, основанные на обзоре последних европейских, американских и российских рекомендаций.
В качестве основного принципа рассматривается сочетание фармакологических и нефармакологических методов лечения, обязательным является обучение больного. Основная цель медикаментозной терапии состоит в устранении боли посредством анальгетиков и нестероидных противовоспалительных препаратов (НПВП). При купировании болевого синдрома необходимо учитывать наличие реактивного синовита, вовлечение периартикулярных тканей, сосудистый, нейропатический компоненты, формирование болевого поведения. Помимо быстродействующих препаратов в арсенале врача имеются медленнодействующие симптоматические препараты (SYSADOA), направленные на торможение деструктивного процесса в хрящевой ткани и прогрессирования заболевания. Согласно международным и российским рекомендациям лечение должно быть персонифицированным, с учетом индивидуальных особенностей больного и коморбидной патологии.
Ключевые слова: остеоартроз, алгоритм лечения, купирование боли, хондропротекторы, медленнодействующие препараты, глюкозамин, хондроитин сульфат, коморбидность.
Для цитирования: Лапшина С.А., Мухина Р.Г., Мясоутова Л.И. Остеоартроз: современные проблемы терапии // РМЖ. Ревматология. 2016. № 2. С. –101.
Для цитирования: Лапшина С.А., Мухина Р.Г., Мясоутова Л.И. Остеоартроз: современные проблемы терапии. РМЖ. 2016;2:95-101.
Osteoarthrosis (OA) is one of the most common musculoskeletal disorders which often results in disability. OA is considered as a heterogeneous cluster of diseases with various etiology but similar morphological, biological, and clinical features. Pathogenic process affects articular cartilage, subchondral bone, ligaments, synovial membrane, and periarticular tissues. Tissue remodeling mediated by proinflammatory molecules and vascular disorders which provoke intraosseous hypertension and focal tissue hypoxia play an important role in OA pathogenesis. The paper discusses current treatment approaches to OA based on the recent European, American, and Russian guidelines. The combination of pharmacotherapy and non-pharmacological methods as well as mandatory patient education are the key components of OA treatment. The primary goal of medical therapy is to reduce pain with analgesics and non-steroidal anti-inflammatory drugs (NSAIDs). When prescribing analgesics, one should consider the presence of reactive synovitis, periarticular tissue involvement, vascular and neuropathic components, and pain behavior. In addition to fast-acting drugs, there are symptomatic slow-acting drugs for OA (SYSADOA) which prevent cartilage destruction and disease progression. According to the international and Russian guidelines, the treatment should be personalized and consider patient’s characteristics and comorbidities.
Keywords: osteoarthrosis, treatment approach, pain relief, chondroprotectors, SYSADOA, glucosamine, chondroitin sulfate, comorbidity.
For citation: Lapshina S.A., Mukhina R.G., Myasoutova L.I. Osteoarthrosis: current issues in the therapy // RMJ. Rheumatology. 2016. № 2. P. 95–101.
Статья посвящена современным проблемам терапии остеоартроза
Остеоартроз (ОА) – наиболее распространенное ревматическое заболевание, приводящее к нарушению функциональной способности опорно-двигательного аппарата и представляющее собой большую медико-социальную проблему.
Термином ОА в настоящее время определяют гетерогенную группу заболеваний различной этиологии, но со сходными морфологическими, биологическими и клиническими признаками, при которых в патологический процесс вовлекаются не только суставной хрящ, но и все структуры сустава: субхондральная кость, связки, суставная капсула, синовиальная мембрана и периартикулярные мышцы [1, 2].
ОА наблюдается более чем у 10–20% населения мира, представляет собой возрастное заболевание, однако нередко встречается и в молодом возрасте [3]. Ряд исследователей считает, что к 2020 г. ОА будет страдать 71% населения в возрасте старше 65 лет. В РФ также неуклонно растет заболеваемость ОА. По данным официальной статистики Минздрава России, число первично зарегистрированных больных с этой патологией ежегодно увеличивается: если в 2011 г. этот показатель составлял 650,5 на 100 тыс. населения, то в 2012 г. он достиг 665,1 [4]. Однако следует отметить, что включены в статистику лишь пациенты, обратившиеся в то или иное лечебное учреждение.
При ОА поражаются прежде всего нагрузочные суставы (коленные и тазобедренные), что значительно ухудшает качество жизни больных из-за постоянного болевого синдрома и является серьезной социально-экономической проблемой. Болевой синдром при ОА, согласно последним данным, повышает кардиоваскулярную летальность и смертность. Таким образом, ОА влияет на жизненный прогноз и является одной из основных причин преждевременной утраты трудоспособности, требуя затрат на медицинское обслуживание. При прогрессировании болезни возникает необходимость в эндопротезировании, что повышает стоимость лечения и требует выделения дополнительных средств для помощи больным [6, 7]. По данным ВОЗ, только гонартроз находится на 4-м месте среди основных причин нетрудоспособности у женщин и на 8-м – у мужчин [8].
В развитии этого заболевания принимают участие несколько факторов, включая иммунологические, биохимические и генетические, т. е. для ОА характерна мультифакториальность поражения [9].
В основе ОА лежат нарушение адаптации суставного хряща к механической нагрузке, смещение баланса обмена хрящевой ткани в сторону катаболических процессов. К дегенерации суставного хряща приводят недостаточный синтез хондроцитами протеогликанов и фрагментация протеогликановых агрегатов [10]. В настоящее время, говоря о патогенезе ОА, активно обсуждают вопросы первичности изменений субхондральной кости, являющейся метаболически активной тканью [11]. Данные последних исследований свидетельствуют о том, что ОА следует рассматривать как аномальное ремоделирование тканей сустава, определяемое провоспалительными медиаторами, такими как интерлейкин (ИЛ)-1β, -6 , -8, -17, фактор некроза опухоли (ФНО), онкостатин, оксид азота [12]. Таким образом, формируется персистирующее воспаление в тканях сустава, поэтому заболевание имеет полное основание именоваться остеоартритом [9, 13]. В целом морфологические изменения синовии при ОА сопоставимы с картиной синовита при хроническом артрите. Секретируемые синовиальной оболочкой провоспалительные медиаторы могут не только приводить к деструкции суставного хряща, но и активизировать свертывающую систему крови, приводя к образованию микротромбов в сосудистом русле субхондральной кости. Повреждение сосудистой сети способствует развитию внутрикостной гипертензии с очаговой гипоксией и ишемией кости и, как следствие, усугублению болевого синдрома при ОА [14, 15].
Сложности ведения больных ОА связаны в первую очередь с наиболее частым развитием заболевания у лиц старше 40 лет, когда характерна ассоциация с большим спектром коморбидных заболеваний. Наиболее часто ОА сочетается с артериальной гипертензией, атеросклерозом, ишемической болезнью сердца, ожирением, сахарным диабетом, хроническими обструктивными заболеваниями легких, заболеваниями желудочно-кишечного тракта (ЖКТ). Распространенность данных коморбидных состояний примерно в 2–3 раза выше при ОА, чем в общей популяции [3]. Примерно у половины пациентов встречается сочетание ОА с заболеваниями периферических вен нижних конечностей. Нарушение периферического венозного кровообращения сопровождается повышенным венозным давлением и явлениями застоя в венах, приводит к нарушению кровоснабжения сустава и связано с наличием локальной воспалительной активности, интенсивностью болевого синдрома [16].
В последние годы разработан ряд рекомендаций по ведению пациентов с ОА: Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартроза (ESCEO) [17, 18], Европейской антиревматической лиги (EULAR) [19], Международного научного общества по изучению остеоартроза (OARSI) [20], Консенсуса экспертов Российской Федерации [21]. Во всех рекомендациях в качестве основного принципа рассматривается сочетание фармакологических и нефармакологических методов лечения. В новых рекомендациях OARSI, а также рекомендациях российских экспертов делается акцент на персонифицированном подходе к лечению ОА с учетом коморбидности и безопасности терапии [20, 21].
Обучение больных должно быть обязательным компонентом всех терапевтических программ при ОА и проводиться с учетом индивидуальных особенностей больного. Оно призвано обеспечить понимание больным сути своего заболевания и умение контролировать его, способствовать приверженности лечению, уменьшению болевого синдрома и улучшению функции суставов [17–21]. Необходимым является ежедневное выполнение упражнений для развития мышечной массы, подвижности суставов, которые оказывают минимальную нагрузку на суставной хрящ, а в большей степени обеспечивают работу мышцы, окружающей сустав: укрепление силы четырехглавой мышцы бедра, а также аэробные нагрузки: ходьба по ровной местности в умеренном темпе, посещение бассейна [17–20].
Важной составляющей терапии является минимизация модифицируемых факторов риска заболевания: повышенной нагрузки на сустав и избыточного веса. Снижение веса позитивно влияет на структурные изменения в хряще и биохимические маркеры обмена хряща и кости, поскольку адипокины – цитокины, синтезируемые жировой тканью, например лептин, резистин, адипонектин, способны поддерживать синовиальное воспаление [10].
Основные цели медикаментозной терапии – уменьшение или купирование болевого синдрома, улучшение функции сустава и повышение качества жизни пациента. Именно выраженный болевой синдром является основным симптомом ОА и поводом для обращения больных за медицинской помощью, приводит к формированию болевого поведения, служит независимым предиктором прогрессирования болезни [22–24].
Исторически анальгетическая терапия ОА в первую очередь связана с применением парацетамола и нестероидных противовоспалительных препаратов (НПВП) [25, 26]. Согласно международным рекомендациям, следует начинать лечение с парацетамола. Но в низких дозах он слабо влияет на купирование болевого синдрома, а повышение доз резко увеличивает риски серьезных осложнений терапии, особенно у пожилых людей, нередко имеющих заболевания печени [27]. НПВП же позволяют существенно снизить интенсивность болевого синдрома, однако они обладают негативным действием на сердечно-сосудистую систему и ЖКТ, кроме того, не предотвращают деструктивные изменения хрящевой ткани и субхондральной кости [25, 26]. Наоборот, некоторые НПВП (салицилаты, индометацин) при длительном применении в течение нескольких месяцев приводят к усилению деструкции хряща, угнетая синтез простагландинов, пролиферацию хондроцитов [11, 12]. Поэтому в современных рекомендациях указано на необходимость кратковременного применения НПВП, предпочтительно селективных НПВП (ингибиторов циклооксигеназы-2), в ряде случаев – напроксена и низких доз ибупрофена [17, 18].
Наличие массы побочных реакций, особенно у пожилых пациентов, многие из которых принимают препараты по поводу сопутствующих заболеваний, необходимость учитывать взаимодействие препаратов делают привлекательным использование местных средств для лечения ОА [9]. Мази, гели, кремы на основе НПВП могут уменьшить потребность в приеме системных препаратов.
При купировании болевого синдрома необходимо учитывать наличие реактивного синовита с характерной припухлостью сустава и локальным повышением температуры. При явно выраженном процессе пациенты жалуются на быструю мышечную утомляемость. Возможно появление полной блокады сустава.
При неэффективности НПВП, наличии хронического синовита, сохраняющемся болевом синдроме рекомендуется внутрисуставное введение пролонгированных глюкокортикоидов. При OA глюкокортикоиды вводят только в колен¬ные суставы. Эффект лечения, выражающийся в уменьшении боли и симптомов воспаления, длится от 1 нед. до 1 мес. Применяют метилпреднизолон (20–40 мг), бетаметазон (2–4 мг). Вводить их не следует более 2—3 раз в год.
Природа болевого синдрома при ОА считается мультифакториальной – в формирование единой картины боли вовлекаются многие компоненты [9, 22, 28, 29]. Следовательно, распознавание симптомов и купирование боли представляют для клинициста сложную задачу. Свой вклад в формирование хронического болевого синдрома могут вносить вовлечение периартикулярных (мышечных) тканей, сосудистый, полинейропатический компоненты, формирование болевого поведения (табл. 1) [28].

Так, повышенное напряжение скелетных мышц ухудшает функциональную активность и качество жизни больного. Каждое локальное болевое раздражение вызывает спинальный сенсомоторный рефлекс и приводит к спазму мышц, в мышце формируются триггерные точки, возникает порочный круг: боль – мышечный спазм – боль. Следовательно, больному могут назначаться миорелаксанты. При лечении нейропатической боли оправданно назначение прегабалина, дулоксетина и других антидепрессантов [20, 21, 29].
Помимо быстродействующих анальгетических препаратов в арсенале врача имеются медленнодействующие симптоматические препараты (Symptomatic Slow Acting Drugs for Osteoarthritis (SYSADOA)), направленные на торможение деструктивного процесса в хрящевой ткани и прогрессирования заболевания, рекомендованные для лечения ОА ESCEO, EULAR, OARSI, российскими экспертами [17–21]. Согласно международным и российским рекомендациям, именно SYSADOA используют в инициальной терапии боли при ОА (рис. 1). Среди них хондроитин сульфат (ХС), глюкозамин сульфат (ГС), препараты авокадо/сои, гиалуроновой кислоты, диацерин. Пожалуй, наибольшую доказательную базу имеют ГС и ХС, чье противовоспалительное действие связано с подавлением экспрессии ядерного фактора транскрипции NF-B, провоспалительных цитокинов, матриксных металлопротеиназ, оксида азота (NO) и простагландинов [31–35]. ГС снижает дефицит гликозаминогликанов в организме, является специфическим субстратом и стимулятором синтеза гиалуроновой кислоты и протеогликанов, способствует восстановлению хрящевых поверхностей суставов [31]. За последние десятилетия проведено большое количество исследований с применением ХС и ГС при ОА, где показано достоверное замедление сужения суставной щели, а также то, что симптоматический эффект лечения не уступает с течением времени эффекту НПВП, при этом их безопасность не отличается от таковой плацебо. Помимо этого, данным препаратам свойственно наличие последействия, т. е. сохранения эффекта после отмены от 4 нед. до 3 мес. Данные препараты, купируя боль и воспаление, снижают потребность в приеме НПВП, уменьшают негативное воздействие последних [31–35].
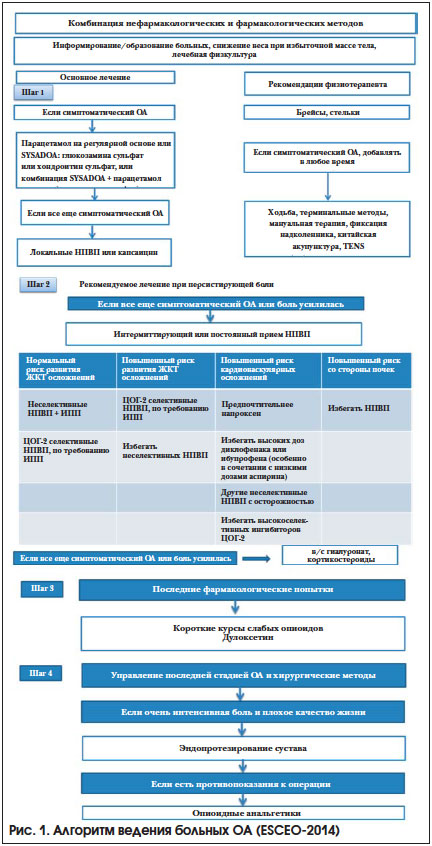
В ESCEO целевая группа выступает за использование глюкозамина в качестве препарата первой линии SYSADOA для контроля симптомов ОА коленного сустава. Эффективной суточной дозой ГС считается доза 1500 мг и выше [17].
Наравне с ГС в рекомендации EULAR (а также OARSI) входит и ХС. На сегодняшний день большая часть препаратов ХС применяется перорально. При попадании в ЖКТ происходит частичное разрушение препарата, его биодоступность снижается. Внутримышечное введение может увеличивать биодоступность ХС и повышать эффективность терапии ХС. Кроме того, использование SYSADOA в инъекционной форме позволяет сократить количество таблетированных препаратов у пациента с коморбидной патологией, уменьшая возможности их взаимодействия [36].
Препаратом ХС в инъекционной форме является Хондрогард. Хондрогард назначается по 100 мг через день. При хорошей переносимости дозу увеличивают до 200 мг, начиная с 4-й инъекции. Курс лечения — 25–30 инъекций. При необходимости через 6 мес. возможно проведение повторного курса лечения. В последние годы проведено достаточно большое количество исследований, в которых продемонстрированы преимущества инъекционной формы данного препарата у разных групп больных, в т. ч. показана его эффективность и у пациентов с серьезной сопутствующей патологией, прежде всего кардиоваскулярной [36, 37].
По заключению экспертов (как OARSI, так и российских), именно ГС и ХС можно использовать для купирования симптомов боли и воспаления у коморбидных пациентов с гонартрозом и генерализованной формой ОА [20]. При этом больным с локальной формой заболевания практически не рекомендуется системная терапия (рис. 2).

Несмотря на появление новых препаратов для лечения ОА, проблема терапии данного заболевания остается достаточно сложной для практического врача, сопряженной с необходимостью тщательной оценки клинической симптоматики, определения компонентов болевого синдрома, учета коморбидных состояний.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
В статье подробно рассмотрены патогенетические и терапевтические аспекты остеоартроза

Причины возникновения ОА. На сегодняшний день ОА считается мультифакториальным и полиэтиологическим заболеванием. К основным факторам риска возникновения ОА относят пожилой возраст, женский пол и суставные перегрузки (чрезмерную физическую активность, ожирение). Выделяют 2 основные формы остеоартроза: первичный (идиопатический) ОА с неясной этиологией и вторичный ОА, возникающий в уже пораженном суставе на фоне различных заболеваний (табл. 1).
Патофизиология ОА изучена далеко не полностью. Очевидно, что в его развитии принимает участие целый ряд факторов, взаимодействующих между собой на биохимическом и механическом уровне, что и приводит к возникновению и прогрессированию заболевания [5].
Хрящ – основной компонент сустава, подвергающийся дегенерации при ОА; вместе с ним страдают и другие субхондральные, капсульные, синовиальные и околосуставные структуры [6 ,7]. Суставной хрящ состоит из матрикса и погруженных в него хондроцитов. Матрикс в свою очередь содержит 2 главные макромолекулы: гликозамины (протеогликаны) и коллаген. ОА характеризуется снижением содержания коллагена и протеогликанов, структура и биомеханические свойства внеклеточного матрикса нарушаются. В частности, потеря гликозаминов приводит к снижению сопротивления матрикса воздействию физической нагрузки, и поверхность хряща становится чувствительной к повреждению.
Основные патологические процессы, приводящие к разрушению хряща, происходят в хондроцитах: чрезмерное местное высвобождение протеолитических ферментов (металлопротеиназ, разрушающих матрикс) и прогрессивное замедление репарации хряща приводят к дисбалансу между синтезом и деградацией внеклеточного матрикса. Кроме того, на хондральном уровне синтезируется широкий спектр биоактивных молекул: провоспалительных цитокинов IL-1, -8, -17, -18 и TNF-α, свободных радикалов (NO), фактор роста (TGF-β), липидные медиаторы (простагландин Е2, лейкотриен B4) [8]. Этот воспалительный компонент сосуществует и усиливает дегенеративные механизмы. Воспаление развивается в первую очередь в синовиальной оболочке. Синовиальная мембрана выполняет фильтрацию строительного материала хряща — гиалуроновой кислоты, т. е. предохраняет вымывание последней из полости сустава. Нарушение биохимического состава синовиальной жидкости приводит к прогрессированию дегенерации хряща. Таким образом, страдают все структуры сустава: обнаруживаются дегенерация хряща, его патологическая гипертрофия и кальцификация, формируются костные выросты – остеофиты, происходит склероз субхондральной кости, истончается и повреждается мениск (рис. 2) [9].

Хондроциты вблизи поверхностного слоя хряща образуют кластеры, а в глубоких слоях подвергаются апоптозу. Пролиферация хондроцитов активизируется, но не может противостоять преобладающей катаболической активности. Хондроциты производят деструктивные ферменты – ADAMTS5, MMP13.
Исходя из вышеописанных механизмов, ведущими направлениями борьбы с ОА считаются модуляция воспаления, регуляция метаболизма хондроцитов и стимуляция синтеза хряща [10]. К сожалению, даже при условии постоянного лечения значительное число пациентов продолжают страдать от хронического болевого синдрома.
Структурные изменения при ОА принято подразделять на 4 рентгенологические стадии (классификация ОА по Kellgren – Lawrence) [11]:
• 0 стадия – отсутствие рентгенологических признаков;
• I стадия (сомнительный) – сомнительное сужение суставной щели, возможны остеофиты;
• II стадия (мягкий) – определенные остеофиты и сомнительное сужение суставной щели;
• III стадия (умеренный) – умеренные остеофиты, определенное сужение суставного пространства, возможная деформация костей;
• IV стадия (тяжелый) – большие остеофиты, сужение суставного пространства, тяжелый остеосклероз, определенная деформация костей.
Патогенез хронического болевого синдрома при ОА наряду с ноцицептивными включает и дисфункциональные механизмы, которые не всегда учитываются при терапии.
Долгое время считалось, что боль при ОА обусловлена исключительно воспалительно-дегенеративными изменениями в суставе, т. е. носит ноцицептивный характер. Источниками этой боли являются синовиальная оболочка, кость и мягкие ткани, окружающие сустав. Дегенеративные изменения хрящевой и костной ткани, а также локальное воспаление провоцируют выработку целого ряда медиаторов, вызывающих дальнейшее повреждение тканей и активацию ноцицепторов. Ноцицептивный тип боли терапевтически чувствителен к морфину, другим наркотическим и ненаркотическим анальгетикам. Соответственно, терапия таких болей чаще всего проводится нестероидными противовоспалительными препаратами (НПВП), эффективно действующими на воспалительные механизмы.
Однако для ряда пациентов такая терапия оказывается недостаточной. Кроме того, как известно, существует расхождение между степенью выраженности патологического процесса, в частности рентгенологической стадией, и интенсивностью боли, которые не взаимосвязаны напрямую. Это свидетельствует об участии в формировании болевого синдрома при ОА, как и любого хронического болевого синдрома, центральных дисфункциональных механизмов (изменения нисходящих антиноцицептивных систем и центральной сенситизации). На медиаторном уровне в развитии хронической боли ведущую роль играет дисбаланс серотонина и нор-адреналина. Поэтому для терапии дисфункционального типа болей необходимо применять препараты центрального действия, способные устранить серотонинергический и адренергический дисбаланс, т. е. прежде всего трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина и норадреналина. Эффективны также антиконвульсанты (габапентин, прегабалин), поскольку они способны уменьшить центральную сенситизацию.
Лечение ОА должно быть комплексным и включает нефармакологические, фармакологические и хирургические методы (табл. 2).

Лекарственная терапия ОА ведется одновременно по нескольким направлениям: уменьшение болей, снятие воспаления и попытки замедления дальнейшей дегенерации хрящевой ткани [12]. Препараты, применяемые для этих целей, принято называть симптом-модифицирующими препаратами (SMOADS) [13]. Существуют 2 основные группы SMOADS:
1. Быстродействующие препараты, включая анальгетики, НПВП, внутрисуставные глюкокортикоиды и опиоиды.
2. Медленнодействующие препараты, или SYSADOA (Symptomatic Slow Acting Drugs for Osteoarthritis).
Что касается первой группы, то препаратами выбора считаются парацетамол и НПВП [14]. НПВП широко применяются в клинической практике, т. к. оказывают сразу и анальгетический, и противовоспалительный эффект: снимают боль, отек и гиперемию. Однако эти препараты неоднозначно влияют на метаболизм хряща, снижая синтез протеогликанов, коллагена и гиалуроновой кислоты, они могут способствовать прогрессированию дегенерации. Кроме того, НПВП имеют ряд побочных эффектов. Как известно, действие НПВП основано на снижении синтеза простагландинов из арахидоновой кислоты посредством ингибирования фермента циклооксигеназы (ЦОГ). ЦОГ существует в двух формах: ЦОГ–1, постоянно присутствующая во всех тканях, и ЦОГ–2, синтезирующаяся на фоне воспаления. Большинство НПВП и ненаркотических анальгетиков ингибируют оба вида ЦОГ. Блокирование ЦОГ-1 обусловливает основные побочные эффекты, среди которых на первом месте стоит поражение ЖКТ на всем его протяжении (стоматит, эзофагит, гастрит, язва желудка и двенадцатиперстной кишки, энтерит, колит, проктит) с возможностью развития кровотечений. При выборе анальгетика следует руководствоваться не только эффективностью, но и безопасностью применения препарата, тем более что пациенту предстоит длительное применение обезболивающего средства [15]. Поэтому предпочтение отдается группе НПВП селективного действия, имеющей менее выраженное негативное влияние на ЖКТ. В России зарегистрированы 3 группы селективных ингибиторов ЦОГ-2:
– производные сульфонанилидов – нимесулид;
– представители коксибов – целекоксиб, валдекоксиб;
– производные оксикамов – мелоксикам.
Не следует, однако, забывать, что постоянное применение даже селективных НПВП имеет свои недостатки. Наиболее угрожающим является повышение риска сердечно-сосудистых осложнений (усиление гипертонии и сердечно-сосудистой недостаточности), что особенно касается пожилых пациентов с соответствующей сопутствующей патологией [15]. Кроме того, по мере хронизации боли применение НПВП становится все менее эффективным, т. к. в процессе формирования боли начинают преобладать центральные патофизиологические механизмы [16].
Внутрисуставные глюкокортикоиды и опиоиды применяются только в ситуациях, когда препараты первой линии неэффективны. Использование препаратов этой группы зависит от их профиля безопасности, согласия пациента, экономической составляющей и других факторов, характерных для конкретного больного.
Терапия ОА – длительный, практически пожизненный процесс, и особое внимание в процессе лечения уделяется предотвращению дальнейшего развития заболевания, разработке мер, направленных на восстановление структурного и функционального повреждения. Для этих целей применяют препараты группы SYSADOA. Симптом-модифицирующее действие SYSADOA развивается более медленно, чем у препаратов первой группы, они имеют выраженное последействие, т. е. эффект сохраняется еще 4–8 нед. и более после прекращения терапии. Препараты этой группы обладают структурно-модифицирующим действием и замедляют прогрессирование заболевания, поэтому их рассматривают в качестве патогенетического базисного лечения ОА.
SYSADOA состоят из биологически активных (хондромодулирующих, хондропротективных) компонентов хрящевой ткани, необходимых для построения и обновления суставного хряща. К ним относятся:
– предшественники хрящевого матрикса (глюкозамин, хондроитин и гиалуроновая кислота);
– модуляторы цитокинов (диацереин и ингибиторы металлопротеиназ).
Наиболее изученными на сегодняшний день хондропротективными веществами являются хондроитин и глюкозамин. Хондроитин вырабатывается хрящевой тканью суставов и входит в состав суставной жидкости. Он способствует отложению кальция в костях, укрепляет соединительнотканные структуры хряща, сухожилий, связок, кожи, способствует регенерации хряща. Сохраняя воду в толще хряща, он повышает прочность соединительной ткани. Именно хондроитин ингибирует специфические ферменты, разрушающие соединительную ткань. Глюкозамин является необходимым компонентом гликозаминогликанов и суставной жидкости, стимулирует синтез в хондроцитах и снижает катаболизм, его недостаточность ухудшает качество синовиальной жидкости и может вызвать хруст в суставах [17]. С возрастом, в результате нейродегенеративных процессов, естественный синтез этих веществ снижается, и с помощью SYSADOA возможно их восполнение.
Накоплена уже достаточная доказательная база, свидетельствующая об эффективности, безопасности SYSADOA и о необходимости их применения в плане долгосрочного лечения и профилактики развития ОА [18, 19]. Они способны влиять на метаболизм костной и хрящевой ткани и стимулировать ее регенерацию, обладают умеренным обезболивающим и противовоспалительным действием и лишены характерных для НПВП побочных эффектов. Вне обострения рекомендуется монотерапия SYSADOA. При обострении процесса и выраженном болевом синдроме рекомендуется комбинирование SYSADOA с НПВП, т. к. анальгетическое действие последних развивается гораздо быстрее. Совместное применение позволяет снизить дозу НПВП и тем самым предотвратить ряд нежелательных побочных эффектов [20].
Среди хондропротекторов большой популярностью пользуются комбинированные препараты хондроитин сульфата и глюкозамина (например, Терафлекс). Их преимущество заключается в сочетании 2-х активных ингредиентов: хондроитина сульфата и глюкозамина в эффективных дозировках. Они являются синергистами и при совместном применении дополняют и усиливают действие друг друга. Хондроитин сульфат и глюкозамин (Терафлекс) замедляют процессы естественного (профилактика) и патологического (терапия артроза) разрушения хрящевой ткани. Препарат улучшает внутреннюю структуру хондроцитов и активирует их деятельность. Механизм его действия связан с:
– активацией синтеза протеогликанов;
– угнетением действия ферментов, разрушающих гиалиновый хрящ;
– увеличением выработки синовиальной жидкости;
– уменьшением вымывания кальция из костей и улучшением фосфорно-кальциевого обмена, т. е. укреплением костной ткани.
Клинически действие препарата проявляется уменьшением болей в области сустава и увеличением объема движений в суставе. Но главное его свойство – замедление дальнейшего прогрессирования заболевания.
Показанием для назначения хондроитин сульфата и глюкозамина (Терафлекса) является любая патология опорно-двигательного аппарата, связанная с дегенеративными изменениями в хрящевой ткани (ОА и остеохондроз). Назначать препарат нужно как можно раньше – при появлении первых признаков заболевания (скрипа, хруста, болевых ощущений). Хондроитин сульфат и глюкозамин (Терафлекс) выпускается в нескольких формах, что обеспечивает удобство применения и максимально удовлетворяет потребности пациента:
– хондроитин сульфат и глюкозамин (Терафлекс) в капсулах для базисной терапии;
– хондроитин сульфат и глюкозамин (Терафлекс Адванс) в капсулах для лечения обострений болевого синдрома;
– хондроитин сульфат и глюкозамин (Терафлекс М) крем для местного применения.
Лечение рекомендуется начинать с препарата хондроитин сульфат и глюкозамин для купирования болевого синдрома (Терафлекс Адванс), который быстро оказывает анальгетическое действие и одновременно начинает стимулировать обновление хрящевой ткани. Терафлекс Адванс помимо хондроитина и глюкозамина дополнительно содержит НПВП ибупрофен, который оказывает быстрое обезболивающее и противовоспалительное действие [21] и более безопасен, чем другие НПВП. При совместном приеме глюкозамина и ибупрофена их взаимодействие позволяет добиться снижения дозы последнего в 2 раза, сохранив обезболивающий эффект, что, безусловно, важно для безопасности лечения. Капсулы хондроитин сульфата и глюкозамина для купирования болевого синдрома (Терафлекс Адванс) просты в применении и меньше таблеток раздражают ЖКТ. Рекомендуется принимать по 2 капсулы 3 р./сут, длительность приема – до 3 нед. Однако курс можно сократить при достижении желаемого результата и перейти на прием базового препарата хондроитин сульфата и глюкозамина (Терафлекс), не содержащего НПВП (по 2–3 капсулы/сут 3 мес.) для продления обезболивающего эффекта и защиты хряща. Возможно также местное применение крема хондроитин сульфата и глюкозамина (Терафлекс М).
Нефармакологические методы лечения и профилактики дальнейшего развития ОА обязательно должны применяться наряду с фармакологическими препаратами. Речь идет о контроле за факторами риска и развитием сопутствующих заболеваний, таких как ожирение, диабет, за состоянием в период менопаузы. Обучение пациентов правильному поведению и соблюдению постуральной гигиены, снижению нагрузки на больной сустав, адекватная физическая активность, защита суставов и физиотерапия, а также контроль веса являются важнейшими инструментами борьбы с травматизацией суставов и болевым синдромом [22, 23].
Снижение нагрузки на пораженный сустав замедляет дегенеративные процессы. Применение супинаторов, трости или костыля облегчает нагрузки при ходьбе. Не рекомендуются длительная ходьба, ношение тяжестей, обувь на высоком каблуке. Индивидуально подобранная лечебная физкультура позволяет увеличить двигательную активность и уменьшить болевой синдром. Физические упражнения проводятся без статических нагрузок (сидя, лежа, в бассейне), несколько раз в течение дня по 10–15 мин, медленно, плавно, постепенно увеличивая нагрузку, без боли. Необходимым моментом является снижение веса при ожирении (целевой индекс массы тела составляет 18,5–25 кг/м2), чему также способствует ЛФК, кроме того, назначается диета с пониженным содержанием животных жиров и включением в меню рыбы, морепродуктов, свежих овощей и фруктов.
Хирургическое лечение используется на поздних стадиях ОА. При неэффективности консервативного лечения, выраженных деформациях сустава с болевым синдромом проводят артропластику или эндопротезирование сустава. Поскольку ОА не является жизнеугрожающим заболеванием, окончательное решение о необходимости хирургического вмешательства всегда остается за пациентом.
В настоящее время к патофизиологическим механизмам развития ОА относят не только механическое поражение сустава и дегенеративный процесс, но и сопутствующее хроническое воспаление, которое способствует разрушению гиалинового хряща [24]. В патологический процесс вовлекаются не только хрящевые структуры, но и все компоненты сустава [25], а также структуры центральной нервной системы, связанные с формированием болевого синдрома.
Понимание патогенетических механизмов развития заболевания вносит коррективы в классические схемы терапии, но применение НПВП и хондропротекторов остается в центре внимания практикующих врачей.
Читайте также:


