Риггз б л остеопороз
• Вы предпочитаете строгую вегетарианскую пищу без мяса, яиц и молокопродуктов?
• Вы редко бываете на улице (ваша кожа не подвергается воздействию солнечных лучей)?
• Вы регулярно принимаете слабительные средства?
• Вам приходилось принимать длительно (более 2 месяцев) таблетки кортизона (или производных препаратов)?
• Пронимаете ли вы длительное время гормоны щитовидной железы?
• Принимаете ли вы длительное время противоэпилептические средства?
Дополнительные вопросы для женщин
• У вас начались регулярные менструации после 15 лет?
• Закончились ли менструации до 46 лет?
• Были ли нарушения менструального цикла?
• Вам удалили матку до 50-летия?
• Вам удалили оба яичника?
• У вас не было беременностей?
• Вы кормили грудью длительное время двоих или больше детей?
• Принимали ли вы половые гормоны после наступления менопаузы?
Подсчитайте количество положительных ответов.
У женщин – 0–6; у мужчин – 0–4
Согласно современным представлениям, у вас есть незначительный риск заболевания в последующие годы, который можно компенсировать питанием с достаточным содержанием кальция и активными физическими упражнениями.
У женщин – 7-10; у мужчин – 5–7
Умеренный риск развития остеопороза вынуждает применять самостоятельные меры по его снижению. Прежде всего, следует пересмотреть образ жизни: изменить рацион питания, включив в него молоко и молочные продукты, усилить физическую активность, отказаться от курения. Целесообразно покрывать недостаток кальция и витамина D3 с помощью препаратов.
У женщин – 11–15; у мужчин – 8-11
У этой группы людей есть достаточно оснований побеспокоиться о здоровье, ибо у них повышенный риск развития остеопороза. Необходимо проанализировать факторы риска и вместе с врачом разработать меры профилактики заболевания. Вероятно, придется коренным образом изменить образ жизни, отказавшись от старых привычек, ведь вы стоите на пороге предстоящих существенных перемен в здоровье. С помощью врача необходимо подобрать препараты для устранения дефицита кальция и витамина D3.
У женщин – от 16 и больше; у мужчин – от 12 и больше
Такое обилие факторов риска вынуждает вас обратиться к врачу, ибо наверняка уже есть признаки заболевания . Естественно, не у всех есть возможность пройти весь цикл обследования. Но даже рутинные методы позволяют нередко правильно установить диагноз и назначить соответствующее лечение.
ЗАКЛЮЧЕНИЕ
Коварство остеопороза заключается в том, что он, как многие хронические заболевания, протекает обычно бессимптомно и диагностируется с первым сложным переломом. Чаще всего это переломы тел позвонков, шейки бедренной кости и костей предплечья. Учитывая немолодой возраст пациентов, лечение этих травм не является легкой задачей.
На основании данных научных исследований и имеющегося клинического опыта установлено, что половину переломов бедра и 80 % переломов позвонков вполне можно предупредить. Наши нынешние познания позволяют высказать оптимистическое предположение о том, что каждый случай остеопороза можно предупредить и на ранних стадиях излечить. Это создает прекрасные предпосылки для настойчивой и последовательной совместной работы врача и пациента.
Теоретические исследования и мировой опыт борьбы с заболеванием показывают, что основной упор необходимо сделать на профилактику остеопороза. При этом в первую очередь не лекарственную, а имеющимися у каждого из нас возможностями. Это рациональное питание с достаточным поступлением в организм кальция, витамина D и других витаминов, минералов и микроэлементов; двигательная активность с использованием посильных тяжестей и комплексов различных упражнений; снижение факторов риска (прежде всего, отказ от курения и чрезмерного употребления алкоголя).
Остеопороз наступает. Но ведь и мы еще по-настоящему не включились в борьбу с ним. Хочется надеяться, что мы его победим. Успеха вам!
СЛОВАРЬ ТЕРМИНОВ
Анаболики – химические вещества, улучшающие белковый обмен, особенно в мышцах.
Анамнез – история развития заболевания.
Аменорея – отсутствие менструаций в период половой зрелости женщины.
Андрогены – мужские половые гормоны.
Бисфосфонаты – препараты, участвующие в строительстве костей и снижающие процесс их разрушения.
ВОЗ – Всемирная организация здравоохранения.
Гематологические болезни – заболевания крови.
Гестагены – комбинация эстрогенов и прогестеронов.
ГЗТ – гормонозаместительная терапия.
Гистологическое исследование – изучение тканей под микроскопом, позволяющее увидеть в них тонкие изменения.
Глюкокортикоиды – гормональные препараты, имеющие многостороннее действие.
Гиперпаратиреоидизм – повышенная функция паращитовидной железы.
Гипертиреоз – повышенная функция щитовидной железы.
Иррадиация – распространение болевого ощущения за пределы пораженного участка или органа.
Канцерогенное вещество – вещество, способное вызывать злокачественные опухоли.
Контрацептивные препараты – противозачаточные средства.
Кортикостероиды – группа лекарственных препаратов, обладающих свойствами гормонов коры надпочечников.
Маркер – химическое вещество, позволяющее при его исследовании в крови выявить ряд заболеваний.
Метастаз – дочерняя злокачественная опухоль.
Менопауза – период после окончания регулярных менструаций.
МЕ – международные единицы (для лекарств).
Метаболиты – продукты обмена веществ, образующиеся в организме.
Олигоменорея – нарушение периодичности менструального цикла.
Остеобласты – клетки-строители костной ткани.
Остеокласты – клетки-разрушители костной ткани.
Остеоденситометрия – измерение плотности костной массы.
Остеомаляция – размягчение костной ткани.
Остеопороз – потеря костями своей массы.
Патогенез – механизм возникновения и развития болезней.
Резорбция – всасываемость продуктов обмена в кровь (например, в кишечнике).
Ремоделирование костной ткани – цепь последовательных процессов, благодаря которым кость растет и обновляется.
Рецепторы – концевые образования нервных волокон, воспринимающие раздражения из внешней и внутренней среды.
Синдром – сочетание признаков (симптомов), имеющих общий механизм возникновения и характеризующих определенные болезни и состояния организма.
Тромбоз – процесс образования кровяного сгустка в сосудах или полостях сердца.
Флебиты – воспалительные заболевания вен.
Эстрогены – женские половые гормоны.
СПИСОК ЛИТЕРАТУРЫ
Беневоленская Л. И. Бисфосфонаты в лечении и профилактике остеопороза // Клиническая фармакология и терапия. – 1996. – № 1.
Беневоленская Л. И., Марова Е. И., Рожинская Л. Я. и др. Остеопороз: эпидемиология, диагностика. Кальцитонин в лечении остеопороза // Методические рекомендации для врачей. – М., 1997.
Беневоленская Л. И. Общие принципы профилактики остеопороза и переломов // В кн.: Третий Российский симпозиум по остеопорозу. – СПб., 2000.
Биологически активные добавки (состав. Соловьева В. А.). – СПб.: Нева, 2003.
Боринштейн Д. Избавься от боли в спине. – М.: Рипол, 2004.
Дзеранова Л. К., Рожинская Л. Я., Марова Е. И. и др. Профилактика остеопороза // Третий Российский симпозиум по остеопорозу. – СПб., 2000.
Лоу К. Все о витаминах. – М.: Крон-пресс, 1998.
Марова Е. И., Родионова С. С., Рожинская Л. Я., Шварц Г. Я. Альфакальцидол (Альфа-Д3) в профилактике и лечении остеопороза. Методические рекомендации. – М., 1998.
Марова Е. И. и соавт. Нейроэндокринология. – Ярославль: Диа-Пресс, 1999. – С. 423–484.
Моисеев B. C. Остеопороз: профилактика и лечение // Клиническая фармакология и терапия. – 1996. – № 1.
Насонов Е. Л., Скрипникова И. А., Насонова В. А. Проблема остеопороза в ревматологии. – М.: Стин, 1997.
Насонов Е. Л. Вторичный остеопороз: патогенез и клиническое значение при воспалительных заболеваниях суставов. Остеопороз и остеопатии. – 1998.
Охотский Б. А. Продукты пчеловодства в лечебном питании. – Днепропетровск: Цветень, 1990.
Ревелл А. Патология кости. – М.: Медицина, 1993.
Риггз Б. Л., Мелтон Ш. Остеопороз. Этиология, диагностика, лечение. – М.: ЗАО "Издательство БИНОМ", 2000.
Родионова С. С., Рожинская Л. Я. Остеопороз. Патогенез, диагностика и лечение. Практическое пособие для врачей. – М., 1997.
Родионова С. С., Колондаев А. Ф., Матковская Т. А. Ксидифон: возможности использования при заболеваниях опорно-двигательного аппарата // Остеопороз и остеопатии. – 2001. – № 1. – С. 38–41.
Родионова С. С., Колондаев А. Ф., Макаров М. А. Использование тридина в лечении остеопороза // Материалы конгресса "Человек и лекарства". – М., 1998.
Беневоленская Л. И. Бисфосфонаты в лечении и профилактике остеопороза // Клиническая фармакология и терапия. – 1996. – № 1.
Беневоленская Л. И., Марова Е. И., Рожинская Л. Я. и др. Остеопороз: эпидемиология, диагностика. Кальцитонин в лечении остеопороза // Методические рекомендации для врачей. – М., 1997.
Беневоленская Л. И. Общие принципы профилактики остеопороза и переломов // В кн.: Третий Российский симпозиум по остеопорозу. – СПб., 2000.
Биологически активные добавки (состав. Соловьева В. А.). – СПб.: Нева, 2003.
Боринштейн Д. Избавься от боли в спине. – М.: Рипол, 2004.
Дзеранова Л. К., Рожинская Л. Я., Марова Е. И. и др. Профилактика остеопороза // Третий Российский симпозиум по остеопорозу. – СПб., 2000.
Лоу К. Все о витаминах. – М.: Крон-пресс, 1998.
Марова Е. И., Родионова С. С., Рожинская Л. Я., Шварц Г. Я. Альфакальцидол (Альфа-Д3) в профилактике и лечении остеопороза. Методические рекомендации. – М., 1998.
Марова Е. И. и соавт. Нейроэндокринология. – Ярославль: Диа-Пресс, 1999. – С. 423–484.
Моисеев B. C. Остеопороз: профилактика и лечение // Клиническая фармакология и терапия. – 1996. – № 1.
Насонов Е. Л., Скрипникова И. А., Насонова В. А. Проблема остеопороза в ревматологии. – М.: Стин, 1997.
Насонов Е. Л. Вторичный остеопороз: патогенез и клиническое значение при воспалительных заболеваниях суставов. Остеопороз и остеопатии. – 1998.
Охотский Б. А. Продукты пчеловодства в лечебном питании. – Днепропетровск: Цветень, 1990.
Ревелл А. Патология кости. – М.: Медицина, 1993.
Родионова С. С., Рожинская Л. Я. Остеопороз. Патогенез, диагностика и лечение. Практическое пособие для врачей. – М., 1997.
Родионова С. С., Колондаев А. Ф., Матковская Т. А. Ксидифон: возможности использования при заболеваниях опорно-двигательного аппарата // Остеопороз и остеопатии. – 2001. – № 1. – С. 38–41.
Родионова С. С., Соколов В. А., Колондаев А. Ф., Марков С. А. Опыт применения остеогенона в травматологии и ортопедии // Вестник травматологии и ортопедии. – 2001. – № 4. – С. 41–46.
Рожинская Л. Я. Системный остеопороз. – М.: Крон-Пресс, 1996.
Рожинская Л. Я., Марова Е. И. Миакальцик (синтетический кальцитонин лосося) в лечении и профилактике остеопороза // Клиническая фармакология и терапия. – 1996. – № 1.
Сакс Д. Менопауза. – М.: Крон-пресс, 1995.
Ужегов Г. Н. Нетрадиционные методы лечения. – М.: Диля, 2004.
Франке Ю., Рунге Г. Остеопороз / Пер. с нем. – М.: Медицина, 1995.
Чернова Т. О., Торопцова Н. В., Колондаев А. В. Российское общество больных остеопорозом и другими заболеваниями костной системы // Третий Российский симпозиум по остеопорозу. – СПб., 2000.
Шестак Н. В. Климакс: как его пережить. – М.: Диля, 2004.
Bartle R. Keine angst vor Osteoporose. – M?nchen, SWV, 2000.
Burr D. B. Effects of bone active agents on bone quality // Osteoporosis Int. – 2002. – Vol 13. – Suppl. 3. – P. 73–74.
Community: Current status and recommendations for the future // Osteoporosis Int., 1998.
Compston J. E., Papapoulos S. E., Blanchard F. Report on osteoporosis in the European.
Compston I. Osteoporose. – M?nchen: Dorling, 2001.
Dambacher M. A., Schacht E. Osteoporosis and active vitamin D metabolites. Litera Rheumatologica 18. – Basle: Eular Publishers, 1996.
Dawson Hughes B. Vitamin D and calcium. Recommended intake for bone health // Osteoporosis Int., 1998.
Deutsches ?rzteblatt, № 12,15 – K?ln, 2004.
Dietary Reference Intakes. Washington, DC: Food and Nutrition Board, Institute of Medicine, National Academy Press, 1997.
Dobrig H., Wipler I. Die Anti-Osteoporose Di?t. – Leoben, Theiss, 2000.
Fleisch H. Bisphosphonates in Bone Disease. From the Laboratory to the Patient // The Parthenon Publishing Group, Third Edition. 1997.
Genant H. K., Cooper C., Poor G., et al. Interim report and recommendation of the World Health Organization task force for osteoporosis // Osteoporosis Int., 1999.
Gr?n S. Ern?hrung bei Osteoporose. – Marburg, Kilian, 2000.
Kenneth H. Cooper. Osteoporose. – M?nchen, Mosaik V., 1999.
Oberbeil K. Fit durch Vitamine. – M?nchen, SWV, 1994.
Ringe I. D. Osteoporose-Risiko Test. – Hamburg. Orion Pharma, 2002.
Данный текст является ознакомительным фрагментом.
- КЛЮЧЕВЫЕ СЛОВА: костная ткань, остеопороз, эндокринология
Остеопороз представляет собой серьезную проблему здравоохранения, значимость которой возрастает с каждым годом. Рост заболеваемости остеопорозом обусловлен такими факторами, как увеличение продолжительности жизни и общая тенденция старения населения – к 2020 г. прогнозируется удвоение числа жителей старше 50 лет. Помимо этого, современное человечество более подвержено остеопорозу, чем наши предки, что связано с изменением образа жизни (гиподинамия, низкая физическая активность, употребление рафинированных продуктов питания и т.п.). Остеопороз – системное заболевание скелета, характеризующееся снижением массы костей и нарушением микроархитектуры костной ткани, что приводит к повышению хрупкости костей и высокому риску их переломов. При денситометрическом обследовании лиц в возрасте 50 лет и старше в соответствии с критериями ВОЗ остеопороз в России выявляется у каждой третьей женщины.
Социальная значимость остеопороза определяется его последствиями – переломами позвонков и костей периферического скелета, что обусловливает значительный рост заболеваемости, инвалидности и смертности среди лиц пожилого возраста и, соответственно, увеличение затрат в сфере здравоохранения. Как показали эпидемиологические исследования, частота переломов проксимального отдела бедренной кости среди населения в возрасте 50 лет и старше в России составляет в среднем 105,9 случаев на 100 тыс. Данные переломы имеют наиболее тяжелые медико-социальные последствия. Так, смертность в течение первого года после перелома колебалась от 30,8 до 35,1% в различных городах страны, причем из выживших больных 78% через год и 65,5% через 2 года нуждаются в постоянном уходе. Стоимость только стационарного лечения пациентов с переломами бедра в 2000 г. в Ярославле составила 1 166 765 рублей в год.
В настоящее время уровень диагностики и лечения остеопороза в нашей стране остается неудовлетворительным. Ответственность за это лежит, в первую очередь, на врачах, которые не диагностируют это заболевание, в том числе и у самих себя. На Западе среди 903 женщин старше 45 лет было проведено рентгенологическое исследование на предмет выявления компрессионных переломов позвонков. Рентгенолог клиники выявил 65 переломов, в то время как приглашенный высококвалифицированный рентгенолог на тех же снимках обнаружил 135 переломов. При этом наличие остеопороза врачи указали лишь в 23 эпикризах, а лечение по поводу остеопороза было назначено 25 больным.
Физиология костной ткани
Губчатая кость формирует в основном кости осевого скелета: тела позвонков, кости таза. Она состоит из множества взаимосвязанных костных пластинок – трабекул. Такое строение обеспечивает наряду с большой площадью поверхности высокую механическую прочность, особенно в позвоночнике. Пространство между трабекулами заполнено костным мозгом. Матрикс губчатой кости содержит меньше неорганического материала (60–65%), чем матрикс компактной кости. Метаболические процессы в этих тканях протекают с разной скоростью: более активно – в трабекулярной, менее активно – в кортикальной костной ткани. Кроме того, масса губчатого вещества в 4 раза меньше, чем компактного, но общая поверхность при этом в 9,4 раза больше. Именно поэтому потеря массы трабекулярной кости происходит в 5 раз быстрее, а остеопоротические изменения в губчатой кости обнаруживаются раньше, чем в кортикальной.
Костная ткань представляет собой активную динамическую систему, в которой постоянно протекают процессы ремоделирования – резорбции старой кости и образования новой. Цикл костного ремоделирования начинается еще в утробе матери и продолжается в течение всей жизни человека. Известно, что у человека ежегодно обновляется около 25% губчатой и 3% кортикальной кости. Специфическими клетками кости являются остеобласты, остеокласты и остеоциты. Их основная функция – продукция костного матрикса и его последующая минерализация. Остеобласты синтезируют подавляющее большинство компонентов органического костного матрикса – коллаген I типа, остеокальцин, костный сиалопротеин, остеопонтин, трансформирующие факторы роста, остеонектин, коллагеназу и др. Основной фермент, синтезируемый остеобластами, – щелочная фосфатаза.
Важной функцией остеобластов является регуляция развития, дифференцировки и функционирования остеокластов. Так, остеобласты секретируют фактор дифференцировки остеокластов RANKL (receptor activation of NF-kappa-ligand). RANKL является трансмембранным лигандом, экспрессируется на поверхности остеобластов, связывается с RANK-рецептором, экспрессированным на клетках-предшественниках остеокластов. Связывание RANKL с RANK-рецептором индуцирует процесс дифференцировки и формирования остеокластов. Остеобластам принадлежит ведущая роль в минерализации органической основы костного матрикса. В зоне формирования новой кости находятся 300–400 остеобластов, за период в 8–9 дней они синтезируют слой остеоида (неминерализованного матрикса) толщиной в 12 мкм. После 10-дневного периода созревания остеоида начинается его минерализация. Каждый десятый остеобласт после завершения формирования костного вещества оказывается замурованным в минерализованном матриксе и превращается в остеоцит. Остальные остеобласты остаются на поверхности кости и переходят в неактивное состояние. Срок активной жизни остеобластов составляет около 10–20 суток. Время построения остеона занимает до 5 недель, этот процесс происходит со средней скоростью 1–2 мкм в сутки.
Еще один тип специфических костных клеток представлен остеокластами, которые резорбируют костную ткань. Остеокласты – это подвижные крупные (20–180 мкм) многоядерные (5–20) окончательно дифференцированные клетки гемопоэтической природы. Остеокласты растворяют как минеральные, так и органические компоненты матрикса. Функционально-активными зонами остеокластов являются периферическая (светлая) зона, непосредственно контактирующая с костным матриксом, а также гофрированный край, который представляет собой скрученную спиралью мембрану с множественными цитоплазматическими складками и является зоной активной резорбции. Зрелые остеокласты прикрепляются к поверхности кости гофрированным краем.
Костный распад начинается со стороны гофрированного края. Благодаря плотному прикреплению остеокластов к костному матриксу под гофрированным краем создается ограниченное внеклеточное пространство, в котором рН снижается до 3,5 (в пределах зоны резорбции) за счет действия протонного насоса (Н+-АТФаза). Секретируемые зрелыми остеокластами и накапливаемые в резорбируемом пространстве гидролитические ферменты в условиях кислой среды и образования свободных радикалов обеспечивают растворение кристаллов костного матрикса. Скорость резорбции костной ткани одним остеокластом колеблется от 103 до 203 мкм2 в сутки. Количество костного матрикса, разрушаемого одним остеокластом, соответствует количеству матрикса, синтезированного 100 остеобластами за то же время. Маркерами остеокластов являются карбоангидраза и тартрат-резистентная кислая фосфатаза (ТРКФ), которая находится на костной поверхности, обращенной к гофрированному краю.
Патогенез постменопаузального остеопороза
Дефицит эстрогенов является пусковым моментом в патогенезе постменопаузального остеопороза. Снижение уровня эстрогенов способствует увеличению продукции остеобластами тканевого фактора RANK, стимулирующего дифференцировку и активность остеокластов, что обусловливает повышенную резорбцию кости и снижение выработки остеопротегерина – фактора, ингибирующего резорбцию костной ткани. Кроме того, дефицит эстрогенов приводит к уменьшению секреции кальцитонина и повышенной чувствительности кости к действию паратиреоидного гормона, что, в свою очередь, усиливает костную резорбцию. Другой – непрямой – механизм развития остеопороза в период постменопаузы связывают с изменением продукции активного метаболита витамина D – 1,25-диоксихолекальциферола (1,25(ОН)2D3), что обусловлено влиянием гипоэстрогении на активность 1-α-гидроксилазы в почках. В результате снижается синтез 1,25(ОН)2D3 и уменьшается абсорбция кальция в кишечнике. Низкий уровень андрогенов в постменопаузе (из-за снижения продукции в яичниках), которые обладают стимулирующим влиянием на костеобразование, также может играть роль дополнительного механизма в развитии постменопаузального остеопороза. С возрастом цикл костного ремоделирования характеризуется более высокой скоростью костной резорбции по сравнению с процессом формирования кости, что отражает состояние негативного кальциевого баланса и обусловливает потерю костной массы (рис. 1).
Лечение остеопороза
Известно, что поздняя диагностика и несвоевременное начало терапии остеопороза характерны для 75% женщин и 90% мужчин. Приоритетной задачей практической медицины является не только своевременная диагностика, но и адекватное лечение остеопороза и его осложнений – остеопоротических переломов, которые могут иметь фатальный характер. Решению этой задачи, несомненно, способствует более широкое информирование о проблеме остеопороза как врачей различных специальностей, так и населения. Активная профилактика остеопороза является ключевой задачей, в решении которой важная роль в отводится эндокринологам.
Лечение остеопороза основано на трех принципах: этиологическом, патогенетическом и симптоматическом. Симптоматическая терапия включает в себя применение диеты, сбалансированной по содержанию кальция, фосфора и белков, назначение комбинированных препаратов кальция и витамина D, которые являются основой патогенетической терапии. Достаточное потребление кальция – необходимое условие для снижения риска остеопоротических переломов, особенно в процессе старения организма. Ранняя профилактика и лечение остеопороза позволяют замедлить развитие заболевания, снизить риск переломов костей и улучшить качество жизни пациента.
- нормализация процессов костного ремоделирования;
- замедление или прекращение потери массы кости (в идеале – ее прирост);
- предотвращение возникновения новых переломов костей;
- уменьшение болевого синдрома, расширение двигательной активности;
- улучшение качества жизни пациента.
В зависимости от преобладающего механизма действия выделяют три основных группы антиостеопоротических препаратов:
- препараты, замедляющие костную резорбцию;
- препараты, стимулирующие костеобразование;
- препараты, влияющие на оба процесса костного ремоделирования.
Кальций и витамин D показаны для профилактики остеопороза у женщин в постменопаузе с нормальной МПК или остеопенией. При установленном остеопорозе недостаточно использования данной комбинации. До недавнего времени значительную долю лекарственных средств для лечения остеопороза составляли ингибиторы ремоделирования костной ткани – препараты, подавляющие резорбцию костной ткани (бисфосфонаты), также применялись анаболические препараты, стимулирующие ремоделирование кости путем усиления образования костной ткани, которые при этом в равной степени усиливали костную резорбцию (терипаратид или другие препараты на основе паратгормона). Стронция ранелат – первый препарат для лечения остеопороза, который стимулирует образование костной ткани и одновременно подавляет костную резорбцию, что приводит к восстановлению баланса костного метаболизма в пользу образования костной ткани.
Стронций является природным элементом, химически сходным с кальцием и магнием. Стронция ранелат состоит из 2 ионов стабильного (не радиактивного) стронция и органической части – ранеловой кислоты. В желудочно-кишечном тракте стронция ранелат распадается на компоненты стронция, влияющие на метаболизм костной ткани, и ранеловую кислоту. Ранеловая кислота не обладает фармакологической активностью, не накапливается в организме, не метаболизируется и быстро выводится в неизмененном виде через почки. Прием препарата одновременно с солями кальция или пищей снижает биодоступность стронция ранелата примерно на 60–70% по сравнению с уровнем биодоступности при приеме препарата через 3 часа после еды. Максимальная плазменная концентрация стронция ранелата (
6 мг/л) достигается через 3–5 часов после разового приема 2 г стронция ранелата. Равновесное состояние достигается через 15 дней.
Стронция ранелат (Бивалос) обладает высоким сродством к костной ткани. Препарат преимущественно определяется во вновь синтезированной костной ткани, где концентрация стронция достигает плато примерно через 3 года лечения. Стронций в организме не подвергается метаболизму и не подавляет активность ферментов системы цитохрома P450. Его выведение не зависит от времени и дозы препарата, а период полувыведения составляет примерно 60 часов. При легкой и умеренной степени хронической почечной недостаточности, когда клиренс креатинина находится в диапазоне от 30 до 70 мл/мин, наблюдается снижение клиренса стронция примерно на 30%, однако коррекции дозы препарата в этом случае не требуется. Применение препарата при тяжелой почечной недостаточности не рекомендуется, поскольку специальные исследования в данной популяции пациентов не проводились.
Таким образом, стронция ранелат – инновационный препарат для лечения остеопороза, обладающий физиологическим механизмом действия на костный метаболизм: одновременно увеличивает образование костной ткани и уменьшает резорбцию кости. Благодаря двойному механизму действия изменяется баланс процессов обмена в костной ткани в пользу образования кости. Двойной механизм действия стронция ранелата доказан большим числом экспериментальных и клинических исследований. В настоящее время продолжается его дальнейшее изучение на более глубоком уровне, о чем свидетельствует целый ряд работ 2010–2011 гг.
Стронция ранелат необходимо назначать в сочетании с кальцием и витамином D3 в дозировках, зависящих от их пищевого потребления. Бивалос назначается в виде 1 саше (пакетик) на ночь. Содержимое пакетика следует развести в стакане воды. Не следует принимать Бивалос одновременно с препаратами кальция и кальций-содержащими продуктами (молоко, молочные продукты). Между их приемом должно проходить 2 часа. Как показали результаты длительного применения препарата, Бивалос безопасен и хорошо переносится пациентами. Наиболее частыми побочными эффектами, зарегистрированными в клинических исследованиях, являлись тошнота, диарея и головная боль. Эти побочные эффекты были слабо выраженными и кратковременными: через 3 месяца терапии их частота была сопоставимой в группах стронция ранелата и плацебо. Увеличения риска венозной тромбоэмболии (ВТЭ) в период с 3-го по 5-й год лечения установлено не было. Кроме того, через 5 лет лечения частота ВТЭ достоверно не отличалась в группах стронция ранелата и плацебо. В октябре 2011 г. в России зарегистрировано новое показание для применения Бивалоса – лечение остеопороза у мужчин с целью снижения риска переломов, что расширяет возможности применения в клинической практике стронция ранелата (Бивалоса) – препарата 1-й линии терапии остеопороза.
В октябре 2011 г. в России зарегистрировано новое показание для применения Бивалоса – лечение остеопороза у мужчин с целью снижения риска переломов, что расширяет возможности применения в клинической практике стронция ранелата (Бивалоса) – препарата 1-й линии терапии остеопороза.












Современные возможности костноанаболической терапии остеопороза
Остеопороз (ОП) – это серьезная медико-социальная проблема, обусловленная широкой распространенностью данного заболевания. Основным клиническим проявлением ОП и одним из ведущих факторов риска последующих переломов является перенесенный пациентом перелом на фоне незначительной травмы. В настоящее время существует эффективное лечение ОП, сочетающее нефармакологические подходы с применением современных антиостео-
поротических препаратов. При своевременных медикаментозных вмешательствах можно уменьшить риск возникновения остеопоротических переломов и повысить качество жизни пациента. Терипаратид – высокоэффективный костноанаболический препарат, который повышает минеральную плотность костной ткани пациентов с высоким риском низкоэнергетических переломов и дает новые возможности решения основной цели лечения заболевания – снижения риска переломов различных
локализаций.
Остеопороз (ОП) – это серьезная медико-социальная проблема, что обусловлено широкой распространенностью недуга, которая увеличивается с возрастом как у мужчин, так и у женщин, поздней диагностикой и отрицательным влиянием на качество и продолжительность жизни людей. Важная особенность этого заболевания заключается в снижении прочности кости, из-за чего со временем многие пациенты получают опасные осложнения этого заболевания – переломы при минимальных травмах [3, 6, 21]. Известно, что минеральная плотность костной ткани (МПКТ) не единственный показатель, определяющий прочность кости, поскольку часть переломов происходит при остеопении или даже нормальных значениях МПКТ. Большое значение имеют качество костной ткани и его составляющие компоненты (микроархитектоника, геометрия, скорость ремоделирования, накопление повреждений, степень минерализации, свойства коллагена/минерального матрикса) [8, 31]. Таким образом, прочность кости отражает интегрированный показатель качества кости и МПКТ.
С учетом этиологии и особенностей выделяют первичный и вторичный ОП. Среди всех форм преобладающей считается первичный ОП, который является самостоятельным заболеванием и чаще встречается у женщин в постменопаузе. На долю вторичных форм в общей структуре ОП приходится около 15–20%. В большинстве случаев – это проявление других заболеваний или следствие приема лекарственных средств, отрицательно воздействующих на костную ткань [20, 25]. Важно помнить, что при вторичном ОП потенциальный риск переломов сопоставим с таковым при его первичной форме. Среди вторичного ОП наиболее распространен стероидный и ОП при эндокринных и ревматологических заболеваниях [5, 34].
В патогенезе постменопаузального ОП пусковым фактором является дефицит эстрогенов, вызывающий ускорение потери костной массы [3, 10, 11]. До менопаузы костное ремоделирование происходит синхронно и объем резорбированной кости равен объему образованной кости. После менопаузы объем резорбции превышает объем формирования костной ткани [31]. При продолжительном отрицательном балансе трабекулы истончаются, теряют свою пластинчатую структуру и становятся цилиндрическими, возрастает биомеханическая нагрузка и напряжение, что приводит к перфорации и разрушению трабекул [26]. Происходит снижение МПКТ и ухудшается качество костной ткани [26, 29]. При этом костные потери могут достигать ежегодно 5% [3, 23]. Со временем масса кости снижается примерно на 25–30%, чему сопутствует повышение риска переломов под влиянием даже минимальных нагрузок. Вместе с тем все женщины в менопаузе имеют недостаточность эстрогенов, но ОП развивается только у каждой третьей из них. Это свидетельствует о влиянии различных, в т.ч. генетических, факторов на возникновение и развитие ОП. К факторам риска развития постменопаузального ОП относятся пожилой возраст, низкая масса тела, злоупотребление алкоголем, кофеином, курение, семейный анамнез заболевания, указания на предшествующие малотравматичные переломы, низкий индекс массы тела (менее 20 кг/м²), ранняя менопауза (до 45 лет), аменорея (более года) в репродуктивном возрасте, овариэктомия в молодом возрасте, иммобилизация [3, 8, 10].
В любом возрасте, в т.ч. в постменопаузе, на фоне возрастного дефицита эстрогенов наиболее выраженные изменения происходят в трабекулярной (губчатой) кости, в основном представленной в телах позвонков, плоских костях, в костях предплечья и в пяточных костях. Так, например, масса трабекулярной кости позвонков снижается в год на 5%, а кортикального слоя – на 1,5%.
К наиболее тяжелым формам вторичного ОП относится стероидный ОП [4, 7, 8]. Длительный избыток глюкокортикоидов (ГК) любой природы способен приводить к развитию ОП и высокому риску переломов [8, 35]. Хотя эндогенный гиперкортицизм (болезнь, или синдром, Иценко–Кушинга) достаточно редкая патология, остеопоротическое поражение костей скелета встречается более чем у половины больных при различных формах эндогенного гиперкортицизма [33, 34]. Более частой проблемой является изменение прочности костной ткани как опасное осложнение глюкокортикоидной терапии (ятрогенный гиперкортицизм). Несмотря на неоспоримую пользу, эти препараты несут потенциальный риск [33, 35]. О колоссальном значении обсуждаемой проблемы свидетельствует тот факт, что остеопоротические переломы наблюдаются у 30–50% пациентов, получающих терапию синтетическими ГК. Причем прочность костной ткани начинает снижаться уже на ранних этапах фармакотерапии [4, 5]. Известно, что потеря костной массы, вызванная приемом ГК, нарастает по мере возрастания суточной и кумулятивной доз, а также длительности применения лекарственного средства. В частности, относительный риск переломов возрастает на 62% при увеличении суточной дозы препарата на каждые 10 мг [33]. До сих пор неясно, существует ли относительно безопасная доза ГК? Даже прием минимальных доз преднизолона (2,5 мг) не исключает отрицательного воздействия на костную прочность. Наиболее высокий риск существует для больных, получающих ГК в дозе 7,5 мг/сут и более в эквиваленте к преднизолону [4, 31].
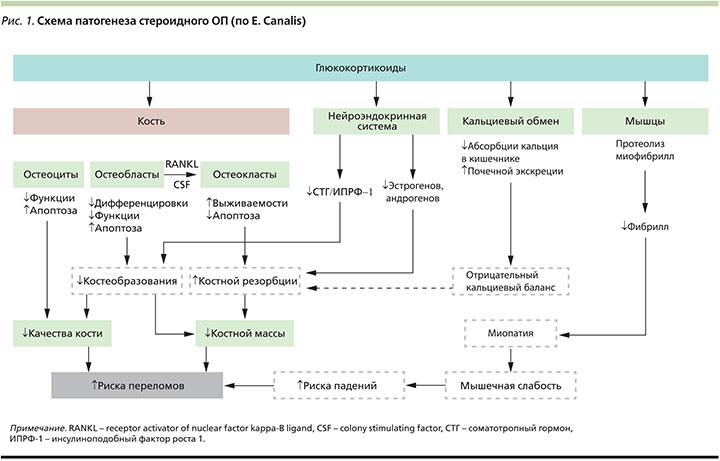
ГК оказывают различное действие на костную ткань и минеральный обмен (рис. 1). В результате воздействия на кость избыточного количества ГК усиливается апоптоз остеобластов, подавляются их активность; замедляется созревание клеток предшественников остеобластов и угнетается остеобластогенез. Возрастает подавляющее действие ПТГ (паратиреоидный гормон) на зрелые остеобласты, что приводит к подавлению костеобразования. Наряду с этим снижается синтез остеобластами коллагена I типа, уменьшается количество костного матрикса, что особенно выражено при эндогенных формах гиперкортицизма [4, 5]. В отношении ГК стало известно, что они влияют на систему костных регуляторных белков (остеопротегерин: рецептор – активатор ядерного фактора NF–kB RANKL – Receptor activator of nuclear factor kappa-B ligand): подавляют продукцию остеопротегерина, противодействующего процессу дифференциации и активизации остеокластов, способствующего формированию кости, и усиливают выработку RANKL, что приводит к стимуляции созревания и повышения резорбтивной активности остеокластов [19, 31]. Определенный вклад в подавление костеобразования при гиперкортицизме вносит снижение продукции тестостерона у мужчин и эстрадиола у женщин [8].
В наши дни существует эффективное лечение ОП, сочетающее нефармакологические подходы с современными антиостеопоротическими препаратами. Для лечения ОП используется несколько групп препаратов различной направленности и разных механизмов действия. В зависимости от влияния на костное ремоделирование фармпрепараты для лечения ОП делятся на антирезорбтивные и анаболические (стимулирующие костеобразование). Антирезорбтивные препараты уменьшают активность процессов ремоделирования кости и увеличивают минерализацию костной ткани [3, 20, 22, 29]. Единственный препарат из группы костноанаболических, стимулирующий формирование новой костной ткани, – это терипаратид [1, 27, 28].
Терипаратид увеличивает количество и активность остеобластов, осуществляющих костеобразование, в результате новая костная ткань заполняет резорбционные полости и создает новый слой костной ткани. Именно этот процесс обусловливает увеличение костной массы, прочности костной ткани и повышение МПКТ [1, 32]. Регуляция костного ремоделирования является сложным процессом, происходящим под влиянием множества локальных и системных факторов, факторов внешней среды и в значительной мере – механической нагрузки на кость. Терипаратид (рекомбинантный человеческий ПТГ) является активным фрагментом эндогенного человеческого ПТГ (1–34). Напомним, что наибольший вклад в регуляцию костного ремоделирования минерального гомеостаза вносит ПТГ – полипептид с молекулярной массой около 9500, построенный из 84 аминокислотных остатков. Причем N-концевой участок (1–34) обладает биологической активностью и достаточен для регуляции минерального гомеостаза [24]. Основная функция ПТГ заключается в регуляции гомеостаза кальция в организме. Наряду с этим он оказывает влияние на обмен фосфора и магния. Органами-мишенями ПТГ являются кости, почки и кишечник.
Синтез и секреция ПТГ находятся в обратной зависимости от концентрации Са2+ в крови. Действие ПТГ осуществляется в трех направлениях [15, 24]:
- усилении высвобождения кальция из костей;
- снижении почечного клиренса кальция (увеличивает реабсорбцию кальция в дистальных канальцах почек, уменьшая его экскрецию);
- стимуляции выработки в почках 1,25(OH)2D3 (повышая активность 1-α гидроксилазы в почках, ПТГ увеличивает конверсию 25(OH)D3 в 1,25(ОН)2D3).
ПТГ обладает двунаправленным действием, что известно как парадокс ПТГ. В частности, прерывистое подкожное введение ПТГ способствует увеличению массы костной ткани, улучшению архитектуры костной ткани, повышению биомеханической прочности, снижению риска остеопоротических переломов [8, 22]. Вместе с тем постоянное воздействие высокой концентрации ПТГ приводит к резорбции костной ткани и гиперкальциемии [3]. Эндогенный ПТГ вырабатывается как постоянно (базальный уровень секреции, постоянное воздействие), так и импульсно (прерывистое воздействие) [24, 27].
Говоря о механизме действия терипаратида, следует отметить, что анаболический эффект (воздействие ПТГ на остеобласты) реализуется через увеличение дифференцировки стволовых клеток в клетки остеобластического ряда, кроме того, увеличивается продолжительность жизни остеобластов и уменьшается частота апоптоза, что также способствует повышению числа остеобластов. ПТГ стимулирует весь процесс костного ремоделирования, в целом повышается костный обмен, однако формирование костной ткани всегда преобладает над резорбцией [12, 19].

Механизмы повышения костеобразования в ответ на введение интермиттирующих доз ПТГ реализуются через специфические рецепторы ПТГ гликопротеинами с молекулярной массой около 800 кДа. Через взаимодействие ПТГ/рецептор к ПТГ увеличивается экспрессия Runx2 (фактор транскрипции и дифференцировки остеобластов), повышается экспрессия других генов, способствующих дифференцировке остеобластов, в результате чего повышается остеобластогенез и выживаемость остеобластов [12, 24, 32].
В исследованиях показано, что ежедневное однократное введение терипаратида стимулирует образование новой костной ткани на трабекулярной и кортикальной поверхностях костей с преимущественной стимуляцией активности остеобластов по отношению к активности остеокластов, как следствие – наблюдается положительный баланс костного ремоделирования за счет выраженного формирования новой костной ткани [9, 14, 27].
С клинических позиций большой интерес представляет ключевое рандомизированное исследование профилактики переломов NEER (Fracture Prevention Trial) с участием 1637 женщин в постменопаузе (не менее 5 лет после менопаузы) с перенесенными ранее одним и более переломами позвонков умеренной степени или двумя и более переломами позвонков легкой степени (средний возраст – 69,5 лет, среднее число переломов позвонков ≈2,3, средняя МПКТ в поясничном отделе позвоночника=-2,6 СО – стандартное отклонение) [22]. Пациенток рандомизировали в три группы, получавших плацебо (n=544) или терипаратид в виде подкожных (п/к) инъекций в разных дозировках: 20 мкг (n=541) и 40 мкг (n=552). Все пациентки получали кальций (1000 мг) и витамин D (400–1200 ME) за 1–2 месяца перед рандомизацией и весь период исследования. Средняя длительность лечения составила 18 месяцев. Рентгенограммы позвоночника оценивали в начале и в конце исследования, также были проведены серии измерений массы костной ткани методом двухэнергетической рентгеновской абсорбциометрии.
Ключевые точки исследования включали вертебральные переломы, невертебральные переломы, МПКТ и оценку безопасности лечения. По результатам исследования, на фоне терипаратида в дозе 40 мкг наблюдался такой же риск переломов, что и в группе терипаратида 20 мкг, но число побочных эффектов было выше.
Результаты работы показали, что снижение риска всех новых вертебральных переломов (по полуколичественной оценке) в группе терипаратида составило 65%, а новых вертебральных переломов средней и выраженной степеней тяжести (снижение высоты тела позвонка от 25 до 40% и более) – 90% (рис. 2). Другое важное доказательство эффективности терипаратида – статистически достоверное снижение относительного риска невертебральных переломов на 53% (бедро, лучевая кость, голеностоп, плечевая кость, ребра, стопа и таз).
Применение терипаратида также способствовало повышению МПКТ.
В частности, статистически достоверное увеличение МПКТ поясничного отдела позвоночника наблюдалось после 3 месяцев лечения, прирост МПКТ в поясничном отделе позвоночника был статистически значимо выше в группе лечения терипаратидом в дозе 20 мкг. По сравнению с плацебо у женщин в группе терипаратида 20 мкг МПКТ поясничного отдела позвоночника увеличилась на 10%, а в шейке бедренной кости – на 2,8% [22].
Для клинической практики важно, что увеличение продолжительности терапии терипаратидом снижает риск низкоэнергетических невертебральных переломов. Последующий post hoc-анализ данных исследования FPT показал, что по сравнению с плацебо коэффициент риска невертебральных остеопоротических переломов снижался на 9,1% на каждый дополнительный месяц лечения терипаратидом в дозе 20 мкг (p=0,002) [28].
В рамках исследования FPT в подгруппе парных биопсий изучена эффективность применения терипаратида при оценке его способности улучшать структуру кости в группе женщин, включенных после периода лечения со средней продолжительностью 19 месяцев (подгруппа парных биопсий) [13]. В частности, был проведен анализ 51 парной биопсии гребня подвздошной кости (плацебо – n=19, терипаратид 20 мкг – n=180 и терипаратид 40 мкг – n=14 с использованием двухмерной (2D) гистоморфометрии и трехмерной (3D) микрокомпьютерной томографии). При проведении анализа две группы терипаратида были объединены в одну. Полученные результаты четко показали, что применение терипаратида способствует статистически значимому увеличению объема и связанности губчатой кости, улучшению морфологии трабекул с тенденцией к пластинчатым структурам, а также увеличению толщины кортикального слоя. Применение терипаратида не было связано с развитием остеомаляции. Подобные положительные изменения свидетельствуют о реверсии структурных нарушений кости и позволяют объяснить выраженное снижение частоты остеопоротических переломов позвонков, которое показано в рандомизированных клинических исследованиях терипаратида.
Для оценки влияния терипаратида на риск новых переломов позвоночника (метод количественной морфометрии – КМ) была отобрана группа из 892 пациентов исследования FPT (из них на терапии плацебо – 448, терипаратидом 20 мкг – 444). Пациентам была проведена повторная оценка рентгенограмм позвоночника слепым методом с целью определения частоты вертебральных переломов при соответствии позвонков следующим критериям:
- сокращение высоты позвонка на 20%, согласно КМ;
- соответствующее снижение высоты позвонка на 4 мм;
- увеличение как минимум на 1 степень, согласно визуальной полуколичественной оценке, проводимой рентгенологом.
В группе терипаратида статистически достоверное снижение относительного риска новых переломов позвонков, согласно методу КМ, составило 84%.
В Европейском наблюдательном исследовании препарата терипаратид (EFOS) проводили оценку частоты клинических вертебральных и невертебральных остеопоротических переломов, боли в спине, а также качества жизни, связанного с состоянием здоровья (HRQoL, EQ-5D) у женщин с постменопаузальным ОП, получавших лечение в течение 18 месяцев в 8 европейских странах [10]. Все 1648 женщин, включенных в исследование, ранее не получали лечения терипаратидом, 91,0% из них ранее получали лечение другими антиостеопоротическими препаратами, 72,8% завершили 18-месячный период исследования.
Важным преимуществом применения терипаратида стало существенное уменьшение боли в спине у пациенток уже через 3 месяца от начала лечения, сохранявшееся на протяжении периода терапии продолжительностью 18 месяцев, а также не менее 18 месяцев после отмены терипаратида. За период наблюдения было отмечено 168 случаев клинических переломов у 138 (8,8%) женщин (821 перелом/10000 пациенто-лет) и сокращение шанса переломов на 47% за последний полугодовой период по сравнению с первым 6-месячным периодом (р 1
Читайте также:


