Ревматоидный артрит и атеросклероз
Ревматические болезни (РБ) характеризуются широкой распространенностью, поражением людей различных возрастных групп, прогрессирующим характером течения со склонностью к хронизации, приводящей к потере трудоспособности и ранней инвалидизации больных. Ревматоидный артрит (РА), системная склеродермия (ССД), системная красная волчанка (СКВ), анкилозирующий спондилит (АС) и многие другие приводят к сокращению продолжительности жизни больных, а 5-летняя выживаемость больных с тяжелыми формами системных болезней соединительной ткани не превышает 50%, что сопоставимо с исходами при лимфогранулематозе и распространенных поражениях коронарных артерий [6,8,10].
С позиции государственной статистики РБ не относятся к категории жизнеугрожающих, однако в клинической практике системные заболевания соединительной ткани нередко являются причиной смерти больных молодого и среднего возраста. Исследования последних лет показали, что ведущей причиной снижения продолжительности жизни при РБ являются кардиоваскулярные осложнения, связанные с атеросклеротическим поражением сосудов. Доклинические формы атеросклероза (эндотелиальная дисфункция, утолщение комплекса интим-медиа, увеличение уровня коронарного кальция) у больных РБ выявляются значительно чаще, чем в общей популяции. В последние годы активно обсуждается высокая смертность больных РБ от сердечно-сосудистых катастроф.
Установлено, что риск преждевременного развития и прогрессирования атеросклероза при РБ выше, чем в популяции и ассоциируется не только с традиционными факторами риска, но и с активностью воспалительного процесса. РБ достоверно сокращают продолжительность жизни больных вследствие индуцирования раннего атеротромбоза, артериальной гипертензии и связанных с ними сосудистых катастроф типа инсультов и инфаркта миокарда (ИМ).
Причина прогрессирования атеросклероза при РБ до конца не ясна, и увеличение риска развития сердечно-сосудистых заболеваний (ССЗ) не может быть полностью объяснены традиционными факторами риска, такими как возраст, пол, курение, артериальная гипертония или сахарный диабет 2 типа. Клинические, лабораторные и эпидемиологические исследования показали, что прогрессирующее системное воспаление – один из нетрадиционных факторов увеличения сердечно-сосудистого риска у этих пациентов [3,6,7].
На сегодня доказано, что аутоиммунное воспаление, лежащее в основе патогенеза РБ, и атеросклероз имеют общие механизмы повреждения сосудистой стенки. Ремоделирование артерий при атеросклеротическом их повреждении проявляется увеличением толщины сосудистой стенки, снижением эластичности, повышением жесткости и упругости, а вен - снижением тонуса, увеличением ёмкостных и кинетических качеств. Как известно, увеличение жесткости артерий связано с повышением риска развития инсульта, ишемической болезни сердца (ИБС) и сердечной недостаточности [1,2].
Ранее атеросклероз считался следствием пассивного накопления липидов в стенке сосуда, но, в настоящее время признано, что это динамический воспалительный процесс, начинающийся с активации сосудистого эндотелия, миграции лейкоцитов, окисления липидов и достигающий высшей точки при дестабилизации атеросклеротической бляшки (АТБ) и тромбозе. РА является примером хронического системного воспалительного заболевания и, что интересно, поразительные общие черты были отмечены между патогенезом атеросклероза и РА. Клеточный состав АТБ и воспалительного инфильтрата синовиальной оболочки при РА одинаков (локальное накопление моноцитов, макрофагов, Т-клеток). В развитии атеросклероза также участвуют эндотелиальные и гладкомышечные клетки сосудов. Они опосредуют хемотаксис лейкоцитов, разрушение внеклеточного матрикса [12,13,17]. Все клетки, вовлеченные в развитие атеросклероза, способны как вырабатывать цитокины, так и реагировать на их действие. В патогенезе атеросклероза цитокины играют двойственную роль: провоспалительные и Th-1- зависимые цитокины способствуют развитию атеросклероза, в то время как противовоспалительные, связанные с регуляторными Т-клетками (T-reg), демонстрируют отчетливое антиатерогенное действие.
Среди большого количества цитокинов, синтезируемых активированными Т-клетками, макрофагами и В-клетками, ключевая роль в развитии аутоиммунного воспаления и сердечно-сосудистых катастроф принадлежит ИЛ-6 – единственному цитокину, непосредственно индуцирующему синтез острофазовых белков (ОФБ) в гепатоцитах. У больных РА наблюдается строгая взаимосвязь между сывороточной активностью ИЛ-6 и уровнем ОФБ в крови, таких как С-реактивный белок (СРБ), α1-антитрипсин, фибриноген и гаптоглобин [18,19]. Повышение уровня ИЛ-6 коррелирует с риском развития коронарной болезни сердца и является предиктором возникновения сердечно-сосудистых событий у пациентов с клинически стабильной ИБС, доказанной ангиографически. Помимо этого, при нестабильной стенокардии и ИМ повышенный уровень ИЛ-6 связан с неблагоприятным прогнозом. При увеличении ИЛ-6 на 1 пг/мл относительный риск развития повторного ИМ или внезапной смерти возрастает в 1,7 раза [15,18,19].
Относительный риск развития ССЗ у больных РА колеблется от 1,4 до 3,96, при СКВ – от 5 до 10 по сравнению с общей популяцией. Риск развития ИМ у молодых женщин (35–44 лет) с СКВ выше в 50 и более раз, чем в популяции [4,5]. Хроническое системное воспаление в популяции в целом и у пациентов с РА, приводит к повышению кардиоваскулярного риска наряду с традиционными факторами риска (курение, дислипидемия, артериальная гипертензия, гиподинамия и прочие).
Учитывая общность патогенеза атеросклероза и РБ, в последние годы объектом интенсивных исследований становятся воспалительные маркеры атеросклероза у данной категории больных. Особое внимание уделяется белкам острой фазы воспаления СРБ, сывороточному амилоидному белку А, также показателям активации иммунитета (провоспалительным цитокинам, их растворимым рецепторам), дисфункции эндотелия (клеточным молекулам адгезии, фактору Виллебранда), органонеспецифическим аутоантителам (антителам к фосфолипидам и окисленному липопротеиду низкой плотности) и иммунным комплексам [8,9].
Небольшое увеличение концентрации СРБ отражает субклиническое воспаление в сосудистой стенке, связанное с атеросклеротическим процессом. В ряде работ прослежена связь между атеросклеротическим поражением сосудов (утолщение комплекса интима-медия (КИМ), наличие АТБ по данным УЗ исследования сосудов) и концентрацией СРБ при СКВ и РА [9,12,18]. Имеются данные, что у мужчин с недифференцированным артритом увеличение концентрации СРБ до 5-15 мг/л связано с увеличением сердечно-сосудистой смертности в 3,7 раза (в течение 10 лет), при концентрации СРБ > 16 мг/л - в 4 раза.
Наиболее выраженными атерогенными свойствами обладают оксигенированные липопротеиды низкой плотности (ЛПНП), белки теплового шока 60/65, индуцирующие сильный локальный иммунный ответ в бляшке. Кроме того, оксигенированные ЛПНП могут стимулировать апоптоз, участвующий в процессах дестабилизации бляшки. Показано увеличение уровней аутоантител (к оксигенированным ЛПНП, белкам теплового шока, кардиолипину, бета2-гликопротеину-1, кардиолипину) и иммунных комплексов у больных РБ по сравнению со здоровыми пациентами, что ассоциировалось с доклиническими проявлениями атеросклероза по данным УЗ исследования толщины КИМ у этих больных13.
Проявления дисфункции эндотелия связывают с недостатком продукции или биодоступности оксида азота в стенке артерий, обеспечивающего вазодилатацию, торможение экспрессии молекул адгезии, агрегации тромбоцитов, антипролиферативное, антиапоптотическое и антитромботическое действие. При атеросклерозе нарушается баланс между гуморальными факторами, оказывающими потенциальное защитное действие (оксид азота, эндотелиальный фактор гиперполяризации, простациклин), и факторами, повреждающими стенку сосуда (эндотелин-1, тромбоксан А2, супероксид-анион) [10,11]. Критериями дисфункции эндотелия могут служить некоторые гуморальные факторы, связанные с деятельностью клеток эндотелия, такие как эндотелин-1, фактор Виллебранда, E-селектин, молекулы межклеточной адгезии, молекулы адгезии сосудистых клеток и другие. Дисфункция эндотелия выявляется при РА и СКВ как на ранней, так и на поздней стадиях заболевания: повышение уровней молекул межклеточной адгезии, молекул адгезии сосудистых клеток, E-селектина, фактора Виллебранда по сравнению со здоровыми пациентами, которое было достоверно связано с наличием атеросклеротических бляшек в сосудах либо признаками доклинического атеросклероза [7,13].
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются рев
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
 |
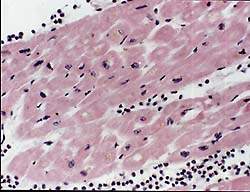
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
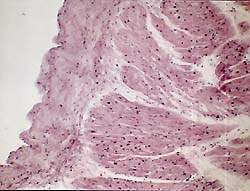 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. . канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. . д-ра мед. наук. М., 1997. С. 50
Толщина каротидной интима-медиа (cIMT) отражает ранний атеросклероз и прогнозирует сердечно-сосудистые события у населения в целом. Повышенный cIMT присутствует у пациентов с ревматоидным артритом, по сравнению с контрольными людьми, с ранних стадий заболевания и, как считается, указывает на ускоренный атеросклероз, но прямых данных нет. Является ли cIMT восприимчивым к быстрому и потенциально обратимому изменению в зависимости от интенсивности воспаления в состояниях полноценного системного воспаления, такого как ревматоидный артрит, остается неизвестным. Если это так, увеличение cIMT в таких болезненных состояниях может не отражать повреждения стенки стенки сосуда и не может быть хорошим предиктором будущих сердечно-сосудистых событий в этих конкретных популяциях. Для решения этих вопросов необходимы перспективные, долгосрочные, продольные исследования.
См. Соответствующие исследования Томаса и др.,
Недавно была обнаружена толщина каротидной интимассы (cIMT) у Hannawi и его коллег у пациентов с ревматоидным артритом (РА) с недавним началом заболевания по сравнению с лицами, контролируемыми по возрасту и с точки зрения пола, [1]. Считается, что неинвазивное измерение cIMT отражает структурные изменения сосудов на относительно продвинутых, но все же субклинических стадиях атеросклероза. cIMT является сильным предиктором будущих сосудистых событий у населения в целом, особенно у людей с низкосортным воспалением, оцениваемых по уровням С-реактивного белка [2].
Независимо от того, является ли cIMT хорошим предвестником будущих сосудистых событий у пациентов с РА, остается открытым вопрос, так как ни одно долгосрочное исследование на сегодняшний день не зарегистрировало такую ассоциацию в этой конкретной популяции. Весьма уместным является то, являются ли исследования, подобные описанным выше, действительно свидетельством ускоренного атеросклероза в РА или отражением альтернативных процессов. Оценка cIMT в когортах РА до сих пор ограничивалась почти исключительно исследованиями поперечного сечения. Эти исследования подходят только для генерации гипотез, а не для доказательства ассоциации или ее направленности. Хорошим примером является ассоциация поперечного сечения увеличенного cIMT с (текущими) уровнями C-реактивного белка в исследовании Hannawi и его коллег. Может ли увеличение cIMT в условиях воспаления высокого класса, таких как RA, просто отражать текущее (но быстро обратимое) воспаление стенки сосуда, а не более постоянные изменения структурного сосуда? И будет ли одно измерение cIMT в этом контексте хорошим индикатором будущих сосудистых событий у пациентов с РА?
Другой неинвазивный метод, используемый в качестве суррогата для атеросклероза, включает в себя оценку вазодилатационных реакций: считается, что эти реакции отражают изменения эндотелиальной функции на ранних стадиях атеросклероза. Как и cIMT, эндотелиальная дисфункция является предиктором будущих сердечно-сосудистых заболеваний в общей популяции [5], присутствует с ранних стадий РА и также интерпретируется как показатель ускоренного атеросклероза [6]. Однако есть веские доказательства того, что измерение функции эндотелия сильно зависит от текущих уровней воспаления. У здоровых людей воспалительный ответ, вызванный вакцинацией, достаточен для временного (и обратимого) ослабления эндотелиальной функции [7]. Снижение воспаления с использованием анти-TNF-терапии в РА быстро (хотя и временно) сопровождается улучшением эндотелиальной функции [8]. Интересно, что полноценное системное воспаление также ассоциируется с нарушениями обмена веществ, такими как дислипидемия и резистентность к инсулину, которые нормализуются при контроле воспаления [9]. Полная или частичная нормализация не может быть исключительной для метаболических нарушений или эндотелиальной дисфункции, но может также возникать в том, что считается структурным изменением кровеносных сосудов. У пациентов с почечной недостаточностью, у которых, как и у пациентов с РА, повышен риск сердечно-сосудистых заболеваний — 6 месяцев терапии статинами привели к улучшению функции эндотелия, а также к значительному снижению CIMT; эти улучшения сохранялись при продолжении лечения на протяжении всей 18-месячной продолжительности исследования [10]. Остается неизвестным, может ли высокосортное воспаление (и его контроль) быстро влиять на структуру стенки сосуда, как оценивается cIMT. Не менее неизвестным остается долгосрочное значение кажущихся, но потенциально прерывистых, нарушений функции и структуры сосудов в РА.
Основополагающим является изучение взаимосвязей между полноценным, но вариабельным системным воспалением, которое характеризует РА и потенциально прерывистые и обратимые оскорбления сосудистой функции и структуры — чтобы доказать, действительно ли они отражают ускоренный атеросклероз, — и оценить их долгосрочную значимость с точки зрения тяжелых сердечно-сосудистых исходов, в частности, у населения РА. Это можно изучить только с помощью длительных, перспективных, продольных и, в идеале, контролируемых исследований, которые в настоящее время отсутствуют.
cIMT = толщина каротидной интимассы; РА = ревматоидный артрит; TNF = фактор некроза опухоли.
Авторы заявляют, что у них нет конкурирующих интересов.

В современной медицине, несмотря на все прогрессивные достижения, остается большое количество заболеваний, имеющих недостаточно изученные причины и сложные многоступенчатые механизмы развития, формирующие разнообразную клиническую картину с поражением тканей и органов, что обуславливает сложности в лечении. Например, системные заболевания соединительной ткани. К этой группе заболеваний относится ревматоидный артрит, отличительной чертой которого является эрозионно-деструктивное поражение суставов, преимущественно мелких. Причина его до сих пор не установлена, в механизме развития основная роль принадлежит атаке иммунитета на собственные ткани организма.
Продолжаются исследования причин и механизмов развития указанной патологии, поиск новых, более эффективных и безопасных методик лечения, особенно комплексного.
Содержание статьи
Ревматоидный артрит суставов: симптомы и лечение
Ревматоидный артрит характеризуется прогрессирующим разрушением суставов, которые на поздних стадиях заболевания приобретают необратимый характер. Типичные признаки патологии:
- наличие эрозивно-деструктивных элементов в области суставных поверхностей;
- разрушение мелких суставов;
- симметричное поражение;
- развитие воспаления в области стоп и кистей;
- деформации, препятствующие нормальному функционированию суставов.
Помимо типичных суставных поражений характерны также и нарушения со стороны других тканей и систем, включающие наличие серозитов (воспалительный процесс в области оболочек сердца, брюшины, плевральной оболочки), формирование воспалительных узелков под кожей, поражение сосудов в виде васкулитов, увеличение лимфоузлов (лимфаденопатии) и периферические поражения нервных окончаний (нейропатии).
Методы лечения ревматоидного артрита определяет врач-ревматолог, специализирующийся на аутоиммунных, воспалительных заболеваний. Он проводит полноценную диагностику: внешний осмотр с анализом всех жалоб и их подробной фиксацией в карте, проведение целого ряда лабораторных анализов и инструментальных исследований (включая данные УЗИ, рентгенографии и иных дополнительных процедур).
Медицинская коррекция базируется на длительных курсах лекарственных препаратов в сочетании с физиотерапией и немедикаментозными методиками, диетической коррекцией и, в некоторых случаях, с оперативным вмешательством. Проводятся курсы противорецидивной терапии и реабилитации, при этом чем раньше будут назначены препараты и рекомендованы методы лекарственного воздействия, тем более благоприятным будет прогноз. В запущенных случаях заболевание грозит стойкой инвалидностью.
Чаще подобная проблема возникает у взрослых, для детей типична своеобразная форма отклонения в виде ЮРА (ювенильной), с особенностями клинической симптоматики, диагностики и терапевтических подходов.

Причины и диагностика патологии
Точные причины заболевания на сегодняшний день не установлены, хотя имеются теории о природе его развития. По мнению большинства исследователей, имеют место наследственная предрасположенность, перенесенные инфекции и действие провоцирующих факторов. Отмечено, что некоторые микроорганизмы (ретровирусы, вирусы герпеса, цитомегаловирус, Эпштейн-Барр, краснухи, а также микоплазмы) способствуют развитию воспалительных процессов в суставах. В результате перенесённой инфекции и неправильной работы иммунитета происходит запуск аутоиммунных реакций — агрессии собственного иммунитета против соединительной ткани суставов и других частей тела, что приводит к разрастанию соединительной ткани и разрушению хрящевых структур и их необратимой деформацией. Процесс приводит к контрактурам — ограничениям в движениях и необратимым деформациям суставов, подвывихам и нарушению их функциональной активности.
В результатах лабораторных исследований обнаруживается увеличение СОЭ, щелочной фосфатазы и специфических показателей системных заболеваний – ревматоидного фактора, сиаловых кислот и серомукоида. При рентгенологическом исследовании появляются специфические симптомы поражения суставов.
Ревматоидный артрит: лечение в домашних условиях или стационарно?
Помещение пациента в стационар, когда возникают подозрения на развитие болезни или при уже установленном диагнозе, показано в следующих случаях:
- при необходимости подтверждения или опровержения диагноза, для уточнения особенностей течения, оценки прогноза в отношении дальнейшей жизни и трудоспособности, решения вопроса с инвалидностью;
- подбор базисной противовоспалительной терапии (БПВТ) препаратами на начальном этапе и затем на протяжении болезни;
- при резком обострении и развитии осложнений;
- когда имеют место тяжелые и системные проявления с вовлечением нервной системы и серозных оболочек;
- при формировании сопутствующих осложнений, признаков септического артрита или других, в том числе связанных с приемом лекарств.
Во всех остальных случаях допускается лечение в домашних условиях при строгом условии постоянного контроля врача с регулярным прохождением обследований.

Как избавиться от ревматоидного артрита: принципы терапии
Основу составляет комплексный подход и сочетание приема лекарств с немедикаментозными методиками, диетой, физионагрузками и реабилитационными мероприятиями. При необходимости к консультированию и разработке схемы терапии привлекается врач-ортопед, невролог, кардиолог, психотерапевт. При незначительной деформации суставов пациентам можно продолжать привычную деятельность с ограничением физических нагрузок и стрессов, при условии профилактики инфекционных заболеваний и отказа от вредных привычек.
Не менее важное условие для уменьшении симптомов, особенно в области нижних конечностей – это контроль за массой тела, что уменьшает нагрузки на пораженные суставные поверхности и кости, снижает риск остеопороза, переломов и деформаций. Правильно подобранная диета с высоким содержанием полиненасыщенных жирных кислот, качественных животных и растительных белков помогает в уменьшении интенсивности воспаления и стимулирует восстановление хрящевых тканей.
Врач подробно рассказывает пациенту как уменьшить проявление болезни за счет изменений физической активности, посредством занятий лечебной физкультурой и применения физиотерапевтических методик. В стадии минимальных проявлений или в период ремиссии показано санаторно-курортное оздоровление.
Стандарт лечения ревматоидного артрита
В последние время наблюдается ощутимый прогресс в понимании основных механизмов формирования, патологию рассматривают как хроническое воспалительное заболевание иммунной природы, при котором наиболее эффективна терапия в начальный период. Сегодня разработан новый стандарт, включающий применение целого ряда препаратов различного действия:
- нестероидные противовоспалительные средства (НПВС);
- гормональные (глюкокортикостероиды, или ГКС);
- биологические;
- синтетические средства для купирования иммунных и воспалительных реакций.
Основа улучшения самочувствия – это базисная противовоспалительная терапия (БПВТ), которую важно начать в первые месяцы развития, причем прием лекарственных средств должен быть регулярным (перорально, инъекционно), с постоянным изменением схемы при малой эффективности. Исчезновение или уменьшение клинических симптомов и признаков воспаления по лабораторным данным свидетельствует о результативности проводимых мер. Применение БПВТ должно осуществляться с учетом возможных побочных эффектов.
Как вылечить ревматоидный артрит
В острой стадии или при обострении хронической патологии необходима медикаментозная коррекция, но как проходит лечение, определяет исключительно лечащий врач. Применяются стероидные средства, препараты фактора некроза опухоли (ФНО), нестероидные противовоспалительные средства (НПВС).
На первом этапе проводят подавление острых процессов, с последующим переходом на поддерживающую терапию в период затухания симптомов и ремиссии. Нестероидные лекарства применяются наиболее активно, обычно это группа неселективных ингибиторов ЦОГ (циклооксигеназа — фермент, ответственный за синтез веществ, способствующих развитию воспаления). Эффект при их приеме развивается быстро, после 3-5 суток приема, но сами лекарства обладают целым рядом побочных эффектов, ограничивающих их длительное применение и выбор для некоторых категорий пациентов. Активно применяют селективные ингибиторы ЦОГ, обладающие меньшим списком побочных эффектов, они относятся к средствам нового поколения, лучше переносятся и более эффективны.
Лечение ревматоидного артрита подразумевает также лекарства группы глюкокортикоидов. Они быстро и сильно подавляют иммунные и воспалительные реакции, влияют на обменные процессы и применимы при неэффективности нестероидных противовоспалительных лекарств. ГКС уменьшают воспаление в области суставов и снижают вероятность поражения внутренних органов, но также имеют внушительный список побочных эффектов и противопоказаний, в связи с чем их употребление строго контролируется и подбирается очень тщательно и индивидуально. При пульс-терапии, в комбинации с цитостатическими средствами применяются только на базе стационара. Домашний неконтролируемый прием этих препаратов запрещен, они могут быть опасными в плане серьезных осложнений.

Препараты нового поколения для лечения ревматоидного артрита
На сегодняшний день для борьбы с данной патологией широко применяются препараты нового ряда – биологическая терапия. Специфические соединения, относящиеся к группе ингибиторов ФНО (факторы некроза опухоли), не позволяют разворачиваться клинической картине иммунного воспаления. Средства относительно недавно применяются, показали хорошие результаты, но значительно влияют на иммунитет, подавляя его на фоне длительного приема. Их назначают в сложных случаях, когда заболевание устойчиво к привычным средствам. Биопрепараты обладают одним существенным недостатком — высокой стоимостью, что ограничивает их широкое применение.
Местная терапия
Практикуется и наружный способ применения медикаментов, с этими целями назначаются лекарства для местного нанесения – гели, мази, кремы, пластыри с противовоспалительными компонентами. Основной эффект заключается в локальном воздействии на ткани сустава и околосуставные поверхности, лекарства используются с целью уменьшения боли и отека. Однако они обладают низкой эффективностью по сравнению с лекарствами, которые принимаются внутрь (таблетки), и рекомендуются только в комплексной терапии.
Часто наружные средства имеют многокомпонентный состав, могут содержать НПВС, гепарин (для улучшения микроциркуляции и проницаемости сосудов), местные анестетики (для уменьшения болезненности сустава).
Как лечиться от ревматоидного артрита при помощи физиотерапии
По мере стихания острого процесса всегда встает вопрос о том, что делать далее, в стадию затухания воспаления и при выходе в ремиссии. На этапе дополнительной коррекции, в том числе и в домашних условиях, показаны физионагрузки. Процедуры способствуют снижению болевых ощущений, устранению скованности по утрам, расширяют физическую активность пациента.
Применяются методики воздействия гальваническими токами и магнитными полями на область пораженных поверхностей, аппликации парафина или озокерита. Не менее эффективны и методики дозированного облучения инфракрасными лучами или ультразвуком определенной частоты.
Магнитотерапия при заболеваниях суставов оказывает наиболее выраженное положительное действие:
- уменьшает боли и отеки в области суставов;
- повышает объем движений;
- устраняет утреннюю скованность;
- позволяет уменьшить лекарственную нагрузку на организм, так как снижает необходимость приема препаратов с обезболивающим эффектом.
Хотя данные методики обладают достаточной активностью, они не могут применяться как единственное средство при решении вопроса как вылечить ревматоидный артрит и без назначения врача. Физиотерапия показана как дополнительная методика на фоне базисного лечения.
Задать вопрос врачу
Читайте также:


