Принципы лечения переломов с замедленной консолидацией и ложных суставов
Заживление перелома может протекать замедленно у тучных людей, при диабете, беременности, лучевой болезни, общем истощении, выряженной анемии, гипопротеинемии, авитаминозе.
К не сращению перелома и формированию ложного сустава приводят местные факторы.
Наиболее частыми причинами нарушений заживления перелома являются:
1. недостаточная репозиция отломков;
2. неэффективная внешняя иммобилизация как по виду повязки, так и по продолжительности фиксации поврежденного сегмента;
3. многократные, неоправданные попытки вправления отломков;
4. интерпозиция мягких тканей;
5. сопутствующее повреждение сосудов, нервов;
6. нестабильный остеосинтез;
7. диастаз между отломками при лечении методом постоянного скелетного вытяжения или после остеосинтеза;
8. неоправданно обширное удаление осколков с образованием дефекта кости;
9. раннее удаление фиксатора;
10. отсутствие внешней иммобилизации при нестабильном остеосинтезе;
11. отсутствие надкостницы и недостаточное кровоснабжение фрагментов (шейка бедра, ладьевидная кость кисти).
Отсутствие сращения часто связывается с нагноением в зоне перелома. Частота гнойных осложнений при оперативном лечении закрытых переломов не превышает 10%. Главными причинами развития инфекционных осложнений в костной ране являются:
1. неполноценная хирургическая обработка открытого перелома;
2. нарушение асептики;
3. травматичная техника оперативного вмешательства;
4. неустойчивый остеосинтез и недостаточная внешняя иммобилизация конечности;
5. закрытие раны кожным лоскутом с излишним натяжением его;
6. неэффективное дренировании раны;
7. не применение антибиотиков до и после первичной хирургической обработки открытого перелома. Т.е – почти все местные причины имеют ятрогенное происхождение.
Клиническим проявлением ложного сустава являются свободная, безболезненная подвижность между отломками на месте перелома, укорочение конечности, нарушение ее функции. При этом из анамнеза известно, что после перелома прошло 2-3 срока, необходимых для сращения перелома данной локализации.
На рентгенограмме определяются следующие признаки:
- Остеосклероз концов отломков (при атрофических ложных суставах - остеопороз их);
- Образование замыкательных пластин на концах фрагментов (при атрофических ложных суставах костномозговой канал закрыт этой пластиной)
Лечении. При замедленной консолидации иногда достаточно удлинить сроки внешней иммобилизации полноценной повязкой и дать дозированную нагрузку на поврежденную конечность.
Метод лечения ложных суставов— только хирургический.
При несросшихся переломах и гиперпластических ложных суставах вне очаговый остеосинтез с помощью компрессионных аппаратов обеспечивает полноценную консолидацию.
При гиповаскулярных ложных суставах и значительных дефектах длинных трубчатых костей необходима биологическая стимуляция костеобразования в виде костной пластики ауто- или алло трансплантатами компактного, или губчатого строения.
Лечение ложных суставов и инфицированных не сращений весьма сложная задача даже для опытных ортопедов. Нередко применяются уникальные костнопластические операции с учетом индивидуальных особенностей возникшей патологии.
2) Остеохондропатия бугристости большеберцовой кости (болезнь Осгутд-Шлаттера).
Остеохондропатии — это группа заболеваний детей и подростков, характеризующиеся дегенеративно-дистрофическим процессом в апофизах костей.
Факторы:
1)Врожденный фактор обусловлен особой врожденной или семейной предрасположенностью к остеохондропатиям.
2) возникновением патологии у лиц, страдающих дисфункциями эндокринных желез.
3) Обменные факторы проявляются в нарушении метаболизма при остеохондропатиях, в частности обмена витаминов и кальция.
4) На сегодняшний день многие исследователи отдают предпочтение травматическим факторам. Здесь имеет значение как частая травма, так и чрезмерные нагрузки, в том числе и усиленные мышечные сокращения. Они приводят к прогрессирующему сдавлению, а затем и облитерации мелких сосудов губчатой кости, особенно в местах наибольшего давления.
5)Наряду с острой и хронической травмой, огромное внимание уделяется и нейротрофическим факторам, приводящим к сосудистым расстройствам. Согласно мнению М.В. Волкова (1985), изменения в скелете при остеохондропатиях — это следствие остеодистрофии ангионеврогенного характера.
Патологическая анатомия. В основе анатомических изменений в апофизах косей при остеохондропатиях лежит нарушение кровообращения, причина которых не ясна, тех участков губчатой костной ткани, которые находятся в условиях повышенной статической и функциональной нагрузки. В результате чего развивается деструкция участка кости с отделением секвестра и перестройкой внутренней костной структуры. При этом наступает изменение формы не только зоны поражения кости, но и развивается нарастающая деформация всего сустава с нарушением конгруэнтности суставных поверхностей.
Остеохондропатия бугристости большеберцовой кости (болезнь Осгуда-Шлаттера)
В научной литературе известно, как асептический некроз бугристости большеберцовой кости, апофизит большеберцовой кости, болезнь Ланелонга-Осгуда-Шлаттера.
В основе заболевания лежит нарушение процессов окостенения бугристости большеберцовой кости. Остеохондропатия часто развивается без видимой причины, однако, иногда удается установить связь с повторной травмой или повышенной функцией четырехглавой мышцы бедра (например, при занятиях спортом или балетом).
При рентгенологической диагностике болезни Осгуда-Шлаттера необходимо иметь в виду множество вариантов нормальной оссификации апофиза большеберцовой кости. Чаще всего апофиз окостеневает в виде хоботообразного отростка в возрасте 10-13 лет, но встречаются варианты с добавочными мелкими ядрами окостенения. Слияние апофиза с метафизом происходит к 16-18 годам.
При диагностике всегда следует учитывать несоответствие между значительным выбуханием бугристости при клиническом исследовании и почти нормальными размерами апофиза на рентгенограмме. Предпочтение необходимо отдавать клиническим данным.
Заболевание продолжается около года, а иногда и несколько лет, и заканчивается восстановлением структуры апофиза. Функция коленного сустава, как правило, не страдает.
Лечение, прежде всего, требует исключения всяких перегрузок и создания относительного покоя, вплоть до кратковременной иммобилизации, и основано на физиотерапевтических методах (магнитотерапия, электрофорез с кальцием и новокаином, бальнеотерапия и грязелечение). Оперативное лечение, как правило, не применяется, за исключением единичных случаев отрыва бугристости при повышенной физической нагрузке.
Билет №10.
1.Открытые переломы. Классификация А.В. Каплана и. О.Н. Марковой.
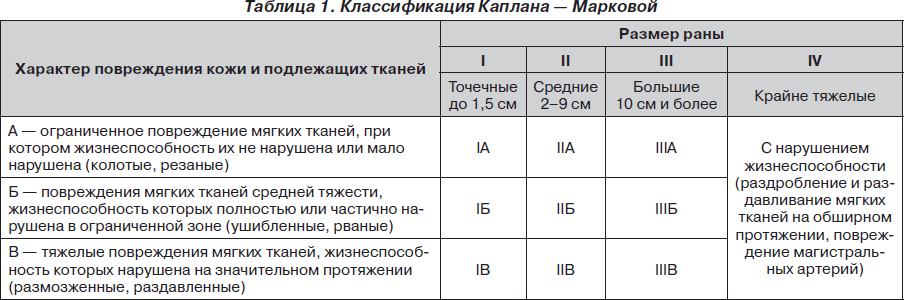
А — легкое ограниченное повреждение мягких тканей, при котором жизнеспособность их не нарушена или нарушена мало (например, при колотых, рубленых ранах);
Б — повреждения мягких тканей средней тяжести, когда жизнеспособность их полностью или частично нарушена в ограниченной зоне. Чаще всего это ушибленные или рваные раны;
В — повреждения мягких тканей тяжелые, когда жизнеспособность их нарушена на значительном протяжении. При IA, IIA, IIIА типах открытых переломов все слои мягких тканей обычно повреждаются путем прокола их сместившимся костным отломком. Открытые переломы IБ, IIБ, IIIБ типов характеризуются наличием ушибленной раны кожи и значительным повреждением подлежащих тканей; ушиб их сопровождается значительным кровоизлиянием из поврежденных мелких и средних кровеносных сосудов. Переломы типов IB, IIB, IIIB отличаются обширными размозжениями мягких тканей независимо от размеров кожного дефекта. Переломы кистей часто крупно- или мелкооскольчатые со значительным смещением отломков. Клинико-анатомические особенности этих переломов обусловлены наличием в механизме травмы элемента сдавления


Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Консолидация костных отломков после перелома происходит по биологическим законам, через определенные временные сроки и зависит от многих факторов.
К местным факторам, способствующим консолидации относятся:
Нарушения процессов консолидации обусловлены как внешними факторами (несоблюдение сроков и правил иммобилизации, отклонения в режимах клинического ведения пациентов), так и внутренними (нарушения минерального, белкового, гормонального обменов). Они ведут к замедлению сращения переломов. Развивается процесс неполноценной консолидации или патологическая репаративная регенерация.
Процесс остеорепарации значительно ускоряется при использовании стабильной фиксации костных отломков и хорошем кровообращении. В тех случаях, когда сохраняется подвижность отломков, происходит микротравматизация капиллярной сети и пролиферация тканей, устойчивых к гипоксии,– волокнистой соединительной и хрящевой. Это обстоятельство может привести к рубцовой интерпозиции в зоне перелома, замедленной консолидации и образованию ложного сустава. Важным фактором сращения перелома кости является состояние местного кровообращения.

При переломах повреждаются не только сосуды окружающих мягких тканей, но и сосуды, проходящие в самой кости. В области метафизов костей, где большой мышечный массив, кровоснабжение, как правило, хорошее. Поэтому переломы этой локализации хорошо срастаются. Однако нижняя треть большеберцовой кости, локтевая кость и некоторые другие при переломе могут быть лишены кровоснабжения, так как повреждается внутрикостная артерия, которая является основным источником питания.
Замедленная консолидация переломов

В тех случаях, когда по истечении максимального срока, необходимого для сращения перелома данной локализации, консолидация не наступает – говорят о замедленной консолидации. При этом отмечается задержка в перестройке фиброзной мозоли в костную.Данный патологический процесс может продолжаться в течение 1,5–2 сроков, необходимых для сращения перлома. Клинически отмечается незначительная эластическая подвижность в месте перелома, боль при нагрузке. Рентгенологические признаки косной мозоли недостаточно выражены, хорошо прослеживается линия перелома.
Лечение замедленной консолидации может быть консервативным и оперативным. Консервативное лечение состоит в продлении иммобилизации перелома на срок, необходимый для его сращения, как если бы он был свежим.
При лечении замедленной консолидации необходимо учитывать, что длительное отсутствие функциональной нагрузки на травмированный сегмент приводит к стойкой мышечной атрофии, ограничению подвижности в иммобилизированных суставах. Эти нарушения даже при сращении перелома потребуют очень длительного реабилитационного периода.
Поэтому попытки консервативного лечения при замедленной консолидации оправданы только тогда, когда клинически и рентгенологически процесс консолидации хорошо прослеживается, но ещё не завершен. Если прогнозируемые сроки консолидации увеличиваются более чем на 1–1,5 месяца, предпочтительно оперативное лечение.
Способы оперативного лечения замедленной консолидации:
- 1. Туннелизация по Беку. Спицей Киршнера или сверлом малого диаметра формируют в различных направлениях каналы, проходящие через линию перелома от одного отломка в другой. По этим каналам прорастают сосуды, что способствует сращению перелома.
- 2. Внеочаговый компрессионно-дистракционный остеосинтез (ВКДО) позволяет долгое время прочно удерживать отломки при плотном их соприкосновении, а так же выполнять попеременно компрессию и дистракцию регенерата. Чаще используют аппарат Илизарова.
- 3. Стабильно-функциональный погружной остеосинтез с использованием интрамедуллярных фиксаторов с блокированием. Этот метод допускает раннюю функциональную нагрузку сегмента до полной костной консолидации. Использование накостного остеосинтеза пластинами LCP – пластины с ограниченным контактом.
- 4. Костная пластика.
Ложные суставы
Ложный сустав – это стойкое нарушение целостности кости, имеющее клинические и рентгенологические признаки. Если консолидация перелома не состоялась в более чем двойной срок сращения для данной локализации и произошло закрытие костномозговых каналов, можно констатировать формирование ложного сустава.
Различают нормотрофический, гипертрофический, гипотрофический, атрофический, истинный фиброзно-синовиальный ложный сустав (неоартроз).
В нормотрофическом ложном суставе сохраняются процессы формирования костной мозоли, но они протекают больше двойного срока сращения для данной локализации.
В гипертрофическом ложном суставе идет усиленное костеобразование, которое сопровождается образованием избыточной костной мозоли, узкой плохо прослеживаемой линией ложного сустава.
Признаки истинного фиброзно-синовиального ложного сустава (неоартроза):
Лечение
В лечении ложных суставов сочетают консервативные и оперативные методы. К консервативным способам лечения относят физиотерапевтические методы: электростимуляция образования костной мозоли, волновое лечение (лазеротерапия, магнитотерапия, светотерапия, теплотерапия), медикаментозное лечение, оптимизирующее минеральный баланс. Нередко применяют анаболические стероиды, которые стимулируют все виды обменов.
При оперативном лечении ложных суставов могут быть использованы все методы, изложенные в разделе хирургического лечения замедленной консолидации.
Оперативные методы делят на очаговые (с вмешательством на патологичесой зоне) и внеочаговые (без вмешательства). К внеочаговым относят применение аппаратов внешней фиксации. При использовании аппаратов внешней фиксации после его наложения чередуют дистракцию и компрессию, а затем стабилизируют аппарат. Как правило, нормотрофические и гипертрофические ложные суставы лечатся без вмешательства на очаге аппаратным остеосинтезом и консервативными методами.
Оперативное лечение с вмешательством на очаге бывает нескольких видов: малоинвазивное и инвазивное. К малоинвазивным методикам относят введение остеогенных материалов (костного матрикса) или остеогенных клеток (остеобластных и стволовых) в костную мозоль либо параоссально в проекции ложного сустава.
Из инвазивных методов применяется декортикация костных концов отломков с резекцией патологической зоны и обязательным восстановлением костномозгового канала. Декортикация производится в области концов костных отломков путём отсечения пластинок кортикальной кости с сохранением их связи с окружающими мягкими тканями. Фрагменты отщеплённого кортикального слоя служат дополнительными стимуляторами костеобразования. При образовании костного дефекта он замещается костными трансплантатами. Фиксация кости осуществляется погружными металлическими конструкциями, либо аппаратами внешней фиксации.
Сроки восстановления, как правило, превышают в два – три раза средние сроки характерные для сращения переломов данной локализации.
КОСТНАЯ ПЛАСТИКА
Костная пластика – это оперативное вмешательство, направленное на восстановление целостности кости, с использованием костно-пластических материалов. В зависимости от разновидности костно-пластических материалов костную пластику подразделяют на: аутопластику, аллопластику, ксенопластику (гетеропластику), брефопластику и комбинированную пластику.
Костная пластика выполняется различными материалами: аутопластика – использование тканей самого пациента, аллопластика – использование трупных тканей или препаратов из этих тканей, ксенопластика (гетеропластика) – использование тканей животных (пересадка тканей от особей другого биологического вида), брефопластика (от греческого brephos – плод) – аллопластика с применением тканей мертворожденных плодов или погибших новорожденных.
Показаниями к костной пластике являются дефекты костной ткани травматического и послеоперационного генеза, нарушения консолидации, деформации развившейся вследствие патологической консолидации, ортопедические заболевания – костные кисты, отдельные формы остеобластокластом, фиброзная дисплазия, последствия остеомиелита.
Использование аутогенных тканей подразумевает пересадку как свободных трансплантатов (лишённых кровоснабжения), так и трансплантатов на сосудистой ножке. Пересаживают кортикальную либо губчатую кость. Свободные трансплантаты являются матриксом для формирования на месте трансплантации новой костной ткани. При этом отмечается рассасывание пластического материала и замещение вновь сформированной костной тканью. Успех костной пластики сопряжён с синхронностью процессов рассасывания старой и формированием новой костной ткани. Костные трансплантаты на сосудистой ножке используются в расчете на полное приживление пересаженной костной ткани. При дефектах большого объёма используют комбинацию кортикальных и губчатых трансплантатов.
Под аллопластикой понимают трансплантацию трупных тканей. Возможна пересадка кортикальной и губчатой костной ткани. Наиболее часто используются кортикальные аллотрансплантаты.
Губчатые аллотрансплантаты обладают более высокой антигенной активностью, которая может привести к развитию воспаления в области пластики и секвестрации трансплантата. Это обусловлено сохранением в губчатой костной ткани элементов костного мозга, обладающего высокой антигенностью. Достаточно широко используют аллогеный деминерализованный костный матрикс – лишённая клеток и минералов белковая строма костной ткани.
При пересадке аллогенных костей, как правило, используют консервированный материал. Целью консервации материала являются стерилизация, снижение антигенности и увеличение сроков хранения пластического материала. С целью стерилизации применяют гамма излучение, химическую стерилизацию, низкие температуры и др. Хранение трансплантатов возможно в жидких, газообразных средах. Наиболее эффективна консервация пластического материала в жидких средах с одновременной стерилизацией материала, снижением антигенности и длительными сроками хранения. К таким консервантам относят жидкие среды на основе растворов формальдегида слабой концентрации.
Заготовка тканей проводится у лиц, скоропостижно скончавшихся от травм, острой сердечно-сосудистой патологии, асфиксии, отравления алкоголем.
Забор материала осуществляется впервые 12 часов, перед изъятием тканей труп подвергается санитарной обработке. При заборе тканей нет необходимости в соблюдении правил асептики и антисептики. Изъятые ткани тщательно промывают проточной водой. Костная ткань освобождается от остатков мягких тканей и костного мозга.
Методика консервации костных тканей: готовят растворы 0,2–0,4% формолового и 0,1–0,2% глутарового альдегида, растворы смешивают в отношении 1:1, pН среды доводят до 7,0–7,4 путем введения фосфатного буфера 20–40 мл на литр консервирующей смеси. Приготовленный к консервации материал помещают в смесь в соотношении 1 часть материала на 5–10 частей консерванта в герметически закрывающейся стеклянной посуде. Хранение проводится в условиях бытового холодильника при t +2°–+4° по Цельсию. В течение первого месяца консервант меняют 2 раза в неделю, далее 1 раз в 1–2 месяца.
Стерилизация биологических объектов наступает в течение 6–12 часов при воздействии на них смеси растворов 0,2– 0,4% формолового и 0,1–0,2% глутарового альдегидов. Биологические ткани, консервированные в смеси ФА и ГА, подавляют рост золотистого, эпидермального стафиллококков, кишечной, синегнойной палочек и спорогенной клостридии. Выявленный синергизм действия смеси растворов формолового и глутарового альдегидов на микрофлору позволяет надежно стерилизовать заготовленные биологические ткани без соблюдения правил асептики в течение 18–72 часов и обеспечивать их устойчивость к инфекции после трансплантации в организм реципиента.
Согласно исследованиям, проведенным на кафедре травматологии, ортопедии и ВПХ ГрГМУ, решающую роль в реваскуляризации консервированных аллотрансплантатов играет сосудистое русло параоссальных тканей и окружающих мышц. Радиологическими исследованиями с помощью радионуклида кальция (45-Са) установлено, что, начиная с 2–3 недель, консервированные в смеси альдегидов кости после их трансплантации в дефекты скелета вступают в минеральный обмен. К двухнедельному сроку наблюдений изотоп регистрировался в области стыков, через месяц – в самом реплантате. Наиболее выраженное накопление зарегистрировано к 4–6 месяцам, что связано с активной перестройкой аллотрансплантата. К 6–9 месяцам содержание 45-Са в реплантированной кости постепенно снижалось, а через 12 месяцев и в более поздние сроки на всем протяжении реплантированной кости и костей ложа реципиента накопление изотопа было равномерным.
Рентгенологическими исследованиями оперированных пациентов выявлена определенная закономерность перестройки аллотрансплантатов. Так, в первом периоде (до 4 недель после операции) не определялось заметных изменений, аллотрансплантат сохранял присущую ему форму и плотность кости. Во втором периоде (1–6 месяцев после трансплантации) выявлялись признаки наличия периостальной мозоли, идущей со стороны кости реципиента. Отмечалось сращение трансплантата с костным ложем и постепенное исчезновение границы между ними. В это время происходило изменение интенсивности тени трансплантата, связанное с его частичным рассасыванием и с замещением собственной костью реципиента. Третий период (6 месяцев – 2 года) характеризуется полной консолидацией аллотрансплантата с костью реципиента и завершением окончательной перестройки костной структуры.
Ксенопластика используется достаточно редко ввиду высокой антигенности тканей. Чаще используют костный матрикс из этих материалов.
Брефоматериалы применяются также редко ввиду ограниченной доступности этого вида пластического материала.
Комбинированная пластика подразумевает совместное применение ауто- и аллотканей в различных вариантах.
Источник: Травматология и ортопедия : пособие для студентов лечебного и педиатрического факультетов / под ред. В.В. Лашковского. – Гродно

Сращение переломов: репаративная регенерация кости после травмы, фазы, стадии срастания перелома
Репаративная регенерация кости после травмы представляет собой сложный биологический процесс, который начинается непосредственно после перелома и развивается на основе физиологической регенерации
Материал применяется только с целью обучения и ознакомления, и используется в рамках цитирования и/или как объект обсуждения.
Внимание! Все материалы размещенные на странице не являются рекламой,
а есть не что иное как мнение самого автора,
которое может не совпадать с мнением других людей и юридических лиц!
Заживление перелома может протекать замедленно у тучных людей, при диабете, беременности, лучевой болезни, общем истощении, выряженной анемии, гипопротеинемии, авитаминозе. Однако в большинстве случаев к не сращению перелома и формированию ложного сустава приводят местные факторы. Наиболее частыми причинами нарушений заживления перелома являются:
- недостаточная репозиция отломков;
- неэффективная внешняя иммобилизация как по виду повязки, так и по продолжительности фиксации поврежденного сегмента;
- многократные, неоправданные попытки вправления отломков;
- интерпозиция мягких тканей;
- сопутствующее повреждение сосудов, нервов;
- диастаз между отломками при лечении методом постоянного скелетного вытяжения или после остеосинтеза;
- неоправданно обширное удаление осколков с образованием дефекта кости;
- раннее удаление фиксатора;
- отсутствие внешней иммобилизации при нестабильном остеосинтезе;
- отсутствие надкостницы и недостаточное кровоснабжение фрагментов (шейка бедра, ладьевидная кость кисти).
Отсутствие сращения часто связывается с нагноением в зоне перелома.
Ложный сустав (псевдоартроз) — нарушение непрерывности кости с развитием несвойственной данному ее отделу подвижности. Различают врожденные (внутриутробное нарушение костеобразования) и приобретенные (осложнение переломов костей, обусловленное нарушением сращения отломков) ложные суставы. Приобретенные подразделяются на гипертрофические, атрофические и нормотрофические.
Факторы, способствующие возникновению ложных суставов:
- значительное расхождение костных отломков после их репозиции,
- недостаточная иммобилизация или преждевременное ее прекращение,
- чрезмерно ранняя нагрузка на поврежденный сегмент конечности,
- нагноение в зоне перелома, местное нарушение кровоснабжения костных отломков,
- интерпозиция мягких тканей.
Клиническим признаки: свободная, безболезненная, патологическая подвижность между отломками на месте перелома (образование неоартроза), укорочение конечности, нарушение ее функции. При этом из анамнеза известно, что после перелома прошло 2/3 срока, необходимых для сращения перелома данной локализации.
При установлении диагноза ориентируются помимо клинических данных, на срок, необходимый в норме для сращения данного типа перелома. После истечения этого срока говорят о замедленно срастающемся или несросшемся переломе, а спустя удвоенный или больший срок — о ложном суставе.
Решающее значение для диагностики ложного сустава имеет рентгенологическое исследование. Рентгенограммы выполняют обязательно в двух взаимно перпендикулярных проекциях, иногда используют добавочные косые проекции, а также томографию. Основные рентгенологические признаки:
- отсутствие костной мозоли, соединяющей концы обоих отломков;
- закругление и сглаживание концов отломков или их коническая форма (атрофический ложный сустав);
- заращение костномозговой полости на концах отломков (развитие замыкательной пластинки). Нередко конец одного отломка имеет полусферическую форму и напоминает суставную головку, а конец другого вогнут наподобие суставной впадины. При этом на рентгенограммах отчетливо видна суставная щель (неоартроз). Утолщение костных отломков в зоне щели ложного сустава, неровные контуры самой щели, ее небольшая ширина характерны для гипертрофического ложного сустава.
Для оценки интенсивности процессов костеобразования в зоне ложного сустава используют радионуклидное исследование.
Лечение несросшихся переломов, посттравматических ложных суставов и дефектов костей представляет сложную задачу. Основной задачей в предупреждении нарушений заживления переломов является своевременное устранение вышеуказанных причин замедленного образования костной мозоли. С этой целью необходимо достичь: полной стабильности отломков и стимуляции репаративного процесса, нормализовав кровоснабжение в зоне перелома.
При замедленной консолидации иногда достаточно удлинить сроки внешней иммобилизации полноценной повязкой и дать дозированную нагрузку на поврежденную конечность.
Средние сроки образования ложного сустава составляют 9-10 мес. после перелома.
Метод лечения ложных суставов — только хирургический.
При несросшихся переломах и гиперпластических ложных суставах внеочаговый остеосинтез с помощью компрессионных аппаратов обеспечивает полноценную консолидацию.
При гиповаскулярных ложных суставах и значительных дефектах длинных трубчатых костей необходима биологическая стимуляция костеобразования в виде костной пластики ауто- или аллотрансплантатами компактного или губчатого строения.
Нарушение консолидации перелома диагностируется травматологом на основании анамнеза, клинической и рентгенологической картины, а также времени, прошедшего с момента травмы. Если превышен средний срок, необходимый для сращения данного вида перелома, говорят о замедленной консолидации. В случае, когда средний срок сращения превышен в два и более раза, диагностируется ложный сустав. Ложный сустав – патологическое состояние, сопровождающееся нарушением непрерывности трубчатой кости и возникновением подвижности в несвойственных ей отделах.
Такое деление в травматологии достаточно условно, но, вместе с тем, имеет большое значение при выборе тактики лечения. При замедленной консолидации остается шанс на сращение. При формировании ложного сустава самостоятельное сращение невозможно.
Для подтверждения диагноза выполняется рентгенография в двух (прямой и боковой) проекциях. В некоторых случаях делают рентгенограммы в добавочных (косых) проекциях. На снимках выявляется отсутствие костной мозоли, сглаживание и закругление концов костных фрагментов, возникновение замыкательной пластинки на концах отломков (закрытие полости в центре трубчатой кости).
На рентгенограмме атрофического ложного сустава определяется коническое сужение концов костных фрагментов, на снимке гипертрофического ложного сустава – утолщение концов отломков и неровные контуры щели. При истинном ложном суставе конец одного отломка становится выпуклым, а другой вогнутым.
Лечение ложного сустава комплексное, включает в себя операцию в сочетании с физио- и медикаментозной терапией, направленной на улучшение питания тканей в области поражения.
Риск возникновения патологии возрастает при нарушениях обмена веществ, эндокринных и инфекционных заболеваниях, нарушениях кровообращения вследствие шока или кровопотери, множественных переломах, тяжелой сочетанной травме, нарушениях иннервации в зоне перелома.
При лечении ложных суставов наиболее эффективны различные виды костной пластики, чрескостный остеосинтез. Операцией выбора является малотравматичный компрессионно-дистракционный остеосинтез (наложение аппарата Илизарова). Продолжительность иммобилизации при любом методе лечения ложных суставов в 2–3 раза больше, чем при лечении аналогичного свежего перелома. После прекращения иммобилизации назначают массаж, ЛФК. физиотерапию, по показаниям – санаторно-курортное лечение.
14. Открытые переломы. Классификация А.В. Каплана и. О.Н. Марковой
Открытым называется перелом кости, сопровождающийся повреждением мягких тканей и кожных покровов в зоне перелома. Открытые переломы сопровождаются тяжелыми повреждениями, ишемией ткани, контаминацией бактериями, все это является причиной плохого заживления перелома и мягких тканей. Открытые переломы составляют около 3% от всех переломов костей.
Согласно классификации, тяжесть повреждения мягких тканей при открытых переломах обозначается различными сочетаниями первых трех римских цифр и первых трех прописных букв алфавита (римские цифры обозначают размеры раны; буквы обозначают вид, тяжесть и обширность повреждения мягких тканей). Буква А обозначает легкое ограниченное повреждение мягких тканей, при которых жизнеспособность их не нарушена или мало нарушена, например при колотых, рубленых ранах. Буква Б – повреждения мягких тканей средней тяжести, жизнеспособность их полностью или частично нарушена в ограниченной зоне. Чаще всего это ушибленные или рваные раны. Буква В – повреждения мягких тканей тяжелые, жизнеспособность их на значительном протяжении нарушена. При IА, IIА, IIIА типе открытых переломов все слои мягких тканей обычно повреждаются путем прокола их сместившимся костным отломком. Открытые переломы IБ, IIБ, IIIБ типов характеризуются наличием ушибленной раны кожи и значительным повреждением подлежащих тканей; ушиб последних сопровождается значительным кровоизлиянием из поврежденных мелких и средних кровеносных сосудов. Переломы IВ, IIВ, IIIВ типов отличаются обширными размозжениями мягких тканей независимо от размеров кожного дефекта. Переломы костей часто крупно- или мелкооскольчатые со значительным смещением отломков. Клинико-анатомические особенности этих переломов обусловлены наличием в механизме травмы элемента сдавления тканей.
Классификация открытых неогнестрельных диафизарных и метафизарных переломов длинных трубчатых костей (по А. В. Каплану и О. Н. Марковой)
Локализация перелома: верхний или нижний метаэпифиз плечевой, локтевой, лучевой, бедренной, большеберцовой, малоберцовой костей. Верхняя, средняя, нижняя треть диафиза плечевой, локтевой, лучевой, бедренной, большеберцовой, малоберцовой костей
Вид перелома: поперечный, косой, винтообразный, крупнооскольчатый, мелкооскольчатый, двойной (без смещения и со смещением отломков)
Читайте также:


