Препараты снижающие боль при остеоартрозе список нпвп
Врачи рекомендуют больным применять НПВП нового поколения при артрозе. Современные лекарственные препараты позволяют сделать лечение более безопасным и комфортным. Заболевание суставов сопровождается болью. На ранних стадиях артроза болевые ощущения возникают периодически. При хронической форме они беспокоят больного постоянно, то усиливаясь, то уменьшаясь. Суставные боли бывают очень сильными и мучительными. Нестероидные противовоспалительные препараты являются спасением для больных артрозом.
Как действуют НПВП
Хотя артроз является дегенеративно — дистрофическим заболеванием, он часто становится причиной появления воспалительных процессов в суставных и околосуставных структурах. Нестероидные противовоспалительные препараты оказывают:
- обезболивающее;
- противовоспалительное;
- жаропонижающее действие.

Принцип действия НПВП основан на нарушении синтеза медиаторов боли — простагландинов. Медиаторами боли называются химические вещества, которые образуются в ткани при ее повреждении. Выработка простагландинов в человеческом организме контролируется ферментом циклооксигеназой (ЦОГ). Фермент ЦОГ принимает участие в превращении арахидоновой кислоты в простагландины. НПВС угнетают циклооксигеназу, не позволяя ей синтезировать простагландины. Из-за снижения количества простагландинов уменьшается боль, понижается температура тела, затухает воспалительный процесс.
Недостатком медикаментов является их отрицательное действие на слизистую оболочку желудка и двенадцатиперстной кишки. Больные, которые вынуждены часто принимать НПВП, страдают от эрозивно — язвенных поражений гастродуоденальной зоны (гастропатии). На фоне облегчения симптомов артроза возникают отрыжка, изжога, тошнота, рвота и боль в желудке. Под действием НПВП появляется язва желудка или двенадцатиперстной кишки.
Прогрессирование заболевания пищеварительного тракта может привести к:
- кровотечениям;
- пенетрации (проникновению в близлежащие органы);
- перфорации (прорыву в брюшную полость) язв;
- стенозированию (сужению) двенадцатиперстной кишки и желудка.
Традиционные НПВС тормозят активность хондробластов и хондроцитов (клеток хрящевой ткани), снижают синтез коллагена и гиалуроновой кислоты, способствуют преждевременной гибели хондроцитов и усиливают дегенерацию хряща. При регулярном их применении артроз прогрессирует.

Побочные эффекты могут вынуждать больных артрозом отказываться от лечения. Гастропатии угрожают не только здоровью, но и жизни пациентов.
Характеристика НПВП нового поколения
При создании НПВП нового поколения особое внимание уделялось снижению вредного влияния на слизистую оболочку гастродуоденальной зоны. Во время исследований были обнаружены изоформы фермента ЦОГ. Действие традиционных НПВС было основано на блокировании изоформ ЦОГ – 1 и ЦОГ – 2. И если угнетение ЦОГ – 2 оказывало обезболивающий и противовоспалительный эффект, то подавление ЦОГ — 1 вызывало нежелательные явления.
Понимание роли изоформ фермента ЦОГ привело к открытию НПВП нового поколения. Чтобы нивелировать негативные качества НПВП, были созданы лекарственные препараты, избирательно воздействующие только на фермент ЦОГ – 2. Они названы селективными ингибиторами ЦОГ – 2.
Клинические исследования подтвердили низкую гастроинтестинальную токсичность новых лекарств. Хотя риск развития гастропатии не исчез, частота ее появления значительно снизилась.

НПВП нового поколения при шейном остеохондрозе и других его видах подразделяют на преимущественно селективные ингибиторы ЦОГ – 2 и специфические (высокоселективные). Преимущественно селективные препараты характеризуются высокой избирательностью к ЦОГ – 2 и низкой к ЦОГ – 1. Высокоселективные подавляют только ЦОГ – 2.
Хотя на первый взгляд высокоселективные препараты при остеохондрозе являются более безопасными, данные клинических исследований свидетельствуют об обратном. В развитии болевого синдрома и воспалительной реакции принимают участие обе изоформы. Поэтому преимущественное угнетение ЦОГ – 2 позволяет добиться отличного лечебного результата с незначительными побочными реакциями.
При существенном подавлении только ЦОГ – 2 возникают дополнительные нежелательные последствия. Применяемые высокоселективные нестероидные противовоспалительные препараты при артрозе негативно влияют на овуляцию и на синтез простациклина (препятствует образованию тромбов).
Селективные ингибиторы ЦОГ – 2 разделяют на 3 группы препаратов:
- Производные сульфонанилидов.
- Представители коксибов.
- Производные оксикамов.
Достоинства и недостатки НПВП нового поколения
НПВП нового поколения не превосходят эффективностью классические препараты. Однако они более безопасны, особенно для людей, страдающих от болезней желудочно-кишечного тракта.
Современные медикаменты не оказывают антитромбоцитарного действия, как неселективные НПВП, поскольку тромбоциты содержат только фермент ЦОГ – 1. Селективные ингибиторы ЦОГ – 2 назначают больным, которые одновременно принимают антикоагулянты.
НПВС нового поколения оказывают положительное воздействие на хрящевую ткань, помогая остановить развитие артроза и восстановить функционирование сустава. Они принуждают хондроциты вырабатывать:
- межклеточное вещество хряща;
- гликозаминогликаны (вещества, образующие матрикс хряща);
- коллаген.
Эти вещества необходимы для полноценного функционирования хрящевой ткани.

В то же время селективные НПВП способны повышать риск развития инфаркта миокарда, сердечной недостаточности и инсульта.
Избирательное угнетение ЦОГ – 2 может приводить к задержке жидкости в организме, повышению артериального давления и обострению сердечной недостаточности.
Производные сульфонанилидов
Одним из первых был произведен селективный ингибитор ЦОГ – Ц 2 Нимесулид (Найз, Нимика, Нимулид, Нимесил). Многочисленные исследования и клинический опыт доказали высокую эффективность и хорошую переносимость препарата. За почти 3 десятилетия применения лекарственного средства серьезных анафилактических реакций или осложнений со стороны пищеварительной системы (образование язвы, кровотечения) не было зафиксировано.
Характерной особенностью Нимесулида является способность не только угнетать деятельность ЦОГ – 2, но и блокировать ее выработку.

Нимесулид относится к преимущественно селективным лекарственным средствам. Он на 88% подавляет активность ЦОГ – 2 и на 45% — ЦОГ – 1. При этом воздействие на ЦОГ – 2 длится дольше.
Лекарственное средство часто назначается больным артрозом из-за его способности снижать в синовиальной (суставной) жидкости уровень коллагеназы. Коллагеназа разрушает коллаген и протеогликаны (вещества межклеточного матрикса соединительной ткани), стимулируя прогрессирование артроза.
После применения Нимесулида при шейном остеохондрозе и артрозе:
- снижается интенсивность боли;
- уменьшается отек;
- воспалительный процесс затухает.
Сустав частично или полностью восстанавливает свою подвижность.
Нимесулид выпускается в виде таблеток, гранул для приготовления суспензии и мази для наружного применения. Гранулы разводят в охлажденной кипяченой воде (содержимое 1 пакетика на 100 мл воды). Приготовленная суспензия хранению не подлежит. Таблетки или суспензию принимают внутрь 2 раза в день. Мазь наносят на пораженное место и слегка втирают. Процедуру повторяют 3 — 4 раза в день. После нее снижается боль и уменьшается опухоль. Препарат помогает улучшить двигательную активность пораженного сустава.

Курс лечение составляет 2 — 8 недель. Он определяется врачом на основании стадии и тяжести заболевания.
После случаев развития серьезных осложнений со стороны печени на фоне приема данного лекарственного препарата были проведены дополнительные исследования на предмет гепатотоксичности Нимесулида. Однако связь лекарственного препарата с появлением гепатопатий не была доказана.
Нимесулид противопоказан беременным женщинам и кормящим мамам.
Представители коксибов

Целекоксиб (Целебрекс) относится к высокоселективным НПВС. Он быстро снижает болевой синдром и уменьшает воспаление. Терапевтические дозы являются безопасными для человека и не вызывают осложнений. Целекоксиб существенно уменьшает риск образования гастродуоденальных язв и других заболеваний пищеварительной системы. Он незначительно увеличивает вероятность тромбоза.
Лекарство быстро всасывается, достигая максимальной концентрации через 2-3 часа. В случае приема жирных продуктов перед употреблением дозы Целекоксиба усваивание замедляется. Максимальная концентрация появится только через 6-7 часов. На этот показатель влияют масса тела и пол пациента. У людей с небольшим весом тела и у женщин концентрация действующего вещества выше, чем у других больных. Таким людям нужно начинать терапию с минимальных доз.
Длительность терапии зависит от состояния больного. Пациентам с сердечно-сосудистыми заболеваниями назначают минимальные дозы и кратковременный курс лечения.
Препарат изготавливается в капсулах. Их принимают дважды в день. Целекоксиб в виде мази не выпускается.

Целекоксиб не назначается больным с тяжелой почечной и печеночной недостаточностью и при пептической язве во время ее обострения. Противопоказанием являются желудочно — кишечное кровотечение и воспаление кишечника. Нельзя применять Целекоксиб:
- людям, страдающим от бронхиальной астмы;
- детям до 18 лет;
- беременным;
- кормящим женщинам.

Вальдекоксиб (Бекстра) быстро всасывается после приема внутрь. В отличие от Целекоксиба, жирная пища не влияет на скорость его усваивания. Максимальная концентрация действующего вещества возникает через 3 часа. Подтверждено негативное влияние Вальдекоксиба на овуляцию. Однако действие является обратимым.
Лекарственный препарат с осторожностью назначают больным с артериальной гипертензией и с сердечной недостаточностью. Не рекомендуется применять Вальдекоксиб пожилым людям, беременным и кормящим женщинам, больным с нарушениями функции печени и почек, кроме того, детям до 18 лет. Запрещается пить Вальдекоксиб при наличии пептической язвы в острой стадии, тяжелой сердечной или почечной недостаточности.
Таблетки пьют 1 раз в день. В первые сутки лечения можно принять препарат дважды. Лекарственной формы препарата в виде мази не существует.
Производные оксикамов
Эффективность и безопасность Мелоксикама (Мовалис, Амелотекс) проверена многократными клиническими исследованиями. Он быстро купирует болевой синдром и снимает воспаление. Среди всех других НПВП нового поколения Мелоксикам чаще всего рекомендуется при артрозе и при шейном остеохондрозе. Достоинством препарата является возможность принимать его длительное время без ущерба для здоровья.
Выпускается лекарственный препарат в виде таблеток, свечей и растворов для внутримышечных инъекций. Таблетки принимают внутрь 1 раз в день во время еды. Свечи вводят 1–2 раза в сутки. Внутримышечное введение показано только в первые 2–3 дня терапии. Мази Мелоксикам не существует.
Мелоксикам не назначают при почечной и печеночной недостаточности. Он противопоказан беременным и кормящим женщинам, а также детям до 15 лет.

Лорноксикам (Ксефокам) является мощным обезболивающим средством. По силе воздействия его можно сравнить с Морфином. Терапевтический эффект сохраняется 12 часов. Лекарственное средство не вызывает нарушений со стороны нервной системы и не вызывает привыкания.
При одновременном приеме с пищей время достижения максимальной концентрации увеличивается с 1,5 до 2 — 3 часов. Препарат выпускается в виде таблеток и порошка для внутримышечных и внутривенных инъекций. Инъекции делают 1 раз в сутки. В первый день лечения может быть назначено 2 введения. Таблетки принимают 2 — 3 раза в день. Лекарственной формы в виде мази не существует.
Противопоказанием является тяжелая форма сердечной, почечной и печеночной недостаточности, желудочно-кишечные или церебрально — сосудистые кровотечения, пептическая язва в острой форме, тромбоцитопения, а также беременность и период кормления грудью.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье рассматриваются вопросы медикаментозной терапии при остеоартрозе. Представлены данные в отношении безопасности применения различных нестероидных противовоспалительных препаратов с учетом возраста больного и необходимости их длительного приема. Показана перспектива улучшения фармакокинетических параметров этих препаратов.
The paper deals with drug therapy for osteoarthrosis, gives data o n the safe use of various nonsteroidal antiinflammatory agents in terms of the patient`s age and the need for their long-term use, and shows the prospects for improving the pharmacokinetiс properties of these drugs.
Д.Е. Каратеев, канд. мед. наук, старший научный сотрудник Института ревматологии (дир. – акад. РАМН В.А. Насонова) РАМН, Москва
D.Ye. Karateyev, Candidate of Medical Sciences, Senior Researcher, Institute of Rheumatology, Russian Academy of Medical Sciences (Director V.A. Nasonova, Academician, Russian Academy of Medical Sciences), Moscow
О стеоартроз (ОА) – самое распространенное заболевание опорно-двигательного аппарата [1], имеющее важное социальное значение. Большинство больных ОА обращаются к врачу за помощью при поражениях нагрузочных суставов (коленных и тазобедренных), вызывающих боли и ограничение движений, что резко снижает качество жизни. ОА коленного сустава является основной причиной болей и функциональных нарушений в пожилом возрасте [2].
При ОА дегенерация суставного хряща, являющаяся основным признаком болезни, закономерно связана с возникновением вторичного воспаления синовиальной оболочки [1, 3]. Боль – основное клиническое проявление ОА – связана с развитием вторичного синовита, который в свою очередь усиливает процессы деградации хряща. В связи с этим в англоязычной литературе для обозначения нозологии используется термин “остеоартрит”, что подчеркивает важность воспалительного компонента при данном заболевании.
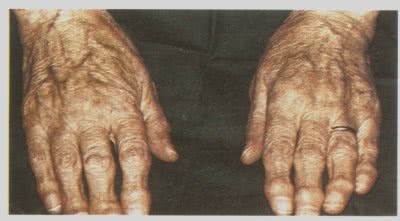
Пример остеоартроза. Узелки Гебердена (дистальные межфаланговые суставы) и Бушара (проксимальные межфаланговые суставы).
Основой лечения болевого синдрома при ОА в настоящее время являются нестероидные противовоспалительные препараты (НПВП) [4]. Трудно найти больного ОА, который не получал бы того или иного препарата этой группы хотя бы изредка. Показано, что НПВП при ОА в большинстве случаев обеспечивают более выраженный обезболивающий эффект, чем ненаркотические анальгетики, например парацетамол [5]. Мировая фармакологическая промышленность предоставляет врачам широкий выбор НПВП с различной химической структурой [6, 7]. Для НПВП характерна индивидуальная реакция на препарат, а также достаточно высокая частота побочных проявлений со стороны желудочно-кишечного тракта (ЖКТ). До сих пор открытым остается вопрос о недостатках и преимуществах той или иной группы НПВП.

Пример остеоартроза. Узелки Гебердена (дистальные межфаланговые суставы) и Бушара (проксимальные межфаланговые суставы).
В России, как и во всем мире, для лечения ОА наиболее часто применяются НПВП, представленные в таблице.
При выборе НПВП для лечения больного ОА врач должен учесть следующие важные моменты:
1. Влияние НПВП на ЖКТ
2. Влияние НПВП на суставной хрящ
3. Возрастные особенности больных ОА
4. Необходимость и возможность длительного приема НПВП
5. Возможности улучшения эффективности и переносимости НПВП
Таблица. НПВП, наиболее часто применяющиеся для лечения ОА
| Группа | Препарат | Средние дозы, мг/сут |
| Производные арилпропионовой кислоты | Ибупрофен (бруфен, мотрин) | 800 – 1600 |
| Флюрбипрофен(флугалин) | 200 | |
| Напроксен(напросин) | 500 – 1000 | |
| Кетопрофен(кетонал) | 150 – 300 | |
| Тиапрофеновая кислота (сургам) | 600 | |
| Производные арилуксусной кислоты | Диклофенак(вольтарен, диклонат, диклак, ортофен диклоран) | 100 – 150 |
| Оксикамы | Пироксикам (фельден) | 20 – 40 |
| Производные индолуксусной кислоты | Индометацин (метиндол) | 100 – 150 |
Влияние на ЖКТ
В настоящее время можно считать доказанным, что прием больших доз НПВП (например, при ревматоидном артрите) часто вызывает эрозивно-язвенное поражение ЖКТ, в первую очередь слизистой желудка (по данным Муравьева Ю. В. и соавт., до 40% от общего числа больных, которым проводилась гастроскопия). Эрозивно-язвенное поражение слизистой ЖКТ является характерным последствием применения НПВП, непосредственно связанным с механизмом их действия – ингибированием циклооксигеназы-1 [8].
В отношении сравнительной безопасности различных НПВП во всем мире проведено большое количество клиничеcких испытаний, и эти исследования нельзя считать завершенными. Однако, суммируя данные различных клинических испытаний, уже сейчас можно получить довольно определенную картину. Согласно данным Комитета по безопасности лекарств Великобритании и ряда других исследований [9], в порядке нарастания относительного риска развития неблагоприятных реакций со стороны ЖКТ наиболее распространенными в нашей стране НПВП являются: 1) ибупрофен; 2) диклофенак; 3) флюрбипрофен; 4) напроксен; 5) кетопрофен; 6) пироксикам; 7) индометацин.
Таким образом, наиболее хорошо переносится ибупрофен, а наиболее часто поражение пищеварительного тракта встречается при лечении индометацином.
Схема: патологические изменения в суставе при остеоартрите
Деградация хряща
Серьезным доводом против длительного применения НПВП у больных ОА является представление о вероятном отрицательном воздействии этих препаратов на хрящ. Следует обратить особое внимание на то, что, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в хряще и кости. Есть целый ряд сообщений о том, что длительный прием НПВП может способствовать прогрессированию деградации хряща [1].
В то же время только на фоне применения индометацина усиление деградации хряща и прогрессирование патологического процесса в суставах можно считать доказанным [10 – 12]. В основном это касается ОА тазобедренного сустава. Наличие отрицательного действия НПВП в отношении прогрессирования ОА для других НПВП весьма дискутабельно. Специальные исследования показали, что тиапрофеновая кислота в отличие от индометацина не вызывает ухудшения рентгенологической картины при гонартрозе даже при многолетнем применении [35]. По всей видимости, не оказывают отрицательного действия на хрящ и производные арилпропионовой кислоты (ибупрофен и др.).
Учет возрастных особенностей больных ОА
Вопрос о переносимости НПВП особенно важен, если учесть, что ОА заболевают, как правило, в пожилом возрасте, когда фармакокинетика различных лекарственных препаратов может меняться, в первую очередь за счет изменения функции печени и почек. Так, показано, что ряд препаратов, таких как индометацин, дифлунисал, напроксен и кетопрофен, могут кумулировать с повышением вероятности токсических реакций у пожилых пациентов, это связывают с возрастным снижением функции почек [13].
С другой стороны, не все препараты пожилые пациенты переносят хуже. Есть данные, что фармакокинетика ибупрофена не меняется в пожилом возрасте на фоне возрастных изменений функций печени в отличие от ряда других препаратов, например сулиндака [14]. В литературе имеются данные о лучшей переносимости флюрбипрофена (флугалина), в частности в отношении влияния на функцию почек, по сравнению с пироксикамом у больных ревматоидным артритом в возрасте старше 60 лет [15].
Необходимость и возможность длительного приема НПВП
Существует довольно распространенное мнение о том, что НПВП необходимо назначать только короткими курсами, максимум на несколько недель, для снятия болевого синдрома. В то же время характерной особенностью ОА является прогрессирующая дегенерация хряща у лиц пожилого и старческого возраста, клинически проявляющаяся болями, скованностью и ограничением движений в пораженных суставах, и по мере прогрессирования явления синовита и соответственно болевой синдром становятся все более стойкими.
В Институте ревматологии РАМН проведено клиническое исследование (являющееся частью обширной многоцентровой апробации), посвященное изучению эффективности и переносимости флюрбипрофена (флугалин) при непрерывном длительном (12 мес) приеме у больных ОА [16 – 18]. Это исследование позволило сделать вывод о том, что флугалин является достаточно эффективным средством для купирования болевого синдрома при ОА, обладающим удовлетворительной переносимостью.
Судя по динамике болевого синдрома у наших пациентов, у большинства больных можно достигнуть стабильного снижения уровня болевых ощущений в суставах при относительно длительном (3 – 6 мес) приеме препарата, особенно в случаях наличия отчетливо клинически определяемого вторичного синовита. При этом суждение об эффективности и переносимости флугалина врач может составить за более короткий (1 – 3 мес) период наблюдения.
При условии отсутствия побочных проявлений в первые 3 – 4 мес более продолжительный (6 – 12 мес) прием препарата не сопровождался, очевидно, существенным повышением риска развития осложнений со стороны ЖКТ.
Возможности улучшения эффективности и переносимости НПВП
Пролонгированные формы НПВП
Одним из способов улучшить фармакокинетические параметры НПВП является применение пролонгированных форм (ретард). Это позволяет более длительно поддерживать достаточно высокий уровень препарата в крови, сократить число приемов препарата в день и добиться некоторого улучшения переносимости со стороны ЖКТ. Наиболее хорошо зарекомендовали себя пролонгированные формы диклофенака (вольтарен-ретард), ибупрофена (бруфен-ретард) и флюрбипрофена (флугалин-ретард).
Ибупрофен показал более высокую эффективность и лучшую переносимость пролонгированной формы по сравнению с обычной таблетированной формой препарата при ОА и ревматоидном артрите [19, 20]. Наши исследования [16 – 18] продемонстрировали, что пролонгированная форма флюрбипрофена (флугалин-ретард) дает несколько более выраженный обезболивающий эффект при ОА, чем короткоживущая форма препарата (что, очевидно, обусловлено более плавным снижением концентрации препарата в крови после однократного приема). Кроме того, имелась отчетливая тенденция к лучшей переносимости пролонгированной формы со стороны ЖКТ. Для больных применение флугалина-ретард было существенно более удобным, поскольку позволяло принимать лекарство 1 раз в день.
Комбинации с гастропротекторами
В настоящее время делаются попытки уменьшить риск развития гастропатий при лечении НПВП путем комбинации их с так называемыми гастропротекторами – средствами, применяемыми для лечения язвенной болезни желудка и двенадцатиперстной кишки, обладающими профилактическим эффектом. Наиболее известен препарат артротек – комбинация диклофенака или мизопростола (сайтотек), который близок по структуре к естественному простагландину Е1, стимулирующему слизеобразование и подавляющему секрецию желудочного сока. Имеется ряд обнадеживающих сообщений об уменьшении частоты эрозивно-язвенного поражения ЖКТ при лечении артротеком, однако это нельзя считать установленным фактом. Есть данные о том, что при ОА артротек достоверно не отличается от диклофенака ни по эффективности, ни по переносимости [21]. Поэтому целесообразность комбинации диклофенак + мизопростол еще требует подтверждения.
Ингибирование циклооксигеназы-2
Другим перспективным направлением по улучшению переносимости НПВП является разработка лекарств, селективно ингибирующих циклооксигеназу-2. Согласно современным представлениям, НПВП обладают рядом фармакологических эффектов. Основным, очевидно, является, как было показано J. Vane в 1971 г., ингибирование простагландинсинтетазы (циклооксигеназы) – фермента, катализирующего превращение арахидоновой кислоты в простагландины, являющиеся медиаторами воспаления. У большинства препаратов из группы НПВП этот механизм также приводит к ингибированию синтеза “полезных” простагландинов, регулирующих уровень кислотности желудочного сока, функционирование слизистого барьера желудка, обладающих вазодилататорным эффектом, что приводит к возможности возникновения нежелательных реакций.
Сейчас известно, что существуют 2 изоформы циклооксигеназы (ЦОГ) – циклооксигеназа-1 (ЦОГ-1) и циклооксигеназа-2 (ЦОГ-2). ЦОГ-1 – конституциональный, “полезный”фермент, синтезирующий тромбоксан А2, простагландин Е2, простациклин, участвующие в важнейших физиологических процессах. ЦОГ-2 – “индуцируемый” фермент, который катализирует синтез простагландинов, участвующих в воспалительном процессе [22]. Очевидно, что для получения противовоспалительного эффекта желательно иметь препарат, ингибирующий синтез “патологической” ЦОГ-2 и не вляющий на “физиологическую” ЦОГ-1. Все широко применяемые НПВП ингибируют как ЦОГ-2, так и ЦОГ-1.
В последние годы синтезированы такие препараты, как мелоксикам и нимесулид, которые способны ингибировать ЦОГ-2 существенно более выраженно, чем ЦОГ-1 [23, 24]. Рядом авторов показано, что эти препараты, вероятно, могут лучше переноситься больными, чем традиционные НПВП, причем эти сведения выглядят более достоверными в отношении мелоксикама. Если рузультаты предварительных исследований будут подтверждены клинической практикой, врачи и больные смогут получить безопасный обезболивающий и противовоспалительный препарат. Однако клинические данные об эффективности и безопасности, похоже, прямо не коррелируют со степенью селективности ингибирования ЦОГ-2. Таким образом, вопрос о преимуществах мелоксикама и нимесулида перед другими НПВП остается открытым.
Итак, основываясь на приведенных выше данных, идеальный НПВП для лечения ОА должны отличать следующие свойства: 1) хороший обезболивающий эффект; 2) низкая частота поражения ЖКТ; 3) отсутствие отрицательного действия на хрящ; 4) удобная лекарственная форма.
По-видимому, в настоящее время этим требованиям наиболее точно отвечают производные арилпропионовой кислоты. Препараты этой группы, в первую очередь ибупрофен, считаются классическими для лечения ОА, поскольку они отличаются хорошим обезболивающим эффектом и удовлетворительной переносимостью.
Ибупрофен (бруфен) является стандартом хорошей переносимости НПВП, что нашло отражение в том факте, что в большинстве стран разрешена безрецептурная продажа этого препарата [25]. Согласно данным ряда исследований [26], применение ибупрофена ассоциировано с наименьшим риском развития язвенного поражения ЖКТ по сравнению со всеми другими препаратами группы НПВП.
Во всем мире ибупрофен широко применяется для лечения больных ОА, поскольку отличается хорошим обезболивающим эффектом и вполне удовлетворительной переносимостью. При этом он оказывает менее выраженное противовоспалительное действие, хотя в ряде случаев и применяется для лечения воспалительных заболеваний суставов, таких как ревматоидный артрит. По сравнению с ибупрофеном флюрбипрофен (флугалин) – препарат следующего поколения, который обладает более мощным противовоспалительным эффектом, что позволяет применять его в меньших дозах. Оба препарата применются для лечения ОА уже несколько десятилетий. За это время проведены многочисленные клинические испытания, продемонстрировавшие достаточно высокую клиническую эффективность, а также вполне удовлетворительную их переносимость. По переносимости как ибупрофен, так и флюрбипрофен в целом ряде исследований превосходили такие препараты, как индометацин, диклофенак, напроксен и ацетилсалициловая кислота [27 – 30]. Наши исследования [16 – 18] показали возможность и относительную безопасность длительного (многомесячного) приема поддерживающей дозы флюрбипрофена. При этом как ибупрофен, так и флюрбипрофен выпускаются в виде широкого спектра лекарственных форм, в том числе и пролонгированных, обеспечивающих хороший клинический эффект при приеме 1 раз в сутки.
При необходимости получения более выраженного противовоспалительного эффекта (при упорном вторичном синовите, периартрите) целесообразно применение диклофенака (вольтарен, диклонат, наклофен), обладающего выраженной противовоспалительной активностью, который также отличается хорошей переносимостью и многообразием лекарственных форм – от быстродействующих до пролонгированных.
В то же время следует отметить, что для НПВП характерна индивидуальная реакция больного на препарат, в связи с чем и другие препараты из этой группы могут быть чрезвычайно полезны ряду пациентов.
1. Агабабова Э. Р. // Клин. ревматология, 1995, №4, с. 3 – 6.
2. Cushnaghan J, et al. // British Med J 1994;308:753–5.
3. Pelletier J-P, Martel-Pelletier J. Rheumatology in Europe 1995;24(2):59–60.
4. Bellamy N and Bradley L. Arthritis and Rheumatism 1996;39:357–62.
5. Rickavance L, et al. Rheumatology in Europe 1995;24(3):330.
6. Денисов Л. Н. // Materia Medica 1995;1:56–67.
7. Насонов Е. Л. Противовоспалитльная терапия ревматических болезней. М.: “М-Сити”, 1996,345 с.
8. Spangler R. Arthritis and Rheumatism 1996;26:435–46.
9. Донован С. Клин. ревматология 1995;2:47–50.
10. Newman N, Ling R. Lan cet 1985;i:11–4.
11. Rashad S, et al. Lancet 1989;2:111–3.
12. Gishen P, et al. Rheumatology in Europe 1995;24:(3):331.
13. Johnson A, et al. Med J Aust 1995;163:155–8.
14. Astbury C, Bird H. J Drugs Dev 1993;6(2):57–61.
15. Hrba J, et al. Rheumatology in Europe 1995;24(3):217.
16. Каратеев Д. Е. и соавт. // III Российский нац. конгресс “Человек и лекарство”, 1996, Тезисы докладов, с. 130.
17. Насонова В. А. и соавт. // Клин. ревматология,1996, №1, с.25–9.
18. Karateyev D, et al. Rhe u matology in Europe 1996;1:355.
19. Delbridhe A, Dumelow N, Donovan S. Rheumatology in Europe 1995;24(3):326.
20. Donovan S, Dumelow N, Delbridge A. Rheumatology in Europe 1995;24(3):326.
21. Насонова В. А. и соавт. // Клин. ревматология, 1995, №5 , с. 35–7.
22. Vane JR. British J Rheumatol 1996;35(1);1–3.
23. Engelhardt G. British J Rheumatol 1996;35(1):4–12.
24. Davis R, Brogden R. Drugs 1994;48:431–54.
25. Рики Р. // Клин. ревматология, 1995, №2, с. 57–60.
26. Griffin M, et al. Ann Int Med 1991;114:257–63.
27. Саундерс С. А., Хиггинс К. М., Донован С. // Клин. ревматология, 1995, №2, с. 50–6.
28. Frank O. Current Medical Research and Opinion 1977;5:91–8.
29. Kogstag O. XIIIth Int Cong Rheumatol 1973. Kyoto Japan.
30. Ren es J, Donovan S, Higgins C, Saunders C. Rheumatology in Europe 1995;24(3):222.
Читайте также:


