Постинъекционный некроз мягких тканей
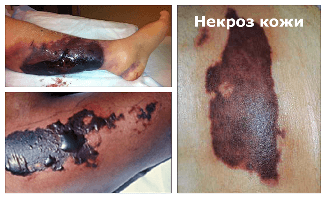
Некроз кожи – это патологический процесс, означающий гибель части ткани в живом организме. Происходит набухание, денатурация и коагуляция цитоплазматических белков и разрушение клеток. Причинами некроза кожи является нарушение кровообращения и воздействие патогенных бактерий или вирусов. По этиологии классифицируются на травматический, токсигенный, трофоневротический и ишемический некрозы.
Учитывая структурно-функциональные особенности органов и тканей, разделяют клинико-морфологические формы некроза:
· Коагуляционный некроз (сухой)
· Колликвационный некроз (влажный)
Причиной гибели ткани кожи могут быть физические или химические травмы, аллергические реакции, нарушения иннервации. Постинфекционные некрозы кожи и подкожной клетчатки, пролежни – это весьма серьезные, крайне неприятные состояния. Пролежни появляются в результате постоянного давления, нарушения кровообращения и влияния нервной системы на питание и обмен веществ в организме, сухости кожи, при недостаточном уходе за лежачим больным, анемии и т. д.
Появление некрозов после уколов объясняется введением очень больших доз медикамента, после которого развивается рефлекторный артериолоспазм, а затем тканевая гипоксия. Чтобы предупредить развитие постинъекционных некрозов кожи, следует вводить одновременно с лекарственным препаратом раствор новокаина и прикладывать на область укола холод.
Онемение, отсутствие чувствительности, бледность кожных покровов, а затем синюшность, почернение кожи или появление темно-зелёного оттенка, общее ухудшение состояния, учащение пульса, подъем температуры, гиперемия и отечность – первые признаки некроза кожи. Если есть быстрое развитие системных проявлений и приём антибиотиков не эффективен, то это тоже признак наличия некротизирующей инфекции. Сильная боль в коже над очагом поражения предупреждает о развитии гангрены.
Тщательная подготовка перед операцией, применение современных методов обеспечивают значительное снижение количества случаев некроза кожи, но все же, каким бы тщательным ни было соблюдение норм стерильности в группу риска по осложнению после операции входят пациенты, страдающие сахарным диабетом, гипертонической болезнью, курильщики. Первые признаки некроза наблюдаются через 2-3 дня после операции.
Проявляется это краевым некрозом по ходу шва. Обнаружив изменения необходимо сохранить корочку покрывающую поверхность раны (струп) как можно дольше, до образования под ней грануляций. В случае более глубокого некроза ткани, когда расходится шов, производят некрэктомию, т. е. очищение краев раны при помощи ферментных гелей и мазей, после затягивания раны накладывают вторичные швы.
Причинами формирования некроза участка кожи после операции может быть нехватка кровяного питания, значительная отслойки тканей или натяжения на участках швов, инфицирование, развивающееся в результате образования гематомы.
Некротизирующие инфекции кожи вызываются различными микроорганизмами с аэробными и анаэробными свойствами. Заболевание возникает при проникновении группы данных возбудителей в подкожную клетчатку. Их взаимодействие приводит к некрозу кожи. Бактериальная гангрена, вызывается микроаэрофильным негемолитическим стрептококком, а стрептококковая гангрена провоцируется токсигенными штаммами БГСА.
Быстро прогрессирующая инфекция, сопровождается симптомами тяжелой интоксикации. Кожа человека может поражаться некротизирующим инфекциям после укуса насекомых, после легких травм, при возникновении лекарственных реакций, нарушения стерильности инъекции, при парапроктите (перианальные абсцессы) и при многих других факторах. На сегодняшний день компьютерная томография достоверно подтверждает наличие инфекции вызывающей некроз кожи.
Биопсия и аспирационная биопсия позволяет установить диагноз при оценке гистологических изменений. Лечение пациентов с некрозом кожи должно проводиться под наблюдением врачей – инфекциониста, реаниматолога и хирурга. Обязательно проводится внутривенная терапия пенициллином, клиндамицином и гентамицином. Подбираются антибиотики в соответствии с результатами микробиологического исследования. И проводится инфузионная терапия и стабилизирование гемодинамики.
Например, при бактериальной гангрене наблюдается медленное развитие, поэтому её лечат как инфекционную форму гангрены. Лечение назначают консервативное, но пораженные некрозом ткани кожи обязательно удаляются хирургическим путем. Залог успешного лечения некроза кожи – ранняя диагностика, интенсивное лечение медикаментами и хирургическое вмешательство.

Эксперт-редактор: Мочалов Павел Александрович | д. м. н. терапевт
Образование: Московский медицинский институт им. И. М. Сеченова, специальность - "Лечебное дело" в 1991 году, в 1993 году "Профессиональные болезни", в 1996 году "Терапия".

Такое отношение к указанным повреждениям сложилось, вероятнее всего, потому, что их относили к осложнениям инъекций, возникающим из-за нарушений правил асептики и техники инъекций [3]. В связи с этим признание наличия этих повреждений в местах инъекций лекарств у пациентов автоматически накладывало вину за их появление на медицинских работников, которые для сохранения своей невиновности вынуждены были тщательно скрывать их наличие [2]. Лишь в последние годы было установлено, что некрозы и абсцессы при инъекциях возникают не из-за нарушений правил асептики и техники прокалываний инъекторами, а из-за локальной фармацевтической агрессивности лекарств, которые при инъекциях в кожу и в клетчаточные ткани могут оказывать внутритканевое денатурирующее (прижигающее) действие [2; 4; 5; 8; 9].
В связи с тем, что обсуждаемые повреждения кожи и других мягких тканей локализуются только в местах инъекций, имеют особый и неповторимый характер, возникают только от внутритканевых прижигающих инъекций, а также требуют специфической профилактики и лечения, они могут представлять собой самостоятельное заболевание.
Цель исследования - конкретизация этиологии, патогенеза, вариантов течения, исходов, а также средств профилактики и лечения повреждений кожи, подкожно-жировой клетчатки и других мягких тканей, возникающих в местах инъекций.
В экспериментах на 30 бодрствующих 2-месячных поросятах обоего пола породы ландрас массой от 5 до 7 кг на глаз, с помощью ультразвукового прибора марки Aloka SSD-900 и с помощью тепловизора марки Thermo Tracer TH9100WRI (NEC San-ei Instruments, Ltd, USA) изучена динамика медикаментозного инфильтрирования и воспаления кожи и подкожно-жировой клетчатки в местах подкожных инъекций растворов лекарственных средств в области передней брюшной стенки. В работе использованы растворы лекарственных средств, выпущенные для инъекций разными производителями, отвечающие своим качеством требованиям соответствующих фармакопейных статей и снабженные сертификатами качества и паспортами лекарственных средств установленных образцов. Осмотическая активность растворов лекарственных средств определена криоскопическим методом с помощью осмометра марки OSMOMAT-030 RS.
Статистическая обработка результатов проведена с помощью программы BIOSTAT, предназначенной для статистической обработки медицинских исследований. Вычисляли среднюю арифметическую (M), ошибку средней арифметической (m), коэффициент достоверности (±). Степень различий показателей определяли в каждой серии по отношению к исходным показателям в контрольной серии. Разницу значений считали достоверной при Р £ 0,05.
Результаты исследования и их обсуждение. Результаты проведенных нами исследований показывают, что при госпитальном лечении пациенты женского и мужского пола ежедневно получают в виде инъекций от 1 до 25 лекарственных средств, многие из которых вводятся 3 раза в день, а иногда и до 6 раз в сутки. При этом практически каждому пациенту в одну из подкожных вен вводится внутрисосудистый катетер, который соединяется с инфузионным устройством, заполненным плазмозамещающей жидкостью. Затем около 80% лекарств вводится в вену с помощью установленного катетера, а остальная часть лекарств вводится в основном в скелетные мышцы, расположенные в области ягодиц и передней поверхности бедер.
Показано, что до начала госпитального лечения места предполагаемых инъекций в области ягодиц, бедер и рук имели физиологическое (здоровое) состояние у 194 из 200 обследованных пациентов женского пола и у 99 из 100 пациентов мужского пола, а к концу госпитального лечения приобрели следы воспалений у всех обследованных нами 200 женщин и 100 мужчин. Причем в последний день госпитального лечения кожа в области ягодиц и бедер у каждого из них имела множественные локальные воспаления округлой формы, локализованные вокруг мест проколов в области ягодиц, бедер и/или в области локтевых ямок. Указанные воспаления имели характер колото-инфильтративных повреждений различных степеней тяжести и сроков давности. Помимо этого, у 29 ± 1,5% пациентов (Р ≤ 0,05, n = 300) дополнительно к указанным повреждениям в местах инъекций имелись кровоподтеки. Самые большие размеры их наблюдались при инъекционном введении гепарина (фото 1).
В опытах на поросятах установлено, что локальные повреждения кожи, подкожно-жировой клетчатки и других тканей возникают как от их прокалываний инъекционными иглами, так и от инфильтраций различными лекарствами и жидкостями. Показано, что наиболее уязвимой к денатурирующему действию препаратов является клетчаточная ткань.
Выяснено, что динамика развития повреждений и их выраженность в местах инъекций различных растворов лекарственных средств и других агрессивных сред различна. По скорости их наступления, выраженности проявления и тяжести исходов все препараты можно разделить на 3 группы: сильные, умеренные и слабые.
В группу сильных и быстро прижигающих средств, подкожные инъекции которых вызывают выраженные воспаления, некрозы и абсцессы, входят спирты, кетоны, альдегиды, кислоты, щелочи, а также кальция хлорид и натрия хлорид. В частности, подкожные инъекция этилового спирта, ацетона, уксусной кислоты, нашатырного спирта, скипидара или керосина либо насыщенных растворов кальция хлорида или натрия хлорида вызывают практически тут же физико-химический ожог кожи и подкожно-жировой клетчатки, который сопровождается формированием очага выраженной гиперемии, гипертермии, болезненности и отечности, в котором кожа через несколько минут приобретает темно-вишневую окраску, а через сутки в очаге возникает некроз тканей, а затем - абсцесс и/или открытая гнойная рана. Причем эти гнойные исходы развиваются несмотря на то, что причиной их появления являются антисептики, дезинфицирующие и прижигающие средства.
В группу умеренно агрессивных денатурирующих средств, подкожные инъекции которых вызывают формирование умеренных локальных воспаленных инфильтратов, входят ненасыщенные водные растворы солей щелочных, щелочно-земельных и тяжелых металлов. Эту группу представляют гипертонические растворы солей натрия, калия, кальция, магния, железа и других металлов. Установлено, что при подкожных инъекциях водные растворы указанных солей вызывают выраженное местное раздражающее действие на кожу и клетчатку в случаях, когда концентрация этих средств в растворах превышает 10%. Показано, что денатурирующее действие препаратов второй группы при подкожных инъекциях проявляется через несколько минут непрерывного взаимодействия с тканями.
Причем повышение их концентрации в растворах выше указанного уровня повышает их местное раздражающее действие, которое может трансформироваться в прижигающее действие. Поэтому при особых условиях взаимодействия эти средства при внутрикожных, подкожных и внутримышечных инъекциях способны вызывать выраженные локальные воспаления, а иногда и физико-химический ожог тканей подобно ожогу, вызываемому аналогичной инъекцией препаратов первой группы. Дело в том, что повышение концентрации солей в растворах повышает их гиперосмотическую активность, которая у большинства веществ при достижении ими концентрации 10% и выше способна стать причиной денатурирующего действия и физико-химичсекого ожога. В связи с этим гиперосмотические (гипертонические) растворы 20%-ного пирацетама, 20%-ного натрия оксибутирата, 24%-ного кордиамина, 25%-ной сернокислой магнезии, 50%-ного метамизола натрия (анальгина), 60 и 76%-ного урографина и других растворов лекарственных средств с аналогичной концентрацией оказывают дегидратирующее действие на клетки (включая форменные элементы крови) и через несколько минут взаимодействия с ними могут погубить их.
Установлено, что из всех растворов для инъекций, имеющих показатель концентрации 10%, самыми гиперосмотическими являются растворы солей натрия и кальция. Так, растворы натрия оксибутирата, натрия тиопентала, натрия гексобарбитала, натрия метамизола, натрия тиосульфата, натрия кофеина-бензоата, натрия сульфацила, натрия гидрокарбоната, натрия цитрата, натрия бензилпенициллина и натрия цефазолина в концентрации 10% имеют осмотическую активность соответственно 1650±10, 1700±11, 1300±9, 800±5, 930±5,840±5, 810±5, 1900±10, 900±5, 570±5, 540±5 (Р≤0,05, n=5) мОсмоль/л воды, а растворы кальция хлорида, кальция глюконата, магния сульфата, глюкозы, маннита, эуфиллина, урографина, пирацетама и лидокаина гидрохлорида в концентрации 10% имеют осмотическую активность соответственно 1300±7, 1200±8 580±5, 600±3, 720±5, 620±5, 540±5, 670±6 (Р≤0,05, n=5) мОсмоль/л воды.
Показано, что подкожные инъекции водных растворов 10%-ного кальция хлорид, 10%-ного кальция глюконата, 10%-ного натрия хлорида или 10%-ного натрия оксибутирата, либо растворов 20%-ного натрия сульфацила, 20%-ного натрия оксибутирата, 20%-ной глюкозы, 20%-ного пирацетама, либо растворов 25%-ного магния сернокислого, 50%-ного натрия метамизола, 60 или 76%-ного урографина приводят к образованию медикаментозных инфильтратов, которые не рассасываются и не уменьшаются в первые минуты после инъекции, а увеличиваются в размерах. При этом в коже на месте инъекции уже через несколько секунд развивается очаг гиперемии, гипертермии, болезненности и отечности, через 5-10 минут кожа над ним становится ярко-красной, после этого еще через 2,5 ± 0,5 минуты кожа в этом участке становится темно-синюшно-багровой, а сам участок кожи приобретает форму круга с четкими границами и узкой ярко-красной каемкой по наружной окружности. На следующие сутки в рамках этого синюшно-багрового участка кожи развивается некроз.
Установлено, что для профилактики некроза в местах инъекций концентрированные лекарственные средства следует разводить перед введением в 10-20 раз водой для инъекций либо раствором 0,25%-ного новокаина. При отсутствии рассасывания инфильтрата его следует немедленно обколоть водой для инъекции или 0,25%-ным раствором новокаина. При этом указанные растворители следует использовать в объемах, достаточных для нормализации осмотической активности введенного гипертонического раствора, а само обкалывание инфильтрата следует осуществить в течение первых 5 минут после его образования, поскольку более позднее обкалывание не предотвращает некроз клетчатки.
Кроме этого, выяснено, что растворы 10%-ного кальция хлорида и 10%-ного кальция глюконата оказывают в местах инъекций денатурирующее действие на кожу и клетчатку не только за счет гиперосмотической активности и дегидратирующего действия, но и за счет специфического необратимого повреждения митохондрий и разобщения в них дыхания и окислительного фосфорилирования, при котором энергия окисления субстратов цикла Кребса выделяется в виде тепла. Доказано, что средствами профилактики кальциевых некрозов клетчатки и кожи являются растворы 5%-ного цитрата натрия и/или ЭДТА, а также растворы иных хелатных (клещевидных) соединений, инактивирующих катионы кальция. Своевременное обкалывание растворами этих антагонистов кальция медикаментозных инфильтратов, образованных инъекциями растворов 10%-ного кальция хлорида или 10%-ного кальция глюконата, полностью защищает ткани от некроза.
Установлено, что чрезмерно выраженная местная физиологическая активность катионов калия также способна вызывать некроз кожи и клетчатки в местах инъекций растворов 4%-ного калия хлорида либо растворов иных солей с катионами К+ в аналогичной концентрации. Дело в том, что гиперкалиевая среда модулирует для клеток гладкомышечных образования сосудистых стенок потенциал действия и вызывает спазм кровеносных сосудов, появление которого вызывает ишемию и инфаркт. Обнаружено, что заблаговременное охлаждение места инъекции путем прикладывания к нему пузыря со льдом эффективно уменьшает сосудосуживающее действие катионов калия и предотвращает некротическое действие раствора 4%-ного калия хлорида. Кроме этого, усилить протекторное действие холода позволяет обкалывание медикаментозного инфильтрата раствором местного анестетика, в частности раствором 1%-ного лидокаина гидрохлорида. Показано, что анестезия сосудистых стенок предотвращает развитие реактивного спазма кровеносных сосудов и, более того, способствует развитию фармакохолодовой гиперемии и анестезии.
В группу слабых местно раздражающих и прижигающих средств, подкожные инъекции которых вызывают формирование легких локальных воспалений обратимого характера, входят водные растворы всех остальных лекарственных средств. Дело в том, что даже вода для инъекции и изотонические растворы 0,9%-ного натрия хлорида вызывают при инъекциях локальное постинъекционное воспаление, которое чаще всего носит кратковременный и обратимый характер. Кроме этого, болезнь кожи, подкожно-жировой клетчатки и других проколотых тканей в месте инъекции любого лекарства вызывает их прокалывание инъекционными иглами, кровоизлияние и кровавое имбибирование.
Показано, что при высокой безопасности введенных лекарств и при соблюдении техники инъекций инъекционная болезнь проявляется локальным асептическим мини-воспалением кожи и подкожно-жировой клетчатки, развивающимся вокруг мест их проколов. При этой легкой форме течения болезни воспаление имеет легкое течение и обратимый характер, поэтому проходит самостоятельно в среднем за неделю и параллельно с этим завершается рубцеванием ранок.
Результаты наших клинических исследований показывают, что при низкой безопасности введенных лекарств и выполненных инъекций инъекционная болезнь развивается бурно, сохраняет локальный характер и протекает в двух вариантах: в виде кровавого либо в виде медикаментозного повреждения тканей.
При кровавом варианте болезнь проявляется массивным и ярким окрашиванием кожи вследствие ее кровавого имбибирования, а при медикаментозном варианте болезнь проявляется локальным воспалением клетчаточных и/или мышечных тканей вследствие их внутритканевого химического ожога. Причем кровавый вариант болезни протекает без некроза и абсцессов, а медикаментозный вариант течет с некрозом тканей, нередко осложняется их инфицированием, нагноением и формированием гнойного абсцесса, появление которого требует госпитализации пациентки в гнойное отделение для хирургического лечения.
В частности, при осмотре кожных покровов пациенток в период их госпитального лечения в гинекологическом отделении и родильном доме установлено, что у всех женщин имеются следы проколов кожи в области ягодиц, передней поверхности бедер либо в различных участках верхних конечностей. Эти повреждения выявляются с первого дня их госпитализации независимо от качества лекарств и технологий инъекционного их введения, а общее количество локальных повреждений увеличивается по мере удлинения срока госпитального лечения.
При этом само медикаментозное воспаление инфильтрированных тканей находится под кожей, носит необратимый и деструктивный характер, развивается очень интенсивно и бурно, как нарыв, поэтому проявляется отечностью, локальной гиперемией, гипертермией и болезненностью. Деструктивное медикаментозно-воспалительное повреждение тканей чаще всего вызывает их некроз, который нередко инфицируется и трансформируется в абсцесс. Указанный вариант течения инъекционной болезни требует локального лечения аналогично лечению банального карбункула или травматического абсцесса. Как правило, необходимо хирургическое лечение. Завершается процесс воспаления рубцеванием.
Профилактика медикаментозной формы инъекционной болезни сводится к предотвращению внутритканевого физико-химического ожога. Исключить ожог позволяет, например, разведение растворов лекарственных средств водой для инъекции или раствором 0,25%-ного новокаина до уровня их изотонической активности.
Причиной инъекционной болезни кожи и подкожно-жировой клетчатки является одно- или многократное колото-инфильтративное специфическое и стандартизированное, но неведомое врачам колото-инфильтративное травмирование кожи, подкожно-жировой клетчатки и других тканей, вызванное, с одной стороны, специфической механической агрессивностью стандартных инъекторов, обусловленное их особыми размерами и формами, а с другой стороны - чрезмерно высокой фармацевтической агрессивностью качественных растворов лекарственных средств, способных оказывать местное раздражающее и прижигающее действие.
Признание официальной медициной описанной нами новой болезни позволит повысить ответственность фармацевтических и медицинских работников за безопасность лекарств и инъекций и уменьшить число воспалительных инфильтратов, абсцессов, флегмон и кровоподтеков.
Рецензенты:

- Виды инъекций
- Роль медсестры в профилактике постинъекционных осложнений
- Несоблюдения правил асептики
- Неправильный выбор места для укола
- Неправильная техника выполнения укола
Виды инъекций
Постинъекционные осложнения (ПИО), как видно из названия, это осложнения возникающие после инъекции (укола). А что такое инъекция? Википедия нам говорит, что инъекция, это способ введения в организм различных растворов (к примеру, лекарственных средств) с помощью шприца и пустотелой иглы. В зависимости от того, куда именно нужно доставить этот самый раствор, существуют несколько видов инъекций:
- подкожная;
- внутримышечная;
- внитуривенная;
- внутрикостная;
- внутрикожная;
- внутриартериальная;
Роль медсестры в профилактике постинъекционных осложнений
Согласно недавно проведенному опросу, большая часть пациентов, особенно старшего поколения, предпочитают инъекции или капельницы, как один из способов введения лекарственных средств в организм. То есть, люди не знают или недооценивают риск возникновения постинъекционных осложнений.
Роль медицинской сестры состоит не только в том, что бы правильно выполнить саму инъекцию, с соблюдением всех правил асептики, но и дать необходимую консультацию по профилактике ПИО. Многие медсестры этим просто пренебрегают. По завершении процедуры, необходимо сделать соответствующую запись в журнале.
Осложнения, которые могут возникать после инъекций (уколов) делятся на 3 группы по фактору их возникновения:
Несоблюдения правил асептики
Асептика — недопущение попадания в открытую рану различных микроорганизмов.
Постинъекционный инфильтрат — возникает, как правило, после подкожных и внутримышечных уколов. Причиной развития может

неправильно поставленный укол может вызвать множество проблем
Также причиной возникновения постинъекционного инфильтрата может стать неправильное определение места для выполнения укола , введение лекарства в места предыдущих уколов или слишком быстрое введение лекарства.
Нарушение стерильности при проведении инъекции является причиной №1 для развития постинъекционного инфильтрата.
Абсцесс – образование внутри мягких тканей воспаленной полости с гнойным содержимым. Причина возникновения постинъекционного абсцесса та же, что и при инфильтратах, только с обязательным присоединением инфекции.

Возникновение и развитие абсцесса
Чаще всего инъекцию делают именно в ягодичные мышцы. Соответственно для уменьшения шанса появления абсцесса следует учитывать ряд факторов:
- Не колите дважды в одну и ту же точку, обязательно меняйте стороны. Каждая инъекция и так является своего рода микротравмой для мышцы. Многократные инъекции в одну точку могут вызвать постинъекционный абсцесс даже при полном соблюдении правил асептики.
- Количество препарата, рекомендованное для одной инъекции, при повторном уколе в ту же точку может привести к некрозу тканей.
- Слабый иммунитет больного и нарушения в кровоснабжении тканей тоже могут привести к абсцессу
Флегмона — острое разлитое гнойное воспаление клетчаточных пространств; в отличие от абсцесса, не имеет чётких границ. Существует несколько типов: подкожная, подфасциальная, межмышечная, забрюшинная, околопочечная (паранефрит), околопрямокишечная (парапроктит), клетчатки средостения, флегмоны стопы, кисти и др.
Причина возникновения — попадание в клетчатку болезнетворных бактерий через поврежденную кожу или из расположенных рядом очагов инфекции (фурункул, кариес зубов, нагноившиеся лимфоузлы и т. д.); иногда заносятся с током крови (гематогенно) из расположенных вдали очагов.
Гепатиты В и С, ВИЧ – самые неприятные и долго не проявляющиеся последствия, которые можно получить во время инъекции с нарушением правил асептики. К счастью, современные возможности использования одноразовых шприцев сводят к минимуму риск заражения через уколы.
Более подробную информацию о видах инфильтратов и способах их лечения можно прочитать в статье «Что такое инфильтрат. Виды и лечение«.
Неправильный выбор места для укола
Повреждение нервных окончаний – чаще возникает при внутримышечных инъекциях, если место укола выбрано выше допустимого, ближе к пояснице. Напомним, что для оптимального внутримышечного укола следует выбирать верхний наружный квадрант ягодицы. Раздражение нервного ствола иглой либо введенным лекарством может привести к сильным люмбалгиям (сильные боли в области поясницы) и ишиалгиям и даже к невритам и параличам.
Повреждение надкостницы – может встретиться, когда для внутримышечного укола в бедро выбирают слишком длинную иглу.
Повреждение сосудов иглой либо лекарством, которое раздражает стенки сосуда.
Неправильная техника выполнения укола
Поломка иглы – возникает из-за нарушения техники внутримышечного укола (выполнение укола стоя и/или без предупреждения), что приводит к резкому спазму ягодичных мышц. Некачественные иглы могут быть как сопутствующим, так и отдельным фактором. Отсутствие опыта выполнения внутримышечных инъекций тоже следует учитывать.
Масляная или воздушная эмболия – в обоих случаях возникает из-за попадания масляного лекарственного раствора или воздуха из шприца в вену. Профилактикой такого грозного осложнения является проверка на предмет попадания иглой в сосуд (слегка оттянуть поршень и убедится, что в шприце нет крови).
Образование тромбов – данное осложнение возникает при длительном использовании одной и той же вены для введения лекарственного средства.
Некроз тканей после укола. По сути, некроз, это процесс отмирания клеток. Согласитесь, очень неприятное явление. Образуется при различных повреждениях клеток организма, при несоблюдении осторожности во время пункции вены и введении раздражающих лекарственных средств помимо вен (подкожно, внутримышечно). Обязательно следует проверять наличие иглы в вене при введении хлористого (10% раствора хлорида кальция).
Гематома происходит из-за сквозного прокалывания вены, благодаря чему кровь поступает в окружающие ткани. Устранить гематому можно теплым компрессом.
Из-за слишком быстрого ввода лекарства может возникнуть головокружение и нарушения в ритме сердца.
Аллергические реакции (крапивница, отек Квинке вплоть до анафилактического шока) возникают в результате невыясненного аллергического анамнеза у пациента. Появляются, как правило, через 30 минут после ведения лекарственного средства, но могут быть и раньше и немедленно после укола. Основными правилами профилактики этого осложнения являются: выяснение аллергоанамнеза перед уколом, особенно перед первым и наблюдение за пациентом в течение первых 30 минут после инъекции, если препарат был введён впервые в жизни.
Кроме этих трех факторов, постинъекционные осложнения классифицируются по срокам их появления:
- немедленные – возникают в первые сутки после укола (аллергическая реакция);
- краткосрочные – срок появления от нескольких дней до недели (инфильтрат);
- отсроченные – могут появиться даже через несколько месяцев (гепатит, ВИЧ).
Как правило, уколы выполняют в мед. учреждениях, и в основном этим занимаются медсестры, соответственно, для профилактики постинъекционных осложнений, медсестра должна соблюдать ряд правил:
- Быть внимательной при подготовке лекарства для укола. Каждый пациент должен получать только то лекарство, которое прописал врач.
- Соблюдать правила асептики и антисептики.
- Соблюдать правила введения лекарств.
- Соблюдать технику выполнения инъекции.
- Легкий массаж области инъекции способствует лучшему рассасыванию лекарства
- Не допускать введения лекарства в одну и ту же точку.
Почти 80% случаев возникновения ПИО приходятся на инъекции, поставленные вне медицинских учреждений и неквалифицированными исполнителями. В частности, уколы на дому.
- Recent Entries
- Archive
- Friends
- Profile
- Memories
Лечение некроза кожи мягких тканей
Проблемы и возможности восстановительного лечения больных с некрозом мягких тканей и костей конечностей
Причиной возникновения некроза тканей является нарушение питания определенного участка тканей вследствие травмы или ее гнилостного воспаления, а чаще совместное влияние того и другого. Происходит это из-за воздействия на клетки механической силы (разрывы, сдавления), а также вследствие развивающейся инфекции и высоких или низких температур.
Некротизироваться могут любые ткани и органы. На быстроту и степень распространения омертвения оказывает влияние продолжающееся механическое воздействие, присоединение инфекции, а также особенности анатомо-физиологического строения поврежденного органа.
Лечебные мероприятия направлены на поддержание общего состояния с использованием активной инфузионной терапии (крови, кровезаменителей, антибиотиков, витаминов и др).
Местное лечение заключается в удалении некроза в пределах здоровых тканей, а объем оперативного вмешательства зависит от вида гангрены, которая бывает сухой и влажной. Сухая протекает благоприятно, и оперативное вмешательство показано при формировании демаркационной линии. При влажной гангрене, когда резко выражены общие проявления, сопровождающиеся тяжелой интоксикацией, проводится немедленная ампутация конечности в пределах здоровых тканей, то есть выше уровня границы некроза.
Известно, что более дифференцированные ткани поражаются гораздо раньше. Поэтому при некрозе мышц и кожи сухожилия и кости оказываются в относительно не пораженном состоянии. При оперативном вмешательстве необходимо учитывать данное явление и не удалять некротизированные участки на всю глубину, а иссекать только пораженные (костную ткань не иссекать независимо от состояния жизнеспособности) с замещением полноценным питающимся кожно-подкожным лоскутом на ножке. Гнойные осложнения ликвидировать путем регионарной инфузии антибиотиков.
При выявлении непораженных костей и сухожилий они закрываются пластическим материалом по одному из существующих методов. В таких случаях удается сохранить сегмент конечности и предотвратить инвалидность пострадавшего. Таких больных было 11.
Все они оперированы по принятой нами методике, которая заключалась в катетеризации магистрального сосуда, удалении некротизированных мягких тканей с замещением мягкотканного дефекта лоскутом на питающей ножке.
У 5-ти из них было повреждение голени, у двух–стопы, у одного–предплечья, а у трех некроз кисти.
У всех больных очень тяжелое повреждение с поражением мягких тканей и кости, у 2-х больных с закрытым переломом голени в результате неправильного лечения (наложена циркулярная гипсовая повязка) наступил некроз голени, потребовавший некрэктомии сегмента.
У одного больного, поступившего через 3-е суток от момента повреждения предплечья, были признаки некроза сегмента на уровне перелома. У другого больного некроз пяточной кости и таранной кости, которые в процессе лечения были удалены.
У трех больных–открытый перелом нижней трети костей голени с острым гнойным осложнением и некрозом большеберцовой кости в пределах 10–15 см.
У одной больной, кисть которой попала под пресс, развился некроз мягких тканей кисти и другие повреждения. Все больные требовали нестандартного подхода в восстановительном лечении.
Поскольку степень повреждения и пораженности рассматриваемых больных очень разнообразна, а систематизация затруднительна, в качестве иллюстрации приведем несколько различных видов поражений.
Примером может быть больная Б. 26 лет.
Во время работы на прессе правая кисть попала под него. Пациентка доставлена в хирургическое отделение районной больницы.
Следовало учесть механизм образования вокруг кисти раны, вызванной от сдавления прессом и возникшей по краю его воздействия. Можно было предположить, что мягкие ткани так поражены, что рассчитывать на их восстановление после воздействия двухтонного пресса нельзя. Образовавшаяся рана на уровне лучезапястного сустава с тыльной поверхности и по верхней борозде с ладонной стороны ушита наглухо, наложена гипсовая шина.
В течение нескольких дней четко обозначались явления некроза поврежденного участка кисти и признаки тяжелой интоксикации.
Поступила в областную больницу из ЦРБ, где была предложена ампутация кисти и формирование культи, в тяжелом состоянии. Правая кисть на тыле от уровня лучезапястного сустава, на ладонной поверхности от верхней ладонной борозды – некротизирована. В обозначенной области кожа черного цвета, местами твердая, все виды чувствительности отсутствуют, из-под струпа и из раны обильное гнойное отделяемое. При рассечении струпа кровотечения нет, а выделяется обильный зловонный гной. Функция кисти полностью нарушена. Рентгенография – костных изменений нет, посев детрита на флору и чувствительность к антибиотикам.
Диагноз: тяжелая травма с размозжением и некрозом части кисти и 2, 3, 4, 5-го пальцев правой кисти.
Оперирована. Катетеризована плечевая артерия через a.Collateralis ulnaris superior и начата инфузия пенициллина 20 млн. ЕД. в составе инфузата.
Сухожилия глубоких сгибателей и разгибателей сшиты над торцом обработанных фаланг.
После иссечения некротических тканей и туалета раны кисти, в области грудной клетки и живота выкроен кожно-подкожно-фасциальный лоскут по размерам дефекта кисти и пальцев, которые помещены в этот лоскут (рис. 2).
Через четыре недели от момента операции питающая ножка пересаженного лоскута отсечена. Кисть после отсечения питающей ножки После заживления ран больная выписана домой.
Инфузия антибиотиков в артерию продолжалась в течение 40 суток с перерывами между оперативными вмешательствами в течение двух недель. Через два месяца от момента заживления ран сформирован второй палец, а по заживлении ран больная выписана и приступила к работе (рис. 4, 5).
Таким образом, предпринятая нами тактика с использованием пластических приемов под прикрытием длительного регионарного введения антибиотиков дала возможность сохранить в определенной степени функцию кисти и, самое главное, предотвратить инвалидность еще молодой женщины.
У всех больных произошло приживление лоскута, у некоторых с явлениями краевого некроза, с последующим заживлением ран самостоятельно, или с добавлением расщепленного кожного лоскута.
Сложной подгруппой больных с тканевыми некрозами были больные с некрозом более глубоко расположенной костной ткани.
Полученный предыдущий опыт лечения больных с мягкотканным некрозом позволил пересмотреть отношение к отчленению некротизированной части конечности, то есть не проводить ее ампутации.
Из практической хирургии и научных исследований известно (М. В. Волков, В. А. Бизер, 1969; С. С. Ткаченко, 1970; М. В. Волков, 1974; Т. П. Виноградова, Г. И. Лаврищева, 1974; И. В. Шумада и др. 1985), что пересаженные консервированные костные аллотрансплантаты, поначалу выполняющие фиксирующую роль, затем превращаются в нормальную кость, а впоследствии осуществляют стабилизирующую и функционально-опорную роль.
Процесс восстановления кости до нормального функционального состояния в зависимости от свойств трансплантата не одинаков. В частности, Т. П. Виноградова, Г. И. Лаврищева (1974) в своей фундаментальной работе четко дифференцировали активность регенерации в зависимости от характеристик трансплантата. Наиболее активным в регенерации и эффективным в лечении больных с костными дефектами является аутотрансплантат, на втором месте замороженный аллотрансплатат, а затем уже лиофилизированный.
Данные представления вынудили нас задуматься о целесообразности использования аутотрансплантата в качестве пластического материала, причем источником его сделать неотторгнувшийся некротизированный фрагмент при тяжелых открытых переломах длинных костей конечностей. Такой способ был использован при лечении 11 больных с тяжелыми повреждениями конечностей с гнойными осложнениями и некрозом мягких тканей и костей.
изобретения. При поступлении больного обследуют. Проводят клинические, лабораторные, бактериологические, функциональные, рентгенологические и другие виды исследования.
Катетеризируют магистральную артерию и налаживают введение антибиотиков в составе инфузата. По ликвидации воспалительных явлений некротические мягкотканные образования иссекают. Обеспечивают фиксацию с помощью авторских фиксаторов (внеочаговых–компрессионно-дистракционно го или стержневого аппаратов) или иммобилизации с помощью гипсовой повязки.
Костные отломки обрабатывают для создания контактности–при поперечном переломе в торцовой части, а при косых переломах–по его форме, но с обеспечением максимального контакта костных фрагментов с фиксацией названными фиксаторами.
Имеющийся мягкотканный дефект замещают лоскутом на питающей ножке, для нижней конечности–с противоположной ноги, а для верхней конечности–с грудобрюшной области.
По приживлении лоскута, через 30 суток от момента замещения дефекта, питающую ножку лоскута отсекают. Гипсовую иммобилизацию или фиксацию компрессионно-дистракционным аппаратом осуществляют до полной консолидации.
Иллюстрацией применения способа может служить больной К. 35 лет.
Поступил через три недели после открытого оскольчатого перелома обеих костей правой голени в средней трети, со смещением отломков.
Лечился в районной больнице. Развился остеомиелит правой голени с некрозом тканей и дефектом их 6x8 см с некрозом концов отломков большеберцовой кости и спицевой остеомиелит пяточной кости в результате проводимого скелетного вытяжения. Явления общей воспалительной реакции.
Рентгенография показала спиральный оскольчатый перелом обеих костей голени со смещением отломков.
Оперирован. Катетеризирована бедренная артерия через возвращающую подвздошную артерию. Введено 10 млн. ЕД. пенициллина. Некрэктомия мягких тканей. Иссечены заостренные нежизнеспособные концы проксимального и дистального отломков около 1 см для создания опороспособной конгруэнтности. На опиле кости с обеих сторон кровоточивости нет, кость белого цвета. Фрагменты взяты на исследование. Концы отломков большеберцовой кости лишены надкостницы около 5 см сверху и снизу, отломки бледно-сероватого цвета.
Костные отломки сопоставлены конец в конец и фиксированы с помощью аппарата Илизарова.
Инфузия антибиотиков в течение недели, а затем пластика мягкотканного дефекта с укрытием обнаженных фрагментов большеберцовой кости кожно-подкожно-фасциально-мышечным лоскутом, выкроенным с противоположной голени.
Пересаженный лоскут прижился, питающая ножка по прошествии 32 суток отсечена. Аппарат Илизарова снят через 2 месяца. Наложена циркулярная гипсовая повязка.
Рентгенография через четыре месяца от момента начала лечения показала, что отломки срослись. Разрешена нагрузка на ногу.
Морфологическое исследование костной ткани, взятой при иссечении отломков.
Морфологическая картина состояния жизнеспособности костной ткани.
Изучено 16 препаратов, взятых у больных с открытым осложненным переломом длинных костей с некрозом мягких тканей и прилежащей кости.
Взяты фрагменты проксимального и дистального отломков сломанной кости. Фиксированы в 12 % растворе нейтрального формалина. После декальцинации в 5 % растворе азотной кислоты и заключения в целлоидин сделаны срезы, которые окрашивались гематоксилином и по Ван-Гизону.
Костная ткань лишена остеоцитов, местами гомогенного строения, линии склеивания не контурируются. Тинкториальные свойства резко нарушены. Зоны базофилии чередуются с участками оксифильной окраски. В некоторых местах видны очаги полного некроза костной ткани (тающая кость). Процесс остеогенеза не выражен. Между участками некротизированной кости в некоторых препаратах видно формирование рубцовой ткани, в которой прослеживаются лимфоидные инфильтраты с наличием плазмоцитов.
В связи с нестандартностью тактического и хирургического решений остановимся подробнее на обсуждении больных данной группы.
Двое больных поступили с явно выраженным некрозом голени, и некрозом предплечья – один. Сомнений в действиях не вызывали, в планах было сохранить коленный сустав при повреждении голени и локтевой сустав при повреждении предплечья, что довольно успешно удалось.
У остальных больных удалось не только сохранить пораженный сегмент, но и восстановить анатомическое и функциональное состояние поврежденной конечности.
У всех оперированных предложенным способом больных наступила консолидация костных отломков и восстановление функции ноги или руки, в зависимости от исходного повреждения конечности. Самое главное, что некротизированная кость не иссекалась. Она сыграла роль аутотрансплантата. Таким образом, в несколько раз сократились сроки лечения больных в сравнении с традиционными способами лечения, даже с признанным самым прогрессивным в наше время способом билокального остеосинтеза, при всех возможностях которого для коррекции длины сегмента конечности требуется не менее двух лет при дефекте кости в 10 см.
При желании шире ознакомиться с травматолого-ортопедическими проблемами и возможностью их решения, можете заказать книги, отражающие наш опыт.
Читайте также:


