Пересадка костного при аутоиммунных заболеваниях
Популярные посты
- Предметы
- Аннотация
- Вступление
- Фон
- Концепция SCT для рекламы
- Обоснование разработки руководства по иммунному мониторингу и биобанкингу у пациентов с БА после СКТ
- Общие рекомендации
- Руководство по клинической практике
- Руководство по основным лабораторным иммунным анализам и хранению биологических образцов
- Рекомендации экспертного центра по расширенному иммунному мониторингу
- Значение иммунологического мониторинга для клинической практики: рекомендации по профилактике инфекций и повторной вакцинации
- Рекомендации по конкретным заболеваниям
- Рассеянный склероз и нейромиелит зрительного нерва
- Системный склероз
- Системная красная волчанка
- болезнь Крона
- Сахарный диабет 1 типа
- Ревматоидный артрит и ювенильный идиопатический артрит
- Выводы
- Дополнительная информация
- Word документы
- Дополнительное приложение
Предметы
- Трансплантация костного мозга
- Медицинское исследование
Аннотация
Вступление
Аутоиммунные заболевания (БА) представляют собой гетерогенную группу заболеваний, поражающих 8–10% населения. Терапевтическая иммуносупрессия и новые биологические методы лечения могут подавлять или ослаблять воспалительный процесс, пока они применяются, но не могут отключить основные механизмы, вызывающие безрецептурную ремиссию, то есть излечение. Несмотря на свою эффективность в большинстве случаев, хроническая иммуносупрессия связана со снижением качества жизни, накопленной токсичностью и повышенным риском сердечно-сосудистых заболеваний и представляет собой значительную социально-экономическую проблему. Для пациентов с поражением основных органов и резистентным к терапии заболеванием иммуносупрессия в высоких дозах с последующей гемопоэтической СКТ использовалась с 1995 года 1 во всем мире, и было показано, что она вызывает длительную ремиссию без лечения при нескольких БА. 2, 3, 4, 5, 6 В последнее время использование MSC показало многообещающие результаты при хроническом GVHD 7 и AD, 8 и общие процедуры для иммунного мониторинга и биобанкинга будут применяться для этих различных типов SCT у пациентов с AD.
Концепция SCT для рекламы
Обоснование разработки руководства по иммунному мониторингу и биобанкингу у пациентов с БА после СКТ
Общие рекомендации
Руководство по клинической практике
У пациентов с БА, рассматриваемых для ПКТ, направление должно быть направлено в центр с соответствующим междисциплинарным взаимодействием между специалистами по гематологии и БА. Такие центры должны иметь аккредитацию JACIE или эквивалентную 18 и должны предоставлять программы для долгосрочного наблюдения, ежеквартально в течение первого года и двухгодичной последующей консультации, после чего, в идеале, с двойным обзором как гематологами, так и специалистами по болезням с оценкой удельные показатели активности. Там, где это возможно, лаборатории должны участвовать во внутренних и внешних схемах обеспечения качества проточной цитометрии, молекулярной генетики и иммунологических маркеров. Следует соблюдать национальные и / или нормативные акты ЕС в отношении биобанкования клеток и тканей.
Руководство по основным лабораторным иммунным анализам и хранению биологических образцов
Все участвующие центры рекомендуют минимальный набор лабораторных анализов для иммунологического мониторинга у пациентов до и в определенные моменты времени после ПКТ (Таблица 1). Они включают в себя полный анализ крови на свежеизолированных РВМС, позволяющий подсчитывать CD4 + и CD8 + T-клетки, CD19 + B-клетки, CD3 - / CD56 + природные клетки-киллеры, CD3 + / CD56 + природные килл-подобные T-клетки и CD14 + моноциты. Кроме того, мониторинг общих уровней Ig и анализ титров аутоантител в сыворотке крови при АБ-опосредованных АД рекомендуется проводить на начальном этапе до мобилизации и ПКТ, ежеквартально в течение первого года и каждые два года после этого. В дополнение к упомянутым базовым лабораторным иммунным анализам рекомендуется хранение биологических образцов для расширенного иммунного мониторинга в более поздние моменты времени. Предоставлен список биологических образцов, рекомендованных для хранения и потенциальных иммунологических исследований (таблица 2). Для содействия согласованной обработке образцов на разных участках были разработаны стандартизированные протоколы сбора, обработки и хранения образцов, которые представлены в дополнительном приложении.
Таблица в натуральную величину
Таблица в натуральную величину
Рекомендации экспертного центра по расширенному иммунному мониторингу
Для центров, имеющих опыт в области проточной цитометрии и адекватных основных средств иммунологического мониторинга, рекомендуется анализировать более широкий набор биомаркеров у пациентов до и после ПКТ. Для иммуноцитометрического анализа были определены восемь панелей, предназначенных для точного цитометрического анализа различных подгрупп клеток в основных клеточных популяциях (таблица 3). Сравнение между центрами может быть возможным при предварительной калибровке всех проточных цитометров с одинаковыми радужными флуоресцентными частицами. Для углубленного изучения Т- и В-клеточного лимфопоэза рекомендуется проанализировать круги иссечения 19 Т-клеточного рецептора и круги, удаляющие к-рекомбинацию, 20, которые можно измерить одновременно с помощью дуплексной ПЦР в реальном времени. 21, 22 Кроме того, предлагается TCR-репертуарный анализ Т-клеток периферической крови с помощью Vbeta-анализа и проточной цитометрии, спектратипирования или высокопроизводительного секвенирования. 23 При условии, что эффективное уничтожение аутореактивной памяти является предпосылкой для благоприятных долгосрочных ответов, предлагается проанализировать частоту аутоантиген-специфических Т-клеток до и после СКТ, где это возможно, например, островковых-Ag-специфических Т-клеток в диабет 1 типа. 24 Здесь окрашивание тетрамера 24, 25 или магнитное предварительное обогащение CD154 + Т-клеток обеспечивает методы для анализа Ag-реактивных Т-клеток с высоким разрешением непосредственно из периферической крови. Кроме того, следует учитывать профили экспрессии генов подмножеств цельной крови или лимфоцитов с использованием технологии микрочипов в определенные моменты времени до и после ПКТ (таблица 2).
Таблица в натуральную величину
Значение иммунологического мониторинга для клинической практики: рекомендации по профилактике инфекций и повторной вакцинации
В существующих руководствах Рабочей группы по аутоиммунным заболеваниям уже рекомендовано, чтобы все пациенты получали Pneumocystis jiroveci , герпес и противогрибковую профилактику и подвергались мониторингу на ЦМВ и ВЭБ (в идеале с помощью ПЦР) на предмет инфекции (первичной или реактивации) в течение не менее 3 месяцев после трансплантации с последующим активным наблюдением до 2 лет после ПКТЗ в соответствии с местной практикой. 18 На этом этапе следует повторить подсчет клеток CD4 +, и, если он все еще ниже 200 клеток / мкл, следует продолжить профилактику или ежеквартальный мониторинг. Если пациент страдает от рецидивирующей или угрожающей жизни инфекции, несмотря на восстановление нейтрофилов, и имеет дефицит подкласса Ig или Ig, следует рассмотреть вопрос о замене внутривенного Ig после взвешивания преимуществ, рисков и затрат. Учитывая предыдущее и часто продолжающееся введение иммуносупрессивных препаратов после ПКТЗ, рекомендуется измерять специфические уровни Ab до и после повторной вакцинации при выполнении в соответствии с опубликованными общими рекомендациями 27, чтобы подтвердить защиту и назначить бустерную вакцинацию у пациентов с неадекватным ответом.
Рекомендации по конкретным заболеваниям
Рассеянный склероз и нейромиелит зрительного нерва
Таблица в натуральную величину
Системный склероз
Системный склероз (SSc) - это редкий AD (распространенность 5–50 на 100 000), характеризующийся ранним повреждением эндотелиальных сосудов с активацией иммунного ответа и усилением синтеза коллагена. Стимуляция Ag и генетическая восприимчивость способствуют аутоиммунитету с последующей активацией T- и B-клеток и активацией фибробластов профиброзными цитокинами, то есть трансформирующим фактором роста-β и фактором роста соединительной ткани. Ранние Т-клеточные инфильтраты в коже и легочной ткани, продукция аутоантител плазматическими клетками, в частности, антицентромера и анти-топоизомераза-I, а также присутствие макрофагов или измененных эндотелиальных клеток способствуют воспалению и фиброзу. Было выявлено несколько генетических ассоциаций между типами HLA и профилями аутоантител, и в ходе скрининговых исследований по всему геному были выявлены специфические полиморфизмы нуклеотидов в соответствующих генах, связанных с SSc. 35 В последнее время использование технологии микроматрицы показало значительные различия в генотипах при биопсии кожи у пациентов с диффузным и ограниченным SSc, которые также отличались от нормальных контролей. 36 В этом контексте несколько лет назад группа по биобанкингу EUSTAR разработала рекомендации по сбору, хранению и распространению биологических образцов SSc (www.eustar.org). В дополнение к документированию минимального необходимого набора данных, в экспертных центрах настоятельно рекомендуется получать и хранить образцы крови и биопсии кожи у пациентов с SSc после ПКТЗ (таблица 4).
Системная красная волчанка
Системная красная волчанка (СКВ) - это редкая хроническая АД (распространенность 20–150 случаев на 100 000) с гетерогенными клиническими проявлениями. 37 Он характеризуется генерацией Abs, направленной против различных аутоантигенов, включая ядерный и цитоплазматический Ags, и активацией комплемента. 37 Аутореактивные плазматические клетки являются ключевыми игроками в индукции и нарушении иммунопатологии при СКВ, а короткоживущие (HLA-DR высокие ) плазменные бласты легко обнаруживаются в периферической крови пациентов с активным заболеванием. 38 Другой отличительной чертой SLE является повышенная регуляция IFN-регулируемых транскриптов генов. 39 IFNα и его ответные белки IP-10 и Siglec-1 являются установленными маркерами для мониторинга активности заболевания при СКВ. 40 Циркуляционные Foxp3 + Tregs расширены в SLE, причем Helios-экспрессирующие Tregs являются наиболее заметным подмножеством Treg, что коррелирует с активностью заболевания. 41 Активность заболевания чаще всего измеряется индексом активности заболевания СКВ, который включает соответствующие клинические и лабораторные значения. 42 На основании этих специфических для болезни особенностей даются рекомендации по иммунному мониторингу при СКВ (Таблица 4).
болезнь Крона
Болезнь Крона - это хроническое воспалительное заболевание кишечника, характеризующееся повторяющимися эпизодами воспаления желудочно-кишечного тракта. Считается, что он возникает из-за нарушения регуляции иммунных реакций слизистой оболочки на кишечную флору у генетически восприимчивых людей. 43 GWAS и мета-анализы выявили 140 локусов чувствительности к болезни Крона у кавказцев, но их наследственность до конца не объяснена. 44 За активностью заболевания следят по показателям на основе симптомов, чаще всего по индексу Харви-Брэдшоу 45 и опроснику по воспалительным заболеваниям кишечника. 46 Недавние исследования выявили измененный фенотип Т-клеток кишечной микробной и периферической крови, в частности, участие Th17-клеток и IL-21 / IL-22-продуцирующих CD4 + Т-клеток в болезни Крона. 47, 48 Кроме того, было показано, что некоторые биомаркеры важны для оценки заболевания, в частности, сывороточные цитокины (IL-22), металлопротеиназа 9 и калпротектин кала. 49 В дополнение к общим рекомендациям по иммунному мониторингу, специфические параметры иммунной системы могут быть важны при болезни Крона (Таблица 4).
Сахарный диабет 1 типа
Сахарный диабет 1 типа является AD, вызванным аутореактивными CD4 + и CD8 + T-клетками против продуцирующих инсулин островковых клеток. 50 Несмотря на то, что в настоящее время стандартным лечением является заместительная инсулиновая терапия, в нескольких клинических испытаниях гемопоэтических ПКТ были продемонстрированы длительные ремиссии без инсулина и без лекарств при впервые возникшем сахарном диабете 1 типа. 4, 51 После ПКТ следует контролировать конечные точки метаболизма, такие как секреция С-пептида, уровень HbA1c и суточная потребность в инсулине. Иммунологические конечные точки могут дать лучшую информацию об эффективности иммунного вмешательства. Хотя корреляция с активностью заболевания не была описана между несколькими островков-специфическими Abs, вовлеченными в сахарный диабет 1 типа (ICA-512 / IA-2, GAD65), 50, 52 их прогностическая и прогностическая ценность в контексте ПКТ еще предстоит определить., Мониторинг ответов Т-клеток после СКТ может быть более актуальным. Здесь методы окрашивания тетрамера позволяют тестировать ответы Т-клеток на HLA-A2-ограниченный инсулин B10, пре-проинсулин, островковый Ag, GAD65 и пре-про-островковый амилоидный полипептид. 24, 25 Мы рекомендуем также рассмотреть возможность публикации инициативы семинара по Т-клеткам Общества иммунологов диабета, касающейся руководящих принципов работы с биологическими образцами в клинических испытаниях сахарного диабета 1 типа. 53, 54
Ревматоидный артрит и ювенильный идиопатический артрит
Ревматоидный артрит (РА), поражающий
Выводы

Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) - метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
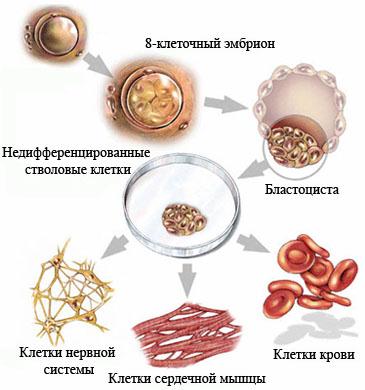
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 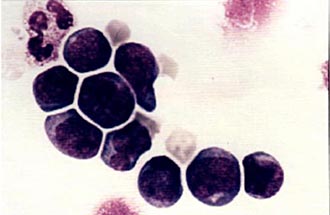 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d"Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Выделяют два основных вида ТКМ:
- 1)аллогенную (АллоТКМ) - при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
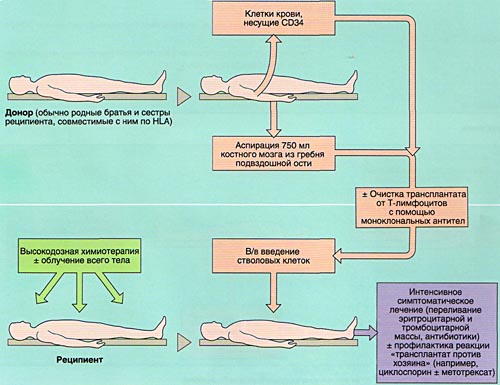
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
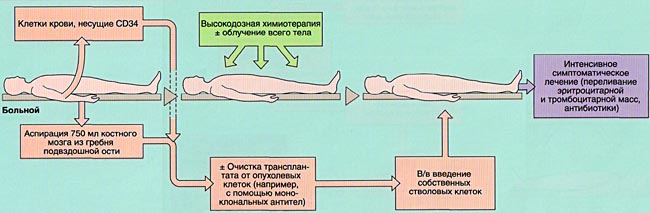
- 2)аутологичную (АутоТКМ) - когда реципиент получает предварительно заготовленный собственный костный мозг;
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Аллогенная трансплантация костного мозга:
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
Аутологичная трансплантация костного мозга:
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
В связи с ограниченным количеством родственных гистосовместимых доноров, которые имеются лишь у 20- 25% больных, в последние годы нашла применение АлТКМ от неродственных HLA-идентичных доноров. Для этих целей созданы международные регистры, позволяющие подобрать потенциального донора костного мозга и оптимизировать прогноз у пациентов, для которых АллоТКМ предпочтительнее (острые лейкозы, хронический миелолейкоз) или является методом выбора (апластическая анемия, гемоглобинопатии, иммунодефициты, нарушения метаболизма). Общее число зарегистрированных доноров в мире превышает 5 миллионов человек, в том числе в России - около 10 тысяч.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
При любой методике ТКМ/ТСКК можно выделить следующие этапы:
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника - моложе 55 лет, неродственная АллоТКМ - моложе 50 лет.
Проведение трансплантации противопоказано при:
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости - также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5x106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ - не менее 2х106/кг (у больных апластической анемией - не менее 3х106/кг), при неродственной АлТКМ - не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего - диметилсульфоксида).
 А) |  Б) |
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования - обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости - порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Профилактика инфекционных осложнений начинается в среднем за 2 недели до трансплантации и включает:
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
- Версия для печати
- Линейный вид
- Комбинированный вид
- Древовидный вид
Трансплантация аутологичных (собственных) стволовых клеток для лечения аутоиммунных
Решил создать новую тему так как многие путают пересадку от донора стволовых клеток и использование собственных стволовых клеток.
При пересадке собственных клеток проблемы с отторжением быть не должно. Ряд тяжелых аутоиммунных заболеваний в Западной Европе и США уже более 10 лет лечат данным методом.
"Сделано более 1000 операций, подробнее см. вот этот набор абстрактов . Результаты просто поражают – в среднем 50% полностью выздоравливают (ремиссия в течении 5 лет наблюдений), еще 25-35% имеют существенное улучшение состояния, а 15-25% не помогает. И это для таких тяжелых заболеваний, как системная красная волчанка и рассеянный склероз, которые считаются в принципе неизлечимыми, смертельно опасными! При этом смертность от процедуры за последние годы снизилась до 1-2%, причем в основном смертельные случаи связаны с тяжелым состоянием больных перед операцией, а не с самой процедурой."
"Аутологическая трансплантация кроветворных стволовых клеток является довольно токсичной процедурой, связанной с риском смерти в 2-3%. Поэтому это лечение не для общей популяции пациентов с рассеяным склерозом, а только для особых случаев, которые не отвечают на стандартную терапию и быстро ухудшаются, то есть для ситуаций когда ожидаемые выгоды уравновешивают риски смерти и инвалидности"
"ASCT is a rather toxic procedure associated with a mortality risk of 2-3%. Therefore, it is not a treatment for the general population of MS patients but only for selected cases that do not respond to standard therapies and worsen rapidly, i.e. in situations where benefits are expected to counterbalance morbidity and mortality risks."
Последний раз редактировалось Igor_Passau; 08.04.2010 в 13:17 .
Последний раз редактировалось Igor_Passau; 08.04.2010 в 13:30 .
The main diseases were multiple sclerosis (n=345), systemic sclerosis (n=175), systemic lupus erythematosus (n=85), rheumatoid arthritis (n=89), juvenile arthritis (n=65), and hematologic immune cytopenia (n=37).
CONCLUSIONS: This largest cohort studied worldwide shows that autologous hematopoietic stem cell transplantation can induce sustained remissions for more than 5 years in patients with severe autoimmune diseases refractory to conventional therapy. The type of autoimmune disease, rather than transplant technique, was the most relevant determinant of outcome. Results improved with time and were associated with the transplant centers' experience. These data support ongoing and planned phase III trials to evaluate the place of autologous hematopoietic stem cell transplantation in the treatment strategy for severe autoimmune diseases.
Я написал Сергею письмо (luk@ibch.ru) по поводу данного лечения. Основные выводы такие:
Igor_Passau > Меня интересует насколько метод аутологичных (собственных) стволовых опробован и безопасен.
Igor_Passau >Насколько данная клиника А.А. Максимова имеет опыт с лечением Болезни >Крона.
"Точно опыт был, один успешный случай мне врач подробно описал, они спасли мальчика, которому уже никакие лекарства не помогали, а после 5 операций хирурги отказались от дальнейшего лечения. Но опыт очевидно небольшой, специализируются они на рассеянном склерозе, а Крон и Бехтерев попадают к ним случайно, обычно очень тяжелые."
Igor_Passau >Интересна как положительная так и отрицательная сторона статистки >лечения.
Igor_Passau >Можно ли ее применять когда болезнь контролируема системными >стероидами?
"Это вопрос к доктору, я не знаю. "
Последний раз редактировалось Igor_Passau; 09.04.2010 в 19:23 .
Клеточная терапия с использованием стволовых клеток – революционная методика для лечения многих серьезных заболеваний. Замена необходимых клеток новыми клетками того же пациента в настоящий момент уже реальность… Одним из лидером в мире в данном направлении по борьбе с БК - клиника в Барселоны (Hospital Clínic, Barcelona)….Клиника трансплантирует собственные стволовые клетки пациентов, которые были извлечены из костного мозга самого же пациента. Утверждается, что данная методика излечивает ВЗК в случае если стандартная терапия не успешна и необходимо проводить оперативное вмешательство, которое тоже не излечивает болезнь.
Клиника Барселона одна из немногих больниц в мире, которая смогла применить данную методику для лечения БК как и клиники в США (где 12 пациенто с БК в получили данную терапию и 11 имеют отличные результаты лечения) и Италии (4 пациента, где 3 получили отличные результат лечения). Данная методика показала, что 80% пациентов получили полную ремиссию на протяжении 6 лет а остальные 20% улучшили свое состояния и стали положительно реагировать на стандартную терапию. В настоящее время в Барселоне 6 пациентов получили значительные преимущества от данной терапии, где 3 пациента закончили успешно лечение, а остальные 3 пациента на разных стадиях терапии.
Успех аутогенной методики трансплантации в лечении БК был возможен только благодаря совместной работе гастроэнтерологов, гематологов и гемостазного отделения и использования опыта трансплантации при заболевании лейкемии и миеломы.
Процесс трансплантации:
В случае если стандартные препараты не помогают или необходима операция, пациент переносит процесс трансплантации аутогенных стволовых клеток, которые извлекаются из клеток костного мозга. Процесс составляет около 2 месяцев и состоит из 6 фаз:
1. Инициация Химиотерапии. На данном этапе идет понижение количества лейкоцитов (иммунных клеток) в крови пациента.
2. Миграция Стволовых клеток в кровь. После подавления иммунитета в фазе 1, организм реагирует методом освобождения стволовых клеток из костного мозга в кровь это и есть клетки, которые будут позже использованы как трансплантируемые.
3. Сбор стволовых клеток по методике Apheresis. Данная методика позволяет отделять компоненты крови.
4. Хранение клеток при криогенной температуре. Когда стволовые клетки отобраны по методике Apheresis, то они замораживаются и хранятся для дальнейшего введения.
5. Повторная Химиотерапия. На данной фазе идет пониженное содержание лейкоцитов в крови. Иммунная система лишена полностью лейкоцитов и готова к трансплантации.
6. Трансплантация аутогенных клеток. Методом переливая крови пациент получает новые свои же клетки для иммунной системы. Иммунная система перезагружена и наступает ремиссия или значительное понижение активности ВЗК.
Читайте также:


