Остеопороз и его биохимическая диагностика
Остеопороз — повышенная ломкость костей из-за нарушения обмена кальция. Нередко заболевание развивается у женщин после менопаузы. Своевременная диагностика остеопороза позволяет предотвратить частые переломы и деформации конечностей, утрату способности двигаться. Обнаружение патологии на ранних этапах гарантирует результативность лечения.

Показания к осмотру
Для предупреждения патологии каждому взрослому старше 40 лет следует сдавать анализ на остеопороз раз в год.
При частых переломах, возникновении ощущения тяжести между лопатками, общей слабости в мышцах и нарушениях нервной проводимости в конечностях, уменьшении роста и выраженном искривлении позвоночника следует провериться на остеопороз. Нередко недуг может сопровождаться патологией зубов, формированием грыж позвоночника или колена, судорогами, поседением и проблемами с ногтями. К нечастым, но грозным симптомам остеопороза относят манифестацию сахарного диабета.
Методы диагностики остеопороза
С целью определения диагноза назначаются различные способы обследования. Общие лабораторные исследования мочи, крови и кала призваны определить или исключить патологии воспалительного характера или обнаружить дефекты обмена веществ, к которым относят и остеопороз. Диагностика включает определение биохимических показателей, изучение прочности и степени минерализации кости, а также обнаружение возможных патологических переломов.
Анализ крови на определение электролитов и гормонов позволит узнать дальнейшую тактику обследования, лечения и прогноза. Изучение гормонального спектра включает исследование концентрации биоактивных веществ щитовидной железы — трийодтиронина (Т3), тироксина (Т4) и уровня йода, секрета паращитовидных желез — паратгомона и кальцитонина. А также на кальциевый обмен влияет биохимия соматотропина (гормона роста), инсулина и глюкокортикоидов, эстрогена и витамина Д3.
- При лабораторном исследовании плазмы общие показатели не будут изменены. Возможно повышение СОЭ.
- Остеокальцин. Является маркером роста костей. Повышение встречается при остеодистрофии почек и остеопорозе после менопаузы, на ранней фазе гипертиреоза и гиперпаратиреоза. Снижение нормы бывает при беременности, нарушении функции паращитовидных желез, формировании метастазов опухолей в костях и приеме ГКС. У детей концентрация высокая в период быстрого роста. Показатели нормы колеблются, и зависят от типа исследования. Нормальное содержание — 0,5—1500 нг/мл.
- В-Cross Laps. Концентрация в плазме указывает на степень деструкции коллагена первого типа. Высокое содержание встречается при менопаузе, ревматоидном артрите, гиперпаратиреозе, обменной остеопатии.
- Щелочная фосфатаза. Повышенная концентрация позволяет заподозрить развитие патологии костей.
- Витамин D. Регулирует фосфорно-кальциевый обмен.
Чтобы диагностировать остеопороз по биохимическому профилю, в таблице представлены нормативные значения электролитов согласно возрасту в ммоль/л:
В урине изучают концентрацию одного из главных маркеров деструкции и резорбции костной ткани, который называется дезоксипиридонолин (ДПИД). Наличие этого вещества в моче встречается при развитии остеопороза в период менопаузы и остеомаляции, на любых стадиях тиреотоксикоза, при первичном гиперпаратиреозе, остеоартритах, костных метастазах, болезни Педжета. Взрослому организму присуща концентрация:
- мужчины — 2,5—5,5 нг/мл;
- женщины — 3,0—7,5.
Для докторов важно, чтобы результаты диагностики предоставляли наиболее полную информацию о состоянии костной системы, на основании которой возможно помочь пациентам максимально. За последние несколько лет современные методы диагностики с высокой точностью определяют костную массу и степень минерализации. Проверить состояние костей позволяют рентгеновские исследования, применение ультразвука и некоторые инвазивные методики.
Изучение обзорных рентгенограмм костей позволяет диагностировать остеопороз при снижении концентрации кальция в тканях на 30—40%, когда изменения кости необратимы.
Денситометрия, которая также относится к рентген/УЗИ-диагностике, позволяет при минимальном облучении изучить плотность кости и обнаружить снижение минерализации уже при 3—4% потере кальция. Перед проведением процедуры за сутки требуется отказ от приема препаратов Са. Диагностика совершенно безболезненна. Раннее выявление позволяет, скорректировав диету пациента и назначив лечение добавками кальция и витаминов, предотвратить развитие патологических переломов и обратить недуг вспять.
Компьютерная и магнитно-резонансная диагностика остеопороза представляет собой разновидность лучевой рентгенографии. Методы позволяют с высокой точностью получить срезы костей и изучить состояние окружающих мягких тканей: нервов, сосудов и органов. Для повышения информативности МРТ проводится процедура с контрастированием, внефазное изучение, спектроскопия и другие. Однако КТ и МРТ считаются дополнительными методами по отношению к денситометрии.
Дополнительная диагностика остеопороза включает такие методы:
- Генетическое обследование на выявление факторов риска остеопороза. Включает изучение полиморфизма генов альфа-1 цепи коллагена 1 типа и рецепторов кальцитонина, а также VDR рецептора витамина D.
- Радиоизотопная сцинтиграфия — метод изучения структуры кости. Процедура сцинтиграфии требует введения радиоактивного вещества. Отличается высокой точностью и специфичностью. Обнаруживает аномалии костной ткани на ранних стадиях.
- Трепанобиопсия. Диагностика заключается в обследовании кусочка кости и костного мозга.
Краткие выводы
Не разработаны единые подходы к лечению остеопороза. Занятия ЛФК, сбалансированная диета с необходимым содержанием нутриентов и регулярные профилактические осмотры позволяют предотвратить недуг, и не допустить развития переломов костей, позвонков и деформаций позвоночника. Лабораторная и инструментальная диагностика заболеваний скелета, остеопороза в том числе, требует специальных знаний и комплексного подхода.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гормональные факторы патогенеза остеопороза
Витамин D и его активные метаболиты являются компонентами гормональной системы, регулирующей фосфорно-кальциевый обмен, и участвуют, с одной стороны, в минерализации костной ткани, с другой - в поддержании гомеостаза кальция. Биологическое действие активных метаболитов витамина D заключается, главным образом, в стимуляции кишечной абсорбции кальция и фосфора, активации обмена и усилении экскреции кальция с мочой.
Показатель, отражающий статус витамина D в организме. 25(OH)D - основной метаболит витамина D, присутствующий в крови. Он образуется преимущественно в печени, при первой ступени гидроксилирования витамина D, обладает умеренной биологической активностью. 25(OH)D в крови пере.
Гормон роста, стимулирующий рост костей, мышц и органов. Пептидный гормон. Вырабатывается соматотрофами передней доли гипофиза под контролем соматостатина и соматолиберина. Основные эффекты: стимуляция линейного роста, поддержание целостности тканей и уровня глюкозы к.
Основной регулятор обмена углеводов. Инсулин – полипептидный гормон, продуцирующийся бета-клетками поджелудочной железы, главный регулятор углеводного обмена. В норме его секреция стимулируется увеличением уровня глюкозы в крови. Повышение концентрации инсулина вызывает усиленное поглощени.
Первоначальный, но временный эффект ПГЕ2 ингибирование активности остеокластов. Среди системных гормонов стимулирующее действие на ПГЕ2 оказывает ПТГ, а ГК являются ингибиторами скелетного ПГЕ2.
Методы измерения костной ткани
Для клиницистов важно, чтобы измерения предоставляли информацию, с помощью которой можно помочь пациентам (например, сократить количество переломов). За последние несколько десятилетий было разработано много методов, позволяющих с высокой степенью точности измерять костную массу количественно в различных участках скелета (фотонная или рентгеновская денситометрия, компьютерная томография, абсорциометрия).
Полезную информацию об обмене костной ткани позволяют получить некоторые инвазивные методы. Гистоморфологический анализ гребня подвздошной кости, даёт возможность получить сведения о скорости образования костной ткани на клеточном и тканевом уровне, однако информации о величине костной резорбции недостаточно. Кроме того, исследование обмена костной ткани ограничивается небольшой областью губчатого вещества и внутренней поверхностью кортикального слоя, что не всегда отражает происходящее в других отделах скелета.
- Диагностика остеопороза возможна только при частичной потере костной массы.
- Не позволяет прогнозировать уровень потери костной массы.
- Оценка изменения плотности костной ткани возможна только через 1,5 - 2 года после назначения терапии.
- Отсутствие возможности быстрой коррекции терапии остеопороза.
Биохимические маркёры ремоделирования кости
Наиболее важный неколлагеновый белок матрикса кости. Остеокальцин (Оsteocalcin, GLA protein) — основной неколлагеновый белок кости, включённый в связывание кальция и гидроксиапатитов. Синтезируется остеобластами и одонтобластами, состоит из 49 аминокислот. Молекулярный вес приблизительно 5.
Биохимические маркёры костной резорбции
Определение натощак кальция в утренней порции мочи (соотнесенного с экскрецией креатинина), является самым дешёвым методом оценки резорбции кости. Этот метод полезен для определения значительно усиленной резорбции, малочувствителен.
Деоксипиридонолин (ДПИД) является перекрёстной пиридиновой связью, присущей зрелому коллагену и не подвергающейся дальнейшим метаболическим превращениям. Он выводится с мочой в свободной форме (около 40%) и в связанном с пептидами виде (60%). Определение Дпид в моче имеет ряд преимуществ.
Основной материал поперечных связей коллагена в костях. Костный коллаген характеризуется наличием поперечных связей между отдельными молекулами коллагена, которые играют большую роль в его стабилизации и представлены в виде деоксипиридинолина (лизилпиридинолина, ДПИД) и пиридинолина (ок.
- высокая специфичность для обмена костной ткани;
- отсутствие метаболических превращений до выведения с мочой;
- возможность проводить исследования без предварительных диетических ограничений.
Значение биохимических маркёров для диагностики и мониторирования терапии остеопороза
Проведённые наблюдения за терапией основными видами групп препаратов, позволили сделать следующие выводы:
- повышение уровня щёлочной фосфатазы и остеокальцина в сыворотке крови часто отмечается при лечении пациентов с остеопорозом фторидами. Определение этих маркёров рекомендовано для контроля за стимулирующим воздействием фторидов на костеобразование;
- антирезорбционные препараты, такие как эстрогены и бифосфонаты, приводят при остеопорозе, который развился после менопаузы, к значительному снижению концентрации маркёров резорбции и синтеза костной ткани, вплоть до пременопазуального уровня.
Определение уровня биохимических маркёров резорбции и ремоделирования кости позволяет:
- при профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования и резорбции костной ткани;
- оценить и прогнозировать уровень потери костной массы;
- дать оценку эффективности назначенной терапии уже через 2 - 3 месяца;
- выбрать наиболее эффективный препарат и определить оптимальный уровень его дозировки индивидуально для каждого пациента;
- быстро оценить эффективность проводимой терапии и существенно сократить материальные и временные затраты пациента на лечение.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболи
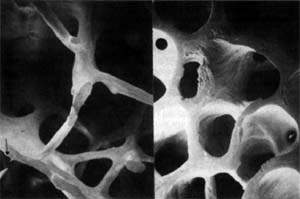 |
| Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. |
Остеопороз — это системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, ведущими к повышенной хрупкости костей с последующим увеличением риска их переломов (рис. 1). Помимо наиболее распространенного постменопаузального остеопороза, в настоящее время в цивилизованных странах в связи с растущей продолжительностью жизни все чаще встречается сенильный остеопороз, а также вторичный остеопороз, обусловленный различными заболеваниями (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта и пр.) или связанный с длительным приемом некоторых лекарственных препаратов, например кортикостероидов.
- Диагностика
В настоящее время для диагностики остеопороза используются преимущественно неинвазивные методы, которые легковыполнимы, безопасны и могут повторяться неоднократно у одного и того же больного. К таким методам относятся рентгенографическое исследование, костная денситометрия и исследование биохимических маркеров костного метаболизма. Каждый из этих методов занимает свою нишу в диагностике заболе-вания.
- моноэнергетическая рентгеновская абсорбциометрия (SXA);
- биоэнергетическая рентгеновская абсорбциометрия (DXA), включая периферическую DXA (pDXA);
- радиографическая абсорбциометрия (RA);
- количественная компьютерная томография (QCT), включая периферическую QCT (pQCT).
В данном перечне отсутствует фотонная денситометрия — предшественница рентгеновской денситометрии, в последнее время используемая весьма редко.
 |
| Рисунок 2 |
Радиографическая абсорбциометрия используется редко, поскольку требует специально оборудованного центра, где при помощи микроденситометра производится сканирование рентгеновских снимков фаланг и определяется их оптическая плотность.
 |
| Рисунок 3 |
Для определения МПК позвоночника можно использовать и QCT, которая является единственным методом, представляющим результаты исследования в трехмерном измерении. Возможность проведения измерений в поперечном сечении, заложенная в QCT, позволяет выделить этот метод среди других, так как он дает возможность дифференцированно оценивать МПК в трабекулярной и кортикальной костной ткани, фиксируя истинные значения МПК в г/см3 [1]. В отличие от DXA при QCT нет искажений МПК, связанных с тучностью пациента, а также вызванных сопутствующей патологией, например спондилоартритом и остеофитами, обызвествлением стенки аорты или участками остеосклероза, развивающимися в результате дегенеративных заболеваний или переломов позвонков. Но большие дозы облучения при QCT, а также высокая стоимость обследования ограничивают широкое применение этой технологии в диагностике остеопороза, использование ее оправданно лишь в ситуациях, требующих дифференциальной диагностики (рис. 4).
 |
| Рисунок 4 |
В последние годы активно развивается ультразвуковая сонография, которая, в отличие от рентгеновской денситометрии, позволяет обследовать другие характеристики костной ткани: SOS — скорость распространения ультразвука в кости и BUA — широковолновое рассеивание (затухание) ультразвуковой волны в исследуемом участке скелета. Эти параметры, по данным многих исследователей, отражают степень эластичности и прочности костной ткани и достаточно высоко коррелируют с МПК позвоночника и шейки бедра [2]. В настоящее время многие специалисты высказывают мнение о том, что с помощью ультразвуковой денситометрии можно предсказывать риск переломов, тем самым обосновывая ее значение как метода для скрининга. Вопрос о возможности применения этих приборов в диагностике остеопороза и оценке эффективности терапии продолжает дискутироваться.
Рентгенография довольно активно используется для диагностики остеопороза и его осложнений. Однако ее нельзя отнести к методам ранней диагностики, поскольку рентгенологические признаки остеопороза появляются тогда, когда 20 — 30% костной массы уже потеряно [3]. Наиболее сложно оценить выраженность остеопороза в позвоночнике, поскольку ни один из его рентгенологических признаков не является специфичным. Часто рентгенография позволяет выявить остеопороз лишь на поздней стадии, когда уже имеются остеопоретические переломы. Для объективной оценки степени снижения минерализации костей разработаны так называемые полуколичественные методы. В основе их лежит вычисление вертебральных, феморальных и метакарпальных индексов. Но они также не могут претендовать на достаточную точность и чувствительность при выявлении ранней стадии заболевания (остеопении), хотя успешно применяются при эпидемиологических исследованиях распространенности остеопороза в популяции [4, 5]. Таким образом, основной функцией ренгенографического метода в диагностике остеопороза является обнаружение переломов, динамическое наблюдение за появлением новых переломов и дифференциальная диагностика остеопоретических переломов от других типов деформаций позвоночника.
Представленные в таблице костные маркеры являются предикторами потери костной массы, переломов костей скелета и используются для мониторинга антиостеопоретической терапии. По этим биохимическим показателям можно судить об эффективности терапии, об адекватности дозы препарата и о его переносимости. Особенно полезны костные маркеры для оценки эффективности терапии в сравнительно короткие промежутки времени, когда денситометрическое исследование еще не информативно (полагают, что повторные денситометрические исследования надо выполнять не чаще одного раза в год). Уровень маркеров костного метаболизма изучался в основном у женщин постменопаузального периода. Оказалось, что уровень почти всех маркеров, за исключением IPCP, повышен и коррелирует со снижением МПК [6]. Полагают, что сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального остеопороза. По мнению P. Delmas (1996) увеличение скорости костной резорбции (по оценке уровней биохимических маркеров) существенно повышает риск развития переломов независимо от исходной костной массы пациентов [7]. Это связано с тем, что хрупкость кости при остеопорозе зависит не только от МПК, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции. Это предположение подтверждается данными P. Garnero et al. (1996), полученными в рамках исследования EPIDOS [6]. Доказано, что увеличение уровня СТх или свободного диоксипиридинолина на 1SD от нормы ассоциировалось с 1,3- и 1,4-кратным увеличением риска переломов шейки бедра (рис. 5).
 |
| Рисунок 5. Комбинированная оценка МПК и скрытой костной резорбции для определения риска перелома шейки бедра у пожилых. МПК определялась по критериям ВОЗ с учетом показателей ниже 2,5 SD от нормальных показателей МПК у молодых здоровых женщин (Ts core |
- Профилактика
- Лечение
Проблема лечения остеопороза за рубежом изучается давно, причем особенно активно в последнее десятилетие, что связано с введением денситометрии. Однако до настоящего времени не разработаны общепринятые терапевтические программы и режимы лечения этого заболевания, что, по-видимому объясняется его многофакторной природой и сложным патогенезом. Основная цель лечебных мероприятий — сбалансирование процессов костного метаболизма и сохранение или улучшение качества жизни пациента. Для этого необходимо добиться замедления или прекращения потери костной массы; уменьшить болевой синдром в позвоночнике и периферических костях; улучшить функциональное состояние больного и предотвратить возможные падения; восстановить трудоспособность и психоэмоциональное состояние. Наряду с этиопатогенетической терапией препаратами, направленными на нормализацию процессов ремоделирования костной ткани и на сохранение минерального гомеостаза, применяется и симптоматическая терапия, включающая в себя диету с повышенным содержанием солей кальция и фосфора, нестероидные противовоспалительные средства, анальгетики, миорелаксанты, которые позволяют уменьшить болевой синдром, мышечное напряжение и тем самым расширить двигательную активность пациента и ускорить начало реабилитационных мероприятий.
Реабилитация подразумевает лечебную физкультуру, ношение корсетов, плавание, курсы легкого массажа.
Все препараты для лечения остеопороза можно разделить на три группы:
1. Препараты, подавляющие резорбцию костной ткани
- эстрогены;
- бисфосфонаты;
- кальцитонины;
- тиазидные диуретики;
- производные фтора;
- анаболические стероиды;
- фрагменты паратиреоидного гормона;
- гормон роста.
- активные метаболиты витамина D;
- иприфлавон (остеохин);
- оссеин-гидроксиаппатитный комплекс (остеогенон).
В этиопатогенетической терапии остеопороза предпочтение отдается группе препаратов, подавляющих резорбцию костной ткани, вследствие их более высокой эффективности и сравнительно небольшого побочного действия.
В целом терапия остеопороза должна быть комплексной и проводить ее следует длительно в виде непрерывного или курсового лечения. Поскольку в настоящее время нет идеального препарата для лечения остеопороза, перспективна комбинированная терапия, в которой сочетаются препараты с различным механизмом действия, что позволяет потенцировать их антиостеопоретическое действие, снизить частоту и выраженность побочных эффектов.
| Профилактика остеопороза заключается в сбалансированном питании, физической активности, и адекватном поступлении в организм витамина D |
При комбинированной терапии лекарственные средства назначают одновременно или последовательно. Их выбор осуществляется индивидуально для каждого больного в зависимости от формы остеопороза, скорости костного обмена, тяжести клинического течения, сопутствующих заболеваний. Основным критерием эффективности любого антиостеопоретического средства является снижение частоты переломов, однако в каждом конкретном случае надо ориентироваться в первую очередь на показатели МПК по данным костной денситометрии и на биохимические маркеры костного обмена. Увеличение МПК более чем на 1% и нормализация биохимических показателей, если они были изменены, свидетельствуют об эффективности проводимой терапии. Учитываться должна и положительная динамика клинической картины: уменьшение болевого синдрома, повышение функциональной активности.
Таким образом, в настоящее время имеется довольно большой выбор диагностических методов, позволяющих установить диагноз остеопороза на разных стадиях, а также эффективных лекарственных препаратов, влияющих на различные звенья патогенеза остеопороза, способных уменьшить или купировать клинически выраженные симптомы заболевания, а также предупредить развитие переломов.
Остеопороз (ОП) – самое частое метаболическое заболевание скелета, характеризующееся прогрессирующим снижением костной массы в единице объема кости по отношению к нормальному показателю у лиц соответствующего пола и возраста, нарушением микроархитектоники костной ткани, приводящими к повышенной хрупкости костей и увеличению риска их переломов от минимальной травмы и даже без таковой.
В костной ткани постоянно идет процесс ремоделирования, т.е. резорбция (рассасывание) костной ткани и замещение ее новой тканью (костеобразование). В процессе ремоделирования различают следующие фазы: активация → резорбция → фаза “обращения” → новообразование кости. В основе ОП лежит нарушение “равновесия”, отмечается повышенная резорбция и снижение костеобразования [1].
Лабораторная диагностика ОП
Цель лабораторной диагностики – исключение заболеваний, проявлением которых может быть остеопения (остеомаляция, болезнь Педжета, костные метастазы, миеломная болезнь и др.), установление причин вторичного ОП, а также - метаболическая характеристика ОП. Последняя важна не только для постановки диагноза, но и для выбора метода адекватной терапии и оценки ее эффективности.
Все методы исследования можно разделить на три большие группы:
1) Оценка кальций-фосфорного обмена и кальций регулирующих гормонов;
2) Оценка биохимических маркеров костного метаболизма;
3) Дополнительные методы гормонального и биохимического анализа, направленные на выявление причины вторичного ОП.
Оценка состояния минерального обмена и кальций регулирующих гормонов
Кальций При первичном ОП уровень кальция в крови, как правило, в пределах нормы, хотя имеются отдельные сообщения о тенденции к его повышению при постменопаузальном ОП с высоким показателем костного обмена. Гиперкальциемия возможна у больных сенильным ОП при длительной иммобилизации после перелома шейки бедра. При первичном ОП гиперкальциурия характерна для тех его вариантов, которые характеризуются повышенным костным обменом.
Фосфор. При первичном ОП уровень фосфора в крови в большинстве случаев нормальный. Тенденция к его снижению отмечена у пожилых людей при сочетании ОП с остеомаляцией (остеопоромаляция). Для оценки почечной реабсорбции фосфора определяют его концентрацию в утренней моче.
Паратгормон (ПТГ) оказывает свое регулирующее влияние на ремоделирование костной ткани, имея точками приложения своего действия кость, почки, желудочно-кишечный тракт (в присутствии витамина D3паратгормон усиливает всасывание кальция). Главным показанием к исследованию ПТГ является наличие гиперкальциемии или пониженное содержание фосфора в крови. При постменопаузальном ОП уровень ПТГ чаще нормальный или пониженный, а при сенильном и стероидном ОП, наоборот, - немного повышен.
Кальцитонин (КТ) – продуцируется парафолликулярными клетками щитовидной железы и оказывает следующее влияние на костную ткань и метаболизм кальция и фосфора:
- ингибирует деятельность остеокластов и тем самым – резорбцию костной ткани;
- стимулирует деятельность остеобластов, синтез костного матрикса и отложение кальция в костях;
- снижает содержание кальция в крови, стимулируя поступление его в кости;
- стимулирует поглощение костями фосфора и снижает содержание фосфатов в крови;
- увеличивает экскрецию с мочой кальция, фосфора, натрия, магния, калия, воды;
- стимулирует превращение в почках неактивной формы витамина D3 в биологически активную _ 1,25 (ОН)2D3(кальцитриол) совместно с ПТГ.
Дигидроксивитамин D 3 (активная форма витамина D3, гормон кальцитриол) образуется в организме после ряда превращений экзогенного витамина D, либо поступающего с пищей витамина D2 (эргокальциферол), либо витамина D3 (холекальциферол), который синтезируется в коже под влиянием УФ лучей из провитамина D. Кальцитриол усиливает всасывание в кишечнике кальция и увеличивает реабсорбцию фосфатов в почечных канальцах, участвует в процессе дифференцировки остеокластов.
Оценка биохимических маркеров метаболизма костной ткани
Скорость формирования и резорбции костного матрикса может быть оценена несколькими путями: измерением ферментной активности остеобластов или остеокластов, а также определением компонентов клеточного матрикса, которые высвобождаются в процессе формирования или резорбции костной ткани.
Маркеры костного формирования
В настоящее время ни один из определяемых маркеров не отвечает всем требованиям, но многие из них хорошо отражают функцию остеобластов.
Щелочная фосфотаза (ЩФ) В клинической практике до сих пор используют определение общей ЩФ в крови как маркера костного обмена. При первичном ОП активность общей ЩФ, как правило, находится в пределах нормальных значений, а активность ее костного изофермента (который является наиболее адекватным из существующих в настоящее время маркеров формирования костной ткани) часто повышена у лиц с высоким костным обменом. Повышение активности ЩФ у больных ОП может быть проявлением свежих переломов костей или присоединением остеомаляции. Значительное повышение активности ЩФ наблюдается при первичном и вторичном гиперпаратиреозе, остеомаляции, связанной с дефицитом витамина D.
Остеокальцин (ОКЦ) – белок, составляющий большую часть неколлагенового белкового матрикса кости. Он является наиболее специфическим маркером остеобластической активности. При первичном ОП выявляется как нормальный, так и слегка повышенный уровень ОКЦ. Повышенное его содержание при первичном ОП обнаруживают у лиц с высоким уровнем костного обмена [2,5]. Повышенный уровень декарбоксилированного ОКЦ может свидетельствовать об увеличении риска возникновения переломов бедра при сенильном ОП [2,6].
Проведение сравнения значений сывороточного ОКЦ с показателями костного обмена выявили, что ОКЦ является хорошим маркером костного обмена, когда костеобразование и костная резорбция изменяются однонаправленно, и специфическим маркером костеобразования, когда имеется рассогласование процессов резорбции и формирования костной ткани.
Повышение концентрации сывороточного ОКЦ у женщин в поздней менопаузе коррелирует со снижением МПКТ в поясничном отделе позвоночника.
Пропептид проколлагена I типа (PICP) Коллаген составляет более 90% органического костного матрикса, при этом на коллаген I типа приходится 97 процентов. При первичном ОП содержание PICP в крови не меняется. У пациентов с ОП обнаружено наличие умеренной корреляции между PICP и гистоморфометрическими показателями костеобразования.
Маркеры костной резорбции
Определение содержания кальция в утренней порции мочи является самым доступным и дешевым способом оценки резорбции костной ткани. Метод информативен в ситуациях с выраженной резорбцией кости, но недостаточно чувствителен при ОП. Кроме этого, маркером уровня костной резорбции служит содержание в крови кислой фосфатазы.
Оксипролин Определяемый в моче оксипролин отражает суммарно функцию остеобластов (процесс формирования) и функцию остеокластов (процесс резорбции). Однако, доля оксипролина, образуемого в результате резорбции, превалирует. Более того, исследуя концентрацию оксипролина в моче, следует иметь в виду, что он не является строго специфичным маркером костного метаболизма, поскольку содержится, хотя и в меньшем количестве, во всех типах коллагеновых молекул. При первичном ОП его экскреция чаще находится в пределах нормы. Около 30% лиц с ОП имеют повышенную концентрацию оксипролина в моче, что соответствует форме ОП с повышенным уровнем костного метаболизма.
Поперечно - связанные соединения коллагена (collagen cross - links) Каждая молекула коллагена содержит ковалентные поперечные связи. Эти соединения идентифицированы как пиридинолин и дезоксипиридинолин . Первый находится в костной, хрящевой тканях и в малых количествах в других типах коллагена. Дезоксипиридинолин обнаруживается, исключительно, в костной ткани.
Общий пиридинолин и дезоксипиридинолин могут быть измерены в утренней порции мочи методом высокоэффективной жидкостной хроматографии. Этот метод считается общепринятым. Экскреция этих веществ - отличный маркер костного обмена в период до менопаузы и сразу после ее наступления.
В последние годы разработан иммуноферментный анализ с использованием моноклональных антител против пиридинолина или дезоксипиридинолина.
Поперечно - связывающие пептиды коллагена I типа Весьма ценным в диагностике ОП с повышенной костной резорбцией (сенильная и менопаузальная формы) оказалось определение в моче С–концевых телопептидов (СТХ). Содержание последних тесно коррелирует с костными потерями в проксимальных отделах бедренной кости и значениями МПКТ поясничного отдела позвоночника. Более того, определение СТХ важно при оценке эффективности антирезорбтивной терапии и в выявлении больных с быстрой потерей костной массы “fast bone losers”. Особое значение в последнее время придают исследованию N–концевых телопептидов (NTX), который является чувствительным предиктором высокого риска переломов костей у женщин в постменопаузе, неполучающих гормональную заместительную терапию (ГЗТ). У женщин в постменопаузе на фоне ГЗТ отмечается существенное снижение концентрации NTX, коррелирующее с увеличением МПКТ в поясничном отделе позвоночника и бедренной кости. Установлено, что высокий уровень NTX является предиктором хорошего ответа на ГЗТ.
Тартратрезистентная кислая фосфатаза (ТРКФ) вырабатывается остеокластами и также может быть использована, как маркер костной резорбции.
Клиническое значение маркеров костного обмена при остеопорозе
Среди маркеров состояния метаболизма костной ткани при первичном ОП “золотым стандартом” в настоящее время является определение деоксипиридинолина, телопептидов и ОКЦ.
Сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального ОП, особенно у женщин с исходно умеренным снижением МПКТ. Увеличение костной резорбции существенно увеличивает риск переломов независимо от исходной костной массы пациентов. Это связанно с тем, что хрупкость кости при ОП зависит не только от МПКТ, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции.
Биохимические маркеры информативны для наблюдения за динамикой костного метаболизма при длительном лечении ОП. Они значительно раньше позволяют определить эффективность данного препарата (в среднем через 3-6 месяцев), чем измерение плотности костной ткани (в среднем через 12 месяцев) от начала лечения.
Читайте также:


