Остеоартроз принципы лечения и диагностики
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
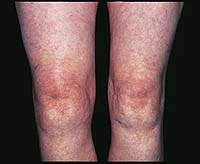 |
| Рисунок 1. Синовит (припухлость, гиперемия, локальное повышение температуры) правого коленного сустава при ОА |
При прогрессировании ОА в результате происходящих дегенеративных процессов хрящ размягчается, разрыхляется. В нем появляются трещины, простирающиеся до кости.
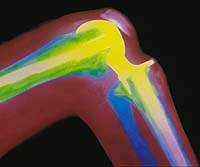 |
| Рисунок 2. Эндопротез коленного сустава. Рентгенограмма |
Особая роль в патогенезе ОА отводится синовиту, морфологически характеризующемуся умеренно выраженными пролиферативными и экссудативными реакциями (гиперплазией синовиальной оболочки и ее мононуклеарной инфильтрацией), наиболее выраженными в местах прикрепления синовии к хрящу с последующим исходом в склероз и липоматоз. В субхондральной кости выявляются микропереломы, утолщение костных трабекул и остеофитоз. Экссудативно-пролиферативные реакции как в субхондральной кости, так и в синовиальной оболочке протекают на фоне нарушений региональной гемодинамики и микроциркуляции с развитием тканевой гипоксии. В последующем прогрессирование болезни принимает, по сути, необратимый характер.
Боль, деформация и тугоподвижность сустава являются основными клиническими проявлениями ОА.
Боль в суставе — наиболее частый и выраженный симптом при ОА, носит неоднородный характер. Причинами ее могут быть деструктивные процессы в хрящевых и субхондральных структурах, нарушения микроциркуляции, особенно при затруднении венозного кровотока в спонгиозной части кости, фиброз капсулы сустава, воспалительный процесс в мягких околосуставных тканях, спазм близлежащих мышц и реактивный синовит.
В целом для заболевания характерен механический ритм болей — возникновение боли под влиянием дневной физической нагрузки и стихание за период ночного отдыха, что связано со снижением амортизационных способностей хряща и костных подхрящевых структур к нагрузкам. При этом происходит прогибание костных балок в сторону спонгиозной кости.
Возможны непрерывные тупые ночные боли, связанные с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
Рефлекторный спазм близлежащих мышц, а также развитие реактивного синовита вызывают постоянные боли.
Реактивный синовит и воспалительный отек параартикулярных тканей усугубляют клиническую картину. При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утреннняя скованность, припухлость сустава, локальное повышение кожной температуры. С прогрессированием заболевания рецидивы синовита учащаются.
Обычно ОА развивается медленно и начинается как моноартикулярное заболевание, но через некоторое время в патологический процесс включаются и другие суставы, чаще всего те, которые компенсаторно брали на себя повышенную механическую нагрузку, чтобы разгрузить первоначально заболевший сустав.
Клинически значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз. Клиническая картина ОА определяется конкретным суставом и группой суставов, вовлеченных в патологический процесс.
Среди неинвазивных методов диагностики гонартроза ведущее место по информативности занимает ультразвуковое двумерное сканирование коленных суставов, которое используют для объективизации и детализации характеристики вторичного синовита, являющегося прогностически неблагоприятным фактором, усугубляющим процессы дегенерации хряща. Наряду с диагностикой наличия синовиальной жидкости можно определить ее характер, особенно над bursa suprapatellaris и появлением жидкости над мыщелками бедренной кости, толщину и характер синовиальной оболочки; при этом ее утолщение при 0,4 см и более, а также контуры суставных поверхностей с учетом однородности контуров хряща на мыщелках бедренной кости и толщину хряща принимают за патологию. Ультразвуковое исследование суставов позволяет также уточнить характер и степень воспалительного процесса для выработки адекватного лечения.
Артроскопия в артрологии для диагностики воспалительных и дегенеративных заболеваний суставов, к сожалению, применяется недостаточно широко и, более того, не выявляет качественных отличий от воспаления синовии при других артритах. Существенно расширяет диагностические возможности артроскопии использование прицельной биопсии, а визуальный контроль позволяет получить фрагмент синовиальной ткани или хряща, наиболее адекватно отражающих развивающийся в суставе патологический процесс, но при этом данная процедура редко показывает распространенность патологического процесса. Артроскопия используется и с лечебной целью — с целью промывания полоски коленного сустава, при которой удаляется хрящевой детрит, а также фрагменты мениска, утолщенной и воспалительной синовии; выполняется аброзивная артропластика при гонартрозе. При коксартрозе ультразвуковое исследование отмечает, наряду с наличием и характером синовиальной жидкости, эхоуплотнение капсулы синовиальной оболочки, хрящевой губы, остеофиты. Однако следует сказать, что как ультразвуковые, так и эндоскопические признаки не могут считаться специфическими при гонартрозе и коксартрозе, поскольку они встречаются и при других заболеваниях суставов, как воспалительного, так и дегенеративного характера.
Основными целями терапии ОА являются: замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА состоит из трех компонентов:
- механическая разгрузка пораженных суставов;
- купирование синовита;
- предотвращение прогрессирования заболевания.
Задачи, которые ставятся при составлении комплекса лечебных мероприятий, можно решать с учетом следующей шкалы приоритетов: болевой синдром, синовит, нарушение трофики суставов и местного кровотока, гипотрофия и гипотония мышц, контрактура.
Режим. Механическая разгрузка сустава является определяющим фактором как в уменьшении болевого синдрома, так и в лечении ОА в целом. Сюда входят рекомендации по исключению длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, ведущих к механической перегрузке определенных зон суставов. В далеко зашедших стадиях заболевания пациенту полезно ходить с тростью, костылями. При выраженных болях в фазу обострения может быть назначен полупостельный режим.
Диета. Четких патогенетических рекомендаций по диете ОА на настоящий момент не существует. Важным условием в лечении ОА коленных суставов является снижение избыточной массы тела. В последнее время рекомендуются пищевые добавки (глюкозамин, хондроитин и др.), но эффективность их требует клинических подтверждений.
В терапии ОА наиболее часто применяются обезболивающие препараты, нестероидные противовоспалительные препараты (НПВП) и средства с хондропротективными свойствами.
В терапии ОА, который сопровождается болевым и воспалительным синдромами, широко применяются НПВП. В настоящее время известно около 100 НПВП различных классов, но поиск новых лекарственных средств этой группы продолжается. Это связано с потребностью в медикаменте, имеющем оптимальное соотношение обезболивающего и противовоспалительного действия и характеризующемся высокой степенью безопасности. В этом плане большой интерес представляет появившийся на российском рынке препарат ксефокам.
Ксефокам — новый НПВП класса оксикамов.
Подобно другим НПВП, ксефокам обладает обезболивающей и противовоспалительной активностью, связанной с подавлением синтеза простагландинов посредством ингибирования циклооксигеназы (ЦОГ).
Так как большинство НПВП подавляют, как правило, и ЦОГ-1 и ЦОГ-2, то развитие гастропатий, а также нарушение функции почек и агрегации тромбоцитов являются запрограммированным фармакологическим эффектом этих препаратов.
Существует достоверная связь между приемом НПВП и развитием патологии верхних отделов ЖКТ: геморрагий, эрозий, язв в желудке (гастропатий), а также эзофагопатий и дуоденопатий, что проявляется болями или чувством тяжести в эпигастральной области, тошнотой, иногда рвотой, изжогой, дисфагией, метеоризмом, диареей и др. Возможно бессимптомное течение гастропатий, в связи с чем увеличивается риск развития таких серьезных осложнений, как кровотечение и перфорация, нередко ведущих к летальному исходу. Кроме того, длительный прием НПВП вызывает энтеропатии и колонопатии с последующим развитием железодефицитной анемии и гипоальбуминемии.
К образованию эрозий и язв приводит подавление НПВП синтеза простагландинов слизистой ЖКТ, что вызывает:
- уменьшение секреции слизистого геля;
- снижение секреции бикарбонатов;
- ухудшение кровотока в слизистой ЖКТ.
Высокий риск возникновения язв ЖКТ отмечается при продолжительной терапии НПВП, но максимален в первый месяц приема препарата. Снижение риска в дальнейшем объясняется, по-видимому, адаптационными механизмами, благодаря которым гастродуоденальная слизистая приобретает способность противостоять повреждающему действию НПВП.
Полагают, что при приеме НПВП нарушается репарация хряща и субхондральной кости за счет угнетения синтеза простагландинов, в частности в зонах микропереломов, с образованием очагов деструкции и кист. При этом, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в суставных тканях пациента.
Установлено, что селективное ингибирование ЦОГ-2 оказывает незначительный эффект при острой боли. В то же время при острой боли концентрация ЦОГ-1 увеличивается в три-четыре раза, поэтому для анальгетического эффекта может иметь значение ингибирование именно этого изофермента. Таким образом, оптимальным сочетанием анальгетического и противовоспалительного эффекта обладают препараты, ингибирующие как ЦОГ-1, так и ЦОГ-2. Ксефокам является наиболее мощным ингибитором обоих изоферментов. Эта способность ксефокама в 100-200 раз превышает таковую у эталонных НПВП, например у диклофенака и пироксикама. При этом соотношение ингибиторной активности ксефокама в отношении ЦОГ-1 и ЦОГ-2 (мера селективности) занимает срединное положение по сравнению с аналогичными показателями других НПВП, что и обеспечивает баланс анальгетической и противовоспалительной активности ксефокама.
Ксефокам угнетает высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность.
Обезболивающий эффект ксефокама отчасти связан с его влиянием на центральную нервную систему. Это подтверждается тем, что внутривенное введение лорноксикама (ксефокама) больным с болями в пояснице повышало уровень эндогенных морфинов при одновременном улучшении состояния. Активация системы нейропептидных опиоидов может быть одним из путей реализации анальгетического эффекта ксефокама. По анальгетическому эффекту ксефокам приравнивается к 20 мг морфина, при этом он не оказывает опиатоподобного действия на ЦНС и не вызывает лекарственной зависимости.
Исследования показали, что в терапевтических дозах ксефокам стимулирует синтез протеогликанов, предотвращая дегенерацию суставного хряща. Эта важная особенность ксефокама делает его препаратом выбора при ОА, поскольку известно, что многие НПВП, напротив, отрицательно влияют на хрящ.
Ксефокам практически весь (на 99%) связывается с белками плазмы, тем не менее он активно проникает в суставные полости, где длительное время (10-12 часов) сохраняется в достаточной терапевтической концентрации — даже когда в плазме его концентрация снижается. Это позволяет принимать препарат всего лишь два раза в день. Благодаря короткому периоду полувыведения из плазмы крови (примерно 4 часа) прием ксефокама сопровождается меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление протекторных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках.
Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети — печенью и кишечником. Такой двойной путь экскреции снижает нагрузку на данные органы и улучшает переносимость ксефокама. После многократного введения ксефокама не наблюдается его кумуляция в плазме, что снижает риск побочных эффектов по сравнению с НПВП, имеющими более длительный период полувыведения. Фармакокинетика ксефокама примерно одинакова у пожилых людей и лиц молодого или зрелого возраста, поэтому не требуется какой-либо коррекции дозы препарата у пожилых.
Клинические испытания подтвердили высокую эффективность и хорошую переносимость ксефокама у больных ОА. В результате месячного приема лекарства в суточной дозе 16 мг уменьшались боль, длительность утренней скованности, улучшалась функция суставов.
К средствам, модифицирующим течение ОА, относятся препараты, в основе действия которых лежат:
- активация анаболических процессов в матриксе хряща
- подавление активности лизосомальных ферментов
- стимуляция синтетических функций хондроцитов.
Традиционно для лечения ОА использовались парентеральные гликозаминогликаны, однако в последнее время предпочтение отдается пероральным препаратам, а именно глюкозаминсульфату и хондроитинсульфату.
При некупируемом реактивном синовите показана пункция сустава, удаление синовиальной жидкости и внутрисуставное введение глюкокортикоидов, которые ингибируют синтез интерлейкина-1 и фактора некроза опухоли-α, участвующих в воспалении и деградации хряща. Широко используются при этом гидрокортизон, метипред, кеналог и дипроспан. Последние препараты характеризуются более выраженным и пролонгированным лечебным действием. Вместе с глюкокортикоидами возможно введение анестетиков (новокаина, лидокаина), действие которых при этом потенцируется. Введение ингибиторов медиаторов воспаления — контрикала (трасилола) или гордокса — благотворно влияет на метаболизм хряща.
В настоящее время рассматривается вопрос о широком внедрении в практику для подавления локального воспаления внутрисуставного введения ксефокама.
Широко применяемые для восстановительного лечения ОА физиотерапевтические методы уменьшают болевой синдром, а также воспалительные процессы и мышечный спазм, улучшают микроциркуляцию, благоприятно воздействуют на метаболические процессы в тканях сустава. При этом используются ультрафиолетовое облучение, электрические токи, переменные магнитные поля, электрофорез и фонофорез лекарственных средств на суставы. При пролиферативных явлениях, вазотрофических расстройствах и контрактурах показаны тепловые процедуры, включая аппликации парафина, озокерита, иловой и торфяной грязи. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. Для укрепления мышц рекомендуется применение электромиостимуляции.
При выполнении лечебного массажа больным ОА следует избегать механического раздражения суставной капсулы, обращая особое внимание на работу с прилегающими к суставу мышцами. Тогда снижается болевой мышечный спазм, повышается тонус ослабленных групп мышц, усиливается трофика пораженных суставов и улучшаются функциональные способности больного.
При выраженном длительном болевом синдроме, не купируемом традиционными средствами, а также при значительных нарушениях функции сустава применяется хирургическое лечение чаще всего на коленных и тазобедренных суставах. Кардинальной операцией является эндопротезирование сустава. Хорошо зарекомендовали себя эндопротезы, в которых узел скольжения состоит из пары металл–полиэтилен.
Важную роль в профилактике ОА играет выявление и своевременная ортопедическая коррекция врожденных аномалий: вывиха бедра, варусной и вальгусной установки голеней, плоскостопия и др. В профессиональной деятельности необходимо исключить длительные статические и стереотипные механические перегрузки суставов. Существенным условием профилактики ОА коленных суставов является нормализация избыточной массы тела.
Лечение остеоартроза остается в основном симптоматическим, с использованием пероральных, внутрисуставных и локальных ЛС и направлено на достижение следующих целей (рис. 11):
■ замедление ггрогресопхжания заболевания;
■ уменьшение боли и воспаления;
■ снижение риска обострений и поражения новых суставов;
■ улучшение качества жизни;
■ предотвращение инвалидизации.
Для подавления боли используют широкий комплекс ж фармакологических (лечебная физкультура, физиотерапия, обучение пациентов) и фармакологических методов.
Ни один из указанных методов не является универсальным. При выборе метода лечения для конкретного пациента следует учитывать:
■ особенности течения заболевания — выраженность симптомов, скорость прогрессирования заболевания, наличие воспалительного компонента;
■ индивидуальные особенности пациента — возраст, наличие сопутствующих заболеваний, их характер и фармакотерапию;
■ свойства ЛС.
Поскольку тучность и нарушение мышечного тонуса — важные факторы риска развития и прогрессирования остеоартроза, снижение избыточного веса и укрепление мышц являются важнейшими направлениями лечения. Снижение (веса уже само по себе ведет к уменьшению болей не только в нагрузочных, но и в мелких суставах кистей. В связи с этим рекомендуются специальные диеты и комплексы физических упражнений (аэробные, двигательные, силовые).
Определенным анальгетическим эффектом обладают физиотерапевтические методы, такие, как холодовые процедуры, чрескожная электростимуляция и др.
Согласно современной классификации противоартроаные ЛС подразделяют на 3 группы:
■ Симптоматические ЛС быстрого действия (простые анальгетики и НПВП).
■ Симптоматические ЛС медленного действия или препараты, модифицирующие симптомы (хондроитин сульфат, глюкозамин сульфат, препараты гиалуроновой кислоты).
■ ЛС, модифицирующи структуру хряща (возможно, таким действием обладают хондроитин сульфат, глюкозамин сульфат).
Кроме того, у некоторых пациентов с эрозивным остеоартрозом или частыми обострениями синовита целесообразно длительное лечение гидроксихлорохином и колхицином:
Гидроксихлорохин 200 мг/сут
Колхицин 1 мг/сут
У пациентов с гонартрозом при появлении признаков воспаления эффективно внутрисуставное введение пролонгированных глюкокортикоидов, таких как триамцинолон, метилпреднизолон и особенно бетаметазон.
В большинстве случаев эффект от внутрисуставного введения глюкокортикоидов сохраняется только в течение короткого промежутка времени. Тем не менее, число внутрисуставных инъекций в течение года не должно превышать трех. При поражении тазобедренного сустава такое лечение следует проводить с особой осторожностью и по очень строгим показаниям.
У больных с умеренными непостоянными болями без признаков воспаления можно ограничиться периодическим приемом простых анальгетиков (парацетамол не более 4 г/сут). Их преимуществом перед НПВП является низкая токсичность для ЖКТ В то же время в недавних исследованиях было показано, что парацетамол в дозе более 2 г/сут так же, как НПВП, может приводить к поражению ЖКТ, а также может способствовать увеличению артериального давления.
"Анальгетическая" доза НПВП при остеоартроае обычно ниже, чем при РА и других воспалительных заболеваниях суставов. НПВП следует принимать не постоянно, а только в период усиления болей. Оптимальными препаратами являются производные пропионовой кислоты (ибупрофен 1200—1800 мг/сут или кетопрофен 100 мг) и арилуксусной кислоты (диклофенак 50—100 мг/сут).
При выраженных постоянных болях, часто связанных не только с механическими факторами, но и с воспалением, НПВП более эффективны, чем парацетамол.
Определенной анальгетической активностью обладает локальная терапия НПВП (мази, кремы, гели).
Выбор того или иного ЛС зависит от нескольких факторов: безопасности, сочетаемости с другими ЛС и отсутствия негативного влияния на хрящ.
Применение индометацина и пироксикама не рекомендуется, так как эти препараты вызывают тяжелые побочные эффекты (особенно у пожилых пациентов) и плохо взаимодействуют с другими лекарственными средствами (гипотензивными, мочегонными препаратами, бета-блокаторами и др.).
Пациентам пожилого возраста с факторами риска НПВП-гастропатии (язвенный анамнез, сопутствующие заболевания и др.) показаны наиболее безопасные ЛС: ингибиторы ЦОГ-2 — мелоксикам (7,5 мг/сут), нимесулид (200 мг/сут), целекоксиб (100—200 мг/сут).
Альтернативный подход к анальгетической терапии остеоартроза связан с применением трамадола гидрохлорида — синтетического анальгетика центрального действия, не вызывающего при правильном приеме физической и психической зависимости. Трамадол назначают в первые дни 50 мг/сут с постепенным увеличением до 200—300 мг/сут. Трамадол хорошо сочетается с НПВП. Его применение особенно оправдано при наличии противопоказании для назначения оптимальных доз НПВП.
Лечение хондроитин сульфатом (1000—15000 мг/сут 2—3 р/сут) приводит к уменьшению болей в суставах, позволяет снизить дозу НПВП и очень хорошо переносится. Анальгетический эффект сохраняется в течение нескольких месяцев после завершения лечения
Сходной эффективностью и переносимостью обладает глюкозамин сульфат который назначают 1500 мг/сут однократно в течение не менее 6 мес, повторными курсами.
Однако тактика лечения этими препаратами (длительность и периодичность курсов) требует дальнейшего изучения.
В Недавно получены данные о возможном структурно-модифицирующем эффекте (замедление сужения суставной щели, образования остеофитов) этих препаратов при остеоартрозе коленного сустава (глюкозамин сульфат, хондроитин сульфат) и мелких суставов кистей (хон рои ин сульфат).
При гонартрозе используют внутрисуставное введение производных гиалуронасоторые представляют собой полисахарид, состоящий из длинной цепи дисахаридов. В настоящее время используют два препарата гиалуроната: низкомолекулярный (молекулярный вес — 500000—730000 дальтон) и высокомолекулярный (молекулярный вес — 6000000 дальтон).
В Оба препарата уменьшают боли в коленном суставе, позволяют отсрочить оперативное лечение, хорошо переносятся.
Очень редко при их введении наблюдается обострение болей в суставах по типу псевдоподагрических атак.
Чрезвычайно эффективно хирургическое лечение (артроскопические операции и особенно эндопротезирование суставов),
которое, тем не менее, следует проводить только при тяжелом инвалидизирующем уважении коленных и тазобедренных
суставов, сопровождающемся сильными болями.
Версия: Клинические рекомендации РФ (Россия) 2013-2017
Общая информация
Федеральные клинические рекомендации по диагностике и лечению остеоартроза
Клинические рекомендации "Остеоартрит" прошли общественную экспертизу, согласованны и утверждены 5 октября 2013 г., на заседании Пленума правления АРР, проведенного совместно с профильной комиссией МЗ РФ по специальности "ревматология". (Президент АРР, академик РАН - Е.Л.Насонов)
ОА - гетерогеннаягруппа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц.
МКБ-10: М15–М19 Артрозы
Аббревиатура: ОА - остеоартроз


Классификация
Выделяют две основные формы остеоартроза: первичный (идиопатический) и вторичный, возникающий на фоне различных заболеваний.
| Первичный (идиопатический) | Локализованный (поражение менее 3 суставов) - Суставы кистей - Суставы стоп - Коленные суставы - Тазобедренные суставы - Позвоночник - Другие суставы Генерализованный (поражение 3 групп суставов и более) - Эрозивный |
| Вторичный | - Посттравматический - Врождённые, приобретённые, эндемические заболевания (болезнь Пертеса, синдром гипермобильности и др.) |
Диагностика
Диагностика
Диагноз ОА устанавливается на основании жалоб и анамнестических данных больного, клинико-инструментального исследования и исключения других заболеваний. Важным фактором диагностики является тщательный сбор анамнеза, позволяющий выделить определенные причины (факторы риска) развития ОА.
Факторы риска, связанные с развитием ОА
| Факторы | Описание |
| Системные | Возраст |
| Пол | |
| Раса | |
| Гормональный статус | |
| Генетические факторы | |
| Минеральная плотность кости | |
| Витамин Д | |
| Локальные | Предшествующее повреждение сустава |
| Слабость мышц | |
| Неправильная ось сустава | |
| Гипермобильность | |
| Внешние факторы | Ожирение |
| Избыточная нагрузка суставов | |
| Спортивная физическая нагрузка | |
| Профессиональные факторы |
Клиническая картина
Чаще в процесс вовлекаются суставы, подвергающиеся большой нагрузке (коленные, тазобедренные), мелкие суставы кистей (дистальные и проксимальные межфаланговые суставы, первый пястно-запястный сустав) и позвоночник. Большое значение имеет поражение тазобедренных и коленных суставов, являющееся основной причиной снижения качества жизни и инвалидизации больных, страдающих ОА.
Клиническая картина ОА включает три основных симптома: боль, крепитацию и увеличение объёмов суставов.
Ведущий клинический признак ОА - боль в суставах, продолжающаяся большинство дней предыдущего месяца. Причины суставных болей многочисленны. Они не связаны с поражением собственно хряща (он лишён нервных окончаний), а определяются изменениями в:
- субхондральной кости – усиление костной резорбции на ранних стадиях заболевания, отек костного мозга, рост остеофитов;
- синовиальной оболочке, связанными с воспалением;
- околосуставных тканях - повреждение связок, мышечный спазм, бурсит, растяжение капсулы сустава;
- психоэмоциональной сфере и др.
В отличие от воспалительных заболеваний суставов внесуставные проявления при ОА не наблюдают.
Патогномоничных для ОА лабораторных признаков не существует. Тем не менее, лабораторные исследования следует проводить в целях:
- Дифференциального диагноза (при ОА отсутствуют воспалительные изменения в клиническом анализе крови, не обнаруживают РФ, концентрация мочевой кислоты в сыворотке крови соответствует норме).
- Перед началом лечения (общий анализ крови и мочи, креатинин сыворотки крови, сывороточные трансаминазы) с целью выявления возможных противопоказаний для назначения ЛС.
- Для выявления воспаления необходимо исследовать СОЭ и С-реактивный протеин. Умеренное повышение характерно для вторичного синовита на фоне ОА. Выраженное повышение свидетельствует о другом заболевании.
- Исследование синовиальной жидкости следует проводить только при наличии синовита в целях дифференциального диагноза. Для ОА характерен невоспалительный характер синовиальной жидкости: прозрачная или слегка мутная, вязкая, с концентрацией лейкоцитов менее 2000/мм3.
Инструментальные исследования
Рентгенологическое исследование — наиболее достоверный метод диагностики ОА, который выявляет сужение суставной щели, краевые остеофиты и заострение мыщелков большеберцовой кости, субхондральный склероз.
При подозрении на ОА коленных суставов рентгеновский снимок делается в передне-задней и боковой проекциях в положении стоя, для исследования пателло-феморального сустава – снимок в боковой проекции при сгибании (В).
При подозрении на ОА тазобедренного сустава необходимо проводить рентгенологическое исследование костей таза с захватом обоих тазобедренных суставов (уровень С).
Классификация рентгенологических изменений при остеоартрите Келлгрена и Лоуренса (1957)
0 | Изменения отсутствуют |
| I | Сомнительные рентгенологические признаки |
| II | Минимальные изменения (небольшое сужение суставной щели, единичные остеофиты) |
| III | Умеренные проявления (умеренное сужение суставной щели, множественные остеофиты) |
| IV | Выраженные изменения (суставная щель почти не прослеживается, выявляются грубые остеофиты) |
Показания к проведению рентгенографического исследования коленных суставов при первом обращении пациента
‒ Молодой возраст
‒ Травма, предшествовавшая появлению боли в суставе (для исключения перелома)
‒ Значительный выпот с выраженной дефигурацией сустава, особенно при поражении одного сустава
‒ Выраженное уменьшение объема движений в суставе
‒ Интенсивная боль в суставе, даже в случае, если диагноз ОА ранее был установлен
‒ Планируемая консультация ортопеда
‒ Неэффективность адекватной консервативной терапии
Повторное рентгенологическое исследование суставов при ОА должно использоваться только в клинических целях. Повторное рентгенологическое исследование суставов при ОА проводится при подозрении на присоединение новой патологии или планируемое хирургическое вмешательство на суставе(при направлении на консультацию к ортопеду).
Диагностические критерии
Таблица . Классификационные критерии остеоартроза (Альтман и др., 1991)
| Клинические | Клинические, лабораторные, рентгенологические |
| Коленные суставы | |
| 1. Боль | 1. Боль |
| и | и |
| 2а. Крепитация | 2. Остеофиты |
| 2б. Утренняя скованность | или |
| 2в. Возраст | 3а. Синовиальная жидкость, характерная для ОА (или возраст |
| или | |
| 3а. Крепитация | 3б. Утренняя скованность |
| 3б. Утренняя скованность | 3в. Крепитация |
| 3в. Костные разрастания | |
| или | |
| 4а. Отсутствие крепитации | |
| 4б. Костные разрастания | |
| Чувствительность 89% | Чувствительность 94% |
| Специфичность 88% | Специфичность 88% |
| Тазобедренные суставы | |
| 1. Боль | 1. Боль |
| и | и не менее 2-х из 3 критериев |
| 2а. Внутренняя ротация | 2а. СОЭ |
| 2б. СОЭ 115°) | 2б. Остеофиты |
| или | 2в. Сужение суставной щели |
| 3а. Внутренняя ротация 50 лет 3г. Боль при внутренней ротации | |
| Чувствительность 86% | Чувствительность 89% |
| Специфичность 75% | Специфичность 91% |
| Суставы кистей | |
| 1. Боль продолжительная или скованность 2. Костные разрастания 2-х и более суставов из 10 оцениваемых* 3. Менее 2 припухших пястно-фаланговых суставов 4а. Костные разрастания, включающие 2 и более дистальных межфаланговых сустава** (2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а) | |
| или | |
| 4б. Деформация одного и более суставов из 10 оцениваемых* | |
| Чувствительность 93% Специфичность 91% | |
Примечания. * — 2-й и 3-й дистальные межфаланговые суставы; 2-й и 3-й проксимальные межфаланговые суставы; 1-й запястно-пястный сустав обеих кистей. ** — 2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а
Дифференциальный диагноз
Диагностика ОА с учётом диагностических критериев трудностей не вызывает. Тем не менее, каждую клиническую ситуацию необходимо проанализировать с точки зрения возможности вторичного происхождения ОА.
Заболевания, с которыми необходимо проводить дифференциальную диагностику ОА
| Анкилозирующий спондилоартрит | Псевдоподагра |
| Реактивный артрит | Псориатический артрит |
| Подагра | Ревматоидный артрит |
| Инфекционный артрит | Фибромиалгия |
| Ревматическая полимиалгия | Диабетическая артропатия |
| Посттравматический синовит | Паранеопластическая артропатия |
| Врождённая гипоплазия головки бедра |
Лечение
Лечение ОА
Цели лечения
· Обеспечить понимание больным своего заболевания и умение управлять им: изменение образа жизни, применение физических упражнений, поддерживающих функцию суставов, защита суставов
· Улучшить функциональное состояние суставов и предотвратить развитие деформации суставов и инвалидизации больного
· Улучшить качество жизни больных
· Предотвратить дальнейшее разрушение суставного хряща
· Избежать побочных эффектов фармакотерапии и обострения сопутствующих заболеваний
При лечении ОА надо учитывать
· Факторы риска ОА
· Интенсивность боли и степень нарушения функций сустава
· Локализацию и выраженность структурных нарушений
· Пожелания и ожидания больного
Лечение ОА должно быть комплексным и включать нефармакологические, фармакологические и хирургические методы.
Нефармакологические методы
Физические упражнения при ОА снижают боль и сохраняют функцию суставов , особенно при сочетании с образовательными программами. Упражнения для укрепления силы четырёхглавой мышцы бедра достоверно уменьшают боль и сопоставимы по эффективности с НПВП. При ОА тазобедренных суставов силовые физические упражнения (изометрические, упражнения с противодействием) уменьшают боль в суставах. Необходимо учитывать противопоказания для занятий лечебной физкультурой у больных ОА, как абсолютные (неконтролируемая аритмия, блокада 3 степени, недавние изменения на ЭКГ, нестабильная стенокардия), так и относительные (кардиомиопатия, пороки сердца, плохо контролируемая артериальная гипертензия).
При ОА коленных суставов необходимы регулярные физические упражнения для укрепления силы четырехглавой мышцы бедра и увеличения объема движений, аэробные нагрузки (А). При ОА тазобедренных суставов тоже требуется выполнение лечебной физкультуры, особенно силовых упражнений (С).
Медикаментозное лечение
Симптоматические лекарственные средства быстрого действия
| Результаты исследований | Рекомендации | |
| Анальгетики | Парацетамол показан при слабых или умеренных болях при ОА без признаков воспаления. В дозе 3,0 г/сут. доказана безопасность применения парацетамола при ОА в течение 2 лет. Высокие дозы сопровождаются развитием осложнений со стороны ЖКТ, почек и вызывают повышение артериального давления у мужчин и женщин. Препарат не следует назначать больным с поражениями печени и хроническим алкоголизмом. | При слабых или умеренных болях в суставах применяется парацетамол в минимальной эффективной дозе, но не выше 3,0 г/сут. (максимальная разовая доза должна не превышать 350 мг) (А). Парацетамол можно применять длительно (А). |
| Нестероидные противовоспалительные препараты | Применяют только в период усиления болей, для купирования болей назначаются минимальные эффективные дозы и по возможности не длительно. Больные должны быть детально информированы о достоинствах и недостатках НПВП, включая безрецептурные препараты. Все НПВП в эквивалентных дозах обладают сходной эффективностью, выбор НПВП определяется прежде всего его безопасностью в конкретных клинических условиях. Осложнения со стороны ЖКТ — одни из наиболее серьёзных побочных эффектов НПВП. Относительный риск их возникновения варьирует у различных НПВП и дозозависим. Наименьшим риском развития желудочно-кишечного кровотечения обладают селективные ингибиторы ЦОГ2. Их следует назначать при наличии следующих факторов риска развития нежелательных явлений: возраст старше 65 лет, наличие в анамнезе язвенной болезни или желудочно-кишечного кровотечения, одновременный приём ГКС или антикоагулянтов, наличии тяжёлых сопутствующих заболеваний. |
Внутрисуставное введение глюкокортикоидов (ГЛК) показано при ОА коленных суставов с симптомами воспаления (А).
Симптоматические лекарственные средства медленного действия
Препараты, содержащие хондроитин сульфат и глюкозамин сульфат рекомендуются при ОА для уменьшения боли, улучшения функции суставов; эффект сохраняется в течение нескольких месяцев после их отмены, хорошо переносятся больными (А).
Производные гиалуроната применяют для внутрисуставного введения при ОА для уменьшения боли (А).
Хирургическое лечение
Уменьшает боль, улучшает двигательную функцию и улучшает качество жизни при ОА тазобедренных суставов. Продолжительность эффекта составляет около 10 лет, частота инфекционных осложнений и повторных операций — 0,2–2,0% ежегодно. Наилучшие результаты эндопротезирования отмечены у больных в возрасте 45–75 лет, с массой тела
Эндопротезирование коленных суставов приводит к уменьшению боли и улучшению двигательной функции.
Показано при ОА с выраженным болевым синдромом, не поддающимся консервативному лечению, при наличии серьёзного нарушения функций сустава (до развития значительных деформаций, нестабильности сустава, контрактур и мышечной атрофии) (А).
Алгоритм ведения больных ОА коленных и тазобедренных суставов


Информация
- Федеральные клинические рекомендации по ревматологии 2013 г. с дополнениями от 2016 г.
Методология
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются систематические обзоры в последней доступной версии The Cochrane Library, базы данных Medline (систематические обзоры (мета-анализы), рандомизированные клинические испытания, когортные исследования или исследования случай-контроль, статьи обзорного характера. Глубина поиска 10 лет.
Методы, использованные для оценки качества и силы доказательств
· Конценсус экспертов
· Оценка значимости в соответствии с рейтинговой схемой
Уровни доказательности, принятые при разработке данных рекомендаций
| A | · высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью систематической ошибки, результаты которого могут быть распространены на соответствующую российскую популяцию. |
| B | · высококачественный (++) обзор или систематический обзор когортных исследований или исследований случай-контроль или · высококачественное (++) когортное исследование или исследование случай контроль с очень низким уровнем систематической ошибки или · РКИ с невысоким (+) риском систематической ошибки, результаты которого могут быть распространены на соответствующую российскую популяцию. |
| C | · когортное исследование или исследование случай контроль или контролируемое исследование без рандомизации с невысоким уровнем систематической ошибки (+), результаты которого могут быть распространены на соответствующую российскую популяцию или · РКИ с очень низким или невысоким (+) риском систематической ошибки, результаты которого не могут быть непосредственно распространены на соответствующую российскую популяцию. |
| D | · описание серии случаев или · неконтролируемое исследование или · мнение экспертов |
Индикаторы доброкачественной практики (Good Practice Points – GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций
Экономический анализ:
Экономический анализ не проводился и публикации по фармакоэкономике не анализировались
Метод валидизации рекомендаций:
· Внешняя экспертная оценка
· Внутренняя экспертная оценка
Читайте также:


