Метаболический синдром при остеоартрозе
Медицинский эксперт статьи


В литературе последних лет достаточно широко освещается понятие коморбидности - одновременного поражения двух или более органов и систем организма. Коморбидность может протекать по типу синтропии - поражения органов под влиянием общих патогенетических факторов или интерференции - возникновения одного заболевания под влиянием другого. Несмотря на большое количество различных определений коморбидности, значение термина наиболее полно отражает следующее: под заболеваниями или нарушениями, которые коморбидны конкретному заболеванию, понимаются такие нарушения, которые встречаются при этом заболевании наиболее часто и имеют с ним некоторые совместные этиологические или патогенетические механизмы.
В последнее время внимание ученых привлекает проблема сочетания разных заболеваний суставов у больных с метаболическими и сердечно-сосудистыми нарушениями. У больных остеоартрозом (ОА) в сочетании с метаболическим синдромом (МС) были установлены значительные нарушения липидного обмена, возрастание активности оксидативного стресса, что способствовало деградации соединительнотканных структур организма. У больных остеоартрозом имеется повышенный риск развития кардиоваскулярных патологий, который увеличивается во время лечения нестероидными противовоспалительными препаратами при наличии других факторов - возрастных изменений, ожирения и артериальной гипертензии (АГ). Например, по данным И. О. Романовой, у 62 % больных остеоартрозом были выявлены АГ и повышение в крови уровня С-реактивного белка, степень которого зависит от факторов риска развития кардиоваскулярных нарушений, болевого синдрома и стадии заболевания. Также у больных, страдающих на остеоартроз были обнаружены повреждение эндотелия и нарушение его функций - снижение антитромбогенной активности сосудистой стенки, повышение упругости артерий, выраженность которых возрастает с увеличением длительности заболевания.
По результатам исследований американских ученых остеоартроз является одной из основных проблем системы охраны здоровья, прежде всего из-за его связи с сердечно-сосудистыми заболеваниями, которые становятся одной из основных причин смерти пациентов. На сегодняшний день существует много доказательств, что остеоартроз не просто заболевание, связанное с нарушениями морфофункционального состояния суставов, а нарушение обмена веществ, при котором развиваются метаболические расстройства, способствующие возникновению и прогрессированию системного патологического процесса. Таким образом, развитие ОА связано не только с ожирением и артериальной гипертензией, но и с другими факторами кардиоваскулярного риска - сахарным диабетом, инсулинорезистентностью и дислипидемией. Учеными из США у 7714 больных была исследована распространенность метаболического синдрома у пациентов с остеоартрозом в связи с метаболическими нарушениями и развитием системного воспаления. Было установлено, что остеоартроз связан с увеличением распространенности метаболического синдрома преимущественно в молодом возрасте. По данным исследования, МС был распространен у 59% больных с остеоартрозом и 23% пациентов без остеоартроза и включал: артериальную гипертензию (75% против 38%), абдоминальное ожирение (63% против 38%), гипергликемию (30% против 13%), повышенный уровень триглицеридов (47% против 32 %) и низкий уровень липопротеинов низкой плотности (44% против 38%). МС чаще всего встречался у пациентов с остеоартрозом независимо от пола и расовой принадлежности. Взаимосвязь между остеоартрозом и метаболическим синдромом была отмечена у молодых пациентов, и уменьшалась с возрастом. Учеными из Калифорнийского университета было проведено исследование ожирения и кардиоваскулярного риска у больных остеоартрозом на протяжении 2002-2006 гг. Было обследовано 6299 взрослых пациентов в возрасте до 35 лет. Остеоартроз был выявлен у 16,5 % женщин и 11,5% мужчин, при этом количество больных увеличивалось с возрастом и было выше среди женщин. Наличие болевого синдрома при остеоартрозе было связано со степенью ожирения, АГ - с курением больных. У мужчин не было выявлено связи сахарного диабета с остеоартрозом, у женщин сочетание диабета и остеоартроза диагностировали в возрасте от 35 до 54 лет. Таким образом, распространенность остеоартроза и сопутствующих ему патологий среди населения США была значительной.
Большое значение в оценке клинического состояния больных остеоартрозом в сочетании с артериальной гипертензией и ожирением имеет индекс массы тела (ИМТ). Известно, что при ожирении преимущественно развивается остеоартроз коленных суставов, в меньшей степени - тазобедренных. Также была установлена взаимосвязь между ИМТ, количеством пораженных суставов и рентгенологическим прогрессированием остеоартроза. Избыточная масса тела (ИМТ > 25) ассоциировалась с повышенной частотой развития остеоартрозом коленных суставов, а не тазобедренных. При ИМТ больше 27,5 рентгенологически отмечено прогрессирование лишь остеоартроз коленных суставов. Доказательства влияния ожирения на развитие коксартроза неоднозначны: некоторые авторы подтверждают возможную ассоциацию этих патологий, другие - нет. При исследовании 298 больных остеоартрозом коленного и тазобедренного суставов рассчитывали ИМТ, измеряли окружность талии и бедер, а также изучали взаимосвязь данных показателей с тяжестью остеоартроза. В результате было установлено, что ожирение наблюдалось у 61,5 % женщин и 59 % мужчин. У этих больных наблюдалось очевидное возрастание распространения сердечно-сосудистых заболеваний и сахарного диабета среди пациентов с более высоким ИМТ. Полученные результаты подтверждают важную роль ожирения как фактора риска в развитии остеоартроза. Метаболические нарушения липидного обмена влияют на развитие сопутствующих патологий и имеют важное значение в прогрессировании остеоартроза коленных суставов.
Группой бразильских ученых исследовались сопутствующие патологии у пациентов с остеоартрозом. Установлено, что распространенность ОА увеличивается с возрастом. Был обследован 91 пациент (средний возраст 59,3 года, 91,4% составляли женщины). Метаболический синдром диагностировали у 54,9 % больных, АГ - у 75,8%, диспипидемии - у 52,6% и ожирение - у 57,1% пациентов. У 61,3% больных ОА наблюдалась депрессия. Депрессия, метаболический синдром или отдельные его компоненты влияют на интенсивность болевого синдрома и физическое состояние пациентов, что свидетельствует о необходимости изучения и лечения сопутствующих заболеваний у пациентов с остеоартрозом.
Шведскими учеными было проведено изучение связи межу уровнем С-реактивного белка, метаболическим синдромом и частотой развития остеоартроза коленных и тазобедренных суставов: повышенная частота развития остеоартроза коленных суставов у пациентов с МС в большинстве случаев была обусловлена повышенным ИМТ, а уровень С-реактивного белка в крови не был связан с развитием остеоартроза.
Норвежскими учеными была исследована группа из 1854 пациентов с сочетанной патологией - ожирением и остеоартрозом. Возраст больных составлял от 24 до 76 лет, ожирение определялось ИМТ выше 30,0. В результате высокий ИМТ в значительно степени был связан именно с гонартрозом, а не коксартрозом.
В научных исследованиях итальянских ученых были определены клинические проявления сопутствующих заболеваний при остеоартрозе. Всего было обследовано 25 589 пациентов, из них 69% женщин и 31 % мужчин. Наиболее частыми сопутствующими патологиями при остеоартрозе были АГ (53%), ожирение (22%), остеопороз (21%), сахарный диабет 2-го типа (15%) и хроническая обструктивная болезнь легких (13%). Болевой синдром при остеоартрозе был более выраженным у женщин, чем у мужчин. Таким образом, результаты данного исследования подчеркивают высокую частоту сопутствующих заболеваний, а также роль разных факторов развития болевого синдрома при остеоартрозе.
В исследованиях отечественных ученых проблема диагностики и лечения остеоартроза, сочетанного с другими патологиями, рассматривается и разрабатывается специалистами как терапевтического, так и ортопедического профиля. По мнению В. А. Филиппенко и соавт., при остеоартрозе развивается дисбаланс синтеза цитокинов и другие иммунологические нарушения, которые лежат в основе формирования хронического воспалительного процесса в суставах. По данным наших исследований, у больных с остеоартрозом наблюдаются нарушения в системе гемостаза, которые проявляются повышением концентрации в плазме крови фибриногена, растворимых фибрин-мономерных комплексов и увеличением фибринолитической активности. При обследовании больных остеоартрозом с ожирением и АГ, кроме увеличения концентрации в крови холестерола и бета-липопротеинов, наблюдалось повышение уровня биохимических показателей состояния соединительной ткани (гликопротеинов, хондроитинсульфатов), что говорит о высокой активности системного воспалительного процесса в организме, усиленного сопутствующими заболеваниями.
По данным И. Е. Корошиной, МС определялся у 82,3 % обследованных больных остеоартрозом. При остеоартрозе у пациентов с метаболическим синдромом часто развивалось поражение сердечно-сосудистой системы, желудочно-кишечного тракта, почек и щитовидной железы, а также возникали сахарный диабет, ожирение и сопутствующие заболевания. Таким образом, метаболические нарушения при ОА могут указывать на участие их в развитии и прогрессировании заболевания.
По результатам исследований И. В. Солдатенко и соавт. были установлены клинические особенности, вариабельность сердечного ритма и эффективность контроля коморбидной с ОА АГ в зависимости от типов ортостатических реакции и суточных профилей артериального давления. Сочетанная с ОА АГ не влияла на исходные показатели вариабельности сердечного ритма, но при этом нарушала реакции на ортостаз. Среди совокупности изученных клинических признаков и показателей вариабельности сердечного ритма статистически значимыми критериями эффективности контроля артериального давления у больных АГ коморбидной с остеоартрозом были возраст больных и соотношение симпато-вагального баланса.
По данным Л. М. Пасиешвили, у больных гипертонической болезнью определялась гипокальциемия и гиперкальциурия, которые значительно увеличиваются при присоединении остеоартроза. Выявленные изменения можно считать одним из механизмов развития и прогрессирования данных патологий. Эти изменения являются неблагоприятным фактором сочетанного течения гипертонической болезни и остеоартроза и могут привести к формированию остеопороза, что является основанием для проведения заместительной терапии.
Таким образом, по результатам исследований зарубежных и отечественных ученых, проблема сочетания остеоартроза с метаболическим синдромом и артериальной гипертензией является важной и актуальной в мировой медицине. Согласно литературным данным, остеоартроз - патология, которая часто сочетается с разными заболеваниями и синдромами. Ведущая роль в развитии и прогрессировании ОА у пациентов среднего и преклонного возраста принадлежит таким компонентам метаболического синдрома, как артериальная гипертензия и ожирение.
Проф. И. Г. Березняков, и. В. Корж. Остеоартроз, артериальная гипертензия и ожирение: проблема коморбидности // Международный медицинский журнал - №4 - 2012

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]
Рассмотрены патофизиология болевого синдрома при остеоартрозе и подходы к терапии с применением нестероидных противовоспалительных препаратов (НПВП). Описаны клиническая эффективность и безопасность применения нимесулида для лечения боли при остеоартрозе.
Pathophysiology of pain syndrome in osteoarthrosis and approaches to the therapy using non-steroidal anti-inflammatory preparations (NAIP) were considered. Clinical efficiency and safety of nemisulide application for relief of pain in osteoarthrosis were described.
Остеоартроз (ОА) — одно из самых распространенных заболеваний опорно-двигательного аппарата, основная причина постоянного болевого синдрома [1] и инвалидизации [2].
Болевой синдром при ОА представляется важной клинической проблемой. Манифестация боли возможна на разных стадиях процесса и не имеет четкой корреляции с рентгенологической картиной: рентгенологические проявления ОА отмечаются примерно у 30% взрослого населения, а болевой синдром развивается у 10–12% [3].
Боль может сохраняться даже после хирургического лечения. Примерно 15% больных, которым проведено эндопротезирование коленного сустава в связи с выраженным ОА, продолжают испытывать боль, несмотря на отсутствие хирургических осложнений и нормальную рентгенологическую картину [4].
В основе успешного управления симптомами ОА лежит понимание патофизиологии и тщательная клиническая оценка болевого синдрома.
Любой сустав, вне зависимости от его размеров, — это сложный орган, в состав которого входят синовиальная мембрана, синовиальная жидкость, хрящ, кость и мягкие ткани. При этом сустав — это еще и орган с едиными нейротрофическими, метаболическими, иммунными и функциональными составляющими, играющими важную роль как в патогенезе самого ОА, так и болевого синдрома при нем.
Известно, что прогредиентно протекающие дегенеративные процессы при ОА отмечаются во всех суставных структурах и объединяют потерю матрикса гиалинового хряща, ремоделирование подлежащей кости, поражение костного мозга, вовлечение связок, растяжение капсулы сустава, ослабление прилегающих к суставу мышц [5]. По мере прогрессирования ОА существенно меняется биомеханика сустава.
При ОА в процесс активно вовлекается периост из-за обнажения костной суставной поверхности [6]. Поверхность костной ткани внутри сустава, лишенная амортизирующих свойств из-за деструкции хряща, испытывает избыточную и неравномерную механическую нагрузку. В субхондральной кости появляются зоны динамической перегрузки, в которых развиваются изменения микроциркуляции. Это способствует возникновению субхондрального остеосклероза, кистовидной перестройки, изменению кривизны суставных поверхностей и образованию остеофитов. Повышение внутримедуллярного давления в субхондральной кости — это еще один источник боли при ОА.
Изменения также затрагивают связки, сухожилия, с развитием лигаментитов, теносиновитов, а также бурситов околосуставных сумок [7]. Прилегающие к суставу мышечные структуры страдают как от реактивного воспаления, развивающегося в суставах, так и от нарушения биомеханики больного сустава. В итоге повышенная механическая нагрузка на мышечный аппарат приводит к гипертонусу мышц, что также способствует нарастанию боли.
Значимая роль в патогенезе ОА отводится синовиту, деструктивно воздействующему на суставные структуры за счет активации фагоцитарных, воспалительных и иммунных реакций, способствующих высвобождению значительного числа медиаторов (цитокинов, простагландинов, матриксных металлопротеиназ, супероксидных радикалов, оксида азота и др.), играющих ключевую роль как в моделировании воспаления, так и восприятии боли [8, 9]. Воспаление синовиальной оболочки вносит существенный вклад в развитие боли, поскольку в ней достаточно широко представлены нервные окончания.
К настоящему времени накоплены данные о роли субстанции Р — нейропептида, способствующего возникновению и поддержанию боли за счет усиления продукции медиаторов воспаления в области суставов [10, 11]. По данным исследований при ОА субстанция Р обнаруживается в синовиальной жидкости и синовиальной оболочке [12, 13], периосте, подхрящевых участках костей, суставных капсулах, где синтезируется в немиелинизированных чувствительных нейронах [14], то есть в тех суставных структурах, из которых чаще и больше происходит болевых импульсов [15]. В хрящевой ткани сустава субстанция Р не обнаружена.
Еще одним проявлением ОА, усиливающим боль, является синовиальный выпот, способствующий растяжению богатой нервными окончаниями капсулы сустава [16, 17].
Кроме того, в качестве весьма специфического для суставов фактора, способствующего развитию болевого синдрома при ОА, рассматривается ангиогенез, при котором помимо роста сосудов отмечается значительный рост новых немиелинизированных чувствительных нервных окончаний [18]. При ОА процесс ангиогенеза наблюдается в синовиальной оболочке, некальцифицированных участках внутрисуставных хрящей и в остеофитах. Интересно, что в периваскулярных немиелинизированных нервных волокнах также обнаруживается субстанция Р и пептид, связанный с геном кальцитонина (CGRP), которые в совокупности способствуют медиации устойчивой жгучей боли, как ее описывают больные ОА [19].
Поскольку внутрисуставной гиалиновый хрящ не имеет ноцицепторов, он, несмотря на существенные дегенеративные процессы в нем, не может служить источником болевой импульсации. Очевидно, что боль при ОА полиэтиологична и происходит из всех выполняющих сустав структур, за исключением хряща [10, 11].
Болевой синдром при ОА может быть острым и хроническим: с периодическими обострениями и их уменьшением. Острая боль является следствием раздражения болевых рецепторов, расположенных в коже, связках, сухожилиях, сумках, костях, синовиальной оболочке, мышцах. Механизмы трансформации острой боли в хронический болевой синдром при ОА изучены недостаточно полно. Предполагается, что хронизации боли при ОА может способствовать длительное раздражение периферической ноцицептивной системы с постоянным вовлечением задних рогов спинного мозга [20]. При этом включаются принципиально иные механизмы формирования болевых импульсов. Ключевой вопрос касается связи между периферическим повреждением и воспалением структур суставов и стимуляцией выработки ЦОГ-2 в центральной нервной системе (ЦНС), где могут иметь значение как нервные, так и гуморальные механизмы. В частности, показано, что довольно продолжительная активность небольших сенсорных нейронов, обусловленная периферическим воспалением, сопровождается высвобождением глутамата/аспартата и субстанции Р в спинном мозге с последующей активацией рецепторов NMDA (N-метил-D-аспартата) в нейронах задних рогов спинного мозга [21]. Доказательством этого является повышенное содержание субстанции Р в спинномозговой жидкости больных ОА [22]. Стимуляция этих рецепторов может вызвать повышение экспрессии ряда ферментов, включая ЦОГ-2, в спинном мозге, что в итоге ведет к усилению болевого синдрома. Гуморальный же механизм воспалительной реакции, связанной с повреждением периферических суставных структур, приводит к высвобождению провоспалительных цитокинов (ФНО-α, ИЛ-1β), которые в свою очередь усиливают экспрессию ЦОГ-2.
Исходя из представлений о патогенезе ОА и болевого синдрома при нем, становится очевидным, что подавление воспаления и предотвращение деструкции суставных структур, с целью снижения синтеза провоспалительных цитокинов, простагландинов (в особенности ПГE2), ферментов синовиальной оболочки, металлопротеиназ, деградации коллагеновых волокон, протеолитической активности и т. п., является одним из приоритетных направлений в терапии ОА. Несомненно, назначение противовоспалительных препаратов не просто желательно, но и показано больным с ОА, испытывающим боль, особенно в тех случаях, когда развитие болевого синдрома тесно связано с тканевым воспалением, а простой анальгетик не оказывает должного эффекта. Подобный терапевтический подход соответствует ведущим рекомендациям национальных и международных руководств по купированию болевых синдромов у пациентов с ОА, где подчеркивается, что терапевтическим методом в таких случаях является использование парацетамола. При этом важно подчеркнуть, что парацетамол не оказывает действия на периферические ЦОГ, а посему не обладает противовоспалительным эффектом. И, кроме того, чтобы реализовать свою функцию, парацетамол должен достичь достаточного уровня концентрации в ликворе, поскольку оказывает комплексное воздействие на ЦНС, усиливая нисходящие от периферии к ЦНС процессы торможения. А это требует применения достаточной дозировки и обязательного соблюдения временного интервала между приемами (1 г трижды в день), чтобы полностью использовать потенциал препарата [27]. Эти аспекты оправдывают применение таких лекарственных препаратов, как НПВП, с учетом соотношения пользы и риска.
Нестероидные противовоспалительные препараты (НПВП) — наиболее назначаемый класс лекарственных средств, предназначенных для лечения болевых синдромов. Общими фармакологическими свойствами НПВП являются подавление биосинтеза простагландинов (ведущих факторов активации болевых рецепторов) за счет блокады изоферментов циклооксигеназы, в частности ЦОГ-2, и нормализация сниженного болевого порога. При назначении НПВП подавление синтеза простагландинов имеет место как на периферическом, непосредственно в месте повреждения и воспаления, так и на центральном уровнях, свидетельствуя о том, что и периферические и центральные механизмы принимают участие в антиноцицептивном действии этих препаратов. Центральный эффект НПВП связан с угнетением синтеза простагландинов, которые образуются в ЦНС и способствуют усилению болевого сигнала. Таким образом, ЦНС является дополнительным местом проявления антиноцицептивных эффектов НПВП.
Одним из наиболее популярных средств среди НПВП является нимесулид. Многочисленные исследования и более чем 30-летний клинический опыт применения показали, что нимесулид (Найз) обладает высокой эффективностью и хорошей переносимостью [28].
В контексте данной статьи хотелось бы прежде остановиться на бесспорных достоинствах нимесулида как препарата выбора для лечения болевых синдромов при ОА, принимая во внимание данные об их механизмах, рассмотренные ранее.
Интересны, прежде всего, ЦОГ-зависимые механизмы действия, обусловливающие эффективность и безопасность нимесулида. Поскольку нимесулид оказывает преимущественное действие на ЦОГ-2, то его эффекты очевидны как на периферии, в суставных структурах, затронутых деструктивным процессом и связанным с ним воспалением, так и в ЦНС [29, 30]. Причем исключительной особенностью нимесулида является способность не только подавлять активность ЦОГ-2, но и блокировать ее образование [31].
Хотя нимесулид и обладает преимущественным эффектом в отношении ЦОГ-2, он оказывает сбалансированное влияние на обе изоформы ЦОГ. В терапевтических концентрациях нимесулид ингибирует 88% активности ЦОГ-2 и 45% активности ЦОГ-1. При этом если воздействие на ЦОГ-1 прекращается через 24 часа после введения, то воздействие на ЦОГ-2 продолжается намного дольше [32], и это различие сохраняется при длительном применении [33, 34].
Неоспоримым преимуществом нимесулида является способность молекулы уменьшать высвобождение ФНО-α, ИЛ-6 и субстанции Р [35–37].
Примечательны ЦОГ-независимые эффекты нимесулида. В частности, в терапевтических концентрациях нимесулид влияет на продукцию токсичных окислительных радикалов и других компонентов нейтрофильной активации [38], ß-глюкуронидазы [39], что может усилить противовоспалительный и анальгетический эффект и потенциально уменьшать вероятность гастроинтестинальной ульцерогенности.
Наконец, трудно переоценить протективное действие нимесулида на суставной хрящ. Известно, что неселективные в отношении ЦОГ НПВП усугубляют тяжесть ОА при длительном применении. В наибольшей степени отрицательно влияют на хрящ производные индолуксусной кислоты (индометацин), чуть меньше — производные пропионовой кислоты (ибупрофен, напроксен и др.), что подтверждается данными рентгенографии. При этом доказано, что селективные ингибиторы ЦОГ-2, в частности нимесулид, не оказывают отрицательного влияния на синтез протеогликанов хрящевой тканью, даже при применении высоких доз [40, 41]. Напротив, нимесулид обнаруживает способность снижать в синовиальной жидкости, полученной из воспаленного сустава, уровень коллагеназы, вызывающей деградацию коллагена и протеогликанов [42].
С клинической точки зрения, многоплановость механизмов действия нимесулида, связанных или не связанных с ЦОГ, выражается в эффективности и быстром модулировании сложного воспалительного процесса и сопряженной с ним боли.
Клиническая эффективность нимесулида показана в многочисленных исследованиях. Известно, что препарат превосходит или как минимум столь же эффективен, как и классические НПВП, в отношении купирования значительного числа болевых синдромов, включая ревматоидный артрит, скелетномышечные боли в спине, послеоперационную и зубную боль, дисменорею. Преимущества нимесулида показаны и при лечении ОА. Так, использование нимесулида позволило добиться значимого уменьшения боли и улучшения самочувствия у подавляющего большинства пациентов с ОА, включенных в двойное слепое сравнительное исследование эффективности и безопасности нимесулида и диклофенака при гонартрозе и коксартрозе [43]. Этот результат представляется более значимым еще и потому, что примерно половина больных до назначения нимесулида получали другие НПВП и не отмечали при этом существенного улучшения своего состояния.
М. И. Шупина* , 1 , кандидат медицинских наук
Г. И. Нечаева*, доктор медицинских наук, профессор
Е. Н. Логинова*, кандидат медицинских наук
Т. В. Кропотина**, кандидат медицинских наук
Ю. В. Арбузова**
* ГБОУ ВПО ОмГМУ МЗ РФ, Омск
** БУЗОО ОКБ, Омск












Остеоартроз и метаболический синдром
Проблема остеоартроза (ОА) и метаболического синдрома (МС) стала актуальной в настоящее время как в связи с ростом частоты ожирения, так и с увеличением продолжительности жизни населения. В литературе появились данные о взаимосвязи ОА с метаболическими нарушениями. Основной причиной МС служит инсулинорезистентность, которая запускает порочный круг симптомов, в итоге приводящих к появлению осложнений, в частности к возникновению и прогрессированию ОА. В обзоре освещены последние данные литературы о взаимосвязях ОА и МС, показана роль снижения массы тела на клинические проявления ОА.
Проблема остеоартроза (ОА) занимает одно из ведущих мест в современной ревматологии, поскольку ОА – это самое частое заболевание среди всех ревматических болезней: на его долю приходится 60–70% [1]. Помимо высокой распространенности ОА характеризуется прогрессирующим течением, приводящим к преждевременной потере трудоспособности. Среди всех причин инвалидности ОА находится на 6-м месте, а в долгосрочной перспективе (к 2020 г.) прогнозируют, что ОА переместится в этом списке на 4-е место [2].
По влиянию на состояние здоровья ОА занимает 4-е место среди женщин и 8-е – среди мужчин среди всех заболеваний. В США ОА страдают 13,2 млн человек, в Европе – 14,5 млн, в Японии – 6,6 млн. В России ОА выявлен у 15 млн человек, причем распространенность этого заболевания за последние годы возросла на 35% [3]. По последним данным ФГБНУ НИИР им. В.А. Насоновой, распространенность ОА среди населения России составила 13% (13 тыс. больных на 100 тыс. населения), что значительно выше результатов официальной статистики, где зарегистрировано в 5 раз меньше больных ОА (2720 на 100 тыс. населения) [4].
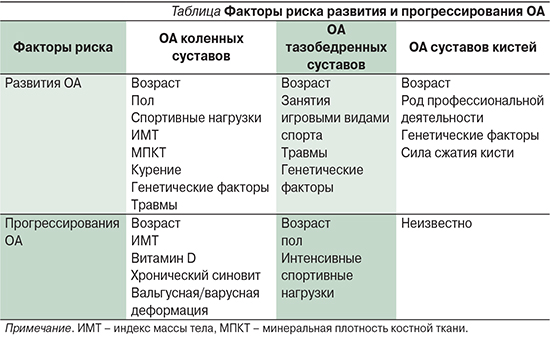
ОА рассматривается как заболевание, затрагивающее все элементы сустава, в первую очередь хрящ, а также субхондральную кость, синовиальную оболочку, связки, капсулу, околосуставные мышцы. Однако, несмотря на массу исследований, этиология ОА до конца не установлена [5]. Полагают, что ОА представляет собой многофакторное заболевание с определенными фенотипами, на развитие и прогрессирование которого влияет множество факторов [6] (см. таблицу).
В настоящее время представление об ОА как исключительно дегенеративном поражении хрящевой ткани ушло в прошлое, данные последних лет свидетельствуют о главенствующей роли воспаления в патогенезе ОА [7]. В связи с этим изменилось и определение ОА, которое подчеркивает, что развитие болезни обусловлено клеточным стрессом и деградацией экстрацеллюлярного матрикса, которые возникают при макро- или микроповреждениях, и при этом активируются ненормальные адаптивные восстановительные ответы, включая провоспалительные пути иммунной системы, костное ремоделирование и образование остеофитов.
Анализ постоянно растущего числа работ свидетельствует об особой роли цитокинов в патогенезе ОА, синтез которых может изменяться в зависимости от продолжительности и тяжести заболевания [10].
Среди многих представителей цитокинов наибольшее значение имеют интерлейкин-1β (ИЛ-1β), фактор некроза опухоли α (ФНО-α), ИЛ-6, -15, -17 и -18. Одним из ключевых цитокинов в патогенезе ОА считается ИЛ-1β: он вызывает воспалительные реакции и катаболические процессы как самостоятельно, так в сочетании с другими цитокинами [8]. При стимуляции ИЛ-1β хондроциты синтезируют протеолитические ферменты (матриксные металлопротеиназы – ММР), вызывающие деградацию коллагена и протеогликана хряща [7]. Кроме того, ИЛ-1β стимулирует выработку активных форм кислорода, которые генерируют образование пероксидов и гидроксилированных радикалов, способных непосредственно повреждать суставной хрящ [9]. У больных ОА высокие уровни ИЛ-1β обнаруживаются как в синовиальной жидкости, так и в синовиальной оболочке, хрящах, а также в субхондральном слое кости [10].
Интересно, что в мета-воспалении при ОА участвует и жировая ткань. Хорошо известно, что избыточная масса тела служит фактором риска не только развития, но и прогрессирования ОА, и здесь как принимается во внимание избыточная нагрузка на суставы при ожирении, так и подчеркивается роль жировой ткани как метаболического органа, т.е. существует взаимосвязь ОА с метаболическими изменениями, происходящими при ожирении. При одном и другом состоянии наблюдается повышенная циркуляция системных воспалительных маркеров, например, таких как С-реактивный белок, ИЛ-1β и ФНО-α [13]. Кроме того, лептин, провоспалительный гормон, вырабатываемый макрофагами жировой ткани, является ключевым медиатором метаболических нарушений при ОА. Недавние исследования показали, что лептин способен вызывать синтез ММП, участвующих в повреждении хряща при ОА [14]. При ОА различные ММП, в т.ч. коллагеназа, стромелизин, желатиназа, мембранные протеиназы и металлоэластазы, обнаруживаются в хряще в повышенных концентрациях по сравнению с нормой, причем степень повышения активности этих ферментов, как правило, коррелирует со степенью повреждения хрящевой ткани [7].
Установлено, что ожирение часто предшествует развитию ОА коленных суставов и увеличивает риск прогрессирования рентгенологических изменений в коленных суставах [15]. По данным мета-анализа, проведенного L. Jiang и соавт., увеличение ИМТ на каждые 5 единиц вызывает увеличение риска развития ОА коленных суставов на 35% [16].
В большом исследовании, проводимом в Канаде в течение 22 лет, показано, что риск развития ОА коленных суставов у лиц с ИМТ>30 кг/м² был в 7 раз выше, чем при ИМТ 27 кг/м² достоверно связан с прогрессированием рентгенологических проявлений гонартроза: сужением суставной щели и увеличением стадии ОА по Kellgren–Lawrence [18].
Исследования, проведенные в Великобритании, показали тесную связь между ожирением (ИМТ>30 кг/м²) и рентгенологическими проявлениями ОА коленных суставов. Были изучены рентгенограммы коленных суставов 785 пар женщин-близнецов (средний возраст – 54,5±7,8 года). Тибиофеморальный ОА рентгенологически оценивался по классификации Kellgren–Lawrence. Обнаружена положительная связь между высоким ИМТ и ОА коленных суставов [19].
Кроме того, в ряде работ продемонстрировано влияние ожирения на ОА тазобедренных суставов. Норвежские исследователи изучали связь ожирения (ИМТ>30 кг/м²) с ОА тазобедренных суставов в общей популяции в течение 10 лет и установили, что при ожирении частота развития коксартроза на 5,8% выше, чем у лиц с нормальной массой тела [20]. Систематический обзор, включивший 12 исследований, выявил ассоциацию ожирения с ОА тазобедренных суставов, причем сильнее эта зависимость проявлялась среди больных с наличием клинических и рентгенологических признаков коксартроза [21].
Пациенты с избыточной массой тела и ожирением имеют высокий риск развития ОА суставов кистей. В Норвегии в 10-летнем исследовании пациентов с высоким ИМТ заболеваемость ОА суставов кистей была на 5,6% выше, чем при нормальных его значениях, причем женщины заболевали достоверно чаще, чем мужчины. Показано, что ожирение – это значимый независимый предиктор развития ОА суставов кистей [21]. В Мичигане при обследовании 1276 человек в возрасте от 50 до 74 лет в течение 23 лет было обнаружено, что ожирение в значительной степени связано как с заболеваемостью ОА суставов кистей, так и с его тяжестью [22].
Ожирение само по себе связано не только с развитием ОА, но и с другими тяжелыми сопутствующими заболеваниями, к которым относятся сахарный диабет 2 типа (СД2), артериальная гипертензия (АГ), дислипидемия, атеросклероз и связанные с ним заболевания, гиперурикемия и др. Среди больных ОА в свою очередь наблюдается высокий уровень коморбидности по сравнению с другими ревматическими заболеваниями.
Согласно данным Международной диабетической федерации IDF (International Diabetes Federation), МС характеризуется увеличением массы висцерального жира и снижением чувствительности периферических тканей к инсулину [24].
Основной признак МС – центральный (абдоминальный) тип ожирения, который характеризуется увеличением окружности талии (ОТ) более 80 см у женщин и более 94 см у мужчин. К дополнительным критериям МС относятся АГ (артериальное давление АД≥130/85 мм рт.ст.), повышение уровня триглицеридов (≥1,7 ммоль/л), снижение уровня липопротеидов высокой плотности ( 3,0 ммоль/л, гипергликемия натощак (глюкоза в плазме крови натощак ≥6,1 ммоль/л), нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ≥7,8 и ≤11,1 ммоль/л). Наличие у пациента центрального ожирения и двух дополнительных критериев служит основанием для диагностики МС [24].
Основное звено в патогенезе МС – инсулинорезистентность, возникающая, когда клетки в организме (печени, скелетных мышцах и жировой ткани) становятся менее чувствительными и в конечном итоге устойчивыми к инсулину, гормону, который производится β-клетками в поджелудочной железе, чтобы облегчить поглощение глюкозы. Вследствие инсулинорезистентности глюкоза больше не поглощается клетками тканей и остается в крови, вызывая повышенную продукцию инсулина (гиперинсулинемия). В дальнейшем клетки поджелудочной железы вследствие апоптоза или истощения перестают вырабатывать инсулин, в результате чего развивается гипергликемия [24].
Изучение частоты МС в США показало: МС и его компоненты встречались значительно чаще среди больных ОА по сравнению с лицами без ОА (59 и 23% соответственно) [25]. АГ была выявлена у 75% пациентов с ОА и у 38% без ОА, абдоминальное ожирение (63 против 38% соответственно), гипергликемия (30 против 13% соответственно), повышение уровня триглицеридов (47 против 32% соответственно), снижение уровня липопротеидов высокой плотности (44 против 38% соответственно).
В Японии при исследовании 1690 человек (596 мужчин, 1094 женщины) в течение 3 лет было отмечено, что частота ОА коленных суставов и степень прогрессирования значительно возрастают с увеличением компонентов МС [26].
Так, C.A. Karvonen-Gutierrez, обследовав 482 женщины среднего возраста (47 лет), установил, что распространенность ОА у женщин без ожирения (ИМТ 30кг/м²), но без компонентов МС – 12,8%, а при ожирении в совокупности с компонентами МС распространенность ОА составила 23,2%. Кроме того, среди этих пациентов наблюдалась выраженная интенсивность болей в коленных суставах и более тяжелое нарушение функции сустава [27].
Гипергликемия и ОА взаимодействуют как на локальном, так и на системном уровнях; локальные эффекты окислительного стресса и гликирования конечных продуктов усугубляют поражение хрящевой ткани, а накопление токсичных продуктов гликолиза может способствовать прогрессированию ОА [26]. S. Dahaghin и соавт. выявили ассоциацию СД с ОА суставов кистей у людей в возрасте 55–62 лет, причем более высокая частота ОА суставов кистей была отмечена в подгруппе пациентов с сочетанием избыточной массы тела, СД и АГ [28]. СД2 утяжеляет деструктивные процессы в тканях коленных суставов. В исследовании, проведенном в Ярославле, изучались 2 группы пациентов: с ОА (n=224) и c ОА и СД2 (n=162). Оказалось, что при наличии СД2 в 2 раза чаще выявляется III стадия ОА (р=0,001), в 1,4 раза более выражен остеофитоз в латеральном (р 30 кг/м²) преобладал ОА II–III стадий (у 97%), у 80% пациентов с ИМТ>40 кг/м² установлены III–IV стадии ОА [31].
Кроме того, существуют данные о влиянии гиперхолестеринемии и гипертриглицеридемии на риск возникновения и прогрессирования ОА. Есть несколько механизмов, с помощью которых сосудистая патология может способствовать развитию ОА. Дистальные отделы костей особенно восприимчивы к сосудистой патологии. Венозная окклюзия в результате застоя крови в мелких сосудах, лежащих в основе пластины хряща, совместно с АГ, повышенной свертываемостью крови и/или микроэмболией может приводить к ишемии субхондральной кости, что в свою очередь способствует резорбции субхондральной кости и повреждению хряща [32].
В ряде недавних исследований установлены гендерные различия в патогенезе ОА и МС. Как правило, инсулинорезистентность в большей степени связана с висцеральным типом ожирения – одним из ключевых сердечно-сосудистых факторов риска для мужчин. Кроме того, первичная инсулинорезистентность ассоциируется с высоким риском возникновения [33] и прогрессирования ОА коленных суставов у мужчин [34]. СД способствует прогрессированию ОА коленных суставов у мужчин [34]. У женщин, страдающих ожирением, увеличение на 5 мкг/л лептина в 1,28 раза увеличивает тяжесть прогрессирования ОА по рентгенологическим признакам [33].
Все вышесказанное подчеркивает необходимость включения в план ведения больного ОА мероприятий, направленных не только на снижение массы тела, но и на основные патогенетические звенья МС [35], результатом которых будет уменьшение симптоматики ОА.
Немедикаментозное лечение ОА, диета и физические упражнения должны быть направлены на снижение массы тела.
Национальный институт здоровья (NIH – National Institutes of Health) США опубликовал клинические рекомендации по лечению избыточной массы тела у взрослых, основной принцип которых заключается в необходимости уменьшения массы тела на 10% по сравнению с исходной [36].
Как правило, при соблюдении диеты и выполнении физических упражнений масса тела снижается только на 5% от первоначального, но полученный результат большинству людей не удается сохранить в течение длительного времени [37].
Добавление медикаментозной терапии к гипокалорийной диете не только облегчает потерю массы тела, но и может предотвратить ее повторное увеличение, которое наблюдается при использовании только гипокалорийной диеты [38]. Согласно Европейским [39] и Российским [40] клиническим рекомендациям по лечению ожирения, назначение медикаментозных препаратов целесообразно тем пациентам с ожирением (ИМТ>30 кг/м²), которые не могут достичь или удержать клинически значимую степень снижения массы тела при использовании диеты и физических нагрузок, включая пациентов с факторами риска развития СД2. Среди препаратов, зарегистрированных в РФ в качестве лекарственного средства для лечения ожирения, рекомендуется орлистат [39]. Механизм действия орлистата основан на подавлении активности желудочно-кишечных липаз, что приводит к уменьшению всасывания жира в кишечнике, а в сочетании с гипокалорийной диетой вызывает значимое снижение массы тела [38].
В ФГБНУ НИИ ревматологии им. В.А. Насоновой подтверждена эффективность орлистата в отношении снижения массы тела у пациентов с ОА коленных суставов. В исследовании участвовали 50 женщин в возрасте 45–65 лет с ОА коленных суставов II–III стадий по Kellgren–Lawrence и ожирением (ИМТ>30 кг/см²), рандомизированных в 2 группы: 1-я группа (25 больных) принимала препарат орлистат в дозе 120 мг (1 капсула) 3 раза в сутки в течение 6 месяцев в комплексе с гипокалорийной диетой и физической активностью; 2-я группа (25 больных) находилась на немедикаментозной терапии ожирения (гипокалорийная диета и физическая активность).
Через 6 месяцев наблюдения снижение массы тела оказалось более выраженным в 1-й группе и составило 10,07% (в среднем на 10,5 кг) по сравнению с больными, которые находились только на гипокалорийной диете, у которых масса снизилась на 0,88% (в среднем на 1 кг). Было отмечено достоверное снижение параметров индекса WOMAC (Western Ontario and McMaster Universities Arthritis Index): уменьшение боли, скованности и улучшение функциональных способностей коленных суставов у больных, находившихся на терапии орлистатом. Кроме того, у этих пациентов отмечено значимое улучшение качества жизни по сравнению с больными с меньшей потерей массы тела (р 0
Читайте также:


