Маркер опухоли мягких тканей
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
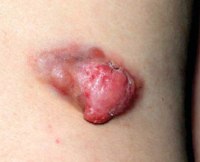
Саркомы – это группа различных по клиническим и морфологическим признакам злокачественных новообразований, которые происходят из любых неэпителиальных тканей. В этом заключено основное отличие саркомы от рака, ростком которого являются эпителиальные клетки.
Риск возникновения данного заболевания повышается при некоторых генетических патологиях:
- синдром базальноклеточных невусов;
- синдром Вернера;
- синдром Гарднера;
- туберозный склероз;
- кишечный полипоз т.д.
А болезнь Реклингхаузена, или нейрофиброматоз 1 типа, является наиболее распространенным наследственным заболеванием, которое осложняется опухолевыми процессами. При этой патологии нейрофибросаркомы возникают примерно в 15% случаев. Описаны также случаи возникновения саркомы в зоне воздействия ионизированного излучения, как патологического, так и с лечебными целями.
Гистоморфологическая классификация сарком
Зачастую точно определить, из какой именно ткани возникла конкретная опухоль, довольно сложно. Кроме того, выделяется большая группа опухолей, которые имеют неясный гистогенез.
Наиболее часто диагностируются фибросаркомы, липосаркомы и рабдомиосаркомы. Вторыми по частоте встречаемости следует злокачественная гистиоцитарная саркома мягких тканей и саркомы неясного генеза. Ангиосаркомы, синовиальные саркомы, злокачественные шванномы, лейомиосаркомы и прочие типы наблюдаются редко.
Опухоли жировых тканей
Промежуточные (местно-агрессивные) формы:
- атипичный липоматоз;
- высокодифференцированные липосаркомы.
Злокачественные формы:
- недифференцированные липосаркомы;
- миксоидные липосаркомы;
- круглоклеточные липосаркомы;
- полиморфная липосаркома;
- липосаркомы смешанного типа;
- липосаркомы без признаков дифференцировки.
Миофибропластические и фибробластические опухоли
Промежуточные, или местно-агрессивные, формы:
- поверхностные подошвенные или ладонные фиброматозы;
- фиброматозы десмоидного типа;
- липофиброматозы.
Редко метастазирующие формы:
- солитарные фиброзные опухоли;
- гемангиоперицитомы, включая липоматозные гемангиоперицитомы;
- воспалительные миофибропластические опухоли;
- миофибропластические саркомы низкой степени дифференцировки;
- миксоидные фибропластические саркомы;
- инфантильные фибросаркомы.
Злокачественные формы:
- зрелые фибросаркомы;
- миксофибросаркомы;
- медленнорастущие фибромиксоидные саркомы;
- гиалинизирующие веретеноклеточные саркомы;
- склерозирующие эпителиоидные фибросаркомы.
Фиброгистиоцитарные опухоли
Промежуточные, или местно-агрессивные формы:
- плеоморфные фиброгистиоцитарные опухоли;
- гигантоклеточные саркомы мягких тканей.
Злокачественные формы:
- недифференцированные плеоморфные саркомы;
- недифференцированные плеоморфные саркомы с гигантскими клетками;
- недифференцированные плеоморфные саркомы с преобладанием воспаления.
Саркома мышечной ткани
Опухоли скелетных мышц:
- эмбриональные веретеноклеточные и анапластические рабдомиосаркомы;
- альвеолярные солидные и анапластические рабдомиосаркомы;
- плеоморфные рабдомиосаркомы.
Саркома гладких мышц: лейомиосаркома, включая и кожные формы.
Периваскулярные опухоли
- Злокачественные гломусные опухоли;
- миоперицитомы.
Сосудистые опухоли
Промежуточные, или местно-агрессивные формы: гемангиоэндотелиомы типа Капоши.
Редко метастазирующие формы:
- ретиформные гемангиоэндотелиомы;
- папиллярные внутрилимфатические ангиоэндотелиомы;
- смешанные гемангиоэндотелиомы;
- саркомы Капоши.
Злокачественные формы:
- эпителиоидные гемангиоэндотелиомы;
- гемангиосаркома мягких тканей.
Костно-хрящевые опухоли
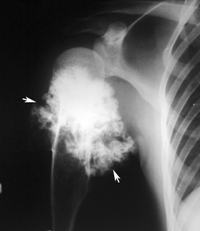
Опухоль костной ткани, или остеогенная саркома:
- обыкновенные: хондробластические, фибробластические, остеобластические;
- телеангиоэктатические;
- мелкоклеточные;
- центральные, имеющие низкую злокачественность;
- вторичные;
- параоссальные;
- периоссальные;
- поверхностные, имеющие высокую злокачественность.
Опухоли хрящевой ткани (хондросаркомы):
- центральные, первичные и вторичные;
- периферические;
- дедифференцированные;
- мезенхимальные;
- светлоклеточные.
Опухоли неясного происхождения
Редко метастазирующие формы:
- ангиоматоидные фиброзные гистиоцитомы;
- оссифицирующие фибромиксоидные опухоли;
- миоэпителиомы;
- парахондромы.
Злокачественные формы:
- синовиальная саркома;
- эпителиоидные саркомы;
- альвеолярная мягкотканная саркома;
- светлоклеточная саркома мягких тканей;
- внескелетные миксоидные хондросаркомы хордоидного типа;
- примитивные нейроэктодермальные опухоли (PNET);
- внескелетные саркомы Юинга;
- десмопластические мелко- и круглоклеточные опухоли;
- внепочечные рабдоидные опухоли;
- злокачественные мезенхимомы;
- миелоидная саркома;
- новообразования, имеющие периваскулярную эпителиоидно-клеточную дифференцировку (PEComa);
- светлоклеточные миомеланоцитарные опухоли;
- интимальные саркомы.
Каждый из названных гистологических типов отличается не только своими морфологическими признаками и гистогенезом, но также имеет определенное клиническое течение. Конечно, подобное многообразие морфологических форм сарком вызывает значительную трудность в их диагностике.
Еще больше гистологическое типирование сарком осложняется в детском возрасте. Обусловлено это тем, что у детей большая часть опухолей происходит из примитивных эмбриональных клеток (эмбриональная саркома) или клеток, которые еще не завершили свое гистогенетическое становление. Такие опухоли, имея большое разнообразие морфологических форм, зачастую не имеют четких признаков гистотиповой дифференцировки, характеризуются резкой анаплазией и вариабельностью клеточного состава. Вместе с тем часто наблюдается и обратная картина: новообразования различного происхождения часто имеют сходные признаки строения. Все это делает типирование опухолей значимой проблемой.
Распределение основных типов сарком по преобладанию в их составе
клеток определенной формы
Рутинная оценка сарком начинается с оценки общего строения опухоли, которая базируется, прежде всего, на ее "узнаваемости" при микроскопии. Описывается общая картина преобладания клеток определенной формы.
Опухоли, состоящие из округлых клеток:
- нейробластома;
- саркома Юинга/PNET;
- мезенхимальная хондросаркома;
- эмбриональная и альвеолярная рабдомиосаркома;
- десмопластичная круглоклеточная саркома;
- круглоклеточная липосаркома;
- малигнизированная рабдоидная опухоль.
Опухоли, состоящие из веретенообразных клеток:
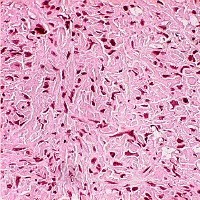
- фибросаркома;
- веретеноклеточная рабдомиосаркома;
- лейомиосаркома;
- злокачественные опухоли периферических нервных стволов;
- веретеноклеточная ангиосаркома;
- монофазная веретеноклеточная синовиальная саркома.
Опухоли, состоящие из эпителиоидных клеток:
- эпителиоидноклеточная синовиальная саркома;
- эпителиоидноклеточная ангиосаркома;
- эпителиоидноклеточные злокачественные опухоли нервного ствола;
- склерозирующая эпителиоидноклеточная фибросаркома;
- злокачественная фиброзная гистиоцитома;
- эпителиоидноклеточная лейомиосаркома.
Остальные гистоморфологические типы сарком, входящие в классификацию, имеют преимущественно смешанную форму клеток. Кроме того, иногда форма злокачественно перерожденных клеток не поддается описанию и определению. В таких случаях опухоль классифицируется как плеоморфная саркома.
Типирование сарком по степени дифференцировки клеток
После определения гистологического типа саркомы оценивается степень ее дифференцировки (G). При этом учитываются такие критерии, как клеточный полиморфизм, митотическая активность и др.
Степени дифференцировки сарком:
- GX – степень дифференцировки клеток определить невозможно;
- G1 – саркома высокодифференцирована;
- G2 – саркома дифференцирована умеренно;
- G3 – саркома низкодифференцирована;
- G4 – недифференцированая саркома.
Дифференциация клеток определяется возможностью установить, к какому именно виду ткани относится конкретная клетка. Чем ниже степень дифференциации клеток, составляющих опухоль, тем более выраженную злокачественность имеет данная саркома. Это напрямую связано с шансами раннего метастазирования в другие органы и ткани. Кроме этого, чем выше злокачественность саркомы, тем быстрее она увеличивается в размерах, тем большую инфильтративность имеет ее рост и тем стремительнее прогрессирует заболевание.
Иммуногистохимическое (ИГХ) типирование сарком
Иммуногистохимическое исследование позволяет:
- провести гистогенетическое типирование опухоли и определить нозологический вариант новообразования;
- определить органопринадлежность первичной опухоли при метастазах неизвестного происхождения;
- определить степень злокачественной трансформации клеток опухоли;
- прогнозировать течение опухолевого заболевания;
- прогнозировать чувствительность и резистентность опухолевых клеток к химиотерапевтическим препаратам и лучевой терапии;
- определить возможность проведения узконаправленной терапии.
Сегодня при верификации сарком используется несколько десятков основных ИГХ-маркеров. Поскольку практически нет ИГХ-маркеров, которые были бы специфичными только для какого-то конкретного типа опухоли, для типирования новообразования должен использоваться набор из нескольких антител.
1. В группу опухолей, состоящих из мелких округлых клеток, относятся новообразования, наиболее часто встречающихся в детском возрасте. Они обычно имеют низкую дифференцировку и высокую степень злокачественности.
- Бластная нейрогенная саркома. Все ее разновидности экспрессируют нейрональные маркеры, такие как нейронспецифическая энолаза (NSE), синаптофизин, хромогранины (CgA), СD56, СD57.
- Рабдомиосаркома. Все ее виды экспрессируют виментин, десмин и мышечный специфический актин (MA), а также СD99. Основными же ее специфическими маркерами является миогенные ядерные регуляторные протеины – миогенин и МуоD1.
- Основными диагностическими маркерами для саркомы Юинга и примитивной нейроэктодермальной опухоли являются СD99 (продукт гена MIC2) и Fli-1. Также клетки этих опухолей экспрессируют виментин, сравнительно часто - синаптофизин, в редких случаях - цитокератины (CK), CD57.
- Клетки мезенхимальной хондросаркомы экспрессируют виментин, S-100 протеин и, реже, СD57.
- Мелкоклеточная остеосаркома характеризуется экспрессией виментина, остеокальцина, может наблюдаться экспрессия СD57 и СD99.
- Мелкоклеточная низкодиференцированная синовиальная саркома мягких тканей, как и другие типы синовиальных сарком (монофазная веретеноклеточная синовиальная саркома, эпителиоидная синовиальная саркома, дедиференцированная полиморфноклеточная саркома), экспрессируют CK, эпителиальный мембранный антиген (EMA), виментин, коллаген IV типа.
- Десмопластическая мелкокруглоклеточная опухоль - очень редкий вид чрезвычайно агрессивного новообразования. Обычно клетки этой опухоли экспрессируют эпителиальные (СК и ЕМА), мезенхимальные (виментин), миогенные (десмин) и нейральные (СD56, NSE) маркеры.
2. К опухолям, состоящим из веретенообразных клеток, прежде всего относятся новообразования, развивающиеся из производных мезенхимы.
- Фибросаркома и инфантильная фибросаркома не имеют специфического иммунопрофиля, но всегда положительны к виментину, а иногда – и к SMA.
- Клетки лейомиосаркомы, как правило, экспрессируют виментин, десмин, МА, SMA, кальдесмон.
- Злокачественная опухоль оболочки периферического нервного ствола экспрессирует виментин, коллаген IV типа и СD57.
- Сосудистая эпителиоидно- и веретеноклеточная саркома, а также саркома Капоши экспрессируют Fli-1, CD31, CD34 и фактор фон Виллебранта (фактор VIII связывающий протеин).
- Гемангиоперицитома и солитарная фиброзная мягкотканая саркома относятся к новообразованиям, пограничным по своему потенциалу злокачественности. Их клетки обычно экспрессируют CD34, CD99, а также bcl-2.
3. Опухоли, состоящие из эпителиоидных клеток, характеризуются признаками, присущими специализированным клеточным элементам соединительной ткани (миофибробластам, эпителиоидным клеткам сосудов, миоэпителиальным клеткам).
- Злокачественная воспалительная миофибробластическая опухоль (воспалительная фибросаркома) демонстрирует иммунореактивность с кальпонином, SMA и десмином.
- Злокачественная фиброзная гистиоцитарная саркома характеризуется коэкспрессией виментина, EMA и CD68, в некоторых случаях наблюдается экспрессия MA, однако не экспрессируются миогенин и МиоD1.
- Периваскулярные эпителиоидноклеточные опухоли (PEC-омы) – это группа опухолей, к которым относятся: ангиомиолипома почек (и других локализаций), светлоклеточная саркома легких ("сахарная" опухоль), лимфангиолейомиоматоз и др. Клетки этих опухолей демонстрируют меланоцитарный иммунофенотип (положительны к: Мелан-А, НМВ45, тирозиназе) с коэкспрессией SMA.
- Эпителиоидная саркома коэкспрессирует виментин и СК.
Помимо гистогенетического типирования опухолей, принципиально важной задачей ИГХ является определение степени злокачественности опухоли и выявление прогностических маркеров. Это позволяет намного более обоснованно и достоверно прогнозировать течение болезни, а также чувствительность опухоли к лечебным средствам.
Злокачественные опухоли продуцируют особые белки, которые могут быть обнаружены в кровяном русле и могут служить своеобразными маркерами как самого факта наличия опухоли, так и в некоторых случаях ее размеров. Специфические опухолевые маркеры, как правило, являются химерными белковыми продуктами, связанными со злокачественным преобразованием, при котором онкоген обычно транслоцируется и сливается с активным промотором отдельного гена.
Определение опухолевых маркеров играет заметную роль в диагностике таких заболеваний, как рак семенников и гермогенный рак яичников, хориокарцинома и гепатома. В идеале опухолевый маркер должен обладать следующими свойствами:
1. Опухоль определенного типа должна всегда продуцировать конкретный маркер. К сожалению, большинство маркеров не обладает этим свойством. При тератобластомах а-фетопротеин (АФП) и хорионический человеческий гонадотропин (ХГЧ) присутствуют в сыворотке 75% больных, а ХЧГ обнаруживается почти при всех хориокарциномах. Кроме карциноэмбрионального антигена (КЭА) и кислой фосфатазы, почти все другие маркеры не могут служить для точного определения стадии развития заболевания.
2. Маркер должен позволять точно определять массу опухоли. Это свойство характерно для b-субъединицы ХГЧ и АФП при гермогенных опухолях и в меньшей степени для простато-специфичного антигена (ПСА) при раке простаты. Степени развития колоректального рака, продуцирующего КЭА, и рака яичников, продуцирующего СА-125, также могут определяться по уровню содержания в плазме крови соответствующих маркеров. Множество других видов рака продуцируют свои специфические маркеры либо в крайне малых количествах, либо слишком интенсивно, чтобы их концентрацию можно было привязать к стадии развития заболевания.
3. Маркер должен продуцироваться при рецидивах заболевания или при метастатическом росте. Одна из основных областей использования маркеров в диагностике — ранее обнаружение рецидивов заболевания. Так, при тератомах возникновение рецидивов всегда сопровождается ростом содержания в плазме либо ХЧГ, либо АФП, даже если первичная опухоль продуцирует оба этих маркера. Маркер-негативные рецидивы (при первично-позитивной опухоли) встречаются крайне редко. Аналогично, повышение уровня КЭА, ПСА или СА-125 является клиническим доказательством наличия рецидивов рака кишечника, простаты или яичников соответственно.

4. Опухоль должна поддаваться терапевтическому воздействию. Если опухоль не поддается лечению, в раннем обнаружении рецидивов мало смысла. Например, рецидивы рака поджелудочной железы практически неизлечимы и их ранняя диагностика просто ставит пациента перед фактом. В противоположность этому, повышение уровня АФП или ХЧГ при тератомах является четким сигналом к проведению полного исследования для назначения соответствующего последующего лечения, которое во многих случаях может оказаться успешным.
5. Маркер должен легко детектироваться и быть специфичным к данному заболеванию. Некоторые маркеры, такие как АФП и ХЧГ (а-субъединица), практически не обнаруживаются в организме, если в нем не присутствует опухоль. В то же время следует отметить, что уровень АФП может возрастать в период беременности и при некоторых заболеваниях печени. Уровень КЭА может возрастать как при колоректальном раке и раке поджелудочной железы, так и при воспалительных заболеваниях кишечника. Повышение уровня КЭА было также зарегистрировано у курящих людей.
Введение в клиническую практику чувствительных методов радиоиммунологического анализа сделало определение уровней АФП и ХЧГ стандартной процедурой при диагностике гермогенных раков и гепатом. И наоборот, содержание некоторых пептидных гормонов (например, антидиуретического гормона (АДГ)) чрезвычайно трудно оценить количественно.
6. В идеале методика определения маркера должна быть достаточно чувствительна, а анализы должны быть относительно дешевыми, чтобы их можно было использовать в мониторинге больших групп населения. Рак яичника, как правило, обнаруживается уже на запущенных неоперабельных стадиях, и смертность от него выше совокупной смертности от раков матки и шейки матки. В этих условиях использование маркера СА-125 может стать обещающим подходом для всеобщей диспансеризация населения.
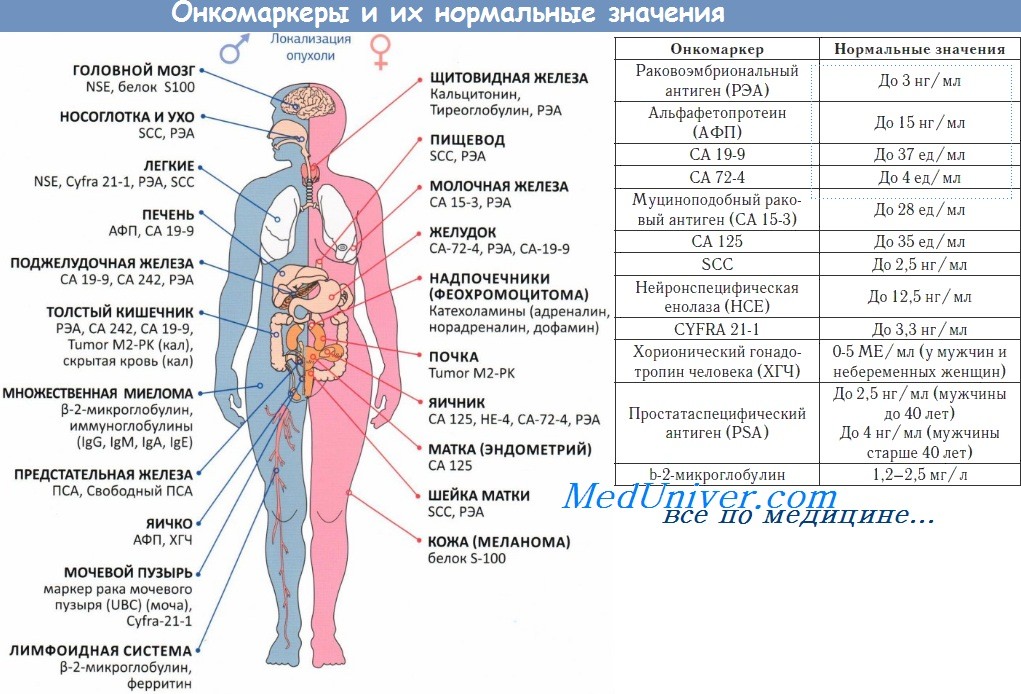
Примеры опухолевых маркеров представлены в таблице. Некоторые из них уже нашли свое применение в клинической практике и потому требуют более подробного рассмотрения.
Видео онкомаркеры в норме и при раке
- Вернуться в оглавление раздела "Онкология"
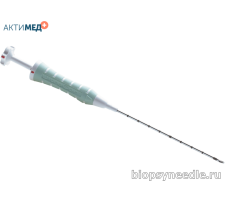
Маркер Gel Mark UltraCor GMUTC005SS для постановки напрямую или через коаксиальную иглу. Набор для постановки длиной 10 см и диаметром 14 Гейдж имеет кончик с насечкой для визуализации под УЗИ, и содержит 4 подушечки из молочной и полигликолиевой кислоты и в дистальной позиции один рентгенконтрастный маркер. Материал маркера – сталь 316L. Подушечки молочной и полигликолиевой кислоты обеспечивают ультразвуковую видимость в течение 4-6 недель, а через 12 недель постепенно растворяются.
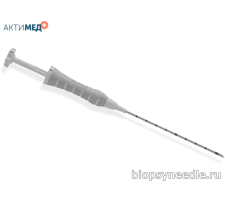
Маркер SenoMark UltraCor MRI SMUCMRI14GSS для постановки напрямую или через коаксиальную иглу. Набор для постановки длиной 13 см и диаметром 14 Гейдж имеет кончик с насечкой для визуализации под УЗИ, и содержит 3 подушечки из полигликолиевой кислоты и в центре один рентгенконтрастный маркер. Материал маркера – сталь 316L. Подушечки полигликолиевой кислоты обеспечивают ультразвуковую видимость в течение 3 недель, а через 12 недель постепенно растворяются.

Маркер SenoMark UltraCor MRI SMUCMRI14GT для постановки напрямую или через коаксиальную иглу. Набор для постановки длиной 13 см и диаметром 14 Гейдж имеет кончик с насечкой для визуализации под УЗИ, и содержит 3 подушечки из полигликолиевой кислоты и в центре один рентгенконтрастный маркер. Материал маркера – титан. Подушечки полигликолиевой кислоты обеспечивают ультразвуковую видимость в течение 3 недель, а через 12 недель постепенно растворяются.
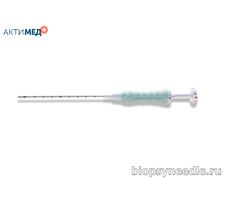
Маркер Gel Mark UltraCor GMUTC005T для постановки напрямую или через коаксиальную иглу. Набор для постановки длиной 10 см и диаметром 14 Гейдж имеет кончик с насечкой для визуализации под УЗИ, и содержит 4 подушечки из молочной и полигликолиевой кислоты и в дистальной позиции один рентгенконтрастный маркер. Материал маркера – титан. Подушечки молочной и полигликолиевой кислоты обеспечивают ультразвуковую видимость в течение 4-6 недель, а через 12 недель постепенно растворяются.
Аннотация
Установка маркера опухоли после визуально-контролируемой биопсии молочной железы стало неотъемлемой частью клинической практики. Наличие маркера помогает различить неоднократно пунктированные новообразования в молочной железе, предотвращает повторную биопсию доброкачественной опухоли, обеспечивает мультимодальную корреляцию, указывает предоперационную локализацию и помогает подтвердить необходимость хирургического вмешательства. На данный момент, среди многих мировых производителей, доступно огромное количество маркеров для определения опухолей молочной железы, различной формы, состава и с био-рассасывающимися компонентами. Данный обзор предназначен для Российских маммологов, с целью ознакомления с уже имеющимися, на сегодняшний день, зарегистрированных продуктов и их применение на практике.
1. Введение
Визуальная идентификация непальпируемой опухоли послужила началом развития визуально-контролируемой биопсии и ее локализации. Минимально инвазивная технология позволила устанавливать надежный патологический диагноз, и в клинической практике практически заменила хирургическое иссечение для первоначальной оценки опухоли [1]. В виду того, что более 60% опухолей оказываются доброкачественными, такое изменение в практике помогло подавляющему большинству пациентов с неопределенным новообразованием молочной железы избежать хирургического вмешательства, и в то же время, снижая осложнения и стоимость процедуры[2–4]. Также образец, забранный, с помощью трепанобиопсии сохраняет структуру ткани, биологические особенности злокачественных образований, такие как статус рецептора.
Так как клиническая практика помогла развить визуально-контролируемую биопсию, установка маркера для идентифицирования места биопсии стала жизненно важным компонентом данной процедуры. Изначально установка маркера была предназначена для случаев, когда цель не была больше видна для последующей биопсии [5]. Широкое распространение произошло в связи с усовершенствованием навыка надежного забора образца небольших новообразований в комбинации с развитием биопсийных устройств большего диаметра, которые могут затемнить или просто удалить видимый компонент цели. Более того, установка маркера доказала чрезвычайную важность в оценке состояния заболевания, когда производилась биопсия более, чем одного места в одной железе, позволяя делать корреляцию между модальностями, предотвращая повторную биопсию доброкачественных образований, и позволяет точно локализовать последующую неоадъювантную химиотерапию. В виду того, что они легко определяются на рентгене, маркеры опухоли позволяют быстро подтверждать нужную цель иссечения при хирургической операции и могут направлять гистологов в необходимую зону в пределах объекта мастэктомии.
2. Цель установки маркера опухоли
2.1. Хирургическая локализация
Установка маркера опухоли позволяет произвести точную повторную идентификацию и точную локализацию пунктированной опухоли. До начала использования клипсы, если результат игольной биопсии давал основание проводить хирургическое иссечение, нужная опухоль локализовалась с помощью идентификации остаточного заболевания на картинке, локализуя пост-биопсийную гематому, либо используя окружающие ориентиры в молочной железе. Данный метод приводил к иссечению большего объекта для того, чтобы увеличить вероятность успешного иссечения цели.
2.2. Интермодальная корреляция
Клипса играет важную роль в корреляции результатов, полученных визуальными методами. Это характерно для патологий, полученных в ходе маммографии и МРТ, требующих дальнейший осмотр ультразвуком. Биопсия молочной железы под ультразвуковым контролем предпочтительный метод забора пробы пораженного участка, поскольку он наиболее удобен для пациента, быстрый для врача, отображается в режиме реального времени и более эффективен с точки зрения затрат, чем стереотаксическая, МРТ и молекулярная биопсия. Однако, не зависимо от того какая модальность была выявлена как сомнительное поражение, есть вероятность того, что проба повреждения не соответствует тому подозрительному объекту. В связи с этим размещение клипсы с постбиопсийной картиной имеет важное значение для точной корреляции между модальностями, чтобы подтвердить, что первоначальное
обнаружение было выбрано верно. Дальнейшая экспертиза или дополнительная биопсия могут быть необходимы, если результаты не соответствуют исходной области подозрения.
Рис. 1(a-d) демонстрирует важность клипсы для подтверждения мультимодальной корреляции. Развивающаяся асимметрия, обнаруженная на скрининоговой маммографии, на границе железистой ткани и ретрогландулярный жир, были выявлены при диагностической маммографии и УЗИ. Вероятный сонографический коррелят был идентифицирован и нацелен для биопсии. Пост биопсионная маммография продемонстрировала клипсу внутри железистой ткани, ниже и спереди развивающейся асимметрии, что побудило повторить снимок. Второй ультразвук продемонстрировал подозрительную массу, которая, по предположениям, соответствует развивающейся асимметрии. Этот участок был взят на биопсию, в ходе чего была выявлена карцинома. Расположение маркера на гаммаграмме после биопсии подтвердило, что вторая масса соответствует маммографической асимметрии.
Расположение клипсы особенно важно для интермодальной корреляции, когда при повторном УЗИ из-за подозрительного результата МРТ обнаружено поражение, что приводит к ультразвуковой биопсии предполагаемого сонографического коррелирования. Майсснитцер и др. обнаружили, что при повторной МРТ, из 80 МРТ диагностированных очагов были взяты на биопсию и было обнаружено, что они доброкачественные, 10 не соотносятся с первоначально диагностированными МРТ. Ограниченная последовательность неконтрастных МРТ может быть выполнена после биопсии, чтобы обеспечить корреляцию и избежать потенциальной задержки в диагностике, если будет выявлено несоответствие между расположением маркера и данными МРТ.
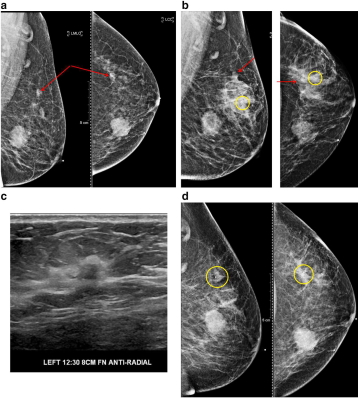
Рис. 1 a)Выявлена развивающаяся асимметрия на маммографии в верхней части левой груди на границе между железистой тканью и ретрогландулярным жиром.
b) Маммография после биопсии. S-образный маркер (желтый круг) не соответствует местоположению первоначально обнаруженной очаговой асимметрии (красная стрела).Результат патологии привел к фиброаденоме с микроскопическим очагамиатипичной протоковой гиперплазии.
с) Второе целевое УЗИ демонстрирует подозрительную массу на оси 12:30, 8 см от соска, лучше соотносится с маммографическим обнаружением.
d) После биопсии массы на оси 12:30 маммография демонстрируетклипсу top hatвнутри развивающейся асимметрии. Выявлена протоковая карцинома с DCIS.
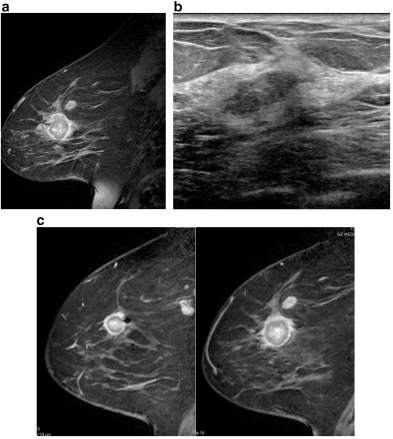
Рис 2
а) МРТ проводится для оценки степени заболевания у пациента с известной 3 см инвазивной протоковой карциномой. Демонстрирует овальную массу в 1 см, предположительнопредставляет собой поражение сателлита в сравнении с метастатическим внутримаммарным лимфатическим узлом.
b) Второе УЗИ было выполнено, чтобы идентифицировать массу для биопсии. Ультразвук демонстрирует овальную гипоэхогенную массу с нечеткими краями.
2.3 Степень оценки заболевания
При обнаружении нескольких поражений в одной груди у пациента известные как рак, размещение маркеров индивидуальных форм на каждом участке позволяет оценить степень заболевания и дифференциацию между доброкачественными и злокачественными участками. Это облегчает хирургическое планирование и лечение. Кроме того, при МРТ у пациентов с недавно диагностированным раком молочной железы, расположение сигнала от маркера опухоли может помочь в оценке степени заболевания и направлении дальнейшей работы. Рис.3(а-b) демонстрирует дополнительные кальцификации, 3 см в правой груди, направленные на стереотаксическую биопсию и признанные как протоковая карцинома. На МРТ отображены 7 см подозрительные немассовые уплотнения совместно с не кальцинированной протоковой карциномой. Фокус восприимчивости новообразования (артефакта) от клипсы расположен в задней части заболевания, что является важной информацией для хирургического планирования. Что указывает на необходимость провести МРТ-биопсию передней части уплотнения, чтобы выявить степень заболевания.
2.4. Неоадъювантная химиотерапия
В условиях неоадъювантной химиотерапии опухоли могут значительно уменьшаются в размерах и могут стать незаметным при визуализации. У пациентов, которые выбирают консервативную терапию груди, клипса, размещенная во время биопсии, может служить единственным надежным ориентиром для предоперационной локализации.
Рис.4 (a-b) служит примером ощутимой инвазивной протоковой карциномы в верхнем квадрате, которая дает метастазы в подмышечную впадину. Пациентка прошла неоадъювантную химиотерапию с проведением полных снимков. Остаточной массы не было обнаружено при маммографии и ультразвуке. Однако клипсу было хорошо видно на обеих модальностях, что было центром предоперационной локализации под ультразвуковым контролем.
2.5 Отказ от повторных биопсий доброкачественных образований
После доброкачественной биопсии наличие клипсы на последующем снимке может предупредить ненужную оценку и биопсию. Это особенно полезно для тех пациентов, которые проходят лечение в разных учреждениях без передачи всех своих соответствующих данных.
3. Маркеры: что есть на рынке?
Маркеры классифицируются по составу, форме, материалу, связанному с рентгеноконтрастной частью клипсы, и их совместимостью с устройствами для биопсии. Необходимые функции включают в себя долгосрочную видимость на УЗИ, точную видимость на МРТ, простоту развертывания и устойчивость к смещению. Большое количество доступных маркеров является следствием отсутствия идеальной клипсы: зачастую существует несколько одинаково хорошо подходящих вариантов маркеров для данного пациента и данного клинического случая. В данном обзоре мы сосредоточили наше внимание на FDA-одобренных маркерах в США, распространяемых компаниями Hologic, Mammotome, Bard® (Becton, Dickinson and Company) и Mermaid Medical.
Обратите внимание, что данный обзор не предназначен для рекомендации производителя и характеристик устройства.
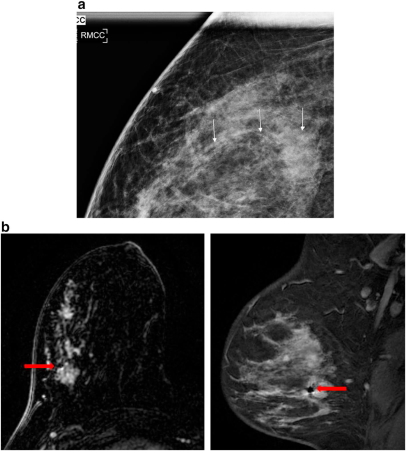
Рис. 3
a) На увеличенном снимке в правой груди видны подозрительные кальцификации в линейном распределении, охватывающий примерно 3 см. Биопсия показала протоковую карциному.
b) МРТ молочной железы проводится для оценки степени заболевания, демонстрирует 7 см уплотнение. Наблюдается улучшение предполагаемой скрытной болезни. Опухоль (артефакт) восприимчива из-за клипсы в месте стереотаксической биопсии находящейся в задней части немассового уплотнения (красная стрелка). Была выполнена последующая МРТ-биопсия самой передней части уплотнения и показала DCIS.
3.1 Наименования и формы маркеров опухоли
Рис.5 демонстрирует варианты клипс, распространяемых компаниями Hologic, Mammotome, Bard and Mermaid Medical и других марок. Использование официальных названий маркеров важно для единой отчетности, и во избежание путаницы при сопоставлении клипсы с сопутствующей патологией, особенно во время предоперационной локализации в груди с несколькими маркерами. Очень важно знать о маркерах с похожими названиями и их схожими формами. Например, клипса “open coil” от производителя
Mammotome и “coil” от производителя Bard схожи по названию, но различны по форме. Клипса “open coil” от производителя Mammotome и клипса “spring” от Bard выглядят почти одинаково, как и клипса "Q" от Hologic и клипса “ring” от Bard. Клипсы “mini cork” и “cork” от Hologic имеют сходные названия и форму и в первую очередь дифференцируются на основе размеров: 2 мм и 3 мм. Рис.6 демонстрирует изображения маркеров “look alike” и “sound alike” (маркеров, которые похожи внешне и на МРТ). Избежав размещения маркеров с похожими названиями или схожей формой в одной груди, можно уменьшить риск неправильной локализации во время операции.
3.2 Состав сплавов
Другая составляющая, отличающая маркеры друг от друга - это материал, из которого они сделаны. Маркеры из титана и нержавеющей стали – наиболее часто используемые материалы. Другие клипсы изготовлены из металлических сплавов (BioDur™108, Inconel™625 и Нитинол) и неметаллические альтернативы (керамика с углеродным покрытием).
1 BioDur™108 схож с нержавеющей сталью, но имеет незначительное количество никеля
( 2 Inconel™625 представляет собой металлический сплав из никеля (58% или больше количества никеля).
3 Нитинол простоит примерно из 50% никеля и 50% титана.
4. Видимость на МРТ
Способность визуализировать опухоль с помощью маркера имеет очень существенное значение для полной и точной оценки заболевания с помощью МРТ. У пациентов с опухолью, МРТ может более точно продемонстрировать заболевание, чем маммография или ультразвук, положение клипсы в рамках заболевания имеет решающее значение для хирургического планирования. Опухоль, благодаря клипсе, отлично реагирует на МРТ-сигнал, легко отображается во всех плоскостях, но она не должна быть огромной, чтобы можно быть заснять всю область.
На видимость влияют три фактора: масса, материал и форма. Клипсы, сделанные из нержавеющей стали, и из BioDur 108 делают опухоль более чувствительной. Титановые клипсы, титановые сплавы, то есть
Нитинол и Inconel 625 , показывают промежуточный результат, в то время как керамические клипсы с углеродным покрытием и PEKK клипсы помогают отобразить новообразование с наименьшим количеством пустот [28–30]. Различные варианты восприимчивости можно увидеть при просмотре МРТ у пациентов с несколькими различными видами клипс.
Форма также играет немалую роль при МРТ. Наш опыт показывает, что титановые клипсы Hologic (TriMark®, CeleroMark®, SecurMark®) отлично отображаются на МРТ, в то время как другие титановые клипсы, такие как S-образные клипсы (Bard), создают меньшую видимость, которая может быть не качественно визуализирована или отображаться только в одной плоскости. Вероятно, это связано с формой маркера, количеством металла в клипсе, а также размерами клипс.
5. Сложности при размещении маркера
Хотя размещение клипсы является прямой и безопасной частью визуально-контролируемой биопсии, после установки маркера могут возникнуть сложности, в виде миграции и экструзии клипсы, неудачного внедрения и аллергической реакции.
5.1. Миграция/ удаление клипсы
Смещение клипсы также может произойти из-за образования гематомы или избытка воздуха в месте
образования опухоли. Это больше всего распространено в стереотаксических и МРТ-процедурах, в которых используются иглы большего размера. Когда гематома образуется сразу после получения образцов, клипса может свободно перемещаться в опухоли. Применение вакуумного отсоса перед размещением клипсы разрушает опухоль, уменьшая количество воздуха и крови, таким образом, уменьшая вероятность миграции зажима [35]. Важно отметить, что видимое смещение клипсы на результатах маммограммы после биопсии может значительно улучшиться по мере того как кровь и воздух реабсорбируются. Если есть подозрения в смещении клипсы, то следует выполнить маммографию для локализации, чтобы пересмотреть положение маркера относительно необходимого места.
Отсутствие визуализации клипсы на маммограмме после биопсии является еще одним потенциальным осложнением, которое может быть связано с неудачным размещением или вытеснением клипсы из груди. Вытеснение клипсы обычно происходит, когда опухоль расположена на поверхности и / или когда имеется чрезмерное кровотечение, особенно когда используется ручное сжатие для гемостаза. Когда клипсу не видно на маммограмме после биопсии, пациент переводится в ультразвуковой аппарат для ультразвуковой проверки размещения зажима в опухоли, идентифицируемой по воздуху и крови, с последующей повторной маммографической визуализацией, так как это надежный и точный метод для повторной маркировки места расположения опухоли.
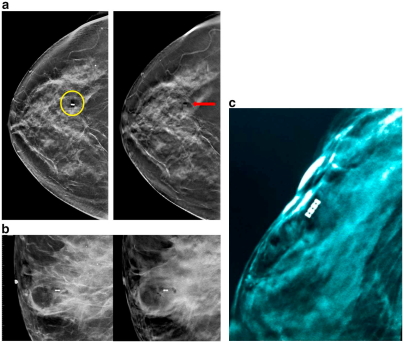
Рис.7
a) Маркер в форме металлической пробки продемонстрирован на С-изображении (слева, круг) также как удлиненная клипса на срезах томосинтеза (справа, стрелка).
b) Неметаллическая клипса MammoSTAR® продемонстрирована менее заметно на С-снимке (слева) и томосинтезе (справа).
с) Срез томосинтеза демонстрирует минимальное или полное отсутствие клипсы Cassi® Star, изготовленного из PEKK с вкраплениями бария.
Читайте также:


