Лечение красной волчанки генной инженерии
- 19201
- 14,9
- 4
- 4
![]()
Ольга Георгинова
![]()
Антон Чугунов![]()
Андрей Панов
- Аутоиммунитет
- Иммунология
- Фармакология
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
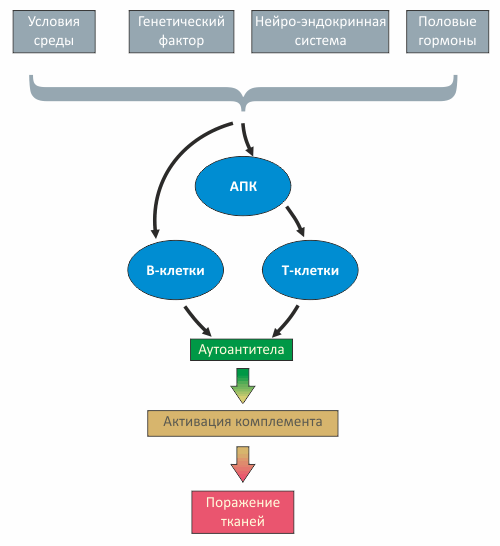
Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Для лечения СКВ применяют также препарат моноклональных антител, селективно действующий на CD20 + В-лимфоциты, — ритуксимаб, зарегистрированный FDA для лечения неходжкинской лимфомы. Впрочем, высокая цена этого препарата не позволила ему получить широкого применения при лечении СКВ в нашей стране.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди

В последние годы настоящей сенсацией стало сообщение о регистрации FDA нового биологического препарата для лечения системной красной волчанки – белимумаба.
Белимумаб – первый генно-инженерный биологический препарат (ГИБП), специально созданный для лечения волчанки, что явилось одним из наиболее крупных достижений ревматологии за последние 50 лет.
Механизм действия Белимумуба очень сложный. Если кратко и упрощенно, то особый интерес исследователей вызывал В-лимфоцитарный стимулятор (B-lymphocyte stimulator – BLyS). В клинических исследованиях показано, что у пациентов с системной красной волчанкой наблюдается увеличение концентрации BLyS в сыворотке, коррелирующей с концентрацией антител к двуспиральной ДНК и динамикой активности заболевания. Эти данные и послужили теоретическим обоснованием для разработки анти-BLyS-препаратов, в первую очередь белимумаба, для лечения СКВ.
Официальные показания для назначения белимумаба при системной красной волчанки:
- умеренная или высокая активность заболевания,
- наличие выраженных иммунологических нарушений (положительные результаты определения антинуклеарного фактора и/или антител к ДНК),
- недостаточная эффективность стандартной терапии.
Белимумаб обычно хорошо переносится, наиболее частыми нежелательными явлениями являются инфекционные осложнения, боль в суставах, головная боль, диарея, тошнота. Очень редко отмечаются тяжелые инфекции и депрессия.
На основании широкомасштабного исследования эффективности белимумаба в реальной клинической практике, результаты которого были доложены на X Международной конференции по системной красной волчанке (Буэнос-Айрес, Аргентина, 18–19 апреля 2013 г.), показана высокая эффективность белимумаба у 501 больного СКВ. Применение белимумаба в течение 6 месяцев приводило к улучшению у 57–65% больных с высокой и средней активностью болезни. У 77% больных, получавших белимумаб, удалось значительно снизить дозу гормонов, а у 9% полностью отменить их. Терапия белимумабом приводила к уменьшению частоты обострений, госпитализаций, снижению показателей активности системной красной волчанки. Первые признаки улучшения, как правило, наблюдаются на 8-й неделе терапии: уменьшение чувства усталости, снижение индексов активности системной красной волчанки. Более выраженное улучшение наблюдается к 12–16-й неделе.

Показания для назначения белимумаба при СКВ в клинической практике:
- Недостаточная эффективность предшествующей терапии в течение по крайней мере 3 месяцев.
- Высокая или средняя активность СКВ.
- Необходимость назначения гормональных препаратов или их комбинация с цитостатиками для поддержания ремиссии.
- Противопоказания для назначения одного из цитостатиков или необходимость назначения цитостатиков в дозе, превышающей рекомендованную.
- Высокий уровень антител к ДНК, низкий уровень комплемента.
- Поражение кожи, суставов, мышц, слизистых оболочек, тромбоцитопения, прогрессирующие на фоне стандартной терапии.
- Нефрит с низкой степенью клинической и морфологической активности.
Основные цели терапии:
- снижение активности заболевания;
- предотвращение рецидивов появления активности;
- снижение суточной дозы гормональных препаратов;
- снижение риска развития необратимых повреждений органов;
- улучшение качества жизни.
Вот такие сегодня новости. А реальный дневник пациентки на Белимумабе можно почитать здесь. К сведению, разработка новых и эффективных препаратов продолжается. Будем внимательно следить 🙂
Ученым впервые удалось полностью избавить подопытных мышей от заболевания, известного под названием системная красная волчанка. Это удалось сделать при помощи одной из разновидностей генной терапии – использования химерных антигенных рецепторов.
Волчанка – аутоиммунное заболевание, клетки иммунной системы у больных становятся гиперактивными и теряют способность различать патогены и здоровые ткани организма. В результате они вызывают воспаление и повреждение суставов, кожи и внутренних органов. По данным Американского фонда волчанки, в мире ею страдает около пяти миллионов человек.
Цель создания химерных антигенных рецепторов состоит в том, чтобы научить Т-клетки иммунной системы бороться с определенными типами клеток, которые связаны с тем или иным заболеванием. Мишенью могут быть, например, клетки определенных видов опухолей, а в случае волчанки ею становятся B-лимфоциты. Из организма пациента извлекают его собственные Т-лимфоциты и подвергают их генетической модификации, в ходе которой им передается специального сконструированный ген определенного белка – поверхностного рецептора клетки. Это и есть химерный антигенный рецептор. Данный белок способен избирательно связываться с антигенами – белками клеток-мишеней. Таким образом, Т-лимфоциты, вернувшись в организм пациента, уже обучены распознавать и уничтожать эти клетки.
Терапия с использованием химерных антигенных рецепторов (CAR-T-терапия) возникла в 1990-е годы и главным направлением ее ожидаемого применения всегда считалось лечение онкологических заболеваний. Недавно в США получили одобрение для клинического применения два метода CAR-T-терапии, предназначенные для борьбы с острым лимфобластным лейкозом и B-клеточной лимфомой. Но специалисты по аутоиммунным заболеваниям давно с интересом следили за развитием этой методики и задумывались над применением ее в своей области.
В 2016 году был достигнут первый успех в этом направлении. В Пенсильванском университете при помощи химерных антигенных рецепторов удалось избавить мышей от редкого аутоиммунного заболевания – пузырчатки (pemphigus vulgaris), поражающего кожу и слизистые оболочки. Но при терапии системной красной волчанки возникали сложности. В распоряжении врачей с 1997 года имеется генно-инженерное антитело ритуксимаб, нацеленное на белок CD20, присутствующий на клеточных оболочках B-лимфоцитов. Оно применяется при некоторых типах лимфом, хроническом лимфолейкозе, а также аутоиммунных заболеваниях: ревматоидном артрите и рассеянном склерозе. Но в лечении системной красной волчанки ритусимаб оказывался неэффективен.
Возникло даже предположение, что B-лимфоциты не важны для борьбы с волчанкой. Но иммунолог Марк Шломчик (Mark Shlomchik) из Питсбургского университета и его коллеги сочли, что дело тут в том, что антителам ритусимаба после прикрепления к B-лимфоцитам для их уничтожения нужна помощь других клеток иммунной системы – макрофагов, а при волчанке активность этих клеток может быть заблокирована. Следовательно, нужно было средство избавления от B-клеток, не нуждающееся в их помощи.
Иммунолог Марко Радик (Marko Radic) из Университета Теннеси и его коллеги решили прибегнуть к созданию химерных антигенных рецепторов. Они использовали в своем эксперименте специально созданные линии лабораторных мышей, у которых была воспроизведена системная красная волчанка. У этих мышей взяли Т-клетки и наделили их химерным рецептором, нацеленным на антиген CD19 B-клеток. Чтобы уничтожить немодифицированные Т-клетки в организме мышей, их подвергли облучению. Затем Т-клетки с химерным рецептором были введены в их организм.
У 26 мышей из 41, получившей модифицированные Т-клетки, были успешно уничтожены все В-лимфоциты с антигеном CD19. Симптомы системной красной волчанки на селезенке, коже, почках и других органах этих мышей полностью исчезли. После эксперимента большинство мышей прожило более года, что для этих животных довольно большой срок. Все мыши из контрольной группы прожили не больше 10 месяцев, а многие из них погибли значительно раньше. Итоги эксперимента подводятся в статье, опубликованной журналом Science Transal Medicine (Kansal et al., Sustained B cell depletion by CD19-targeted CAR T cells is a highly effective treatment for murine lupus).
CAR-T-терапия – весьма радикальное средство, ведь для спасения пациента она полностью уничтожает его B-лимфоциты, и его организм утрачивает способность вырабатывать антитела к другим антигенам. Поэтому прошедшие лечения пациенты должны затем до конца жизни регулярно получать донорские антитела. Но исследователи считают, что ее применение для борьбы с волчанкой оправдано не менее, чем в случаях с лимфомой и лейкозом, ведь у некоторых больных волчанка развивается не менее агрессивно, чем рак, и в таких случаях тяжелое поражение тканей почек может привести к смерти пациента.
Полный текст:
- Аннотация
- Об авторах
- Литература
- Cited By
Системная красная волчанка (СКВ) является прототипом хронического аутоиммунного заболевания. Распространенность СКВ составляет от 20 до 70 случаев на 100 тыс. женщин и варьирует в зависимости от расовой и этнической принадлежности. Несмотря на значительные успехи традиционной терапии, многие проблемы, связанные с ведением этих больных, требуют незамедлительного решения: так у 50-80% больных СКВ выявляются признаки активности и/или частые обострения, около 30% вынуждены прекратить работу, наличие IV класса волчаночного нефрита увеличивает риск развития терминальной почечной недостаточности. За последние 20 лет достигнут огромный прогресс в изучении патогенеза СКВ: найдены биологические мишени для воздействия лекарственных средств и определены принципиально новые терапевтические задачи. Белимумаб – первый генно-инженерный биологический препарат, созданный специально для лечения СКВ, что по праву рассматривается как одно из наиболее крупных достижений ревматологии за последние 50 лет.
Arbuckle MR, McClain MT, Rubertone MV et al. Development of autoantibodies before the clinical onset of systemic lupus erythematosus. N Engl J Med. 2003;349(16):1526–33. DOI: 10.1056%2FNEJMoa021933.
James JA, Harley JB, Scofield RH. Epstein-Barr virus and systemic lupus erythematosus. Curr Opin Rheumatol. 2006;18(5):462–7. DOI: 10.1097%2F01.bor.0000240355.37927.94.
Costenbader KH, Gay S, Alarcón-Riquelme ME et al. Genes, epigenetic regulation and environmental factors: which is the most relevant in developing autoimmune diseases? Autoimmun Rev. 2012;11(8):604-9. DOI: 10.1016/j.autrev.2011.10.022. Epub 2011 Oct 25.
Pons-Estel GJ, Alarcón GS, Scofield L et al. Understanding the epidemiology and progression of systemic lupus erythematosus. Semin Arthritis Rheum. 2010; 39(4):257-68. DOI: 10.1016/j.semarthrit.2008.10.007. Epub 2009 Jan 10.
Danchenko N, Satia JA, Anthony MS. Epidemiology of systemic lupus erythematosus: a comparison of worldwide disease burden. Lupus. 2006;15(5):308–18. DOI: 10.1191%2F0961203306lu2305xx.
Helmick CG, Felson DT, Lawrence RC et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part I. Arthritis Rheum. 2008;58(1):15–25. DOI: 10.1002/art.23177.
Bernatsky S, Boivin JF, Joseph L et al. Mortality in systemic lupus erythematosus. Arthritis Rheum. 2006;54(8):2550–7. DOI: 10.1002%2Fart.21955.
Nikpour M, Urowitz MB, Ibañez D, Gladman DD. Frequency and determinants of flare and persistently active disease in systemic lupus erythematosus. Arthritis Rheum, 2009;61(9):1152–8. DOI: 10.1002/art.24741.
Yelin E, Tonner C, Trupin L et al. Longitudinal study of the impact of incident organ anifestations and increased disease activity on work loss among persons with systemic lupus erythematosus. Arthritis Care Res (Hoboken). 2012;64(2):169–75. DOI: 10.1002/acr.20669.
Rose BD, Appel GB. End-stage renal disease due to lupus nephritis. UpToDate, 2012 (http://www.uptodate.com/contents/end-stage-renal-disease-due-to-lupus -nephritis).
Fessler BJ, Alarcón GS, McGwin G Jr et al. Systemic lupus erythematosus in three ethnic groups. XVI. Association of hydroxychloroquine use with reduced risk of damage accrual. Arthritis Rheum. 2005;52(5):1473–80. DOI: 10.1002%2Fart.21039.
Slawsky KA, Fernandes AW, Fusfeld L et al. A structured literature review of the direct costs of adult systemic lupus erythematosus in the US. Arthritis Care Res (Hoboken). 2011;63(9):1224–32. DOI: 10.1002/acr.20502.
Petri M et al. Derivation and Validation of the Systemic Lupus International Collaborating Clinics Classification Criteria for Systemic Lupus Erythematosus. Arthritis Rheum. 2012;64(8):2677–86. DOI: 10.1002/art.34473.
Jordan B, Lutalo PMK, D’Cruz DP. Novel therapeutic agents in clinical development for systemic lupus erythematosus. BMC Med. 2013;11:120. DOI: 10.1186/1741-7015-11-120.
Furie RA, Petri MA, Wallace DJ et al. Novel evidencebased systemic lupus erythematosus responder index. Arthritis Rheum. 2009;(61):1143–51.
Zonana-Nacach A, Barr SG, Magder LS, Petri M. Damage in systemic lupus erythematosus and its association with corticosteroids. Arthritis Rheum. 2000;43(8):1801–8. DOI: 10.1002%2F1529-0131%28200008%2943%3A8%3C1801%3A%3AAID-ANR16%3E3.0.CO%3B2-O.
Sanz I, Lee FE. B-cells as therapeutic targets in SLE. Nat Rev Rheumatol. 2010;6(6):326–37. DOI: 10.1038/nrrheum.2010.68.
Leandro MJ, Cambridge G, Edwards JC et al. B-cell depletion in the treatment of patients with systemic lupus erythematosus: a longitudinal analysis of 24 patients. Rheumatology (Oxford). 2005;44(12):1542–5. DOI: 10.1093%2Frheumatology%2Fkei080. Epub 2005 Sep 27.
Lindholm C, Börjesson-Asp K, Zendjanchi K et al. Longterm clinical and immunological effects of anti-CD20 treatment in patients with refractory systemic lupus erythematosus. J Rheumatol. 2008;35(5):826–33. Epub 2008 Apr 1.
Looney RJ, Anolik JH, Campbell D et al. B cell depletion as a novel treatment for systemic lupus erythematosus: a phase I/II dose-escalation trial of rituximab. Arthritis Rheum. 2004;50(8):2580–9. DOI: 10.1002%2Fart.20430 .
Turner-Stokes T, Lu TY, Ehrenstein MR et al. The efficacy of repeated treatment with B-cell depletion therapy in systemic lupus erythematosus: an evaluation. Rheumatology (Oxford). 2011;50(8):1401–8. DOI: 10.1093/rheumatology/ker018. Epub 2011 Mar 12.
Terrier B, Amoura Z, Ravaud P et al. Safety and efficacy of rituximab in systemic lupus erythematosus: results from 136 patients from the French AutoImmunity and Rituximab registry. Arthritis Rheum. 2010;62(8):2458–66. DOI: 10.1002/art.27541.
Furie R, Looney RJ, Rovin B et al. Efficacy and safety of rituximab in subjects with active proliferative lupus nephritis (LN): results from the randomized, double-blind phase III LUNAR study. Arthritis Rheum. 2009;60(Suppl 1):S429.
Lightstone L. The landscape after LUNAR: rituximab’s crater-filled path. Arthritis Rheum. 2012;64(4):962–5. DOI: 10.1002/art.34362. Epub 2012 Jan 9.
Merrill JT, Neuwelt CM, Wallace DJ et al. Efficacy and safety of rituximab in moderately-to-severely active systemic lupus erythematosus:the randomized, double-blind, phase II/III systemic lupus erythematosus evaluation of rituximab trial. Arthritis Rheum. 2010;62(1):222–33. DOI: 10.1002/art.27233.
Pepper R, Griffith M, Kirwan C et al. Rituximab is an effective treatment for lupus nephritis and allows a reduction in maintenance steroids. Nephrol Dial Transplant. 2009;24(12):3717–23. DOI: 10.1093/ndt/gfp336. Epub 2009 Jul 17.
Traczewski P, Rudnicka L. Treatment of systemic lupus erythematosus with epratuzumab. Br J Clin Pharmacol. 2011;71(2):175–82. DOI: 10.1111/j.1365-2125.2010.03767.x.
Jacobi AM, Goldenberg DM, Hiepe F et al. Differential effects of epratuzumab on peripheral blood B cells of patients with systemic lupus erythematosus versus normal controls. Ann Rheum Dis. 2008;67(4):450–7. DOI: /10.1136%2Fard.2007.075762. Epub 2007 Aug 2.
Lied GA, Berstad A. Functional and clinical aspects of the B cell-activation factor (BAFF): a narrative review. Scand J Immunol. 2011;73(1):1–7. DOI: 10.1111/j.1365-3083.2010.02470.x.
Moore PA, Belvedere O, Orr A. et al. BLyS: Member of the tumor necrosis factor family and B lymphocyte stimulator. Science. 1999;285(5425):260–3. DOI: 10.1126%2Fscience.285.5425.260.
Schneider P, MacKay F, Steiner V et al. BAFF, a novel ligand of the tumor necrosis factor family, stimulates B cell growth. J Exp Med. 1999;189(11):1747–56. DOI: 10.1084%2Fjem.189.11.1747.
Treml JF, Hao Y, Stadanlick JE et al. The BLyS family: Toward a molecular understanding of B cell homeostasis. Cell Biochem Biophys. 2009;53(1):1–16. DOI: 10.1007/s12013-008-9036-1. Epub 2008 Nov 26.
Gross JA, Johnston J, Murdi S et al. TACI and BCMA are receptors for TNF homologue implicated in B-cell autoimmune disease. Nature. 2000;404(6781):995–9.
Stohl W, Metyas S, Tan SM et al. B lymphocyte stimulator overexpression in patients with systemic lupus erythematosus: Longitudinal observations. Arthritis Rheum. 2003;48(12):3475–86. DOI: 10.1002%2Fart.11354.
Petri M, Stohl W, Chatham W et al. Association of plasma B lymphocyte stimulator levels and disease activity in systemic lupus erythematosus. Arthritis Rheum. 2008;58(2):2453–9.DOI: 10.1002/art.23678.
Sanz I. Targeting B-cell in SLE: good news at last. Nat Rev Rheum. 2011; 7(5):255-6. DOI: 10.1038/nrrheum.2011.48.
Halpern WG, Lappin P, Zanardi T et al. Chronic administration of belimumab, a BLyS antagonist, decreases tissue and peripheral blood B-lymphocyte populations in cynomolgus monkeys: Pharmacokinetic, pharmacodynamic, and toxicologic effects.Toxicol Sci. 2006;91(2):586–99. DOI: 10.1093%2Ftoxsci%2Fkfj148. Epub 2006 Mar 3.
Baker KP, Edwards BM, Main SH et al. Generation and characterization of LymphoStat-B, a human monoclonal antibody that antagonizes the bioactivities of B lymphocyte stimulator. Arthritis Rheum. 2003;48(11):3253–65. DOI: /10.1002%2Fart.11299.
Navarra SV, Guzman RM, Gallacher AE et al. BLISS-52 Study Group.Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: A randomised, placebo-controlled, phase 3 trial. Lancet. 2011;377(9767):721–31. DOI: 10.1016/S0140-6736(10)61354-2. Epub 2011 Feb 4.
Furie R, Petri M, Zamani E et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011;63(12):3918–30. DOI: 10.1002/art.30613.
Furie RA, Petri MA, Wallace DJ et al. Novel evidence-based systemic lupus erythematosus responder index. Arthritis Rheum. 2009;61(9):1143–51. DOI: 10.1002/art.24698.
Furie R, Petri M, Zamani E et al. A phase III, randomized, placebo-controlled study of belimumab, a monoclonal antibody that inhibits B lymphocyte stimulator, in patients with systemic lupus erythematosus. Arthritis Rheum. 2011;63(12):3918–30. DOI: 10.1002/art.30613.
Manzi S, Sanchez-Guerrero J, Merrill JT et al. Effects of belimumab,a B lymphocyte stimulator-specigic inhibitor, on disease activity across multiple organ domains in patients with systemic lupus erythematosus: combined results from two phase III trials. Ann Rheum Dis. 2012; 71(11):1833-8. DOI: 10.1136/annrheumdis-2011-200831. Epub 2012 May 1.
Van Vollenhoven RF, Petri MA, Cervera R et al. Belimumab in the treatment of systemic lupus erythematosus: high disease activity predictors of response. Ann Rheum Dis. 2012; 71(8):1343-9. DOI: 10.1136/annrheumdis-2011-200937. Epub 2012 Feb 15.
Jacobi AM, Odendahl M, Reiter K et al. Correlation between circulating CD29high plasma cells and disease activity in patients with systemic lupus erythematosus. Arthritis Rheum. 2003;48(5):1332–42. DOI: 10.1002%2Fart.10949
Petri M, Singh S, Tesfasyone H et al. Prevalence of flare and influence of demographic and serologic factors on flare risk in systemic lupus erythematosus: a prospective study. J Rheumatol. 2009;36(11):2476–80. DOI: 10.3899/jrheum.090019. Epub 2009 Oct 15.
Tseng CE, Buyon JP, Kim M et al. The effect of moderate dose corticosteroids in preventing of severe flares in patients with serologically active, but clinically stable systemic lupus erythematosus: finding of a prospective, randomized, double-blind, placebo-controlled trial. Arthritis Rheum. 2006;54(11):3623–32. DOI: 10.1002%2Fart.22198.
Merril JT, Ginzler EM, Wallace DJ et al. Long-term safety profile of belimumab plus standart therapy in patients with systemic lupus erythematosus. Arthritis Rheum. 2012; 64(10):3364-73. DOI: 10.1002/art.34564.
Molta С et al. Outcomes Associated with Belimumab in Patients with Systemic Lupus Erythematous (SLE) in Clinical Practice Settings: Results from OBSErve Study in the United States (U.S.). Lupus. 22, Abstr Suppl; 036, 2013.
Ramos-Casals M et al. Recomendaciones sobre el uso de belimumab en el lupus eritematoso sistémico. Guía de Práctica Clínica GEAS-SEMI. Rev Clin Esp. 2012; 213(1):66–7. DOI: 10.1016/j.rce.2012.10.004.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
2 феративный) увеличивает риск развития терминальной почечной недостаточности с последующим переводом на гемодиализ [10]. Среди нерешенных проблем развитие необратимых повреждений органов в первые 5 6 лет после начала СКВ, что обусловлено как ее течением, так и побочными эффектами терапии, в первую очередь длительным применением высоких и средних доз ГК и ЦТ [11]. Еще одной проблемой при СКВ является высокая стоимость лечения и мониторинга пациентов. Так, по данным K.A. Slawsky и соавт. [12], в 2011 г. прямые годовые расходы на лечение пациента с СКВ в США оценивались в долл. Диагностика. Диагноз СКВ должен основываться на наличии клинических проявлений заболевания и данных лабораторного обследования. Для подтверждения диагноза требуется не менее 4 из 11 критериев ACR, 1997 (чувствительность 85%, специфичность 95%). Диагностические критерии СКВ (ACR, 1997) 1. Сыпь на скулах: фиксированная эритема с тенденцией к распространению на носогубную зону. 2. Дискоидная сыпь: эритематозные приподнимающиеся бляшки с прилипающими кожными чешуйками и фолликулярными пробками, на старых очагах возможны атрофические рубцы. 3. Фотосенсибилизация: кожная сыпь, возникающая в результате реакции на солнечный свет. 4. Язвы в ротовой полости: изъязвления полости рта или носоглотки, обычно безболезненные. 5. Артрит: неэрозивный, поражающий 2 периферических суставов, проявляющийся болезненностью, отеком и выпотом. 6. Серозит: плеврит (плевральные боли и/или шум трения плевры, и/или плевральный выпот); перикардит (шум трения перикарда при аускультации и/или признаки перикардита при эхокардиографии). 7. Поражение почек: персистирующая протеинурия 0,5 г/сут и/или цилиндрурия (эритроцитарная, зернистая или смешанная). 8. Поражение ЦНС: судороги; психоз (в отсутствие приема лекарственных средств или метаболических нарушений). 9. Гематологические нарушения: гемолитическая анемия с ретикулоцитозом; лейкопения 3 Таблица 1. Диагностические критерии СКВ (SLICC/ACR, 2012) КЛИНИЧЕСКИЕ КРИТЕРИИ Острое активное поражение кожи Сыпь на скулах (не учитываются дискоидные высыпания) Буллезные высыпания Токсический эпидермальный некроз как вариант СКВ Макулопапулезная сыпь Фотосенсибилизация: кожная сыпь, возникающая в результате реакции на солнечный свет, или подострая кожная волчанка (неиндурированные псориазоформные и/или круговые полициклические повреждения, которые проходят без образования рубцов, но с возможной поствоспалительной депигментацией или телеангиоэктазиями) Хроническая кожная волчанка Классическая дискоидная сыпь: локализованная (выше шеи) генерализованная (выше и ниже шеи) Гипертрофические (бородавчатые) поражения кожи Панникулит Поражение слизистых оболочек Отечные эритематозные бляшки на туловище Капилляриты (красная волчанка обморожения, болезнь Гетчинсона, проявляющаяся поражением кончиков пальцев, ушных раковин, пяточных и икроножных областей) Дискоидная красная волчанка по типу красного плоского лишая или overlap Язвы слизистой оболочки (в отсутствие следующих причин: васкулит, болезнь Бехчета, инфицирование вирусом герпеса, воспалительные заболевания кишечника, реактивный артрит и употребление кислых пищевых продуктов) Ротовой полости: неба щек языка Носовой полости Нерубцовая алопеция, в том числе диффузное истончение волос или повышенная хрупкость волос с видимыми обломанными участками (в отсутствие следующих причин: алопеция очаговая, вследствие приема лекарств, дефицита железа и андрогенная) Артрит Синовит с вовлечением 2 суставов, характеризующийся отеком или выпотом или болезненность 2 суставов и утренняя скованность по крайней мере 30 мин Серозит Типичный плеврит в течение >1 дня, или плевральный выпот, или шум трения плевры Типичная перикардиальная боль (боль в положении лежа, купирующаяся в положении сидя с наклоном вперед) >1 дня, или перикардиальный выпот, или шум трения перикарда, или электрокардиографические признаки перикардита (в отсутствие следующих причин: инфекция, уремия и перикардит Дресслера) Поражение почек Соотношение уровня белок/креатинин (или суточная протеинурия) в моче >500 мг белка за 24 ч, или эритроциты в моче ( 5), или цилиндры в моче ( 5) Нейропсихические поражения Эпилептический приступ Психоз Моно/полиневрит (в отсутствие других причин, таких как первичный васкулит) Миелит Патология черепно-мозговых нервов/периферическая нейропатия (в отсутствие других причин: первичный васкулит, инфекции и сахарный диабет) Острое нарушение сознания (в отсутствие других причин: токсические/метаболические, уремия, прием лекарств) Гемолитическая анемия Лейкопения 4 ИММУНОЛОГИЧЕСКИЕ КРИТЕРИИ AНФ выше референсного уровня Анти-дсДНК выше референсного уровня (или >2-кратное увеличение, определяемое методом ELISA) A-Sm АФЛ положительные, определенные любым из следующих способов: положительный волчаночный антикоагулянт ложноположительная реакция Вассермана средний или высокий титр акл (IgA, IgG или IgM) положительный результат теста на анти-β2-гликопротеин I (IgA, IgG или IgM) Низкий уровень комлемента: С3 С4 СH50 6. Положительная реакция Кумбса при отсутствии гемолитической анемии Клинических критериев Иммунологических критериев ных инфекций не превышала 5 10% [22]. Несмотря на эффективность РТМ, продемонстрированную в открытых испытаниях, в 2 рандомизированных клинических исследованиях (РКИ) не подтверждена его эффективность по сравнению с плацебо (ПЛ) у больных с волчаночным нефритом (LUNAR) [23, 24] и СКВ без поражения почек (EXPLORER) [25]. В то же время при более детальном анализе данных установлен значительно более выраженный эффект РТМ по сравнению с ПЛ у больных с достигнутой деплецией, высоким уровнем а-днк и низким уровнем комплемента [25]. К возможным объяснениям неудач в этих РКИ можно отнести слишком малый срок наблюдения, высокие дозы ГК и назначение микофенолата мофетила (ММФ) в группе ПЛ. РТМ продолжает использоваться не по прямому назначению у больных с высокой активностью СКВ, обусловленной прогрессирующим нефритом, поражением ЦНС и цитопенией, в случаях неэффективности высоких доз ГК и ЦТ. Дополнительное преимущество назначения РТМ в комбинации с ММФ при СКВ его эффективность и возможность значительно снизить дозу ГК у больных с IV классом волчаночного нефрита. Новая стратегия лечения волчаночного нефрита РТМ в фазе индукции, принятая в Великобритании, предусматривает значительное уменьшение дозы и длительности применения ГК в фазе поддерживающей терапии [26]. Эпратузумаб (ЭПМ) моноклональные антитела (мат) к CD22-рецепторам В-лимфоцита. В настоящее время проводится РКИ эффективности ЭПМ у больных СКВ со средней и тяжелой степенью активности. CD22 является трансмембранным лектиноподобным рецептором, который присутствует на поверхности зрелых, наивных и переходных клеток, но отсутствует на клетках памяти и плазматических клетках и играет важную роль в регуляции функции В-клеток [27]. ЭПМ вызывает умеренное истощение В-лимфоцитов, однако в отличие от РТМ не приводит к апоптозу и полной деплеции В-лимфоцитов. Его основной мишенью являются наивные, зрелые и переходные В-лимфоциты, содержание которых уменьшается на 40% после применения ЭПМ [28]. В настоящее время получены промежуточные результаты РКИ EMBLEM 12-недельного многоцентрового рандомизированного двойного слепого плацебоконтролируемого исследования IIb фазы, в котором оцениваются эффективность и безопасность ЭПМ, а также его доза у пациентов с умеренной и тяжелой СКВ. В исследование включено 227 пациентов. Продемонстрирована выраженная клиническая эффективность ЭПМ в кумулятивной дозе 2400 мг: снижение активности заболевания, измеряемой с помощью специального композитного индекса BILAG. Применение ЭПМ в дозе 600 мг/нед сопровождалось наибольшим улучшением оценки по BILAG-2004 (от A/B до C/D) по сравнению с ПЛ во всех доменах органов, при этом отмечены также хорошая переносимость препарата и отсутствие тяжелых осложнений [27]. В настоящее время заканчиваются еще 2 РКИ III фазы, состоящих из 12-недельных циклов, у пациентов с умеренной и тяжелой СКВ (EMBODY 1 и EMBODY 2). В исследования планируется включить 780 пациентов, срок окончания исследований февраль 2014 г. (NCT , NCT , HYPERLINK « Еще одно открытое клиническое исследование эффективности и безопасности ЭПМ, включающее 1400 пациентов с умеренной и тяжелой СКВ, планируется завершить в 2016 г. (NCT , HYPER- LINK « Анти-BLyS-терапия. При отсутствии прямых показаний для применения РТМ при СКВ и незавершенных к настоящему времени исследований эффективности ЭПМ настоящей сенсацией стало сообщение о регистрации FDA нового биологического препарата для лечения СКВ белимумаба [44, 45]. Белимумаб первый ГИБП, специально созданный для лечения СКВ, что явилось одним из наиболее крупных достижений ревматологии за последние 50 лет [29, 30]. Открытие ключевого значения В-клеток в иммунопатогенезе СКВ привлекло внимание к изучению не только самих В-клеток, но и В-клеточных цитокиновых лигандов в качестве возможных мишеней терапевтического воздействия. Особый интерес исследователей вызвал В-лимфоцитарный стимулятор (В-lymphocyte stimulator BLyS) [31], известный также как В-клеточный активирующий фактор (B-cell-activating factor BAFF) и лиганд суперсемейства фактора некроза опухоли 13b, который является важней- 36
Читайте также:





