Клиника и лечение деформирующего артроза
Остеоартроз — хроническое невоспалительное заболевание суставов неизвестной этиологии, характеризующееся прогрессирующей дегенерацией суставного хряща, структурными изменениями субхондральной кости и сопутствующим реактивным синовитом
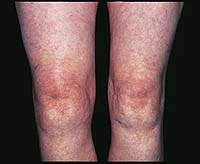 |
| Рисунок 1. Синовит (припухлость, гиперемия, локальное повышение температуры) правого коленного сустава при ОА |
При прогрессировании ОА в результате происходящих дегенеративных процессов хрящ размягчается, разрыхляется. В нем появляются трещины, простирающиеся до кости.
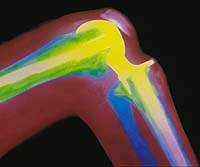 |
| Рисунок 2. Эндопротез коленного сустава. Рентгенограмма |
Особая роль в патогенезе ОА отводится синовиту, морфологически характеризующемуся умеренно выраженными пролиферативными и экссудативными реакциями (гиперплазией синовиальной оболочки и ее мононуклеарной инфильтрацией), наиболее выраженными в местах прикрепления синовии к хрящу с последующим исходом в склероз и липоматоз. В субхондральной кости выявляются микропереломы, утолщение костных трабекул и остеофитоз. Экссудативно-пролиферативные реакции как в субхондральной кости, так и в синовиальной оболочке протекают на фоне нарушений региональной гемодинамики и микроциркуляции с развитием тканевой гипоксии. В последующем прогрессирование болезни принимает, по сути, необратимый характер.
Боль, деформация и тугоподвижность сустава являются основными клиническими проявлениями ОА.
Боль в суставе — наиболее частый и выраженный симптом при ОА, носит неоднородный характер. Причинами ее могут быть деструктивные процессы в хрящевых и субхондральных структурах, нарушения микроциркуляции, особенно при затруднении венозного кровотока в спонгиозной части кости, фиброз капсулы сустава, воспалительный процесс в мягких околосуставных тканях, спазм близлежащих мышц и реактивный синовит.
В целом для заболевания характерен механический ритм болей — возникновение боли под влиянием дневной физической нагрузки и стихание за период ночного отдыха, что связано со снижением амортизационных способностей хряща и костных подхрящевых структур к нагрузкам. При этом происходит прогибание костных балок в сторону спонгиозной кости.
Возможны непрерывные тупые ночные боли, связанные с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
Рефлекторный спазм близлежащих мышц, а также развитие реактивного синовита вызывают постоянные боли.
Реактивный синовит и воспалительный отек параартикулярных тканей усугубляют клиническую картину. При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утреннняя скованность, припухлость сустава, локальное повышение кожной температуры. С прогрессированием заболевания рецидивы синовита учащаются.
Обычно ОА развивается медленно и начинается как моноартикулярное заболевание, но через некоторое время в патологический процесс включаются и другие суставы, чаще всего те, которые компенсаторно брали на себя повышенную механическую нагрузку, чтобы разгрузить первоначально заболевший сустав.
Клинически значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз. Клиническая картина ОА определяется конкретным суставом и группой суставов, вовлеченных в патологический процесс.
Среди неинвазивных методов диагностики гонартроза ведущее место по информативности занимает ультразвуковое двумерное сканирование коленных суставов, которое используют для объективизации и детализации характеристики вторичного синовита, являющегося прогностически неблагоприятным фактором, усугубляющим процессы дегенерации хряща. Наряду с диагностикой наличия синовиальной жидкости можно определить ее характер, особенно над bursa suprapatellaris и появлением жидкости над мыщелками бедренной кости, толщину и характер синовиальной оболочки; при этом ее утолщение при 0,4 см и более, а также контуры суставных поверхностей с учетом однородности контуров хряща на мыщелках бедренной кости и толщину хряща принимают за патологию. Ультразвуковое исследование суставов позволяет также уточнить характер и степень воспалительного процесса для выработки адекватного лечения.
Артроскопия в артрологии для диагностики воспалительных и дегенеративных заболеваний суставов, к сожалению, применяется недостаточно широко и, более того, не выявляет качественных отличий от воспаления синовии при других артритах. Существенно расширяет диагностические возможности артроскопии использование прицельной биопсии, а визуальный контроль позволяет получить фрагмент синовиальной ткани или хряща, наиболее адекватно отражающих развивающийся в суставе патологический процесс, но при этом данная процедура редко показывает распространенность патологического процесса. Артроскопия используется и с лечебной целью — с целью промывания полоски коленного сустава, при которой удаляется хрящевой детрит, а также фрагменты мениска, утолщенной и воспалительной синовии; выполняется аброзивная артропластика при гонартрозе. При коксартрозе ультразвуковое исследование отмечает, наряду с наличием и характером синовиальной жидкости, эхоуплотнение капсулы синовиальной оболочки, хрящевой губы, остеофиты. Однако следует сказать, что как ультразвуковые, так и эндоскопические признаки не могут считаться специфическими при гонартрозе и коксартрозе, поскольку они встречаются и при других заболеваниях суставов, как воспалительного, так и дегенеративного характера.
Основными целями терапии ОА являются: замедление прогрессирования дегенерации хряща и максимально возможное сохранение функции сустава. Терапевтическая тактика при ОА состоит из трех компонентов:
- механическая разгрузка пораженных суставов;
- купирование синовита;
- предотвращение прогрессирования заболевания.
Задачи, которые ставятся при составлении комплекса лечебных мероприятий, можно решать с учетом следующей шкалы приоритетов: болевой синдром, синовит, нарушение трофики суставов и местного кровотока, гипотрофия и гипотония мышц, контрактура.
Режим. Механическая разгрузка сустава является определяющим фактором как в уменьшении болевого синдрома, так и в лечении ОА в целом. Сюда входят рекомендации по исключению длительного пребывания в фиксированной позе, долгого стояния на ногах, длительной ходьбы, повторяющихся стереотипных движений, переноса больших тяжестей, ведущих к механической перегрузке определенных зон суставов. В далеко зашедших стадиях заболевания пациенту полезно ходить с тростью, костылями. При выраженных болях в фазу обострения может быть назначен полупостельный режим.
Диета. Четких патогенетических рекомендаций по диете ОА на настоящий момент не существует. Важным условием в лечении ОА коленных суставов является снижение избыточной массы тела. В последнее время рекомендуются пищевые добавки (глюкозамин, хондроитин и др.), но эффективность их требует клинических подтверждений.
В терапии ОА наиболее часто применяются обезболивающие препараты, нестероидные противовоспалительные препараты (НПВП) и средства с хондропротективными свойствами.
В терапии ОА, который сопровождается болевым и воспалительным синдромами, широко применяются НПВП. В настоящее время известно около 100 НПВП различных классов, но поиск новых лекарственных средств этой группы продолжается. Это связано с потребностью в медикаменте, имеющем оптимальное соотношение обезболивающего и противовоспалительного действия и характеризующемся высокой степенью безопасности. В этом плане большой интерес представляет появившийся на российском рынке препарат ксефокам.
Ксефокам — новый НПВП класса оксикамов.
Подобно другим НПВП, ксефокам обладает обезболивающей и противовоспалительной активностью, связанной с подавлением синтеза простагландинов посредством ингибирования циклооксигеназы (ЦОГ).
Так как большинство НПВП подавляют, как правило, и ЦОГ-1 и ЦОГ-2, то развитие гастропатий, а также нарушение функции почек и агрегации тромбоцитов являются запрограммированным фармакологическим эффектом этих препаратов.
Существует достоверная связь между приемом НПВП и развитием патологии верхних отделов ЖКТ: геморрагий, эрозий, язв в желудке (гастропатий), а также эзофагопатий и дуоденопатий, что проявляется болями или чувством тяжести в эпигастральной области, тошнотой, иногда рвотой, изжогой, дисфагией, метеоризмом, диареей и др. Возможно бессимптомное течение гастропатий, в связи с чем увеличивается риск развития таких серьезных осложнений, как кровотечение и перфорация, нередко ведущих к летальному исходу. Кроме того, длительный прием НПВП вызывает энтеропатии и колонопатии с последующим развитием железодефицитной анемии и гипоальбуминемии.
К образованию эрозий и язв приводит подавление НПВП синтеза простагландинов слизистой ЖКТ, что вызывает:
- уменьшение секреции слизистого геля;
- снижение секреции бикарбонатов;
- ухудшение кровотока в слизистой ЖКТ.
Высокий риск возникновения язв ЖКТ отмечается при продолжительной терапии НПВП, но максимален в первый месяц приема препарата. Снижение риска в дальнейшем объясняется, по-видимому, адаптационными механизмами, благодаря которым гастродуоденальная слизистая приобретает способность противостоять повреждающему действию НПВП.
Полагают, что при приеме НПВП нарушается репарация хряща и субхондральной кости за счет угнетения синтеза простагландинов, в частности в зонах микропереломов, с образованием очагов деструкции и кист. При этом, купируя болевой синдром и явления синовита, НПВП не задерживают дегенеративно-дистрофических изменений в суставных тканях пациента.
Установлено, что селективное ингибирование ЦОГ-2 оказывает незначительный эффект при острой боли. В то же время при острой боли концентрация ЦОГ-1 увеличивается в три-четыре раза, поэтому для анальгетического эффекта может иметь значение ингибирование именно этого изофермента. Таким образом, оптимальным сочетанием анальгетического и противовоспалительного эффекта обладают препараты, ингибирующие как ЦОГ-1, так и ЦОГ-2. Ксефокам является наиболее мощным ингибитором обоих изоферментов. Эта способность ксефокама в 100-200 раз превышает таковую у эталонных НПВП, например у диклофенака и пироксикама. При этом соотношение ингибиторной активности ксефокама в отношении ЦОГ-1 и ЦОГ-2 (мера селективности) занимает срединное положение по сравнению с аналогичными показателями других НПВП, что и обеспечивает баланс анальгетической и противовоспалительной активности ксефокама.
Ксефокам угнетает высвобождение свободных радикалов кислорода из активированных лейкоцитов, что усиливает его анальгетическую и противовоспалительную активность.
Обезболивающий эффект ксефокама отчасти связан с его влиянием на центральную нервную систему. Это подтверждается тем, что внутривенное введение лорноксикама (ксефокама) больным с болями в пояснице повышало уровень эндогенных морфинов при одновременном улучшении состояния. Активация системы нейропептидных опиоидов может быть одним из путей реализации анальгетического эффекта ксефокама. По анальгетическому эффекту ксефокам приравнивается к 20 мг морфина, при этом он не оказывает опиатоподобного действия на ЦНС и не вызывает лекарственной зависимости.
Исследования показали, что в терапевтических дозах ксефокам стимулирует синтез протеогликанов, предотвращая дегенерацию суставного хряща. Эта важная особенность ксефокама делает его препаратом выбора при ОА, поскольку известно, что многие НПВП, напротив, отрицательно влияют на хрящ.
Ксефокам практически весь (на 99%) связывается с белками плазмы, тем не менее он активно проникает в суставные полости, где длительное время (10-12 часов) сохраняется в достаточной терапевтической концентрации — даже когда в плазме его концентрация снижается. Это позволяет принимать препарат всего лишь два раза в день. Благодаря короткому периоду полувыведения из плазмы крови (примерно 4 часа) прием ксефокама сопровождается меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление протекторных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках.
Ксефокам полностью метаболизируется в печени, при этом одна треть его неактивных метаболитов выводится почками, а две трети — печенью и кишечником. Такой двойной путь экскреции снижает нагрузку на данные органы и улучшает переносимость ксефокама. После многократного введения ксефокама не наблюдается его кумуляция в плазме, что снижает риск побочных эффектов по сравнению с НПВП, имеющими более длительный период полувыведения. Фармакокинетика ксефокама примерно одинакова у пожилых людей и лиц молодого или зрелого возраста, поэтому не требуется какой-либо коррекции дозы препарата у пожилых.
Клинические испытания подтвердили высокую эффективность и хорошую переносимость ксефокама у больных ОА. В результате месячного приема лекарства в суточной дозе 16 мг уменьшались боль, длительность утренней скованности, улучшалась функция суставов.
К средствам, модифицирующим течение ОА, относятся препараты, в основе действия которых лежат:
- активация анаболических процессов в матриксе хряща
- подавление активности лизосомальных ферментов
- стимуляция синтетических функций хондроцитов.
Традиционно для лечения ОА использовались парентеральные гликозаминогликаны, однако в последнее время предпочтение отдается пероральным препаратам, а именно глюкозаминсульфату и хондроитинсульфату.
При некупируемом реактивном синовите показана пункция сустава, удаление синовиальной жидкости и внутрисуставное введение глюкокортикоидов, которые ингибируют синтез интерлейкина-1 и фактора некроза опухоли-α, участвующих в воспалении и деградации хряща. Широко используются при этом гидрокортизон, метипред, кеналог и дипроспан. Последние препараты характеризуются более выраженным и пролонгированным лечебным действием. Вместе с глюкокортикоидами возможно введение анестетиков (новокаина, лидокаина), действие которых при этом потенцируется. Введение ингибиторов медиаторов воспаления — контрикала (трасилола) или гордокса — благотворно влияет на метаболизм хряща.
В настоящее время рассматривается вопрос о широком внедрении в практику для подавления локального воспаления внутрисуставного введения ксефокама.
Широко применяемые для восстановительного лечения ОА физиотерапевтические методы уменьшают болевой синдром, а также воспалительные процессы и мышечный спазм, улучшают микроциркуляцию, благоприятно воздействуют на метаболические процессы в тканях сустава. При этом используются ультрафиолетовое облучение, электрические токи, переменные магнитные поля, электрофорез и фонофорез лекарственных средств на суставы. При пролиферативных явлениях, вазотрофических расстройствах и контрактурах показаны тепловые процедуры, включая аппликации парафина, озокерита, иловой и торфяной грязи. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. Для укрепления мышц рекомендуется применение электромиостимуляции.
При выполнении лечебного массажа больным ОА следует избегать механического раздражения суставной капсулы, обращая особое внимание на работу с прилегающими к суставу мышцами. Тогда снижается болевой мышечный спазм, повышается тонус ослабленных групп мышц, усиливается трофика пораженных суставов и улучшаются функциональные способности больного.
При выраженном длительном болевом синдроме, не купируемом традиционными средствами, а также при значительных нарушениях функции сустава применяется хирургическое лечение чаще всего на коленных и тазобедренных суставах. Кардинальной операцией является эндопротезирование сустава. Хорошо зарекомендовали себя эндопротезы, в которых узел скольжения состоит из пары металл–полиэтилен.
Важную роль в профилактике ОА играет выявление и своевременная ортопедическая коррекция врожденных аномалий: вывиха бедра, варусной и вальгусной установки голеней, плоскостопия и др. В профессиональной деятельности необходимо исключить длительные статические и стереотипные механические перегрузки суставов. Существенным условием профилактики ОА коленных суставов является нормализация избыточной массы тела.
Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалисты
проконсультируют Вас.

Деформирующий артроз (остеоартроз) – это заболевание, при котором происходит разрушение и истончение суставной хрящевой ткани. Патологический процесс сопровождается разрастанием и деформацией костной ткани, что выражается в изменении внешнего вида кости. В запущенных формах болезнь может приводить к частичной или полной утрате двигательной функции и инвалидности.
Самые распространённые виды остеоартроза получили собственные названия. Так для обозначения артроза тазобедренного сустава используется термин коксартроз, а заболевание, при котором страдает коленный сустав, получило название гонартроз.
Основным симптомом заболевания является боль в пораженных суставах и мышцах вокруг них. На начальной стадии заболевания боль слабая и возникает только в случае повышенной нагрузки на сустав. Со временем заболевание прогрессирует и любое даже незначительное движение сопровождается локальной болью в пораженной области.
Следует помнить, что любая боль, возникающая в суставах, может быть признаком серьезного заболевания, в том числе деформирующего артроза. Именно поэтому при первых симптомах заболевания следует обратиться к врачу травматологу-ортопеду.
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья. Телефон для записи +7 (495) 292-39-72
Основными причинами возникновения остеоартроза являются:
- переохлаждение;
- повышенные или, наоборот, чересчур низкие физические нагрузки;
- различные травмы;
- пожилой возраст.

В зависимости от причины возникновения различают первичный и вторичный деформирующий артроз. Первичным артроз считают, если структурные изменения в суставном хряще происходят без видимой причины. Вторичный артроз развивается в случае травмы или как следствие какого-либо заболевания (асептического некроза головки бедренной кости, ревматоидного артрита и т. д.).
В зависимости выраженности патологических изменений, различают три стадии заболевания:
- Стадия компенсации. На этой стадии возникают небольшие структурные изменения хряща. Он мутнеет, теряет эластичность. Возникают боли после повышенных нагрузок, однако рентгенография пока еще не может выявить начавшиеся разрушение. Консервативное лечение наиболее эффективно именно на этой стадии.
- Стадия субкомпенсации. Хрящ истончается, разрыхленные участки разрастаются, образуя дефекты. Участок кости, прилегающий к хрящу, становится плотнее, нарушая питание хряща. Форма кости деформируется, появляются кисты. Возникают боли даже при легких нагрузках на сустав и при ходьбе. Рентгеновский снимок показывает наличие изменений в костной ткани. Эта стадия заболевания уже с трудом поддается консервативному лечению.
- Стадия декомпенсации. Эта стадия характеризуется частичным или полным разрушением хряща. На этой стадии происходит видимое увеличение объема сустава, что значительно ограничивает движение. Начинается воспаление внутрисуставных структур. Эти и многие другие изменения приводят к возникновению постоянной боли, которая теперь возникает не только при движениях, но и в состоянии покоя. Рентген фиксирует отсутствие просвета между суставами, что говорит о значительном износе хряща или его полном отсутствии. На этой стадии заболевание уже не поддаётся лекарственной терапии. Единственно возможным способом лечения остается оперативное вмешательство и замена пораженного сустава на искусственный с помощью операции эндопротезирования.
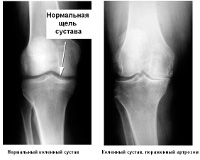
На начальной стадии деформирующий артроз доставляет минимум дискомфорта и поддается консервативному лечению. Именно поэтому так важно вовремя обратиться к врачу при возникновении первых болей в области сустава.
В зависимости от результатов исследования ортопед назначит эффективный в данном случае вид лечения. Метод выбранной терапии зависит от стадии заболевания, его локализации и причины возникновения.
Узнать подробности и записаться на прием к специалисту вы можете по телефону +7 (495) 292-39-72

- Немедикаментозные методы
- Медикаментозное лечение
- Хирургическое лечение
Для лечения деформирующего артроза на разных стадиях используются разные методы. Начинают лечение болезни с использования немедикаментозных мероприятий. Часто одного только изменения образа жизни достаточно, чтобы остановить развитие заболевания. Когда появляется боль, используют медикаментозную терапию. На определенном этапе болезни человеку может потребоваться хирургическое лечение.
Немедикаментозные методы
На начальной стадии артроза можно обойтись одними только немедикаментозными мероприятиями, если нет болевого синдрома. Чтобы замедлить развитие болезни, необходимо сделать следующее:

похудеть, если имеется избыточный вес;
повысить физическую активность;
укрепить мышцы ног, в первую очередь четырехглавую мышцу бедра;
меньше нагружать больной сустав.
Если деформирующий артроз уже имеет клинические проявления, то немедикаментозные мероприятия используются вместе с препаратами. Используется лечебная физкультура, физиотерапия. Пациентам рекомендована низкокалорийная диета, использование ортезов и тейпов.
Медикаментозное лечение
Препараты используются с целью уменьшения болевого синдрома, а также замедления прогрессирования деформирующего артроза. Они используются в различных формах. Основные способы применения предполагают нанесение на кожу, приём внутрь или выполнение внутрисуставных инъекций.
С целью обезболивания используют нестероидные противовоспалительные средства (НПВС), в редких случаях прибегают к помощи наркотических анальгетиков (опиатов).
НПВС позволяют уменьшить боль. При этом они не оказывают лечебного эффекта. Препараты данной группы не замедляют развитие остеоартроза. Все НПВС в той или иной степени вредят здоровью при долговременном приеме. Большинство из них провоцируют язву желудка, увеличивают риск кишечных кровотечений. Некоторые повышают сердечно-сосудистые риски или вредны для печени.
Поэтому при лечении НПВС исповедуются такие основные принципы:

их следует принимать, только если это действительно необходимо (пациент страдает от боли в суставах);
дозы должны быть минимальными;
по возможности НПВС стоит заменить другими средствами и методами, уменьшающими боль, либо дополнительное использование других процедур и препаратов должно позволять пациенту уменьшить дозу нестероидных противовоспалительных средств.
НПВС могут использоваться не только внутрь, но и местно, в виде геля или крема. Это более безопасно, но менее эффективно. Хотя нередко комбинация местной лекарственной формы и таблеток дает возможность уменьшить дозу лекарств для приема внутрь, что в свою очередь позволяет снизить риск осложнений.
Эта группа включает два препарата: хондроитин и глюкозамин. Они выпускаются в огромном количестве лекарственных форм. Есть кремы с хондропротекторами, таблетки, капсулы, растворы для парентерального введения. Но в применении местных средств и уколов нет смысла. Локальные формы не работают, а инъекции нецелесообразны из-за большой продолжительности курса терапии.
Хондропротекторы обычно назначают пожизненно. Эффект от их приема развивается медленно. Первые результаты человек может ощутить только через 3-6 месяцев. Тем не менее, они уменьшают боль, улучшают метаболизм хрящевой ткани, и при этом на 100% безопасны для организма. Поэтому многие врачи назначают глюкозамин и хондроитин в таблетках, несмотря на не слишком убедительную доказательную базу в отношении эффективности этих препаратов при деформирующем артрозе.
Методика основана на внутрисуставном введении двух препаратов:
гиалуроновая кислота – выполняет функцию смазки для суставов, улучшает состав синовиальной жидкости, уменьшает трение суставных поверхностей, снижает или устраняет болевой синдром на 6-12 месяцев;
богатая тромбоцитами плазма – стимулирует регенераторные процессы в хрящевой ткани.
Гиалуронат покупают в аптеке. Богатую тромбоцитами плазму готовят из крови пациента. Из неё удаляются все лишние форменные элементы и часть жидкости. Остается большое количество тромбоцитов. При их введении в сустав выделяются факторы роста, которые обеспечивают репарацию (восстановление) хрящевой ткани.
Используются только в крайних случаях. Могут вводиться лишь в колено, не чаще чем 2-3 раза в год. Введение глюкокортикоидов проводится только в случае присоединения воспалительного процесса в суставе с выраженным болевым синдромом. Этих препаратов по возможности стараются избегать из-за негативного влияния на метаболизм хрящевой ткани.
При деформирующем артрозе иногда используются бисфосфонаты, психотропные препараты, ингибиторы металлопротеиназ, фибринолитики, кальцитонин, антиоксиданты, ингибиторы провоспалительных цитокинов. Реже назначают корректоры микроциркуляции, метаболические средства.
Хирургическое лечение
Если консервативное лечение перестало работать, приходится прибегать к помощи хирургов. Рассмотрим основные группы операций, которые могут проводиться при деформирующем артрозе.
Артроскопия – это общее название для операций, которые проводятся малоинвазивным методом. В ходе таких вмешательств врач через миниатюрные разрезы вводит внутрь сустава инструменты и камеру с освещением. При помощи манипуляторов он выполняет необходимые действия. Контролирует он их, отслеживая изображение на мониторе.
При артрозе возможно проведение во время артроскопии таких действий:

промывание сустава или лаваж;
полировка гиалинового хряща;
нанесение на субхондральную кость отверстий;
удаление свободно располагающихся внутри сустава тел;
резекция дегенеративно измененных тканей, в том числе менисков;
иссечение синовиальной оболочки.
Операция ставит своей целью уменьшение боли, улучшение функциональности сустава. Артроскопия имеет и диагностическую цель. После тщательного изучения суставной полости врач может назначить корригирующую остеотомию (иссечение костной ткани), стабилизирующую операцию, мозаичную артропластику.
При деформирующем артрозе появляются дефекты суставной поверхности. Это места, где хрящ истончён или вовсе отсутствует. Для нормального функционирования сустава и уменьшения боли важно, чтобы хрящ был полноценным и покрывал всю суставную поверхность кости. Некоторые операции позволяют восстановить суставную поверхность. Большинство хирургических вмешательств проводится артроскопическим методом.
Все операции направлены на достижение одной из двух целей:
1. Стимуляция костного мозга. Внутри сустава должен образоваться кровяной сгусток, в который будут мигрировать стволовые клетки. Они превратятся в хондробласты, замещая дефект хрящевой ткани.
2. Имплантация (вживление, пересадка) хондроцитов, либо клеток, способных к хондрогенезу (стимуляции образования хряща).
Для стимуляции костного мозга используют:
шейвирование – иссечение хряща до здоровой ткани без обнажения субхондральной кости;
абразивная хондропластика – аналогичное вмешательство, выполняемое посредством артроскопии;
микрофрактуринг – создание множественных отверстий в субхондральной кости глубиной около 3 мм;
туннелизация – врач рассверливает обнаженные участки субхондральной кости, делая тонкие каналы глубиной до 3 см.
После перфорации субхондральной кости из неё начинают выходить в полость сустава стволовые клетки, которые продуцируются костным мозгом. Происходит разрастание фиброзной ткани. Тем не менее, по своим характеристикам она значительно уступает гиалиновому хрящу. Поэтому эффект временный, в дальнейшем артроз будет прогрессировать.
Более современными методами является имплантация хондроцитов, либо клеток, обладающих хондрогенным потенциалом. В этом случае дефект суставной поверхности закрывает не фиброзный, а гиалиновый хрящ. Варианты лечения:
пересадка аллотрансплантатов (донорских хрящей);
мозаичная костно-хрящевая аутопластика – пересадка собственных хрящей из донорских участков тела, возможно при дефекте суставной поверхности не более 4 квадратных сантиметров;
имплантация фиксированных на матрице культивированных аутохондроцитов (берут небольшой фрагмент хряща, выращивают в лаборатории, придают нужную форму и при повторной операции пересаживают в сустав) – метод очень дорогой и применяется только в экономически развитых странах.
Практически все хирургические методы, кроме эндопротезирования, дают лишь временный эффект. Поэтому в основном используется такая тактика ведения пациентов с деформирующим артрозом:

1. Пациента лечат консервативными методами, пока это возможно. То есть, пока сохраняется подвижность сустава, отсутствует боль или она может быть купирована медицинскими препаратами.
2. Если качество жизни значительно снижается на фоне прогрессирования заболевания, выполняется эндопротезирование. Собственный разрушенный сустав удаляют, на его место устанавливают искусственный эндопротез.
Современные методы эндопротезирования дают отличные результаты в подавляющем большинстве случаев. Современные эндопротезы служат десятилетиями. Использование компьютерных навигационных систем позволяет установить искусственный сустав идеально точно, тем самым избежав его нестабильности или расшатывания в будущем. Разработаны малоинвазивные методы эндопротезирования со значительно меньшим повреждением мягких тканей в ходе проведения операции. Это уменьшает кровопотерю, снижает риск послеоперационных осложнений и улучшает переносимость послеоперационного периода. Быстрее проходит ранний период реабилитации, в ходе которого заживают мягкие ткани.
Полное восстановление занимает в среднем полгода. По истечению этого времени становится возможной максимальная нагрузка на прооперированный сустав. Эндопротезы последних поколений обладают высокой износостойкостью и функциональностью. Они не стесняют движений человека и не провоцируют воспалительных реакций.
Читайте также:


