Как делают операцию на мышечный мостик
… являются одной из причин нарушения коронарного кровообращения с развитием ишемии миокарда вплоть до некроза.
ММ появляются в эмбриональный период развития параллельно с формированием коронарных артерий и представляют собой вариант нормы или врожденную анатомическую аномалию развития и формирования сосудистой системы сердца и миокарда. По данным морфологических исследований, длина ММ колеблется от 4 до 40 мм (наиболее часто от 10 до 19 мм), толщина в среднем составляет 2,8 мм.
ММ - частая находка, их обнаруживают в 30%случаев всех аутопсий, при этом при ангиографии они обнаруживаются в 5% случаев, возможно из-за того, что тонкие ММ вызывают незначительную компрессию коронарных артерий во время систолыи не видны при коронарографии (после использования провокационных тестов - внутрикоронарное введение ацетилхолина или эргометрина, способствующих систолическому сжатию туннелированной артерии, увеличивающих силу и частоту сердечных сокращений, - частота обнаружения ММ при ангиографии может возрастать до 40%).
Поскольку ММ – это частая находка при аутопсии в норме, некоторые авторы считают её доброкачественным анатомическим изменением. Данная мальформация присутствует с рождения, но ей клинические симптомы обычно не развиваются до третьей декады жизни.
Наличие систолического сужения просвета артерии в месте ММ может вызвать нарушение коронарного кровотока, несмотря на то, что для кровоснабжения миокарда определяющее значение имеет кровоток в диастолу. Установлена связь наличия ММ с приступами стенокардии, инфарктом миокарда и внезапной смертью после значительной физической нагрузки, особенно при наличии гипертрофии миокарда левого желудочка и тахикардии. Ишемия миокарда, инфаркт, внезапная сердечная смерть у детей, подростков и молодых людей очень редко вызываются атеросклерозом, зачастую причиной такой патологии в детском и юном возрасте становятся аномалии коронарных артерий, в том числе и их интрамуральное расположение. Факторами, способствующими развитию ишемии миокарда, являются коронарный спазм, тахикардия, возникающая при физических нагрузках и уменьшающая продолжительность диастолического наполнения коронарных артерий, тромбоз в месте ММ.
Клинически наличие глубоко расположенных ММ может проявляться болями стенокардического характера, инфарктом миокарда, желудочковыми нарушениями ритма, преходящей атриовентрикулярной блокадой, внезапной остановкой сердца. Эти осложнения очень редки и, вероятно, связаны с выраженной компрессией коронарных сосудов при глубоком залегании в толще миокарда. Нагрузочные тесты могут индуцировать появление на ЭКГ неспецифических признаков ишемии миокарда, нарушение внутри-желудочковой проводимости или аритмии, которые на ЭКГ покоя не регистрировали. Диагноз клинически выраженного ММ должен быть поставлен у пациентов, которые имеют стенокардию без традиционных факторов риска и признаков ишемии.
Значимость систолического и диастолического сужения может подтвердить внутрисосудистое ультразвуковое исследование (ВСУЗИ), которое может измерить не только диаметр, но и площадь просвета при несферическом просвете сосуда. Мультиспиральная компьютерная томография (МСКТ) также является эффективным неинвазивным методом диагностики ММ, с помощью которого можно определить длину и глубину расположения туннелированной артерии, ее диаметр и процент стеноза на уровне ММ во время систолы и диастолы. Кроме того, МСКТ эффективна для визуализации других аномалий коронарных артерий, миокарда, эпикарда и близлежащих образований грудной клетки.
Медикаментозная терапия должна включать бета-блокаторы, блокаторы кальциевых каналов и антитромбоцитарные агенты. Цель терапии – освобождение от симптомов и признаков ишемии миокарда, профилактика будущих коронарных событий. Обычно в качестве препаратов первой линии применяют бета-блокаторы. ! Важно помнить, что нитраты могут ухудшать состояние таких пациентов, а нагрузка жидкостью, напротив, – увеличивать сопротивление сосудов к компрессии и уменьшать ишемию. Следовательно, классические антиангинальные подходы в случае ишемии, обусловленной интрамуральным прохождением коронарной артерии, не только неэффективны,но и могут усугубить нарушения перфузии миокарда.
У больных, рефрактерных к фармакотерапии, используется хирургическое рассечение мышечных мостиков, аортокоронарное шунтирование и стентирование данного сегмента коронарной артерии. Показания к стентированию или хирургическому лечению при наличии клинически значимого ММ можно выставить, когда доказаны клинические проявления ишемии миокарда. Для этого применяются нагрузочные тесты, стресс-эхокардиография, суточное мониторирование ЭКГ и радиоизотопные методы с физической нагрузкой. Необходимо отметить, что стентирование коронарных артерий часто (в 50% случаев) связано с рестенозами и перипроцедурными осложнениями (Mohlenkamp S, Hort W, Ge J, Erbel R.; 2002).
Рекомендации для спортсменов:
-
1. Спортсмены с ММ при условии отсутствия ишемии миокарда в покое и при физической нагрузке могут быть допущены к занятиям всеми видами спорта.
2. Спортсмены с ММ и объективными признаками скрытой ишемии миокарда или перенесенным инфарктом миокарда в анамнезе могут быть допущены к занятиям низкоинтенсивными видами спорта (класс IA).
3. Спортсмены, перенесшие операцию по рассечению мышечных мостиков или стентирование, могут быть допущены к занятиям низкоинтенсивными видами спорта на срок не менее 6 мес после вмешательства. Асимптомным спортсменам для решения вопроса о допуске к занятиям спортом необходимо проведение нагрузочного теста. В случае нормальной толерантности к физической нагрузке и отсутствии признаков скрытой ишемии миокарда спортсмены могут быть допущены к занятиям всеми видами спорта.
Аннотация научной статьи по клинической медицине, автор научной работы — Андреев Сергей Леонидович, Шипулин Владимир Митрофанович, Александрова Екатерина Александровна, Гуля Марина Олеговна
Представлен клинический случай диагностики, лечения и динамического наблюдения мышечного мостика передней нисходящей артерии у пациента молодого возраста. Показано и обсуждено развитие осложнений заболевания с дальнейшим успешным хирургическим лечением.
Похожие темы научных работ по клинической медицине , автор научной работы — Андреев Сергей Леонидович, Шипулин Владимир Митрофанович, Александрова Екатерина Александровна, Гуля Марина Олеговна
Myocardial muscle bridge: complications and treatment (clinical case)
The article presents clinical case illustrating diagnosis, treatment, and dynamic follow-up of a young patient with the left anterior descending coronary artery muscular bridge. The authors demonstrate and discuss the development of complications with further successful surgical treatment.
инсультов в Российской Федерации / под ред. В.И. Скворцовой. - М. : Литтерра, 2008. - 192 с.
6. Способ клинического определения вероятности наличия перенесенного "немого" инсульта у пациентов с артериальной гипертонией : приоритетная справка № 2013137008 от 6 августа 2013 г. / Обладатель СибГМУ совместно с авторами: Л.И. Тюкалова, М.А. Лукьянова, Н.А. Заутнер.
7. Girerd X., Giral P. Risk stratification for the prevention of cardiovascular complications of Hypertension // Curr. Med. Res. Opin. - 2004. - Vol. 20(7). - P. 1137-1142.
8. Hacke W., Kaste M., Olsen T.S., Orgogozo J.-M. et al. European Stroke Initiative recommendations for stroke management. Organization of stroke care // J. Neurol. - 2000. - P. 732-748.
9. Haffner S.M. Obesity and the metabolic syndrome: the San Antonio Heart Study // Br. J. Nutr. - 2000. - Vol. 83, suppl. 1. -P. 67-70.
10. Leonardi-Bee J., Bath P., Phillips S.J., Sandercock P. Blood pressure and clinical outcomes in the International Stroke Trial // Stroke. - 2002. - Vol. 33. - P. 1315-1320.
11. Wong E., Hachinski V. Closing remarks: on stroke prevention guidelines, organization of care and future perspectives // Stroke Prevention / ed. by B. Gorelick. - Oxford, 2002. - P. 255-257.
Сведения об авторах
Тюкалова Людмила Ивановна, докт. мед. наук, профессор, заведующая кафедрой поликлинической терапии
МИОКАРДИАЛЬНЫЙ МЫШЕЧНЫЙ МОСТИК: ОСЛОЖНЕНИЯ И ЛЕЧЕНИЕ
СЛ. Андреев, В.М. Шипулин, Е.А. Александрова, М.О. Гуля
ФГБУ "НИИ кардиологии" СО РАМН, Томск E-mail: anselen@rambler.ru
MYOCARDIAL MUSCLE BRIDGE: COMPLICATIONS AND TREATMENT
S.L. Andreev, V.M. Shipulin, E.A. Alexandrova, M.O. Gulya
Federal State Budgetary Institution "Research Institute for Cardiology" of Siberian Branch under the Russian Academy of Medical Sciences, Tomsk
Представлен клинический случай диагностики, лечения и динамического наблюдения мышечного мостика передней нисходящей артерии у пациента молодого возраста. Показано и обсуждено развитие осложнений заболевания с дальнейшим успешным хирургическим лечением.
Ключевые слова: миокардиальный мышечный мостик, ишемическая болезнь сердца, постинфарктное ремоде-лирование левого желудочка, резекция аневризмы левого желудочка.
The article presents clinical case illustrating diagnosis, treatment, and dynamic follow-up of a young patient with the left anterior descending coronary artery muscular bridge. The authors demonstrate and discuss the development of complications with further successful surgical treatment.
Key words: myocardial muscle bridge, coronary artery disease, postinfarction left ventricular remodeling, left ventricular aneurysm resection.
С.Л. Андреев и соавт.
МИОКАРДИАЛЬНЫЙ МЫШЕЧНЫЙ МОСТИК: ОСЛОЖНЕНИЯ И ЛЕЧЕНИЕ..
Миокардиальными мышечными мостиками (ММ) называется одна из самых распространенных врожденных патологий коронарных артерий (КА), при которой сосуд частично локализуется в толще миокарда, а не непосредственно под эпикардом. Типичное расположение - средняя треть передней нисходящей артерии (ПНА). Эта врожденная аномалия ассоциируется с ишемией миокарда, нарушением проводимости, инфарктом миокарда и внезапной смертью [11].
Патофизиологически ММ характеризуется наружным сжатием сосуда в фазу систолы с уменьшением или полным прекращением антероградного кровотока в систолу и даже возникновением ретроградного тока крови. Кроме того, в связи с затрудненным или ретроградным кровотоком в указанном сегменте участок КА, сдавливаемый ММ, более склонен к эндотелиальной дисфункции, атеросклерозу и тромбозу [5].
По распространенности ММ в миокарде присутствуют практически у трети взрослых людей, хотя далеко не все из них настолько выражены, что могут оказывать влияние на клиническое состояние больного и проявляться симптомами нарушения перфузии сердца [11]. Гемодина-мически значимые ММ во время коронарографии обнаруживаются у 0,5-4,9% больных [4].
В случае клинической значимости ММ больным показано лечение препаратами с отрицательными ино- и хронотропным эффектами, такими как р-адреноблока-торы или антагонисты кальциевых каналов, либо их комбинацией. В случаях, рефрактерных к фармакотерапии, используется чрескожное коронарное вмешательство (стентирование данного сегмента артерии) или аорто-коронарное шунтирование. Возможно проведение мио-томии (рассечение "мостика"). В случае возникновения осложнений (нарушения ритма, аневризмы левого желудочка) - симптоматическое лечение [4, 6].
Цель исследования: представить клинический случай диагностики ММ у пациента молодого возраста с осложненным течением и определить последующую тактику его лечения.
Пациент К., 23 лет, поступил в отделение сердечнососудистой хирургии ФГБУ "НИИ кардиологии" СО РАМН в апреле 2013 г. с основным диагнозом - ишемическая болезнь сердца (ИБС): стенокардия напряжения II функционального класса. Постинфарктный кардиосклероз (23.09.2011 г.). Хроническая аневризма верхушки левого желудочка (ЛЖ), передней стенки и межжелудочковой перегородки. Пристеночный тромб ЛЖ. Желудочковая эк-страсистолия 4а градации по Lown. Хроническая сердечная недостаточность 11А стадии, I функционального класса по Нью-Йоркской классификации. Предъявлял жалобы на боли в области сердца при значительной физической нагрузке с одышкой, снижение трудоспособности.
Из анамнеза выяснено, что 23.09.2011 г. больной на фоне интенсивной физической нагрузки почувствовал жгучие, нестерпимые боли в области сердца. По скорой медицинской помощи был доставлен в кардиологичес-
кий стационар, где по данным электрокардиограммы зафиксирован острый крупноочаговый передне-перегородочный инфаркт миокарда. Проводилась специализированная антиангинальная, тромболитическая и антикоа-гулянтная терапия. Выполнено ультразвуковое исследование сердца, где отмечено, что фракция выброса (ФВ) ЛЖ не снижена, полости сердца не расширены; в области верхушки левого желудочка и передне-перегородочного сегмента участки а- и гипокинезии, картина формирующейся аневризмы верхушки ЛЖ. Выполнено коро-нарографическое исследование, где установлено наличие мышечного мостика в средней трети передней нисходящей артерии со стенозом во время систолы до 60-70% (рис. 1). После курса консервативного стационарного лечения пациент был выписан с рекомендациями к приему р-блокаторов, антагонистов кальция и антиагреган-тов.
После госпитализации в апреле 2013 г. пациенту в стационаре выполнили ультразвуковое исследование сердца, было дано заключение - выраженная дилатация ЛЖ: конечный диастолический объем (КДО) 163 мл, размеры других камер в норме. Мышечно-фиброзная аневризма верхушки ЛЖ и прилежащих к ней части передних отделов межжелудочковой и передней стенки ЛЖ объемом 56 мл; стенка аневризмы значительно истончена (до 2,53 мм) в передних и боковых отделах верхушки, меньше -в других отделах; в передних отделах МЖп зоны истончения перемежаются с зонами с относительно сохраненной толщиной миокарда. Гипокинез задних отделов МЖП. Пристеночный тромб 42x58x10 мм, выстилающий полость аневризмы в области верхушки ЛЖ. ФВ ЛЖ умеренно снижена (по Симпсону 36%). Замедление расслабления ЛЖ. Структура и функция клапанов не нарушена.
Повторно выполнена коронарография, на фоне медикаментозной терапии наличие гемодинамически значимых стенозов не выявлено.
В мае 2013 г. пациенту выполнено оперативное лечение в объеме резекции аневризмы ЛЖ с реконструкцией по Мениканти и тромбэндокардэктомия из ЛЖ. Размер тромба, измеренный интраоперационно, составил 45*60*12 мм (рис. 2). Состояние пациента в послеоперационном периоде стабильное, лечение плановое.
В дальнейшем пациент проходил контрольные обследования после операции в сроки через 2 недели, 6 мес. и 12 мес. За время наблюдения пациент отмечал стабильное состояние, стенокардию напряжения на уровне 1-11 функционального класса, периодические перебои в работе сердца. Продолжал получать консервативное лечение в виде р-блокаторов, антагонистов кальция, антиаг-
Динамика эхокардиографических показателей пациента К.
Показатели До операции 2 недели 6 мес. 12 мес.
КДО, мл 163 128 120 118
КДИ 83,7 65,7 61,6 60,6
КСИ 53,4 38 34,9 35,4
ФВ ЛЖ, % 36 42 43 42
Ударный объем, мл 59 54 52 49
Рис. 1. Коронарография пациента К. А - фаза систолы. Стрелкой показан ММ в средней трети ПНА с гемодинамически значимым сужением. Б - фаза диастолы. Стеноз в ПНА не отмечен
регантов и антиаритмических средств. Пациенту выполнялись общеклинические исследования, магнитно-резонансная томография сердца с контрастированием полостей сердца, спировелоэргометрия с определением объема потребления кислорода на кг массы тела в минуту и сцинтиграфия миокарда с 99мТС-Технетрилом.
При спировелоэргометрии с подсчетом объема потребления кислорода на кг массы тела в минуту до операции отмечен показатель 16,3, через 6 мес. результат вырос до 18,2 и оставался на прежнем уровне через 12 мес. - 18,0.
Отмечено снижение дефекта перфузии миокарда ЛЖ по данным сцинтиграфии с 40 до 32% до операции и через 12 мес. после нее.
Касательно эхокардиографической динамики отмечалось постепенное увеличение ФВ с сокращением объемов ЛЖ. Динамика изменений эхокардиографических показателей пациента К. приведена в таблице 1.
Патология КА в виде ММ, по данным различных авторов, варьируется достаточно широко - в зарубежной литературе частота их выявления, по материалам вскрытий, - от 5,4 до 85,7% [12].
Тем не менее, несмотря на довольно частую встречаемость, в большинстве случаев ММ клинически не проявляются и не приводят к каким-либо осложнениям. Так, в 1995 г. У Ди1Шег1 и соавт. [9] изучили отдаленные результаты у 28 больных с ММ на коронарограмме, что составило 0,82% от всех исследований, выполненных за 8-летний период. Пациенты были разделены на 2 группы в зависимости от степени систолического сужения до и более 50%. Через 11 лет ни у одного из пациентов не воз-
никло инфаркта миокарда. 71% пациентов 1-й группы и половина больных 2-й группы (степень сужения более 50%) чувствовали себя удовлетворительно. Однако 70% пациентов 2-й группы имели клинические симптомы стенокардии, в связи с чем требовался прием антиангиналь-ных препаратов.
По данным испанских авторов I. Lozano и соавт. [10], в течение 4 лет были прослежены 35 больных с ММ без ИБС. Все пациенты имели хороший отдаленный прогноз, однако большей половине из них из-за наличия атипичного болевого синдрома была необходима регулярная терапия р-блокаторами или антагонистами кальция.
Стоит отметить, что нитроглицерин не используется для лечения данной группы больных, он увеличивает степень систолического сужения артерии в области мостика, а нагрузка жидкостью, напротив, увеличивает сопротивление сосудов к компрессии и уменьшает ишемию. Следовательно, классические антиангинальные подходы в случае ишемии, обусловленной интрамуральным прохождением коронарной артерии, не только неэффективны, но и могут усугубить нарушения перфузии миокарда [11]. Таким больным показано лечение препаратами с отрицательными ино- и хронотропным эффектами, такими как р-адреноблокаторы или антагонисты кальциевых каналов, либо их комбинацией [7]. Антиишемичес-кое действие этих препаратов определяется снижением потребности миокарда в кислороде, уменьшением внут-римиокардиального давления и экстрасосудистой коронарной сопротивляемости.
Кроме того, педиатры и кардиологи должны помнить, что ишемия миокарда, инфаркт, внезапная сердечная смерть у детей, подростков и молодых людей очень редко вызываются атеросклерозом и тромбозом сосудов; зачастую причиной такой патологии в детском и юном воз-
А.Ю. Шаманаев и соавт.
ВЛИЯНИЕ КОМПОЗИЦИИ ДИГИДРОКВЕРЦЕТИНА И АРАБИНОГАЛАКТАНА.
расте становятся аномалии коронарных артерий, в том числе и их интрамуральное расположение [1].
В случаях, рефрактерных к фармакотерапии, используется чрескожное коронарное вмешательство (стенти-рование данного сегмента артерии) или аортокоронар-ное шунтирование. Ранее широко использовалось проведение миотомии в виде рассечения "мостика", но, по данным современной литературы, к данному способу прибегают все реже из-за невысокой эффективности и травматизации миокарда [2]. При развитии осложнений проводится симптоматическое лечение [3].
Представленный клинический пример является во многом показательным, манифестация патологии проявилась у пациента в виде острого инфаркта миокарда в возрасте 21 года. Не менее типично расположение ММ со стенозом до 70% в средней трети ПНА по данным ко-ронарографии. Несмотря на консервативное лечение, заболевание осложнилось возникновением аневризмы верхушки ЛЖ и тромбозом полости ЛЖ, возникновением частой экстрасистолии. При повторной коронарог-рафии через 1,5 года после острого инфаркта миокарда значимых стенозов КА выявлено не было, это может быть объяснено медикаментозной терапией (провокационные пробы во время исследования не проводились) и выраженным снижением сократимости миокарда ЛЖ в бассейне ПНА в виде гипо- и акинезии, что, очевидно, привело к снижению давления ММ на стенку артерии.
Хирургическая тактика была обусловлена необходимостью удаления тромба ЛЖ и борьбы с постинфарктным ремоделированием ЛЖ в виде реконструкции его в модификации Мениканти. Послеоперационный период наблюдения в течение 12 мес. показал эффективность хирургического лечения, что отобразилось на инструментальных показателях работы сердца.
Таким образом, наличие ММ является важным фактором возникновения ИБС и возможных осложнений, особенно у пациентов молодого возраста. Знания о данной патологии и использование в дифференциальной диагностике является необходимым в практике кардиологов и педиатров.
1. Белозеров Ю.М. Инфаркт миокарда у детей // Российский вестник перинатологии и педиатрии. - 1996. - № 3. -С. 36-40.
2. Бокерия Л.А., Суханов С.Г., Стерник Л.И., Шатахян М.П. Ми-окардиальные мостики. - М. : НЦССХ им. А.Н. Бакулева РАМН, 2013. - 158 с.
3. Карташева А. Мышечные мостики миокарда // Medicine review. - 2008. - Т. 1(01). - С. 60-61.
4. Мазур Н.А. Факторы риска внезапной кардиальной смерти у больных молодого возраста и меры по профилактике // Рус. мед. журнал. - 2003. - Т. 11, № 19. - С. 1077-1079.
5. Berry J.F., von Mering G.O., Schmalfuss C. et al. Systolic compression of the left anterior descending coronary artery: a case series, review of the literature, and therapeutic options including stenting // Cath. Cardiovasc. Intervent. - 2002. -Vol. 56. - P. 58-63.
6. Bose D., Philipp S. High-Resolution Imaging of Myocardial Bridging // New England Journal of Medicine. - 2008. - Vol. 4.
7. Elyonassi B., Kendoussi M., Khatouri A. et al. Muscle bridge and myocardial ischemia. Study of 6 cases // Ann. Cardiol. Angiol. -1998. - Vol. 47, No. 7. - P. 459-463.
8. Hongo Y., Tada H., Ito K. et al. Augmentation of vessel squeezing at coronary myocardial bridge by nitroglycerin: study by quantitative coronary angiography and intravascular ultrasound // Am. Heart J. - 1999. - Vol. 138, No. 2. - P. 345-350.
9. Juilliere Y., Berder V., Suty-Selton C. et al. Isolated myocardial bridges with angiographic milking of the left anterior descending coronary artery: a long-term follow-up study // Am. Heart J. - 1995. - Vol. 129, No. 4. - P. 663-665.
10. Lozano I., Baz J.A., Lopez-Palop R. et al. Long-term prognosis of patients with myocardial bridge and angiographic milking of the left anterior descending coronary artery // Rev. Esp. Cardiol.
- 2002. - Vol. 55, No. 4. - P. 359-364.
11. Mohlenkamp S., Hort W., Ge J., Erbel R. Update on Myocardial Bridging // Circulation. - 2002. - Vol. 106. - P. 2616-2622.
12. Venkateushu K.V., Mysorekar V.R., Sanikop M.B. Myocardial bridges // J. Indian Med. Ass. - 2000. - Vol. 98, No. 11. - P. 691693.
Сведения об авторах
Андреев Сергей Леонидович, младший научный сотрудник отделения сердечно-сосудистой хирургии ФГБУ "НИИ кардиологии" СО РАМН. Адрес: 634012, г. Томск, ул. Киевская, 111а. E-mail: anselen@rambler.ru
Шипулин Владимир Митрофанович, докт. мед. наук, профессор, руководитель отделения сердечно-сосудистой хирургии ФГБУ "НИИ кардиологии" СО РАМН. Адрес: 634012, г. Томск, ул. Киевская, 111а. E-mail: shipulin@cardio.tsu.ru
Александрова Екатерина Александровна, аспирант отделения сердечно-сосудистой хирургии ФГБУ "НИИ кардиологии" СО РАМН. Адрес: 634012, г. Томск, ул. Киевская, 111а.
Гуля Марина Олеговна, врач-лаборант лаборатории радионуклидных методов исследования ФГБУ "НИИ кардиологии" СО РАМН. Адрес: 634012, г. Томск, ул. Киевская, 111а.
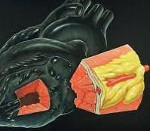
Миокардиальные мышечные мостики — наследственная аномалия, связанная с нефизиологическим частичным расположением коронарных артерий в сердечной мышце. Локальное изменение гемодинамики редко приводит к серьезным последствиям, особенно при неглубоком залегании сосудов, в большинстве случаев протекает бессимптомно. При этом в туннельной части артерии создаются условия для атеросклеротического поражения сосудистой стенки с характерными осложнениями: ИБС, инфарктом миокарда, синдромом внезапной сердечной смерти. Лечение осуществляется только при ухудшении качества жизни пациента и развитии жизнеугрожающих состояний, включает лекарственную терапию, эндоваскулярные процедуры и открытые хирургические манипуляции.
МКБ-10

- Причины миокардиальных мышечных мостиков
- Патогенез
- Классификация
- Симптомы миокардиальных мышечных мостиков
- Осложнения
- Диагностика
- Лечение миокардиальных мышечных мостиков
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Коронарные артерии в норме расположены в верхнем слое стенки сердца (эпикарде), иногда наблюдается образование внутримышечного туннеля, при котором часть сосуда находится в глубине миокарда. Частота встречаемости в общей популяции, по официальным данным, составляет от 0,2 до 1%. До 70% случаев приходится на дефект правой межжелудочковой артерии, 16% – огибающей, 14% – правой коронарной артерии. Точное количество людей с данной аномалией неизвестно, поскольку многие пациенты не обращаются за медицинской помощью из-за отсутствия симптоматики. Независимые исследования не выявили четкой корреляции между частотой обнаружения миокардиальных мостиков, возрастом и массой тела больных. Среди пациентов с осложненным течением патологии преобладают лица мужского пола.

Причины миокардиальных мышечных мостиков
Непосредственной причиной образования миокардиальных мостиков является нарушение формирования венечных сосудов на этапе внутриутробного развития. В норме сосуды находятся на поверхности сердца, окруженные соединительной и жировой тканью эпикарда. При данной аномалии они частично проходят в толще миокарда. Если протяженность туннелированного участка составляет менее 10-15 мм, это рассматривается как вариант нормы. При большей длине интрамурального отрезка артерии и его глубоком залегании возможны нарушения кровообращения.
Провоцирующие факторы нетипичной локализации сосудов достоверно не установлены. Предполагается, что в основе развития мышечных дефектов лежит моногенная мутация белка сердечной мышцы MYH6, способная вызвать избыточную пролиферацию некоторых участков миокарда, что создает условия для образования аномалии. Не исключена роль общих этиофакторов: острых инфекций, перенесенных матерью до 10 недели беременности, вредных привычек, преклонного возраста родителей.
Патогенез
Некоторые специалисты полагают, что нарушение нормального кровообращения при наличии миокардиальных мостиков объясняется внешним сжатием коронарной артерии в фазу систолы вплоть до полной остановки кровотока. Однако, учитывая, что в этот период сокращения сердца миокард получает лишь 15% от всего объема крови, клиническое значение данного феномена остается открытым. Вероятно, более значимую роль играют особенности строения сосудистой стенки в туннелированной части. Интрамуральный сегмент имеет более тонкую стенку и склонность к развитию дисфункции эндотелия, что создает благоприятные условия для тромбообразования.
Систолическое сжатие приводит к формированию турбулентных потоков крови, травмированию сосуда, особенно при повышенной нагрузке на сердце, высоких цифрах ЧСС. Образование тромбоцитарного агрегата в венечных артериях с высокой степенью вероятности завершается инфарктом миокарда. Кроме того, в клетках мышечного мостика часто нарушается липидный и белковый обмен. Дисбаланс сопровождается отложением холестерина, некоторых фракций липопротеидов на внутренней оболочке сосуда и развитием атеросклеротического поражения, которое способно существенно уменьшить просвет артерии.
Классификация
Номенклатура миокардиальных мышечных мостиков долгое время не была востребована вследствие отсутствия четкого представления о том, является данное состояние вариантом нормы или патологией. После доказанной роли аномалии в развитии ишемии сердечной мышцы была предложена комплексная классификация, основанная на морфологических особенностях и клинических проявлениях:
1. По глубине залегания:
- Поверхностный тип — толщина мышечной ткани над сосудом составляет не более 1 мм.
- Глубокий тип — толщина миокарда над туннельной частью артерии колеблется от 1 до 8 мм.
- Правожелудочковый тип — сосуд полностью погружен в миокард, находится непосредственно под эндокардом.
2. По степени систолического сужения:
- I степень — уменьшение просвета венечной артерии сердца до 50%.
- II степень — сужение от 50 до 70%.
- III степень — сужение более 70%.
3. По клиническому течению:
- Бессимптомные миокардиальные мостики.
- Симптомы стенокардии с проявлениями на ЭКГ, Эхо-КГ, при проведении стресс-тестов.
- Инфаркты и их последствия.
Симптомы миокардиальных мышечных мостиков
Обычно аномалия протекает бессимптомно и либо не диагностируется вовсе, либо обнаруживается случайно. Клинические проявления обычно не возникают до тридцати лет. Затем при определенных условиях (повышенная нагрузка на сердце, гипертрофия сердца, алкогольная кардиомиопатия, стрессовые ситуации) наличие туннелированной артерии, особенно на фоне атеросклеротического поражения венечных сосудов, может привести к несоответствию между пропускной способностью кровеносного русла и потребностью миокарда в кислороде.
Осложнения
По данным современных исследований, развитие тяжелых негативных последствий нехарактерно. В единичных случаях миокардиальные мостики осложняются ишемической болезнью сердца на фоне атеросклероза. У отдельных больных выявляются аритмии. Редким и наиболее грозным осложнением патологии является синдром внезапной кардиальной смерти, который сопровождается потерей сознания, исчезновением пульса и дыхания и при отсутствии неотложной медицинской помощи завершается летальным исходом.
Диагностика
Обычно больной с мышечными мостиками обращается к врачу по поводу болевых ощущений в грудной клетке, чувства перебоев при сердцебиении. Кардиолог или терапевт собирает анамнез, выясняет продолжительность и особенности болей и одышки, характер нарушений ритма, связь симптомов с двигательной активностью, эффективность лекарственных средств (в частности, нитроглицерина), наличие факторов риска. Аускультативно может определяться тахикардия, аритмия. Специфические симптомы аномалии отсутствуют, поэтому применение лабораторных и инструментальных методов является обязательной частью диагностического поиска. Для выявления патологии используются:
Дифференциальная диагностика миокардиальных мостиков, прежде всего, проводится с ИБС и инфарктом миокарда, поскольку любой приступ загрудинных болей может быть проявлением некроза сердечной мышцы. Также требуется исключить перикардит, миокардит, приобретенные пороки сердца, плеврит, пневмонию, остеохондроз грудного отдела позвоночника, межреберную невралгию.
Лечение миокардиальных мышечных мостиков
Необходимость терапии аномального расположения коронарных сосудов остается дискутабельной. В отсутствие симптоматики применение мер коррекции в большинстве наблюдений не оправдано. При наличии болевого симптома, выявлении органических повреждений миокарда используют одну из трех стратегий лечения патологии, разработанных на основе патоморфологии, патогенеза, клинических проявлений:
- Медикаментозные методы. Считаются первым средством помощи пациентам с ангиографически подтвержденными миокардиальными мостиками. Главной целью является улучшение качества жизни больного, профилактика осложнений, летального исхода. Лекарственная терапия включает применение препаратов, уменьшающих силу и частоту сердечных сокращений. Назначаются бета-блокаторы, устраняющие тахикардию, улучшающие кровенаполнение коронарных артерий во время диастолы, снижающие сократительную способность миокарда. При непереносимости средств этой группы возможно использование блокаторов кальциевых каналов. Введение нитратов нерационально, поскольку они могут провоцировать учащение сердечных сокращений. Медикаментозное лечение проводится на фоне коррекции режима физической активности.
- Чрескожные эндоваскулярные процедуры. Вопрос о хирургическом вмешательстве ставится только при стойкой невосприимчивости больного к медикаментозной терапии. Оптимальным методом считается стентирование коронарной артерии. Недостатком данной методики является вероятность развития послеоперационных осложнений после нескольких месяцев благополучия – возможно массивное тромбообразование вследствие особенностей кровотока в области имплантата. Определенные сложности представляет постановка стента, что увеличивает риск перфорации коронарной артерии хирургическими инструментами. С учетом этих факторов предпочтение при оперативном лечении аномалии все чаще отдают более радикальным методам.
- Открытые хирургические вмешательства. Являются приоритетным направлением в терапии осложненных миокардиальных мостиков. Основными вариантами являются открытое коронарное шунтирование и супраартериальная миотомия. В первом случае создание дополнительного пути тока крови обеспечивает восстановление нормальной перфузии и снабжение клеток необходимыми веществами. Вторая операция сводится к рассечению мышечных волокон над коронарной артерией и ее освобождению от сдавливающих тканей. Хирургические манипуляции позволяют устранить ишемию миокарда, предупредить приступы стенокардии, значительно снизить риск инфаркта.
Реабилитация после инвазивного вмешательства направлена на восстановление физического и психологического состояния. Производится перевязки, назначаются антибиотики и обезболивающие средства, проводится профилактика отеков. Выписка после эндоваскулярных манипуляций осуществляется в срок до 5 дней. Продолжительность госпитализации после открытой операции составляет не менее 2 недель.
Прогноз и профилактика
Для миокардиальных мышечных мостиков нехарактерно развитие тяжелых неотложных состояний. Обычно пациенты в течение всей жизни не подозревают о наличии аномально расположенной артерии сердца. При невыраженной компрессии сосуда прогноз исключительно благоприятный. Появление признаков ишемии миокарда, ухудшение качества жизни больных требует регулярного наблюдения у специалистов, назначения терапии. Специфическая профилактика патологии не разработана. Общие мероприятия включают ведение здорового образа жизни, правильное питание, регулярное обследование у кардиолога. Необходимо по возможности исключить чрезмерные психические и физические нагрузки.
Читайте также:


