Интерлейкин 1 при остеоартрозе
Изучены клиническая эффективность и безопасность применения диацереина у больных остеоартрозом суставов кистей. Показано, что препарат уменьшает боль и скованность в мелких суставах кистей, улучшает функцию суставов и обладает удовлетворительной переносим
Clinical efficiency and safety of diacerein use for patients suffering from osteoarthrosis of hand joints were studied. The medication was stated to reduce pain and constraint in small hand joints, improves joint function and has satisfactory tolerance.
Остеоартроз (ОА) является одним из наиболее распространенных заболеваний опорно-двигательного аппарата, особенно у лиц старшей возрастной группы. В пожилом возрасте, наряду с поражениями коленных и тазобедренных суставов, значительное место занимает ОА дистальных и проксимальных межфаланговых суставов кистей. Распространенность этой разновидности ОА в европейских странах увеличивается от 10% у пациентов в возрасте 40–49 лет до 92% у больных старше 70 лет.
Изучение патогенеза ОА способствовало разработке и внедрению в практику лекарственных средств, классифицируемых как симптоматические препараты медленного действия, которые оказывают не только симптоматический эффект, но, возможно, обладают структурно-модифицирующим действием [1]. К таким препаратам относится диацереин, обладающий ингибирующим действием на выработку и активность интерлейкина-1 [2–7]. В клинических исследованиях продемонстрирована эффективность диацереина по сравнению с плацебо и нестероидными противовоспалительными препаратами (НПВП) в отношении действия, оказываемого на боль и функциональное состояние тазобедренных и коленных суставов [8, 9], тогда как терапевтическая ценность диацереина у больных ОА суставов кистей практически не изучена [10].
Целью настоящего исследования было оценить клиническую эффективность и безопасность диацереина у больных ОА суставов кистей.
В сравнительное контролируемое рандомизированное исследование было включено 60 женщин, соответствующих клиническим критериям диагностики ОА суставов кистей [11]. Исследование проводилось в соответствии с основными принципами Good Clinical Practice (GCP) и Хельсинкской декларацией. Все больные выразили добровольное информированное согласие в письменной форме, кроме того, было принято положительное решение локального этического комитета. Методом адаптивной рандомизации больные были распределены в две группы: 30 больных (1-я группа) принимали Артродарин (диацереин) в дозе 50 мг 2 раза в сутки в течение 4 месяцев и диклофенак натрия 100 мг/сутки, остальные 30 больных (2-я группа) — диклофенак натрия 100 мг/сутки. Группы больных до начала исследования были сопоставимы по основным клиническим и демографическим показателям (р > 0,05) (табл. 1). Средний возраст пациентов 1-й группы составил 57,5 ± 5,3 года, 2-й группы — 58,9 ± 7,4 года. Длительность суставного синдрома менее 5 лет была отмечена у 46,7% пациентов 1-й группы и 53,3% больных 2-й, от 6 до 10 лет — у 36,7% и 23,3%, более 10 лет — у 16,6% и 23,3% пациентов соответственно. У 83,3% больных 1-й группы и у 66,7% пациентов 2-й группы были выявлены узлы Гебердена и/или Бушара. У 18 больных (60%) 1-й группы и 20 (66,6%) больных 2-й группы наблюдалась II рентгенологическая стадия заболевания, у 12 больных (40%) 1-й группы и 10 (33,3%) больных 1-й группы — I рентгенологическая стадия. Критериями включения являлись: достоверный диагноз ОА суставов кистей, боль, по крайней мере, в трех суставах, интенсивность боли в анализируемых суставах > 40 мм по визуальной аналоговой шкале (ВАШ), I или II рентгенологическая стадия, необходимость приема НПВП, отсутствие клинически значимых нарушений функции печени и почек, подписанное информированное согласие. В исследование не включали пациентов с сердечной, почечной и печеночной недостаточностью, сахарным диабетом 1-го типа, обострением язвенной болезни желудка и 12-перстной кишки, а также больных, получавших на момент включения в исследование или за 6 месяцев до этого симптоматические лекарственные средства медленного действия.
Из 60 пациентов, включенных в исследование, полный курс лечения завершил 51 больной (85%). 4 больных из 1-й группы и 5 пациентов из 2-й группы выбыли на первом месяце лечения из-за возникновения нежелательных явлений.
Для оценки эффективности терапии проводили исследование выраженности боли, скованности, нарушения функции в суставах по ВАШ, оценивали функциональные индексы Дрейзера [12] и Auscan [13], потребность в НПВП, качество жизни с использованием общего опросника SF-36.
Статистическая обработка материала проводилась с использованием специализированного статистического пакета SPSS 17.0. В группах вычисляли среднее арифметическое (М), среднеквадратическое отклонение (σ), среднюю ошибку среднего арифметического (m), доверительный интервал. При сравнении показателей в группах пользовались t-критерием Стьюдента. Изучение динамики исследуемых показателей в процессе лечения проводили с помощью парного критерия Стьюдента. Во всех случаях нулевую гипотезу отвергали при p 2 = 8,24; р = 0,004). Уменьшили дозу принимаемых НПВП на 50% и более 26,9% 1-й группы и 12% 2-й, а 19,2% больных 1-й группы и 76% пациентов 2-й группы (χ 2 =14,28; р = 0,000) продолжали принимать НПВП в прежней дозе.
Достигнутый клинический эффект, как показало дальнейшее наблюдение в сроке до 9 месяцев за пациентами, получавшими Артродарин (диацереин), сохранялся у 15 из 26 больных (57,7%) еще в течение 2–3 месяцев. Пациенты, принимавшие только диклофенак, отмечали возвращение симптоматики в течение нескольких дней после прекращения лечения. На фоне терапии Артродарином (диацереином) и НПВП показатели качества жизни больных имели тенденцию к улучшению в обеих группах (табл. 3). Однако статистически значимое (p
Е. А. Леушина
О. В. Симонова, доктор медицинских наук, профессор
ГБОУ ВПО Кировская ГМА МЗ РФ, Киров
Медицинский эксперт статьи


В последние годы большое внимание исследователей фокусируется на идентификации протеаз, ответственных за деградацию ВКМ суставного хряща при остеоартрозе. Согласно современным представлениям, важную роль в патогенезе остеоартроза играют матриксные металлопротеазы (ММП). У больных с остеоартрозом обнаруживают повышенный уровень трех представителей ММП - коллагеназ, стромелизинов и желатиназ. Коллагеназа ответственна за деградацию нативного коллагена, стромелизин - коллагена IV типа, протеогликанов и ламинина, ажелатиназа - за деградацию желатина, коллагенов IV, Vh XI типов, эластина. Кроме того, предполагают наличие еще одного фермента - аггреканазы, который обладает свойствами ММП и отвечает за протеолиз хрящевых протеогликановых агрегатов.
В суставном хряще человека идентифицированы три типа коллагеназ, уровень которых значительно повышен у больных остеоартрозом, - коллагеназа-1 (ММП-1), коллагеназа-2 (ММП-8) и коллагеназа-3 (ММП-13). Сосуществование трех разных типов коллагеназ в суставном хряще свидетельствует о том, что каждая из них играет свою специфическую роль. Действительно, коллагеназы-1 и -2 локализуются главным образом в поверхностной и верхней части промежуточной зоны суставного хряща, тогда как коллагеназу-3 обнаруживают в нижней части промежуточной и в глубокой зонах. Более того, результаты иммуногистохимического исследования продемонстрировали, что в процессе прогрессирования остеоартроза уровень коллагеназы-3 достигает плато и даже снижается, тогда как уровень коллагеназы-1 постепенно повышается. Имеются данные о том, что при остеоартрозе коллагеназа-1 главным образом участвует в воспалительном процессе в суставном хряще, тогда как коллагеназа-3 - в ремоделировании ткани. Экспрессируемая в хряще больных с ОА коллагеназа-3 осуществляет деградацию коллагена II типа более интенсивно, чем коллагеназа-1.
Из представителей второй группы металлопротеаз, стромелизинову человека идентифицированы также три - стромелизин-1 (ММП-3), стромелизин-2 (ММП-10) и стромелизин-3 (ММП-11). Сегодня известно, что только стромелизин-1 вовлечен в патологический процесс при остеоартрозе. В синовиальной мембране больных с остеоартрозом не определяется стромелизин-2, однако он обнаружен в очень малом количестве в синовиальных фибробластах больных с ревматоидным артритом. Стромелизин-3 также обнаружен в синовиальной оболочке больных с ревматоидным артритом вблизи фибробластов, особенно в зонах фиброза.
В группе желатиназ в хрящевой ткани человека идентифицировано только две - желатиназа 92 кД (желатиназа В, или ММП-9) и желатина-за 72 кД (желатиназа А, или ММП-2); у больных с остеоартрозом определяют повышение уровня желатиназы 92 кД.
Не так давно была идентифицирована еще одна группа ММП, которые локализуются на поверхности клеточных мембран и называются ММП мембранного типа (ММП-МТ). К этой группе принадлежат четыре фермента - ММП-МТ1 - ММП-МТ-4. Экспрессия ММП-МТ обнаружена в суставном хряще человека. Хотя ММП-МТ-1 обладает свойствами коллагеназы, оба фермента ММП-МТ-1 и ММП-МТ-2 способны активироватьжелатиназу-72 кД и коллагеназу-3. Роль этой группы ММП в патогенезе ОА требует уточнений.
Протеиназы секретируются в форме зимогена, который активируется другими протеиназами или органическими соединениями ртути. Каталитическая активность ММП зависит от наличия цинка в активной зоне фермента.
Биологическая активность ММП контролируется специфическими ТИМП. К настоящему времени идентифицированы три типа ТИМП, которые обнаруживают в суставных тканях у человека, - ТИМП-1-ТИМП-3. Четвертый тип ТИМП идентифицирован и клонирован, однако он до сих пор не был обнаружен в суставных тканях человека. Эти молекулы специфически связываются с активным центром ММП, хотя некоторые из них способны связывать активный центр прожелатиназы 72 кД (ТИМП-2, -3, -4) и прожелатиназы 92 кД (ТИМП-1 и -3). Данные свидетельствуют о том, что при ОА в суставном хряще существует дисбаланс между ММП и ТИМП, результатом которого является относительный дефицит ингибиторов, что, возможно, частично связано с повышением уровня активных ММП в ткани. ТИМП-1 и -2 обнаруживают в суставном хряще, они синтезируются хондроцитами. При остеоартрозе в синовиальной оболочке и синовиальной жидкости обнаружен только первый тип ТИМП. ТИМП-3 обнаруживают исключительно в ВКМ. ТИМП-4 почти на 50% имеет идентичную аминокислотную последовательность с ТИМП-2 и-Зина 38% - сТИМП-1. В других клетках-мишенях ТИМП-4 ответственен за модуляцию активации прожелатиназы 72 кД на поверхности клеток, что свидетельствует о важной роли в качестве тканеспецифического регулятора ремоделирования ВКМ.
Другим механизмом контролирования биологической активности ММП является их физиологическая активация. Существует мнение, что ферменты из семейства сериновых и цистеиновых протеаз, таких, как АП/плазмин и катепсин В соответственно, и являются физиологическими активаторами ММП. В суставном хряще больных с остеоартрозом обнаружен повышенный уровень урокиназы (уАП) и плазмина.
Несмотря на то, что в тканях сустава обнаруживают несколько типов катепсинов, наиболее вероятным активатором ММП в хряще считают катепсин-В. В тканях сустава человека обнаружены физиологические ингибиторы сериновых и цистеиновых протеаз. Активность ингибитора АП-1 (иАП-1), а также цистеиновых протеаз снижена у больных с остеоартрозом. Аналогично ММП/ТИМП - именно дисбалансом между сериновыми и цистеиновыми протеазами и их ингибиторами можно объяснить повышенную активность ММП в суставном хряше больных с остеоартрозом. Кроме того, ММП способны активировать друг друга. Например, стромелизин-1 активирует коллагеназу-1, коллагеназу-3 и желатиназу 92 кД; коллагеназа-3 активирует желатиназу 92 кД; ММП-МТ активирует коллагеназу-3, а желатиназа-72 кД потенциирует эту активацию; ММП-МТ также активирует желатиназу 72 кД. Цитокины можно разделить на три группы - деструктивные (провос-палительные), регуляторные (в том числе противовоспалительные) и анаболические (факторы роста).
Типы цитокинов (по van den Berg W.B. et al)
Лейкемический ингибирующий фактор
Мнсулиноподобные факторы роста
Костные морфогенетические белки
Морфогенетические белки, полученные из хряща
Биологически активные вещества, стимулирующие деградацию суставного хряща при остеоартрозе
- Интерлейкин-1
- Интерлейкин-3
- Интерлейкин-4
- ФНО-а
- Колониестимулирующие факторы: макрофагальный (моноцитарный) и гранулоцитарно-макрофагальный
- Субстанция Р
- ПГЕ2
- Активаторы плазминогена (тканевый и урокиназный типы) и плазмина
- Металлопротеазы (коллагеназы. элластазы, стромелизины)
- Катепсины А и В
- Трилсин
- Бактериальные липополисахариды
- Фосфолипаза Аг
Данные литературы свидетельствуют, что ИЛ-ip и, возможно ФНО-а, - главные медиаторы деструкции суставных тканей при остеоартрозе. Однако до сих пор не известно, действуют ли они независимо друг от друга или между ними существует функциональная иерархия. На моделях остеоартроз у животных показано, что блокада ИЛ-1 эффективно предотвращает деструкцию суставного хряща, тогда как блокада ФНО-а приводит лишь к ослаблению воспаления в тканях сустава. В синовиальной мембране, синовиальной жидкости и хряще больных обнаружены повышенные концентрации обоих цитокинов. В хондроцитах они способны увеличивать синтез не только протеаз (главным образом ММП и АП), но и минорных коллагенов, например I и III типов, а также уменьшать синтез коллагенов II и IX типов и протеогликанов. Эти цитокины также стимулируют активные формы кислорода и такие медиаторы воспаления, как ПГЕ2. Результатом таких макромолекулярных изменений в суставном хряще при остеоартрозе является неэффективность репаративных процессов, что приводит к дальнейшей деградации хряща.
Вышеназванные провоспалительные цитокины модулируют процессы угнетения/активации ММП при остеоартрозе. Например, дисбаланс между уровнями ТИМП-1 и ММП в хряще при остеоартрозе может опосредоваться ИЛ-ip, так как исследование in vitro продемонстрировало, что повышение концентрации ИЛ-1 бета приводит к снижению концентрации ТИМП-1 и увеличению синтеза ММП хондроцитами. Синтез АП также модулируется ИЛ-1бета. Стимуляция in vitro хондроцитов суставного хряща с использованием ИЛ-1 вызывет дозозависимое увеличение синтеза АП и резкое снижение синтеза иАП-1. Способность ИЛ-1 уменьшать синтез иАП-1 и стимулировать синтез АП является мощным механизмом генерации плазмина и активации ММП. Кроме того, плазмин является не только ферментом, активизирующим другие ферменты, он также принимает участие в процессе деградации хряща путем прямого протеолиза.
ФНО-а также синтезируется в виде мембранно-связанного предшественника с массой 26 кД; путем протеолитического отщепления он высвобождается из клетки в виде активной растворимой формы с массой 17 кД. Протеолитическое отщепление осуществляется ФНО-а-конвертирующим ферментом (ФНО-КФ), который относится к семье адамализинов. A.R. Amin и соавторы (1997) обнаружили повышенную экспрессию мРНК ФНО-КФ в суставном хряще больных с остеоартрозом.
Биологическая активация хондроцитов и синовицитов ИЛ-1 и ФНО-а опосредуется связыванием со специфическими рецепторами на поверхности клеток - ИЛ-Р и ФНО-Р. Для каждого цитокина идентифицировано два типа рецепторов - ИЛ-IP I и II типов и ФНО-Р I (р55) и II (р75) типов. За передачу сигналов в клетках тканей суставов отвечают ИЛ-1PI и р55. ИЛ-1Р I типа обладает несколько большей аффинностью к ИЛ-1бета, чем к ИЛ-1а; ИЛ-1Р II типа - наоборот, имеет большее сродство к ИЛ- 1а, чем к ИЛ- ip. До сих пор остается неясным, может ли ИЛ-IP II типа опосредовать сигналы ИЛ-1 или он служит только для конкурентного ингибирования связи ИЛ-1 с ИЛ-1РI типа. В хондроиитах и синовиальных фибробластах больных с остеоартрозом обнаруживают большое количество ИЛ-1PI и р55, что в свою очередь объясняет высокую чувствительность этих клеток к стимуляции соответствующими цитокинами. Этот процесс приводит как к повышению секреции протеолитических ферментов, так и к деструкции суставного хряща.
Не исключается участие ИЛ-6 в патологическом процессе при остеоартрозе. В основе этого предположения лежат следующие наблюдения:
- ИЛ-6 увеличивает количество клеток воспаления в синовиальной мембране,
- ИЛ -6 стимулирует пролиферацию хондроцитов,
- ИЛ-6 усиливает эффекты ИЛ-1 в отношении повышения синтеза ММП и угнетения синтеза протеогликанов.
Однако ИЛ-6 способен индуцировать продукцию ТИМП, но не влияет на продукцию ММП, поэтому считают, что именно этот цитокин принимает участие в процессе сдерживания протеолитической деградации суставного хряща, который осуществляется по механизму обратной связи.
Еще одним представителем семьи ИЛ-6 является ЛИФ - цитокин, который вырабатывается хондроцитами, полученными от больных с остеоартрозом, в ответ на стимуляцию провоспалительными цитокинами ИЛ-ip и ФНО-а. Л ИФ стимулирует резорбцию протеогликанов хряща, а также синтез ММП и продукцию NO. Роль этого цитокина при остеоартрозе окончательно не выяснена.
ИЛ-17 - гомодимер массой 20-30 кД, обладающий ИЛ-1-подобным действием, однако значительно менее выраженным. ИЛ-17 стимулирует синтез и выделение ряда провоспалительных цитокинов, в их числе ИЛ-ip, ФНО-а, ИЛ-6, а также ММП в клетках-мишенях, например в макрофагах человека. Крометого, ИЛ-17 стимулирует продукцию NО хондроцитами. Подобно ЛИФ, роль ИЛ-17 в патогенезе ОА мало изучена.
Неорганический свободный радикал NО играет важную роль в деградации суставного хряща при ОА. Хондроциты, полученные от больных с остеоартрозом, вырабатывают большее количество NО как спонатанно, так и после стимуляции провоспалительными цитокинами в сравнении с нормальными клетками. Высокое содержание NO обнаружено в синовиальной жидкости и сыворотке крови больных с остеоартрозом - это результат увеличения экспрессии и синтеза индуцированной NO-синтазы (hNOC) - фермента, ответственного за продукцию NO. Недавно была клонирована ДНК хондроцитспецифической hNOC, определена аминокислотная последовательность фермента. Аминокислотная последовательность указывает на 50% идентичность и 70% сходство с hNOC, специфичной для эндотелия и нервной ткани.
NO угнетает синтез макромолекул ВКМ суставного хряща и стимулирует синтез ММП. Более того, увеличение продукции NО сопровождается снижением синтеза антагониста ИЛ-IP (ИЛ-1РА) хондроцитами. Таким образом, повышение уровня ИЛ-1 и снижение - ИЛ-1 РА приводит к гиперстимуляции NО хондроцитов, что в свою очередь ведет к усилению деградации хрящевого матрикса. Имеются сообщения о терапевтическом эффекте in vivo селективного ингибитора hNOC в отношении прогрессирования экспериментального остеоартроза.
Естественные ингибиторы цитокинов способны непосредственно препятствовать связыванию цитокинов с рецепторами клеточных мембран, снижая их провоспалительную активность. Естественные ингибиторы цитокинов можно разделить на три класса по способу их действия.
К первому классу ингибиторов относят антагонисты рецепторов, которые препятствуют связыванию лиганда с его рецептором путем конкуренции за связывающий центр. К настоящему времени такой ингибитор найден только для ИЛ-1 - это вышеупомянутый конкурентный ингибитор системы ИЛ-1/ИЛIP ИЛ-1 PA. ИЛ-1 РА блокирует многие эффекты, которые наблюдаются в тканях суставов при остеоартрое, включая синтез простагландинов синовиальными клетками, продукцию коллагеназы хондроцитами и деградацию В КМ суставного хряща.
ИЛ-1РА обнаруживают в различных формах - одной растворимой (рИЛ-1РА) и двух межклеточных (мкИЛ-lPAI и мкИЛ-1РАП). Аффинность растворимой формы ИЛ-1РА в 5 раз превышает таковую у межклеточных форм. Несмотря на интенсивный научный поиск, функция последних остается неизвестной. Экспериметы in vitro показали, что для угнетения активности ИЛ-1бета необходима концентрация ИЛ-1РА, в 10-100 раз превышающая норму, в условиях in vivo требуется тысячекратное повышение концентрации ИЛ-1РА. Этот факт может частично объяснить относительный дефицит ИЛ-1 РА и избыток ИЛ-1 в синовии больных с остеоартрозом.
Второй класс естественных ингибиторов цитокинов представлен растворимыми рецепторами цитокинов. Примером таких ингибиторов у человека, имеющих отношение к патогенезу остеоартроу, являются рИЛ-1Р и рр55. Растворимые рецепторы цитокинов представляют собой укороченные формы нормальных рецепторов, связываясь с цитокинами, они препятствуют их связыванию с мембранно-ассоциированными рецепторами клеток-мишеней, действуя по механизму конкурентного антагонизма.
Основным предшественником растворимых рецепторов являются мембранно-связанные ИЛ-1РП. Аффинность рИЛ-IP по отношению к ИЛ-1 и ИЛ-1 РА различна. Так, рИЛ-1РН обладает большим сродством к ИЛ-1 р, чем к ИЛ-1 РА, а рИЛ-1PI - проявляет большую аффинность к ИЛ-1РА, чем к ИЛ-ip.
Третий класс естественных ингибиторов цитокинов представлен группой противовоспалительных цитокинов, к которым относят ТФР-бета, ИЛ-4, ИЛ-10 и ИЛ-13. Противовоспалительные цитокины снижают продукцию провоспалительных, а также некоторых протеаз, стимулируют продукцию ИЛ-1РА и ТИМП.
Цитокины – это молекулы локального действия, которые синтезируются параллельно и обладают способностью индуцировать продукцию друг друга. Они обеспечивают многочисленные системные эффекты на организм. Большинство цитокинов, за исключением ИЛ–1 и ИЛ–4, действуют преимущественно местно, поэтому концентрация цитокинов в синовиальной жидкости сустава выше, чем в сыворотке крови. Но в случае несостоятельности местных защитных реакций они попадают в системную циркуляцию, и их действие проявляется на организменном уровне. Важную роль в процессе деградации хряща играют провоспалительные цитокины. Они синтезируются, секретируются и действуют через свои рецепторы на клетки–мишени уже на ранней стадии воспаления. ИЛ–1 считается главными медиаторами деструкции суставного хряща. Механизм его действия многокомпонентен. Под его влиянием запускается лизосомальный механизм клеточного повреждения с разрушением матриксными протеиназами коллагена и протегликанов суставного хряща. Он также может вызывать повреждение ДНК и индуцировать апоптоз хондроцитов, активировать продукцию оксида азота и свободных радикалов. В синовиальной жидкости, суставном хряще больных ОА обнаружены повышенные концентрации этих цитокинов, нарастающие по мере деструкции суставного хряща. ИЛ–1 – иммунорегуляторный медиатор, выделяемый мононуклеарными клетками, макрофагами, синовиоцитами и хондроцитами путем экзоцитоза при воспалительных реакциях и тканевых повреждениях. Он является основным медиатором воспалительных реакций. На сегодняшний день все имеющиеся типы лечения деформирующего остеоартроза испытанные в мультифокальных клинических исследованиях, недостаточно эффективны. Многие препараты, показавшие высокую эффективность в эксперименте, зачастую обладают выраженными побочными эффектами, которые делают их неприменимыми в клинической практике. Поэтому разработка новых подходов к терапии этой нозологии является важнейшей задачей медицины. ТЭС–терапия направлена на избирательную активацию защитных (антиноцицептивных) механизмов мозга, расположенных в подкорковых структурах. ТЭС–терапия – это метод увеличивающий степень адаптации организма к повреждению, воздействие которого носит комплексный, системный, гомеостатический характер. В настоящее время известны антигипоксический, противоотечный и иммуномодулирующий эффекты. Предполагаемой мишенью для лечебного воздействия ТЭС–терапии на течение деформирующего остеоартроза крупных суставов являются цитокиновые сети и стресс–лимитирующая система.
Цель исследования – возможности применения метода ТЭС–терапии в комбинированном лечении деформирующего остеоартроза крупных суставов с позиций коррекции дисбаланса ИЛ-1.
Материалы и методы исследования. В исследование включено 120 пациентов с деформирующим остеоартрозом крупных суставов.
1 группа (20 пациентов) – добровольцы – условно здоровые люди (контрольная группа). У них производили забор крови для определения уровня ИЛ–1, ИЛ–6, ИЛ–10, –эндорфина. Кроме того у них производили исследование микроциркуляторного русла (МЦКР) коленного сустава. В этой группе у пациентов проводили (согласно стандарту первичной медико–санитарной помощи при гонартрозе и сходных с ним клинических состояниях (Приложение к приказу Министерства здравоохранения Российской Федерации от 24 декабря 2012 г. № 1498н)): общий анализ крови, общий анализ мочи, биохимический анализ крови, рентгенографию коленного сустава, магнитно–резонансная томография коленного сустава.
Обработка результатов. Накопление данных будет проводиться в журнале с помощью таблиц Exсel 2010. Обработку данных проводили путем использования программы STATISTIKA 6, русскоязычная версия адаптирована к Windows XP.
Результаты исследования. При оценке цитокинового профиля и –эндорфина в 1 группе получены следующие данные. Содержание ИЛ–1 составило 0,67 ± 0,23 пг/мл, ИЛ–6 – 7,0 ± 2,50 пг/мл, ИЛ–10 – 7,03 ± 2,86 пг/мл и–эндорфинов 7,22 ± 1,75 пг/мл.
Выводы. Полученные данные согласуются с данными литературы [1, 2, 3].
Марина Поздеева о патогенезе и эффективной фармакотерапии данной патологии
Остеоартроз (ОА) — распространенное заболевание суставов, причем прослеживается тенденция к росту числа случаев ОА: за последнее десятилетие первичная заболеваемость в РФ выросла на 20 %, а общая распространенность — на 48 % [1]. При этом ОА коленного сустава входит в число основных причин потери нетрудоспособности как у мужчин, так и у женщин [1].
Понятие и классификация остеоартроза
ОА представляет собой гетерогенную группу состояний различной этиологии и схожими биологическими, морфологическими и клиническими проявлениями. При ОА преимущественно поражаются несущие вес суставы: коленные, бедренные, плечевые и суставы пояснично-крестцового отдела. Могут пострадать дистальные и проксимальные межфаланговые суставы, пястно-запястные суставы, однако подобная локализация встречается гораздо реже. В развитии заболевания важную роль играют ежедневные нагрузки, которые большей частью даются на несущие суставы.
Первичным, или идиопатическим, считается остеоартроз, причина которого остается неустановленной. Он может быть локальным (поражены один или два сустава) и генерализованным (поражены три и более суставов). Локальный ОА чаще всего ассоциируется с поражением коленных суставов (гонартроз) и тазобедренных суставов (коксартроз). При вторичном ОА существует очевидная причина болезни: травма, метаболические нарушения, другие ревматологические заболевания в анамнезе и так далее.
Факторы риска остеоартроза
Причины возникновения остеоартроза суставов могут быть следующие:
- возраст
- ожирение
- травма
- наследственность (фамильная история ОА)
- низкий уровень эстрогенов у женщин
- мышечная слабость
- особенности труда (например, регулярные тяжелые физические нагрузки)
- инфекция
- акромегалия
- воспалительный артроз в анамнезе (например, ревматоидный артрит)
- наследственные метаболические нарушения (например, алкаптонурия, гемохроматоз, болезнь Вильсона)
- гемоглобинопатии (к примеру, серповидноклеточная анемия, талассемия)
- невропатические расстройства, ведущие к развитию сустава Шарко (сирингомиелия, спинная сухотка, сахарный диабет)
- морфологические факторы риска (например, врожденный вывих бедра)
- поражение костной ткани (болезнь Педжета, асептический некроз и другие)
- хирургические вмешательства на суставах в анамнезе (к примеру, менискэктомия)
Патофизиология ОА
Первичный и вторичный ОА имеют общую патологическую основу. Раньше предполагалось, что ОА — это дегенеративное расстройство, возникающее вследствие биохимического распада гиалинового хряща в синовиальных суставах. Однако сегодня принята несколько иная точка зрения, которая предполагает, что страдает не только суставной хрящ, но и весь сустав, в том числе субхондральная кость, синовиальная оболочка и близлежащие ткани.
Несмотря на дегенеративную природу ОА, появляется все больше свидетельств того, что после синтеза хондроцитами и выброса в суставную полость цитокинов развивается воспалительный процесс. Провоспалительные медиаторы (цитокины интерлейкин-1 и фактор некроза опухоли) не участвуют в деградации матрицы [2], а активируют хондроциты поверхностного слоя хряща, что увеличивает синтез матричных металлопротеиназ и, следовательно, дегенерацию суставного хряща.
В начальной стадии ОА из‑за повышения синтеза протеогликанов — основного компонента матрикса — происходит отек хряща. Этот этап может продолжаться несколько лет или даже десятилетий, и его основное проявление — это гипертрофия суставного хряща.
Далее, по мере прогрессирования ОА, уровень протеогликанов снижается до крайне низких значений, и изменяется их качественный состав. Поврежденный хрящ подвергается перегрузкам, вследствие чего повышается синтез металлопротеиназ (коллагеназы, стромелизина и других). Они способствуют дальнейшему разрушению протеогликанов и всей коллагеновой сети, что и предопределяет прогрессирующую дегенерацию хряща. В результате хрящ смягчается и теряет эластичность и повреждается все сильнее. Микроскопически на гладкой поверхности суставного хряща на этой стадии заболевания заметны шелушение и вертикальные расселины.
Для ОА характерны васкуляризация хряща и изменения в субхондральной кости. В ней формируется активно минерализующийся остеоид, а затем образуются субхондральные кисты и микропереломы. Это приводит к развитию субхондрального склероза.
Дифференциальная диагностика
Начальная цель, стоящая перед врачом, — дифференциация ОА от артритов, в том числе ревматоидного. Дифференциальная диагностика основывается на данных физического обследования и истории болезни. Картину дополняет рентгенологическое обследование и лабораторные показатели.
Симптомы остеоартроза
- боль в суставах (первый признак заболевания, может появляться на ранних стадиях);
- снижение амплитуды движения, крепитация — хруст в суставах (часто присутствует);
- чувство скованности во время или после отдыха. После сна характерна скованность суставов — обычно менее 30 минут.
- чаще всего поражаются дистальные межфаланговые суставы;
- могут поражаться проксимальные межфаланговые суставы и суставы у основания большого пальца;
- узлы Гебердена (пальпируемые остеофиты в дистальных межфаланговых суставах) более характерны для женщин, чем для мужчин;
- воспалительные изменения, как правило, отсутствуют или остаются незамеченными (маловыраженными).
Ревматоидный артрит (РА) преимущественно поражает запястья, а также метакарпофаланговые и проксимальные межфаланговые суставы. Поражение дистальных межфаланговых или суставов пояснично-крестцового отдела для него нехарактерно. Кроме того, РА связан с длительной (более 1 часа) утренней скованностью, припухлостью и повышением температуры суставов.
Также ОА следует дифференцировать от:
- аваскулярный некроз костной ткани
- фибромиалгия
- подагра и псевдоподагра
- анкилозирующий спондилоартрит
- нейропатическая артропатия (сустав Шарко)
- болезнь Лайма
- пателлофеморальный синдром
- псориатический артрит
Диагностика
Диагностика остеоартроза основана на данных клинического и рентгенологического обследования. В клинических исследованиях изучались возможности определения количества аутоантител и маркеров синовиальной жидкости как индикаторов ОА [4]. Ни один из этих показателей не доказал своей надежности для диагностики и контроля ОА.
Как правило, показатели острой фазы воспаления при ОА находятся в пределах нормы. В случае эрозивного артрита возможно повышение СОЭ. В синовиальной жидкости определяются лейкоциты в количестве ниже 2000 в мкл, с преобладанием мононуклеаров.
Метод выбора в диагностике ОА — рентгенографическое исследование [5]. Некоторые особенности суставного хряща и мягких тканей, которые не отображаются на рентгенограмме, можно визуализировать с помощью МРТ. Однако у большинства пациентов с ОА в проведении МРТ нет необходимости.
УЗИ не играет роли в повседневной клинической оценке пациента с ОА. Оно может применяться в качестве инструмента для мониторинга дегенерации хряща, а также для проведения внутрисуставных инъекций.
Артроцентез может помочь исключить воспалительный артрит, инфекции или кристаллическую артропатию, ассоциированную с отложением микрокристаллов различного состава.
От результатов диагностики зависит какие методы будут применяться для лечения остеоартроза.
Терапия
Лечение остеоартроза направлено на купирование болевого синдрома и улучшение функционального состояния сустава. В оптимальном варианте пациенты должны получать комбинацию нефармакологических методик и фармакотерапии [6].

- нормализация веса [7]
- лечебная гимнастика
- физиотерапия
- трудотерапия
- разгрузка некоторых суставов (например, колена, бедра)
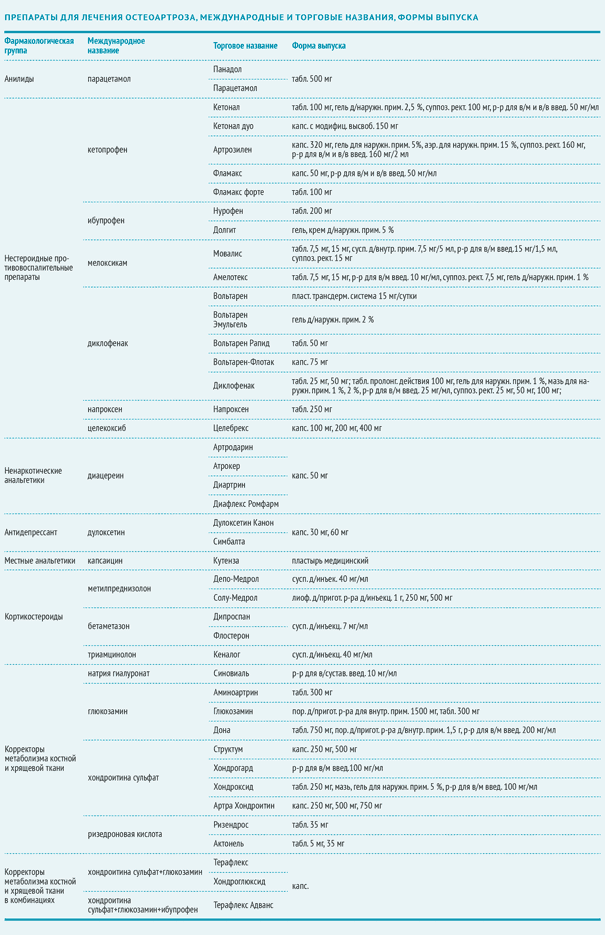
Фармакотерапия ОА, рекомендации Международного общества по изучению ОА (OARSI), 2014 год
Применяют следующие препараты для лечения остеоартроза:
Мета-анализ 2010 года подтвердил эффективность парацетамола в качестве умеренного обезболивающего средства при ОА [8]. Однако исследования показали повышенный риск побочных эффектов, ассоциированных с применением парацетамола, включая желудочно-кишечные (ЖК) проявления и мультиорганные нарушения [8]. В связи с этими данными OARSI рекомендует применять препарат строго в соответствии с дозировкой и длительностью курса.
Сравнительное двойное слепое рандомизированное исследование 2011 года с участием 100 пациентов с ОА коленного сустава показало, что местный анальгетик капсаицин в качестве обезболивающего препарата при остеоартрозе на 50 % эффективнее, чем плацебо [9].
Последние исследования демонстрируют клинически значимый краткосрочный анальгетический эффект [10]. Есть еще несколько рекомендуемых препаратов для лечения остеоартроза.
Четыре исследования, изучающие применение хондроитина при ОА, показали неоднозначные результаты. В одних испытаниях было выявлено некоторое обезболивающее действие, а в других эффект хондроитина не отличался от эффективности плацебо [11]. Кроме того, специалисты Международного общества по изучению ОА — OARSI отмечают высокую степень неоднородности исследований и низкое их качество, в связи с чем окончательная оценка эффективности хондроитина крайне затруднена. Таким образом, в качестве симптоматического средства эффект хондроитина признан сомнительным, а в качестве препарата для лечения ОА не рекомендуется.
Мета-анализ 2010 года, изучающий данные шести исследований с участием 1533 пациентов, выявил относительно умеренный, но статистически значимый обезболивающий эффект ненаркотического анальгетика диацереина по сравнению с плацебо [12]. В мета-анализе также отмечено значительное увеличение риска диареи среди добровольцев, принимающих диацереин. Однако диацереин признан более безопасным, чем НПВП.
Исследования доказали, что ингибитор обратного нейронального захвата серотонина и норадреналина, антидепрессант III поколения дулоксетин эффективнее плацебо купирует боль при ОА [13]. Однако 16,3 % пациентов, получающих дулоксетин, испытывают побочные эффекты (по сравнению с 5,6 % в группе плацебо). К ним относятся тошнота, сухость во рту, сонливость, усталость, снижение аппетита, гипергидроз. В связи с этим необходимость в применении дулоксетина для лечения ОА у лиц с сопутствующими заболеваниями (сахарный диабет, артериальная гипертензия и другие сердечно-сосудистые заболевания, почечная недостаточность, ЖК-кровотечения, депрессия, ограничение физической активности, в том числе и вследствие ожирения) признана сомнительной*.
Два крупных исследования, оценивавших эффективность глюкозамина в лечении ОА дали противоречивые результаты [6]. Одно исследование показало статистически значимый анальгетический эффект, а другое засвидетельствовали отсутствие такового. Последний мета-анализ, в который вошло масштабное исследование, не доказал эффективности глюкозамина вовсе. На основании этих данных специалисты OARSI пришли к выводу о сомнительной эффективности глюкозамина в качестве симптоматического средства при ОА. В качестве средства для лечения ОА не рекомендуется [6].
Результаты клинических исследований (КИ), изучающих эффективность интраартикулярного введения гиалуроновой кислоты (ГК), оказались спорными [6]. Противоречивые данные мета-анализов и отдельных исследований ставят под сомнение целесообразность применения препаратов гиалуроновой кислоты при ОА коленного и тазобедренного суставов. При ОА нескольких суставов ГК не рекомендуется.
Прием данных препаратов входит в рекомендации по лечению остеоартроза пациентам без сопутствующих заболеваний. При сопутствующих заболеваниях ЖКТ необходимо наряду с НПВП назначать ингибиторы протонной помпы. Пациентам из группы высокого риска (ЖК-кровотечение, инфаркт миокарда, хроническая почечная недостаточность в анамнезе) пероральные НПВП категорически не рекомендуются.
Обзор литературы, проведенный японскими учеными в 2010 году, свидетельствует, что высокие дозы ризедроновой кислоты не уменьшают выраженность симптомов ОА, однако могут способствовать ослаблению прогрессирования ОА, сохраняя структурную целостность субхондральной кости [14]. Лабораторно этот эффект проявляется снижением уровня маркера деградации хряща CTX–II. Таким образом, эффективность резидроновой кислоты требует дальнейшего изучения.
Исследования показали умеренную эффективность кодеина и морфина при ОА коленного и бедренного сустава. Мета-анализ 2006 года, проведенный Кокрановским сообществом по результатам плацебоконтролируемых исследований с участием 1019 пациентов, выявил статистически значимые преимущества трамадола по сравнению с плацебо [15].
- Фоломеева О. М., Эрдес Ш. Ф. Распространенность и социальная значимость ревматических заболеваний в Российской Федерации // Доктор (ревматология). 2007. № 10. С. 3–12.
- Poole AR. An introduction to the pathophysiology of osteoarthritis. Front Biosci. 1999 Oct 15. 4: D662–70.
- van Baarsen LG et al. Heterogeneous expression pattern of interleukin 17A (IL-17A), IL-17F and their receptors in synovium of rheumatoid arthritis, psoriatic arthritis and osteoarthritis… Arthritis Res Ther. 2014. 16 (4):426.
- Brandt KD. A pessimistic view of serologic markers for diagnosis and management of osteoarthritis. Biochemical, immunologic and clinicopathologic barriers. J Rheumatol Suppl. 1989 Aug. 18:39–42.
- Recht MP et al. Abnormalities of articular cartilage in the knee: analysis of available MR techniques. Radiology. 1993 May. 187 (2):473–8.
- Zhang W et al. OARSI recommendations for the management of hip and knee osteoarthritis, part I: critical appraisal of existing treatment guidelines and systematic review of current research evidence. Osteoarthritis Cartilage. 2007 Sep. 15 (9):981–1000.
- Felson DT et al. Weight loss reduces the risk for symptomatic knee osteoarthritis in women. The Framingham Study. Ann Intern Med. 1992 Apr 1. 116 (7):535–9.
- Bannuru RRDU, McAlindon TE. Reassessing the role of acetaminophen in osteoarthritis: systematic review and meta-analysis. Osteoarthritis Research Society International World Congress; 2010 Sep 23–26; Brussels, Belgium. Osteoarthritis Cartilage 2010; 18 (Suppl 2):P 250.
- Kosuwon W et al. Efficacy of symptomatic control of knee osteoarthritis with 0.0125 % of capsaicin versus placebo. J Med Assoc Thai¼Chotmaihet Thangphaet 2010; 93 (10):118e95. Epub 2010/10/27.
- Bannuru RR et al. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum 2009; 61 (12):1704–11.
- McAlindon T. E. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis //Osteoarthritis and Cartilage. — 2014. — Т. 22. — №. 3. — С. 363–388.
- Bartels EM et al. Symptomatic efficacy and safety of diacerein in the treatment of osteoarthritis: a meta-analysis of randomized placebo-controlled trials. Osteoarthritis and Cartilage/OARS. Osteoarthritis Research Society 2010; 18 (3):289–96.
- Citrome L, Weiss-Citrome A. A systematic review of duloxetine for osteoarthritic pain: what is the number needed to treat, number needed to harm, and likelihood to be helped or harmed? Postgrad Med 2012; 124 (1):83.
- Iwamoto J. et al. Effects of risedronate on osteoarthritis of the knee //Yonsei medical journal. 2010. №. 2. 164–170 pp.
- Cepeda MS, Camargo F, Zea C, Valencia L. Tramadol for oste-oarthritis. Cochrane Database Syst Rev 2006; (3):CD005 522. Epub 2006/07/21.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Читайте также:


