Инновации в лечении остеоартроза
Артроз — заболевание, симптомы которого должен знать каждый. Эта опасная и очень распространенная патология на ранней стадии может быть почти незаметна, однако, прогрессируя, способна причинять нестерпимую боль и даже привести к инвалидности. О том, как этого избежать, поговорим в нашей статье.



Почему возникает артроз и когда следует приступать к его лечению
Остеоартроз, или деформирующий артроз, представляет собой заболевание, которое заключается в разрушении и истончении суставной хрящевой ткани. При этом ткань сустава становится более рыхлой и разрастается, приводя в итоге к появлению костных отростков и воспалению внутри сустава.
На ранней стадии больные испытывают небольшой дискомфорт при движениях, на который могут не обращать внимания. На второй стадии заболевания возникают сильные боли, приводящие к ограничению подвижности сустава. Третья стадия, помимо болей, сопровождается полным или почти полным разрушением суставной хрящевой ткани. Еще несколько десятилетий назад больные с третьей стадией артроза оказывались прикованными к инвалидному креслу. Сегодня возможности медицины значительно расширились, и в случае полной деградации хрящевой ткани пациентам предлагается операция по протезированию.
Если во второй половине ХХ века болезнь диагностировали преимущественно у лиц старше шестидесяти лет, то сейчас исследователи говорят о повышенной заболеваемости уже после сорока. Группа риска довольно обширна: в нее входят не только граждане старше указанного возраста, но и лица, занятые физическим трудом, страдающие избыточным весом, спортсмены, те, кто перенес травмы или имеет генетическую предрасположенность. Заболеванию больше подвержены женщины, нежели мужчины.
Существенно замедлить развитие артроза, помочь сохранить подвижность конечностей и избежать серьезного хирургического вмешательства можно при помощи своевременной терапии — вот почему так важно при первых же симптомах обратиться к ревматологу.
С точки зрения европейской медицины, лечение такого серьезного заболевания, как артроз, требует комплексного подхода с учетом симптоматики на различных стадиях заболевания. В комплекс лечебных мер, кроме приема лекарственных препаратов, включают мероприятия по снижению веса, кинезиотерапии, физиотерапии, а при необходимости назначают хирургическое вмешательство. Программа лечения составляется врачом-ревматологом с учетом локализации болезни, особенностей организма пациента, но обязательно включает в себя целый спектр действий, направленных на борьбу с проявлениями заболевания.
Взгляд же традиционной китайской медицины (ТКМ) на лечение артроза отличается. Основными причинами заболевания, приводящими к истончению и деформации хрящевой ткани, с точки зрения ТКМ, являются нарушения обменных процессов, патологии эндокринной и лимфатической систем, снижение иммунитета. Именно на устранение данных причин и направлено воздействие методов китайской медицины. При этом в случае положительной динамики устраняются и симптомы болезни.
Именно поэтому сегодня все чаще можно встретить мнение специалистов о необходимости сочетания методов западной и восточной медицины [1] .
Первой задачей, возникающей при лечении артроза, становится снятие боли и воспаления в суставе. Для этого назначают нестероидные противовоспалительные препараты (НПВП), такие как ибупрофен, кеторолак, пироксикам, диклофенак и их производные — в форме таблеток, инъекций, гелей, мазей или ректальных свечей. Помните, что применение этой группы лекарств лишь снимает основные симптомы недуга. Более того, длительный прием НПВП способен ускорить процесс разрушения хрящей, поэтому применять их необходимо с большой осторожностью и только по назначению врача.
В тяжелых случаях и при низкой эффективности лечения нестероидными противовоспалительными препаратами для устранения боли и воспаления применяют кортикостероиды. Как правило, их вводят в организм в виде инъекций непосредственно в капсулу сустава. Кортикостероиды при длительном применении могут ухудшать состояние хрящей, поэтому назначают их лишь при сильных болях. Как и НПВП, данная группа медикаментов служит для устранения болевых ощущений и воспаления и не замедляет течение артроза.
Хондропротекторы являются одной из самых важных составляющих медикаментозного лечения артроза: они насыщают хрящевые ткани питательными веществами, стимулируя рост клеток. К группе хондропротекторов относится, например, глюкозамин, выпускаемый в форме таблеток или капсул. Не следует ожидать быстрого эффекта от применения хондропротекторов: улучшение состояния хрящей можно заметит лишь после длительного приема препаратов. Кроме того, они не помогут в том случае, если болезнь достигла третьей, самой тяжелой, стадии.
В китайской медицине восстановление здоровья сустава начинается с диагностики, во время которой оценивается общее состояние организма и выявляется первопричина артроза. Затем доктор составляет программу воздействия на биологически активные точки. Комплексное лечение артроза включает в себя следующие методы ТКМ:
При этом основное внимание уделяется иглорефлексотерапии как наиболее эффективному методу лечения в традиционной китайской медицине. Результаты терапии во многом зависят от квалификации специалиста. Находясь в руках умелого врача, пациент в скором времени сможет отметить улучшение самочувствия, сопровождающееся снятием боли, восстановлением подвижности суставов, укреплением иммунитета, нормализацией кровообращения и обмена веществ [2] .
- Пункция (малоинвазивное вмешательство). Применяется и для диагностики заболевания. В суставную капсулу вводят иглу, забирая часть жидкости, — это позволяет получить материал для анализов, снизить нагрузку на капсулу, а при необходимости еще и ввести кортикостероидные препараты непосредственно в очаг воспаления.
- Артроскопия диагностическая. Артроскопия представляет собой введение специального аппарата артроскопа через микроразрезы в коже. Это позволяет тщательно обследовать сустав, а также удалить отделившиеся фрагменты хрящей, устранив причины воспалительного процесса и болей.
- Остеотомия коррегирующая. Суть этой хирургической процедуры заключается в подпиливании костей больного с их последующей фиксацией под другим углом. Операция позволяет снизить нагрузку на сустав и устранить боли на длительный период. Такое радикальное воздействие назначается нечасто — слишком велика нагрузка на организм пациента и слишком продолжителен срок реабилитации.
- Эндопротезирование. В тех случаях, когда иные виды лечения не помогли, а болезнь полностью или почти полностью разрушила суставы, их заменяют протезами из пластика, металла или керамики. Эндопротезирование — тяжелая и дорогостоящая операция, требующая продолжительной реабилитации. Многих пациентов в течение нескольких месяцев после хирургического вмешательства мучают боли. Однако эндопротезирование для больного зачастую является единственной альтернативой перспективы быть обездвиженным. Срок службы современных протезов достигает двадцати лет, и все эти годы пациент сможет жить полноценной жизнью.
Несмотря на общие черты в симптоматике, артроз разных суставов имеет свои признаки и особенности лечения. Например, использование мазей при артрозе тазобедренного сустава неэффективно из-за мышечной и жировой ткани, препятствующей попаданию препарата к месту воспаления. Зато те же мази хорошо показывают себя при нанесении на коленный или локтевой сустав. Давайте рассмотрим, какие симптомы характерны для артроза суставов (голеностопного, коленного, локтевого, плечевого, пальцев рук и тазобедренного) и какое лечение подходит каждому из случаев.
Чтобы избежать возникновения артроза, особенно при наличии предрасположенности, следует придерживаться простых правил: носить удобную обувь, поддерживать физическую активность, соблюдая при этом меру при нагрузках, избегать травм и переохлаждения. Для профилактики заболевания особенно важно поддерживать нормальный вес, ведь каждый лишний килограмм увеличивает нагрузку на суставы.
«Болезненные симптомы при артрозе являются следствием дегенеративно-дистрофических изменений в тканях сустава. При лечении, которое после необходимых диагностических процедур назначают специалисты по китайской медицине, целью является не просто снятие болезненных симптомов, а в первую очередь устранение самих причин возникновения патологии. Обычно прибегают к иглорефлексотерапии — воздействию на 300 активных точек тела очень тонкими стерильными иголками. Дополнительно может быть показан точечный массаж туйна, моксотерапия (прогрев полынными сигарами), а также фитотерапия.
* Лицензия на оказание медицинских услуг №ЛО-77-01-000911 от 30 декабря 2008 года выдана Департаментом здравоохранения города Москвы.
Болезни, связанные с поражением хрящевой ткани сустава, в частности остеоартроз (ОА), являются важнейшей проблемой здравоохранения, особенно в странах с высокой продолжительностью жизни.
Проблемы, связанные с ведением больных ОА, сохраняют сегодня свою актуальность, и в значительной степени они обусловлены тем, что лечение ОА, как правило, начинается на поздних стадиях развития заболевания, когда повреждения хряща уже значительны. Между тем полноценная регенерация суставного хряща, который не кровоснабжается и имеет низкий уровень метаболизма, возможна лишь при небольших по площади повреждениях (K. Gronning et al., 2016).
В настоящее время проводятся многочисленные исследования по разработке новых подходов к восстановлению поврежденных хрящевых тканей, в том числе основанных на применении технологий тканевой инженерии и регенеративной медицины. Тканевая инженерия – подход, при котором используются фундаментальные структурно-функциональные взаимодействия в нормальных и патологически измененных тканях при создании биологических заместителей для восстановления или улучшения функционирования тканей.
Для культивирования часто используют соматические стволовые клетки взрослого организма, которые представляют собой недифференцированные клетки, находящиеся в составе дифференцированной ткани. В достаточно большом количестве они содержатся в костном мозге, сетчатке глаза, роговице, пульпе зуба, печени, коже и поджелудочной железе. Чаще всего используют клетки, полученные путем пункции костного мозга.
Однако источником стромальных стволовых клеток могут быть и другие ткани. В настоящее время разработана методика выделения фибробластоподобных клеток из гетерогенной популяции клеток жировой ткани (Р. Zuk et al., 2001).
Если говорить о факторах роста, то наиболее изученным и активным является так называемый трансформирующий фактор роста-β (TGF-β). В наибольшей концентрации он содержится в костном матриксе, где стимулирует пролиферацию клеток соединительной ткани и их дозревание. При применении в высоких концентрациях может проявляться побочное действие TGF-β: гипертрофия хондроцитов и оссификация хряща. Кроме того, к недостаткам метода следует отнести его высокую стоимость.
Известно, что тромбоциты содержат факторы роста и вещества, которые являются потенциальными хондропротекторами. Следовательно, обогащенную тромбоцитами плазму можно с успехом использовать для стимуляции регенеративных процессов в суставных хрящах. При этом хорошего терапевтического эффекта можно добиться лишь с помощью плазмы, содержащей не менее 1 млн тромбоцитов в 1 мкл. Главным действующим веществом в данном случае являются именно факторы роста, в том числе TGF-β, который в большом количестве содержится в концентрате тромбоцитов. Однако, как свидетельствуют данные литературы, этот метод лечения наиболее эффективен у молодых пациентов с незначительными дегенеративными изменениями суставов.
Межклеточный матрикс представляет собой полимер с трехмерной структурой, который обеспечивает организацию и удержание клеток, создавая условия для их роста. Матрикс чаще всего формируют из коллагена или гиалуроната (коллагеновые волокна покрывают фибронектином).
В многочисленных экспериментах in vitro и in vivo была продемонстрирована способность препарата Пиаскледин снижать уровень маркеров деградации хряща и оказывать стимулирующее действие на хрящевую ткань. Пиаскледин оказывает ингибирующее действие на коллагеназу и простагландины 2 типа, уменьшает синтез фибронектина, что, в свою очередь, способствует естественному восстановлению конструкции хряща. Кроме того, он снижает выработку металлопротеиназ, ингибирует интерлейкины‑1β, -6, -8, а также оказывает стимулирующее действие на синтез коллагена ІІ в хондроцитах. В условиях клиники было продемонстрировано, что на фоне приема Пиаскледина происходит повышение уровня TGF-β (как TGF-β1, так и TGF-β2) в синовиальной жидкости коленных суставов. Данный эффект наиболее выражен на 1-2-м месяце лечения. Таким образом, представлялось вполне вероятным, что использование Пиаскледина отдельно или в комбинации с TGF-β1 будет способствовать дифференциации стволовых клеток в культуральной среде.
Чтобы проверить данную гипотезу, в недавнем исследовании сравнивали влияние TGF-β, препарата Пиаскледин и их комбинации на хондрогенную дифференцировку стволовых клеток в фибриновых и фибрин-альгинатных каркасах (B. Hashemibeni et al., 2018).
Установлено, что Пиаскледин более выражено увеличивает выживаемость и пролиферацию дифференцированных клеток в каркасе фибрина по сравнению с TGF-β и комбинацией Пиаскледин + TGF-β. Комбинация Пиаскледина и TGF-β значительнее увеличивала пролиферацию стволовых клеток в фибриновом каркасе, чем только TGF-β или только Пиаскледин в фибрин-альгинатном каркасе (рис. 1). Кроме того, при лечении Пиаскледином, в том числе в комбинации с TGF-β, отмечался достоверно более низкий уровень в хрящевой ткани коллагена Х, ответственного за побочное действие TGF-β (оссификация хряща и других мягких тканей) по сравнению с монотерапией TGF-β. Авторы исследования также отмечают, что и Пиаскледин, и TGF-β значительно повышали уровень аггрекана – протеогликана, участвующего в сохранении гидратированности хрящевой ткани. Протеогликаны, в частности аггрекан, являются основными компонентами матрикса суставного хряща, поэтому данные о возможности влияния на их концентрацию в хрящевой ткани немаловажны. По результатам полимеразно-цепной реакции установлены значительные различия в экспрессии коллагена ІІ, X и аггрекана между группами (рис. 2-4), и на основании этих данных можно сделать вывод, что Пиаскледин по ряду биостимулирующих эффектов не уступает TGF-β1, а по некоторым – превосходит его.
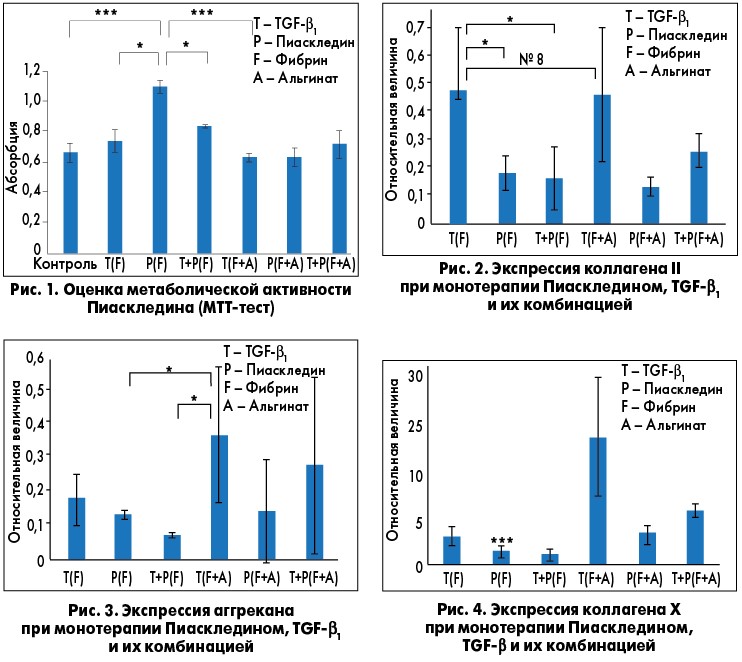
Эти результаты позволяют лучше понять данные клинических исследований с применением Пиаскледина, прежде всего проспективного рандомизированного двойного слепого плацебо-контролируемого исследования ERADIAS, в котором изучали влияние препарата на прогрессирование ОА тазобедренного сустава. Было показано, что в группе пациентов, получавших Пиаскледин, доля пациентов с прогрессированием ОА была меньшей (на 20%), чем в группе плацебо (E. Maheu et al., 2014). Профессор О.Б. Яременко в ходе выступления привел данные собственного исследования, которые перекликаются с результатами исследований с применением Пиаскледина. Согласно этим данным прием Пиаскледина сопровождается 5-кратным снижением уровня маркера деградации коллагена, что сопровождается соответствующими клиническими изменениями.
Таким образом, развитие инновационных методов терапии ОА позволяет надеяться на то, что в ближайшие годы эндопротезирование суставов будет не единственным методом радикального лечения этого инвалидизирующего заболевания. В настоящее время задача врачей – диагностировать ОА на более ранних стадиях и своевременно назначать терапию, способствующую активации процесса регенерации хрящевой ткани. Одним из таких терапевтических методов является применение Пиаскледина, обладающего доказанной клинической эффективностью и потенциальными хондропротективными свойствами.
Подготовила Александра Демецкая
СТАТТІ ЗА ТЕМОЮ Кардіологія
У низці рандомізованих клінічних випробувань та їхніх відкритих продовжень голімумаб продемонстрував ефективність при ревматоїдному артриті (РА), псоріатичному артриті (ПсА) й анкілозуючому спондиліті (АС) у пацієнтів, які раніше не отримували біологічної терапії. Водночас клінічні дані щодо використання цього препарату у хворих, які вже отримували біологічне лікування, обмежені. Метою цієї роботи було оцінити ефективність голімумабу як біологічного препарату 1-ї, 2-ї чи 3-ї лінії в пацієнтів із РА, ПсА й АС в умовах реальної клінічної практики. .
Остеоартрит (ОА) – це дегенеративна хвороба суглобів, яка розвивається внаслідок руйнування суглобового хряща й ушкодження інших тканин суглоба. Якщо безпосередня причина ОА невідома, його називають первинним, або ідіопатичним. Первинний ОА є найпоширенішою формою артриту, що вражає 60% чоловіків і 70% жінок віком понад 65 років. Головні фактори ризику ОА – вік, патологічне навантаження на суглоби, надмірна маса тіла й ожиріння, діабет та інші метаболічні порушення, травми й інфекції суглоба тощо. Фізичні вправи, зокрема біг за відсутності травм, не підвищують ризик розвитку ОА, хрустіння пальцями теж не збільшує ймовірність виникнення цього захворювання. Цікаво, що ОА й остеопороз є практично взаємовиключними патологічними станами: в пацієнтів з ОА майже ніколи не розвивається остеопороз, і навпаки.
Рекомендации EACVI о мерах предосторожности, показаниях, приоритетности исследований, защите пациентов и медицинского персонала.
Комбінації ІАПФ із БКК увійшли в медичну практику близько 20 років тому, проте вже знайшли чимало прихильників і мають доказову базу. Поєднання ІАПФ із БКК не лише ефективно знижує АТ, але й проявляє плейотропність: антиішемічний і антиатерогенний впливи, рено- та вазопротекцію. .

Деформирующий остеоартроз сустава
Остеоартроз является довольно распространенной суставной патологией в современном обществе. По статистике, около 12% населения страдает этим заболеванием. Наиболее часто она встречается у лиц старше 50 лет, хотя нередко диагностируется и в более молодом возрасте.
Заболевание характеризуется развитием дегенеративных изменений в хрящевой ткани, приводящих к ее разрушению. Локализация процесса, чаще всего, это коленные, тазобедренные, голеностопные суставы. Реже наблюдается остеоартроз в межфаланговых суставах кистей рук.
Каковы причины и симптомы заболевания?
Точные причины заболевания до сих пор не выяснены. Предполагается роль генетического фактора в развитии патологии. Значение также имеет повышенная нагрузка на суставы, травмы суставов, избыточная масса тела.
Основными проявлениями остеоартроза являются боли в суставах, ограничение их подвижности,

Возникновение остеоартроза
костные деформации. Такие симптомы заболевания порой резко ограничивают обычную повседневную деятельность. Пациентам иногда сложно преодолеть подъем по лестнице, ходьбу пешком. В тяжелых случаях данная патология может приводить к инвалидизации и обездвиженности.
Каковы современные методы лечения остеоартроза?
Традиционное консервативное лечение остеоартроза заключается в устранении болевого синдрома в период обострения и назначения препаратов, улучшающих трофические процессы в хрящевой ткани (хондропротекторы). Из анальгетиков наиболее часто применяются нестероидные противовоспалительные препараты (НПВП): Диклофенак, Мовалис, Ибупрофен, Ксефокам. Они быстро устраняют боль и уменьшают отек в суставе.

Имплант при остеоартрозе
Хондропротекторные средства улучшают трофику хряща, замедляют его дегенерацию, в отдельных случаях способны даже способствовать его регенерации. Они представлены в основном производными протеогликанов и гликозаминогликанов. Несмотря на активное их применение в последние годы, эффективность хондропротекторов не доказана в клинических исследованиях.
Некоторые специалисты также рекомендуют внутрисуставное введение глюкокортикоидных гормонов и гиалуроновой кислоты. Методика заключается во введении лекарственного препарата с помощью шприца внутрь сустава. При введении глюкокортикоидных гормонов (Кеналог, Дипроспан) наступает быстрый положительный эффект, уменьшается боль, увеличивается подвижность сустава. К сожалению, такой способ лечения не лишен недостатков. Гормональный препарат может вызывать быстрое разрушение хрящевой ткани, поэтому этот метод используют крайне редко.
Для внутрисуставного введения гиалуроновой кислоты используются препараты Fermathron, Hyalgan. Опять же, их эффективность, как и остальных хондропротекторов, не доказана. В любом случае, консервативные способы лечения всего лишь замедляют дегенеративные процессы в тканях сустава и не излечивают заболевание.
Хирургические методы лечения остеоартроза

околосуставня остеотомия
3. Эндопротезирование сустава. Проводится на поздних стадиях развития заболевания. Методика заключается в замене пораженного сустава на искусственный. Эффективность процедуры довольно высокая, имплантат может полноценно функционировать до 20 лет. Период реабилитации после такой операции составляет до 4х месяцев.
Способы профилактики заболевания
Существуют два основных направления профилактики остеоартроза: снижение избыточной массы тела и адекватная физическая нагрузка. Для коррекции веса рекомендуют соблюдение специальной низкокалорийной диеты в сочетании с умеренной физической активностью.

При остеоартрозе нужно уменьшить нагрузку
Специалистами Американской Ассоциации Ревматологов предложена методика профилактика остеоартроза суставов нижних конечностей с помощью ходьбы. Такой вид физической активности является обычной ежедневной нагрузкой, установлено, что пациент среднего возраста, страдающий остеоартрозом, тратит на ходьбу пешком всего лишь около 90 минут в неделю. Поэтому ревматологи рекомендуют совершать в день как минимум 3000 шагов, постепенно увеличивая их количество. Со временем нагрузка должна составить до 6000 шагов в день.
Гимнастика, которая также не редко прописывается больным остеоартрозом, состоит в основном, из динамических нагрузок на опорно-двигательную систему. Советы по лечению суставов, которые можно найти в интернете, а также народные средства для лечения остеоартроза не всегда правильны.
Например, нередко можно встретить совет разрабатывать сустав, не смотря на острую боль. Эти действия только ухудшат состояние больного и вызовут прогрессирования заболевания.
Методика разработана специалистами Массачусетского университета (США) и рекомендуется как для профилактики, так и для лечения пациентов с начальными формами остеоартроза. Она позволяет увеличить подвижность суставов и отсрочить применение более радикальных способов лечения.
Профессор Н.А. Шостак
РГМУ
Факторы, способствующие развитию ОА
1. Хроническая микротравматизация хряща.
2. Возраст пациентов.
4. Нагрузка на суставы.
5. Врожденные или приобретенные дефекты опорно-двигательного аппарата.
6. Наследственная предрасположенность (узелки Гебердена встречаются в 2 раза чаще у матерей и в 3 раза чаще у сестер больного ОА).
Различают первичный и вторичный ОА. Первичный (идиопатический) ОА развивается в периферических суставах, наиболее часто в дистальных и проксимальных межфаланговых суставах кистей (с образованием узелков Гебердена и Бушара), 1-м запястнопястном, 1-м плюснефаланговом, тазобедренном и коленном суставах, межпозвоночных дисках и суставах позвоночника, особенно шейного и поясничного отделов.
В зависимости от распространенности процесса выделяют 2 формы первичного ОА:
- локальная форма характеризуется поражением одного или двух суставов (ОА суставов кистей, стоп, коленного, тазобедренного суставов, ОА позвоночника);
- для генерализованной формы характерно поражение 3-х и более суставов или группы суставов (проксимальные межфаланговые суставы оценивают как одну группу, а дистальные межфаланговые суставы - как другую).
Вторичный ОА развивается в результате травмы, врожденной дисплазии опорно-двигательного аппарата, эндокринных заболеваний (акромегалия, гиперпаратиреоз), метаболических нарушений (охроноз, гемохроматоз, подагра) и других заболеваний костей и суставов (ревматоидный артрит, инфекционные артриты, асептические некрозы костей).
Ведущими патогенетическими факторами при ОА являются дегенерация и деструкция суставного хряща, развивающиеся вследствие несоответствия между механической нагрузкой на суставную поверхность хряща и его способностью сопротивляться этой нагрузке. Изменение суставного хряща может быть обусловлено как врожденными и приобретенными внутренними факторами, так и внешними воздействиями окружающей среды. Наиболее выраженные патоморфологические изменения при артрозе происходят в хрящевом матриксе. Они приводят к развитию прогрессирующей эрозии хряща и разрушению коллагеновых волокон II типа, а также деградации протеогликановых макромолекул. В основе нарушения метаболизма хряща лежат количественные и качественные изменения протеогликанов - белково-полисахаридных комплексов, обеспечивающих стабильность структуры коллагеновой сети, которая является основой хрящевого матрикса. Повреждение хряща при артрозе является результатом повышенного синтеза и освобождения из хондроцитов коллагеназы, стромелизина (металлопротеаз), разрушающих протеогликаны и коллагеновую сеть. Возрастание в пораженном хряще синтеза коллагеназы и стромелизина, которое может быть генетически обусловленным и находится под контролем цитокинов, освобождаемых из синовиальной мембраны, ведет к дальнейшей деградации матрикса хряща.
Воспаление в суставе связано также с уровнем цитокинов, которые часто обнаруживаются в синовиальной жидкости больных артрозом. Цитокины, в частности, интерлейкин-I, стимулируют хондроциты и приводят к возрастанию синтеза металло- и сериновых протеаз. Кроме того, цитокины способны тормозить синтез наиболее физиологичных ингибиторов энзимов и блокировать синтез основных элементов матрикса - коллагена и протеогликанов.
Патологическая анатомия. Хрящ из прочного, эластичного и голубого превращается в сухой, желтый, тусклый с шероховатой поверхностью. На ранней стадии ОА, как правило, в местах максимальной нагрузки образуются локальные зоны размягчения хряща, на более поздних стадиях происходит фрагментация, образуются вертикальные трещины в нем. Местами хрящ обызвествляется. Растрескивание хряща приводит к изъязвлению с обнажением подлежащей кости и отделением фрагментов, которые поступают в полость сустава в виде детрита. При истонченном хрящевом покрове распределение давления между суставными поверхностями становится неравномерным. Это ведет к локальным перегрузкам, нарастанию трения между суставными поверхностями.
В последние годы разрабатывается концепция вязкоэластической защиты сустава: упруговязкие свойства синовиальной жидкости зависят от содержания в ней гиалуронана. Способность поглощать воду и удерживать ее определяют основное свойство гиалуроновой молекулы. Физиологическая роль гиалуронана состоит в обеспечении защиты, смазки и механической стабилизации коллагеновой сети и клеток в тканях сустава и на их поверхности. При артрозе в суставе нарушается реологический гомеостаз, который связан с вязкоэластическими свойствами среды сустава и обеспечивает условия для его нормального функционирования.
Клиника и диагностика остеоартроза
Основными клиническими проявлениями ОА являются боль, деформация и тугоподвижность суставов. Кардинальным клиническим симптомом ОА является боль в пораженных суставах. Боль носит неоднородный характер и имеет разнообразные механизмы возникновения.
Типы болей при остеоартрозе
2. Непрерывные тупые ночные боли чаще в первой половине ночи связаны с венозным стазом в субхондральной спонгиозной части кости и повышением внутрикостного давления.
4. Постоянные боли обусловлены рефлекторным спазмом близлежащих мышц, а также развитием реактивного синовита.
При наличии синовита, помимо боли в суставе как при движении, так и в покое, характерны утренняя скованность, припухлость сустава, локальное повышение кожной температуры. По мере прогрессирования заболевания рецидивы синовита учащаются. Постепенно развиваются деформация и тугоподвижность суставов за счет развития фиброзно-склеротических и гипотрофических изменений параартикулярных тканей. На ранней стадии ОА нарушения функции сустава обусловлены болевым синдромом и рефлекторным спазмом мышц. При прогрессировании заболевания на снижение объема движений влияют сухожильно-мышечные контрактуры, остеофиты и нарушение конгруэнтности суставных поверхностей.
Клиническая картина ОА определяется конкретным суставом, вовлеченным в патологический процесс. Наиболее значимыми и инвалидизирующими формами ОА являются гонартроз и коксартроз.
Коксартроз - наиболее частая и тяжелая форма ОА, которая обычно заканчивается прогрессирующим нарушением функции сустава вплоть до полной ее потери. Основными симптомами коксартроза являются боли механического характера в области тазобедренного сустава, часто сопровождающиеся прихрамыванием.
Для постановки диагноза ОА тазобедренного сустава, согласно критериям Американской коллегии ревматологов (АКР), необходимо наличие боли в тазобедренном суставе и двух признаков из следующих трех:
Читайте также:


