Индекс выраженности остеоартроза университетов западного онтарио и макмастера
Сравнение однократного внутрисуставного введения нового препарата с поперечными связями гиалуронана названием FLEXOTRON CROSS и препарата Синвиск-Уан при остеоартрозе коленного сустава

Процедуры рандомизации
Включенные в исследование пациенты были рандомизированы (1:1) в 2 группы. Для этого сотрудником, клинически не вовлеченным в исследование, были созданы последовательно пронумерованные непрозрачные запечатанные конверты с указанным распределением в группу. После подписания согласия на участие в исследовании участник выбирал 1 конверт, а затем получал гиалуронан в соответствии с распределением.
Вмешательство
Пациентам из группы FLEXOTRON CROSS было выполнено однократное внутрисуставное введение 3 мл препарата FLEXOTRON CROSS. Пациентам из группы Синвиск Уан было выполнено 1 введение 6 мл препарата Синвиск Уан. Все введения выполнял один и тот же опытный врач с соблюдением асептических мер без ультразвукового контроля или других методов визуализации. Исследователь, который выполнял все оценки, был заслеплен относительно рандомизациии лечения. Пациенты также были заслеплены с использованием экрана, помещенного между ними и их коленом, с целью предотвращения визуальной оценки места введения во время процесса введения. Они также не были проинформированы о том, какой препарат гиалуронана они будут получать в ходе исследования.Во время исследования использование простых анальгетиков, глюкозамина илихондроитина, НПВП или физиотерапии для коленного сустава было запрещено. Ацетаминофен (500 мг; максимальная суточная доза 4 г) был единственным вспомогательным препаратом, разрешенным при боли в колене. Применение ацетаминофена было запрещено в течение 24 часов перед каждым визитом. Использование вспомогательных препаратов в течение периода исследования регистрировалось пациентом в дневнике.Серьезные отклонения от протокола включали хирургическое вмешательство, начало физиотерапии и использование запрещенных препаратов. Пациенты считались неприверженными к лечению, если они пропускали какой-либо визит.
Показатели исходов
Первичным показателем являлось изменение оценки боли от 0 до 100 мм на визуальной аналоговой шкале (ВАШ; 0 = отсутствие боли и 100 = невыносимая боль) от исходного уровня до 6 месяцев14. При постановке отметки на ВАШ пациенту предлагали оценить среднюю степень тяжести боли в коленном суставе при движениях в колене за предыдущую неделю.Вторичные маркеры включали индекс выраженности остеоартрита университетов Западного Онтарио и МакМастера (WOMAC, шкала Ликерта), индекс Лекена, тест со вставанием со стула и ходьбой c отсчетом времени (TUG), тест устойчивости на одной ноге. (SLS), использование вспомогательных анальгетиков и шкала удовлетворенности пациентов(см. приложение)15-19.
Оценка безопасности
Оценка безопасности выполнялась на основании сообщений пациентов о возникновении нежелательных явлений и по результатам физикального обследования, которое проводилось врачом при каждом контрольном визите. Оценивающий врач должен был решить, было ли каждое нежелательное явление связано с терапией в рамках исследования или нет. Серьезное нежелательное явление определялось как явление со смертельным исходом, опасное для жизни, приводящее к стойкой инвалидизации или требующее госпитализации.
Статистический анализ
С помощью программного обеспечения SPSS Sample Power 3.0 (IBM) и статистической методики, применяющейся в рамках исследования, однофакторного ковариационного анализа независимых выборок (ANCOVA) с использованием исходных данных для результирующей переменной в качестве ко-варианты, было установлено, что необходимый размер выборки составляет 59 участников в каждой группе (p = 0,8, альфа = 0,05; поскольку предварительных данных не было, мы использовали величину среднего коэффициента по Коэну, равную 0,09 для R2 для ко- варианты, и величину среднего отклонения, равную 0,25для ANOVA [дисперсионный анализ]). Исходя из предположения, что 10% пациентов будут исключены из исследования, количество участников было увеличено до 65 человек в группе.Исходы оценивались с помощью анализа всех рандомизированных пациентов согласно назначенному лечению. Выборка включала в себя всех пациентов, которым было выполнено введение, и которые прошли как минимум 1 обследование после оценки исходного уровня;для учета отсутствующих данных использовался метод переноса данных последнего наблюдения вперед.Все статистические оценки выполнялись с использованием программного обеспечения SPSS (версия 12.0). Исходные характеристики сравнивали с использованием t-критерия и критерия хи-квадрат. 1-факторный ANCOVA независимых выборок с использованием исходных данных для результирующих переменных в качестве ко-вариант использовался для анализа различий между двумя группами в отношении первичных и вторичных исходов через 1, 3 и 6 месяцев после введения. Анализ Джонсона-Неймана использовался для определения области статистически значимых различий между группами, когда предположение о равных внутригрупповых коэффициентах регрессии ANCOVA было отклонено. Изменения показателей первичного и вторичного исхода среди оценок на исходном уровне, через 1, 3 и 6 месяцев последующего наблюдения оценивали с использованием однофакторного ANOVA с повторными измерениями и ретроспективного анализа Бонферрони. Значения P 
Мочевая кислота может активировать механизмы врожденного иммунитета при остеоартрите (ОА), способствуя развитию и прогрессированию заболевания. Мы оценили эффективность воздействия колхицина на болевой синдром и функциональность при симптоматическом коленном ОА (КОА) и на лежащие в основе его действия механизмы.
Эффективность колхицина в отношении модификации симптоматики и воспаления при остеоартрите коленного сустава (COLKOA) — это двойное слепое, с контролем плацебо, рандомизированное исследование, в котором проводили сравнение применения колхицина перорально в дозировке 0,5 мг два раза в день в течение 16 недель с плацебо при остеоартрите коленного сустава (КОА). Первичной конечной точкой было улучшение на ≥30% показателей общего индекса выраженности остеоартроза университетов Западного Онтарио и МакМастера (WOMAC) на 16 неделе терапии.
Вторичные конечные точки включали в себя снижение болевого синдрома (0−10 по шкале Ликерта); болевой синдром по шкале WOMAC; общая оценка состояния пациента (0−100); функциональный статус; отклик по шкале международного общества по изучению артрита (OARSI) и оценки исходов ревматоидного артрита в клинических исследованиях (OMERACT); качество жизни; и изменения уровня биомаркеров метаболизма хрящевой ткани и воспаления в сыворотке крови, моче и синовиальной жидкости (СЖ), а также концентрации колхицина в плазме крови/СЖ.
Из 109 случайным образом распределенных участников исследования у 39% (95% доверительный интервал (ДИ) 27−52%) и 49% (95% CI 36−62%) в группах колхицина и плацебо соответственно была достигнута первичная конечная точка по окончании исследования (P = 0,284, отношение шансов 0,66, 95% ДИ 0,31−1,41). На клинических вторичных конечных точках не было выявлено убедительных доказательств различий в эффективности лечения.
Применение терапии значительно снижало средний сывороточный уровень высокочувствительного СРБ (P = 0,008) и карбоксиконцевого перекрёстно-связывающего телопептида коллагена I типа (CTXI) в СЖ (P = 0,002); при лечении имелась тенденция к снижению уровня воспалительных маркеров (IL-6, IL-8, TNFa, CD14 и IL-18 в СЖ), но данные различия не были статистически значимыми.
Применение колхицина (0,5 мг перорально дважды в день) снижает уровень биомаркеров воспаления и интенсивного метаболизма костной ткани, которые, как известно, ассоциированы с тяжестью ОА, но не смягчает симптоматику КОА в течение периода исследования в 16 недель. Оправдано проведение более долгосрочного исследования для оценки медленнодействующих модификационных эффектов в отношении заболевания.
Leung YY, Haaland B, Huebner JL, Wong SBS, Tjai M, Wang C, Chowbay B, Thumboo J, Chakraborty B, Tan MH0, Kraus VB.
Osteoarthritis Cartilage. 2018 May; 26(5): 631−640
DOI:10.1016/j.joca.2018.01.026

Uric acid may activate an innate immune response in osteoarthritis (OA), contributing to disease pathology and progression. We evaluated the effectiveness of colchicine on pain and function in symptomatic knee OA (KOA) and the underlying mechanism of action.
Colchicine effectiveness in symptoms and inflammation modification in knee osteoarthritis (COLKOA) was a double-blind, placebo-controlled, randomized trial comparing 16 weeks of treatment with 0.5 mg twice-daily oral colchicine to placebo for knee osteoarthritis (KOA). The primary endpoint was ≥30% improvement in total Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC) score at week 16.
Secondary endpoints included improvement in pain (0−10 Likert scales); WOMAC pain; patient global assessment (0−100); physical function; the OARSI-OMERACT response; quality of life; and change in serum, urine, synovial fluid (SF) biomarkers of cartilage metabolism and inflammation, and plasma/SF colchicine concentrations.
Of 109 randomly assigned participants, 39% (95% confidence interval (CI) 27−52%) and 49% (95% CI 36−62%) in the colchicineand placebo arms respectively met the primary endpoint at study end (P = 0.284, odds ratio 0.66, 95% CI 0.31−1.41). No strong evidence of treatment differences was identified on clinical secondary endpoints. Treatment significantly reduced mean serum hs-CRP (P = 0.008) and SF CTXI (P = 0.002); treatment tended to reduce inflammatory markers (SF IL-6, IL8, TNFα, CD14 and IL-18), but these differences were not statistically significant.
Colchicine (0.5 mg twice-daily orally) reduced inflammation and high bone turnover biomarkers known to be associated with OA severity and progression risk, but did not reduce KOA symptoms over a 16-week study period. A longer-term study to evaluate for slow-acting disease modifying effects is warranted.
The trial has been registered at clinicaltrials.gov as NCT02176460. Date of registration: June 26, 2014.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Лечение. Цели лечения
Оценка исходов остеоартрита
Исход заболевания и эффективность терапии оценивают по динамике боли в суставах, скованности, функциональной активности (индексы Lequesne, WOMAC) и качеству жизни больного (анкета SF-36, см. Приложение к статье Ревматоидный артрит).
• Индекс Lequesne включает оценку боли в покое и при ходьбе (5 вопросов), максимально проходимого расстояния (1 вопрос) и повседневной активности (4 вопроса). Балльная оценка каждого вопроса суммируется и составляет счёт тяжести заболевания. Счёт в пределах 1—4 классифицируется как лёгкий OA, 5-7 -умеренный OA, 8—10 — тяжёлый OA, 11 — 13 — очень тяжёлый OA, 14 — крайне тяжёлый OA.
• Индекс WOMAC (Western Ontario and McMaster University, — опросник для самостоятельной оценки пациентом выраженности боли (в покое и при ходьбе — 5 вопросов), скованности (длительность и выраженность — 2 вопроса) и функциональной недостаточности в повседневной деятельности (17 вопросов). Оценка проводится по ВАШ в см - от 0 (нет симптомов/ограничений) до 10 (максимальная выраженность симптомов/ограничений), и затем все показатели суммируются.
• Анкета SF-36 оценивает влияние эмоционального и физического состояния пациента при выполнении работы или обычной повседневной деятельности.
Показание к госпитализации. Лечение больных с OA следует проводить в амбулаторных условиях, за исключением необходимости хирургического вмешательства или наличия выраженных болей в суставах.
Немедикаментозное лечение. Обучение больных
Режим и физическая активность
Физические упражнения при OA способствуют снижению боли и сохранению функциональной активности суставов. Кроме того, физические упражнения необходимы больным с точки зрения профилактики сердечно-сосудистых заболеваний.
• Полезны езда на велосипеде, плавание, прогулки. Беги подъём по лестнице нежелательны.
• При OA с поражением коленных суставов используют упражнения для укрепления силы четырёхглавой мышцы бедра, что приводит к достоверному уменьшению боли.
• Следует начинать с изометрических упражнений с постепенным переходом к упражнениям с противодействием, проводить в соответствии с индивидуальными возможностями больного.
• Необходимо учитывать противопоказания для занятий лечебной физкультурой у больных OA - как абсолютные (неконтролируемая аритмия, атриовентрикулярная блокада 3-й степени, недавние изменения на ЭКГ, нестабильная стенокардия), так и относительные (кардиомиопатия, пороки сердца, плохо контролируемая артериальная гипертензия).
Диета. В отличие от первичной профилактики OA, специальных исследований, подтверждающих роль снижения массы тела в задержке прогрессирования уже имеющегося OA, не проводили. Следует ориентировать больных на поддержание нормальной массы тела с позиции механической разгрузки суставов, а также профилактики сердечно-сосудистой патологии.
Применение специальных приспособлений
• Применение повязок или наколенников, фиксирующих колено в вальгусном положении, использование ортопедических стелек с приподнятым на 5—10° латеральным краем важно для уменьшения нагрузки на медиальные отделы коленного сустава. Указанные приспособления оказывают обезболивающий эффект и улучшают функцию суставов.
• Применение ортезов и шинирование 1-го запястно-пястного сустава способствуют устранению подвывиха и улучшению функции кисти.
• С целью механической разгрузки суставов рекомендуют хождение с тростью, причём в руке, противоположной поражённой нижней конечности (специальные исследования по этому поводу отсутствуют; тем не менее использование трости внесено в международные рекомендации).
Физиотерапия
Медикаментозное лечение. Симптоматические лекарственные средства быстрого действия
• Парацетамол показан при умеренных болях (при OA без признаков воспаления ) с целью уменьшения боли. Дозу парацетамола подбирают индивидуально, но не более 2,0 г/сут, так как более высокие дозы сопровождаются развитием осложнений со стороны ЖКТ. В указанной дозе доказана безопасность применения парацетамола при OA в течение 2 лет.
• НПВП показаны при OA в случае неэффективности парацетамола, а также при наличии признаков воспаления.
♦ Преимущества по эффективности какого-либо НПВП над другим не выявлено.
♦ Выбор НПВП определяется прежде всего его безопасностью в конкретных клинических условиях. Например, среди клинико-фармакологических свойств индометацина следует принять во внимание его отрицательное воздействие на метаболизм суставного хряща при OA.
♦ Осложнения со стороны ЖКТ — одни из наиболее серьёзных побочных эффектов НПВП. Относительный риск их возникновения варьирует у различных НПВП и дозозависим. Наименьшим риском развития желудочно-кишечного кровотечения обладают селективные ингибиторы ЦОГ-2. Их следует назначать при наличии следующих факторов риска развития нежелательных явлений: возраст старше 65 лет, наличие в анамнезе язвенной болезни или желудочно-кишечного кровотечения, одновременный приём ГК или антикоагулянтов, тяжёлые сопутствующие заболевания.
♦ Приём неселективных НПВП в сочетании с синтетическим простагландином мизопростолом в дозе 200— 800 мг/сут, несмотря на наличие положительного эффекта в отношении ЖКТ, имеет значительно более высокую стоимость лечения.
♦ НПВП при OA применяют только в период усиления болей, в отличие от их систематического приёма при воспалительных артритах. Доза НПВП при OA ниже, чем при артритах. Неселективные ингибиторы ЦОГ: ибу-профен по 400—600 мг 3 раза в сутки, кетопрофен по 100 мг/сут, диклофенак по 50 мг 2 раза в сутки, лорноксикам 12-16 мг/сут. Селективные ингибиторы ЦОГ-2: мелоксикам 7,5 мг/сут, нимесулид по 100 мг 2 раза в сутки, целекоксиб по 100 мг 1 —2 раза в сутки.
• Трамадол (опиоидный анальгетик, в первые дни по 50 мг/сут с постепенным увеличением дозы до 200—300 мг/сут) применяют в течение короткого периода для купирования сильной боли при условии неэффективности парацетамола или НПВП, а также невозможности назначения оптимальных доз этих ЛС.
Симптоматические лекарственные средства медленного действия
• Колхицин. Применяют в случае множественного поражения суставов при OA с признаками воспаления и выраженными болями, резистентным к другому лечению. Применение колхицина основано, с одной стороны, на обнаружении в указанных случаях OA кристаллов пирофосфата кальция в синовиальной жидкости, а с другой стороны — на свойстве колхицина тормозить дегрануляцию нейтрофилов, стимулированных кристаллами. Колхицин назначают в дозе 1 мг/сут.
• Внутрисуставное введение глюкокортикоидов. Введение ГК в полость сустава показано при OA с симптомами воспаления. При OA ГК вводят только в коленные суставы. Эффект лечения, выражающийся в уменьшении боли и симптомов воспаления, длится от 1 нед до 1 мес. Применяюттриамцинолон (20-40 мг), метилпреднизолон (20-40 мг), бетаметазон (2-4 мг). Частоту введения не следует превышать более 2—3 в год. Более частое введение не рекомендуют ввиду прогрессирования разрушения хряща.
• Препараты, содержащие хондроитин сульфат и глюкозамина сульфат, уменьшают боли в суставах при ОА; эффект сохраняется в течение нескольких месяцев после их отмены, хорошо переносятся больными (принимаются перорально и парентерально). Получены данные об их возможном структурно-модифицирующем действии (замедление сужения суставной щели, образования остеофитов) при OA коленных суставов (хондроитин сульфат, глюкозамина сульфат), мелких суставов кистей (хондроитин сульфат), при остеоартрите у женщин постменопаузального возраста (глюкозамина сульфат).
♦ Хондроитин сульфат применяют по 750 мг 2 раза в сутки - первые 3 нед, затем по 500 мг внутрь 2 раза в сутки, длительность курса — 6 мес.
♦ Глюкозамина сульфат назначают внутрь по 1500 мг/сут (однократно) или в/м 2—3 раза в неделю, общий курс 4-12 нед, курсы повторяют 2— 3 раза в год.
• Производные гиалуроната применяют для внутрисуставного введения. В настоящее время применяют 2 препарата гиалуроната: низкомолекулярный (мол. масса 500-730 килодальтон) и высокомолекулярный (мол. масса 6000 килодальтон). Оба препарата уменьшают боли в коленных суставах, эффект длится от 60 дней до 12 мес. Лечение хорошо переносится, очень редко при их введении боли в суставе могут усиливаться по типу псевдоподагрической атаки.
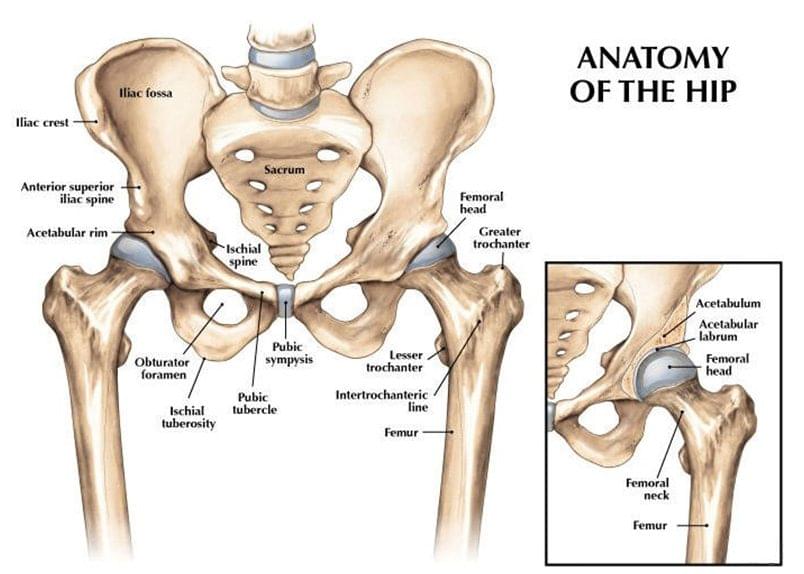
Тазобедренный сустав — это шаровидный многоосный сустав с большой амплитудой движения в различных направлениях, который образован вертлужной впадиной тазовой кости и головкой бедренной кости. Головка бедренной кости помещается в вертлужной впадине тазовой кости и надежно удерживается там посредством связок и окружающих мышц, которые обеспечивают огромную стабильность сустава.
Тазобедренный сустав имеет три оси вращения, в соответствии с чем может осуществлять сгибание и разгибание, отведение и приведение, ротацию внутрь и кнаружи, а также круговое вращение. Эти движения возможны благодаря различным компонентам сустава, повреждение каждого из которых может негативно повлиять на амплитуду движения сустава и его способность выполнять свою функцию.
Субъективное обследование
Первым шагом во время обследования является расспрос пациента, в ходе которого врач получает от человека информацию об имеющихся у него симптомах. Сбор анамнеза и анализ жалоб пациента являются очень важным компонентом субъективного обследования, поскольку это позволяет клиницисту построить гипотезу, объясняющую механизм травмы, тип поврежденных структур, степень повреждения и т.д. Здесь важно все: локализация боли, характера боли, как она меняется в течение суток, активность, провоцирующая боль, факторы, способствующие ее уменьшению.
История болезни пациента, а также его социальная/семейная история также важны, поскольку это помогает клиницисту исключить наследственные заболевания. Любые хирургические вмешательства, которые специфичны в отношении тазобедренного сустава, также важны, например, пациент, который перенес операцию по замене тазобедренного сустава и в настоящее время жалуется на боль в этой области. Имеют значение сопутствующие заболевания и принимаемые в настоящий момент лекарства.
- Травмы в анамнезе.
- Внезапный приступ боли.
- Наличие отека или деформации.
- Невозможность опираться на ногу.
- Опухоль или пульсация в паху; опухоль яичек.
- Гематурия.
- Запор, рвота или лихорадка.
- Ночная потливость, необъяснимая потеря веса, потеря аппетита.
- Ночные боли.
- Онкология в анамнезе.
- Неврологические симптомы нижних конечностей — слабость, онемение или покалывание.
- Использование стероидов.
Также важно учитывать другие (отсутствие мотивации, наличие депрессии, плохой сон и т.д.) признаки, поскольку они могут препятствовать физиотерапевтическим процедурам.
Объективное обследование
По завершении беседы с пациентом врач приступает к объективному обследованию.
Во время пальпации специалист оценивает:
- Сосудистая система — пульс, капиллярный кровоток.
- Температура — воспаление/инфекционный процесс.
- Отек — суставной выпот.
- Болезненность — поясничный отдел позвоночника, структуры таза, большой вертел, паховая связка, бедренный треугольник, коленный сустав.
Амплитуда движений в тазобедренном суставе (активные и пассивные) измеряется с помощью гониометра и документируется. Эти измерения являются базовыми и помогают определить, насколько эффективна программа лечения.
- Тест Томаса — оценка на предмет укорочения флексоров бедра и сгибательной контрактуры тазобедренного сустава.
- Тест Эла — оценка на предмет укорочения прямой мышцы бедра.
- Тест Тренделенбурга — оценка силы абдукторов бедра.
- FABER тест — оценка амплитуды движений в тазобедренном суставе.
- FADDIR — оценка на предмет фемороацетабулярного импинджмента.
- Тест Обера — оценка состояния илиотибиального тракта.
Инструментальная диагностика
Методом выбора является рентгенография тазобедренного сустава в прямой и боковой проекциях. Это позволяет исключить переломы. Однако, в некоторых случаях, даже если рентгенологическая картина в норме, требуется проведение дополнительных исследований, например, КТ или МРТ тазобедренного сустава, с целью исключения скрытых переломов или повреждения мягких тканей.
В сложных случаях КТ может быть полезна для получения дополнительной информации, которая необходима при планировании операции. Также стоит учитывать, что интерпретация рентгеновского снимка будет осложнена у пожилых людей наличием других состояний, например, дегенеративных процессов.
Изменения хряща коленного сустава при остеоартрите, обнаруженные при магнитно-резонансном обследовании с отсроченным контрастированием гадолинием после терапии гидрализатом коллагена: пилотное рандомизированное контролируемое исследование
T.E. МакАлиндон †* , M. Ньют †, Н. Кришнан ‡, Р. Рутазер §, Л.Л. Прайс §, Д. Берштейн ||, Дж. Гриффит <, K. Флешнгар #
† Отделение ревматологии, Tufts Medical Center, Box 406, 800 Washington Street, Boston, MA 02111, United States
‡ Отделение рентгенологических исследований, Beth Israel Deaconess Medical Center, 300 Brookline Avenue, Boston, MA 02115, United States
† Научно-исследовательский центр биостатистики, Institute for Clinical Research and Health Policy Studies, Tufts Medical Center, Box 063, 800 Washington Street, Boston, MA 02111, United States
‡ Отделение рентгенологических исследований, Beth Israel Deaconess Medical Center, 4 Blackfan Circle, Boston, MA 02115, United States
† Центр планирования и базы данных, Tufts Clinical and Translational Science Institute, Tufts Medical Center, Box 063, 800 Washington Street, Boston, MA 02111, United States
# Отделение исследований и бизнес-перспектив, GELITA AG, Gammelsbacherstrasse 2, D-69412 Eberbach, Germany
РЕЗЮМЕ
Цель: Определить выявит ли какой-либо из двух подходов - магнитно-резонансное обследование с отсроченным контрастированием гадолинием (dGEMRIC) или Т2 картирование - краткосрочные изменения гиалинового хряща коленного сустава среди пациентов, получающих гидрализат коллагена.
Схема: Проспективное, рандомизированное, пилотное исследование гидрализата коллагена при умеренном остеоартрите коленного сустава, проводимое под контролем плацебо в одном центре по двойной слепой схеме. Участникам разрешили продолжить прием ранее употребляемых обезболивающих средств. Первичным исходом было изменение времени релаксации T1 на dGEMRIC в области хряща во временную точку 24 недели. Вторичные конечные точки включали изменение времени расслабления на T1 dGEMRIC между начальным этапом и 48 неделей, изменение времени расслабления T2 на этапе 0, 24 и 48 недель, симптомы и шкалу функционирования, полученные на каждом визите, а также общий прием обезболивающих средств.
Результаты: Среди выборки из 30 рандомизированных испытуемых показатель dGEMRIC увеличился в медиальных и боковых областях большеберцовой кости (среднее повышение 29 и 41 мс соответственно) у участников, получающих гидролизат коллагена, но снизился (среднее снижение 37 и 36 мс соответственно) в группе плацебо с изменениями между двумя группами в течение 24 недель, достигая значимости. Других значимых изменений между двумя группами не наблюдалось в других четырех областях или каких-либо значений Т2 или клинических исходов.
Заключение: Эти предварительные результаты показывают, что метод dGEMRIC может обнаруживать изменение в содержании протеогликана в хряще коленного сустава у пациентов, принимающих гидролизат коллагена через 24 недели.
Введение
Представляя масштаб влияния остеоартрита на общественное здравоохранение важно отметить, что существует маленькое количество препаратов, модифицирующих течение данного заболевания. Несмотря на то, что некоторые факторы могли затруднять проведение испытаний эффективности воздействия при остеоартрите, отсутствие эффективного биомаркера здоровья суставов было основным препятствием к разработке препарата. Однако, применение сложных технологий обработки изображений для оценки структурных изменений суставов при остеоартрите предоставляет возможность измерить патологическое развитие критических структур, таких как суставной хрящ. Два подхода на основе магнитно-резонансного исследования, для которых предварительные результаты означают такой потенциал, включает магнитно-резонансное обследование хряща с отсроченным контрастированием гадолинием (dGEMRIC)1 и Т2 картирование. 2
dGEMRIC использует отрицательно заряженное контрастное вещество Gd-DTPA2 для накопления в гиалиновом хряще в концентрации, в обратной зависимости соответствующей содержанию протеогликанов. 1 Исследования ex-vivo показали строгую зависимость показателя dGEMRIC с количественными показателями содержания протеогликанов и с приближенно-количественным гистологическим показателем. 3 Более низкий индекс dGEMRIC был связан с участками поражения гиалинового хряща, определенными на артроскопии коленного сустава 4 и среди пациентов с синдромом дисплазии тазобедренного сустава. 5 Метод различает между коленными суставами, подверженными разному уровню физической активности как в поперечном, так и в продольном направлении. 7 С другой стороны, время релаксации Т2 отражает содержание воды в хрящевых тканях и связано с возрастом и симптоматической дегенерацией, несмотря на качественные различия в природе повышения T2, связанные с возрастом относительно дегенерации. 8 Также оказалось, что параметры немедленно реагируют на изменения после упражнений и отдыха. 9 Поскольку, изменения протеогликанов, распределения и содержания воды являются характерными чертами раннего остеоартрита, данные методики обладают потенциалом работы в качестве косвенных показателей степени здоровья хряща. Эффективное использование данных свойств может позволить провести эффективное испытание вмешательств, модифицирующих предполагаемые структуры при ОА на ранней стадии развития заболевания. Однако данные возможности пока еще не были протестированы.
Поскольку препарат представлен как оказывающий благоприятное воздействие на хрящ, гидролизат коллагена (ГК) является представителем большинства видов предполагаемых процедур при лечении ОА, чьи разработки и клиническое подтверждение будут в значительной степени обеспечены доступностью объективных показателей здоровья суставного хряща. ГК является питательным продуктом, полученным из коллагеновой ткани животных, включающим ряд полипептидов с молекулярной массой от 3 до 10 кДа. ГК вызывает синтез коллагена 2 типа и протеогликанов во внеклеточном матриксе в дозозависимой форме 10 , хорошо всасывается через слизистую оболочку желудочно-кишечного тракта на моделях мышей и распространяется в гиалиновом хряще, где он накапливается. 11 На моделях мышей линии STR/ort со спонтанным ОА пероральное введение ГК сокращало развитие и прогрессирование поражения хряща. 12,13 Ряд клинических отчетов и наблюдений показывают, что ГК может облегчать симптомы ОА в рамках одного рандомизированного клинического исследования, показавшего смешенные результаты. 14
Поскольку наше знание свойств параметров данных методов визуализации и эффективности ГК в условиях in-vivo являются недостаточными для создания схемы характерного клинического исследования, мы провели пилотное исследование для определения могут ли dGEMRIC и T2 картирование различать изменения гиалинового хряща коленного сустава среди участников, принимающих препараты ГК (Fortigel®) по сравнению с испытуемыми, получавшими плацебо.
Методы
Мероприятия в рамках исследования
Состав ГК, используемый в данном исследовании (Fortigel®), представлял собой жидкость, состоявшую 10 г ГК, 0,4 г фруктозы, солодовый экстракт, лимонную кислоту, ксантановую камедь, сорбат калия, ацесульфам К, сукралозу, а также природные и искусственные красители в 10 мл воды. Плацебо, аналогичное по внешнему виду и вкусу, содержало аналогичные вспомогательные вещества, но ГК отсутствовал.
Рандомизация и заслепление
Участников рандомизировали на основании 1:1 для получения ГК или плацебо с использованием списка блочной рандомизации, сформированного компьютером, распределенные по индексу массы тела на границе 32 кг/м 2 . Список рандомизации был сгенерирован Др. Иммой Фишер, биоматематиком Institute for Medical Information Processing, Тюбингенского университета в Германии. Список рандомизации сохранялся спонсором, Gelita AG. Активный состав и состав плацебо были предоставлены в аналогичных ампулах Gelita AG. Они были поставлены в исследовательское фармацевтическое учреждение Tufts — New England Medical Center, где персонал хранил состав в готовом для распределения виде. Исследовательское фармацевтическое учреждение распределяло испытуемый препарат участникам в течение 8 недель.
Одновременное применение обезболивающих средств
В ходе исследования участникам было разрешено продолжить прием болеутоляющих средств или нестероидных противовоспалительных препаратов. Мы поощряли участников поддерживать установленный режим, принимая данные препарата во время исследования, и просили, чтобы они планово учитывали потребление данных препаратов на календаре, предоставленном командой исследования.
Оценка исследования включала визит скрининга и исходную оценку (неделя 0), плановые визиты на неделе 8, 16, 24, 32, 40 и 48 с перерывом 7 дней между каждым периодом оценки исследования.
Протокол проведения МРТ
dGEMRIC и T2 МРТ исследование проводили на исходном этапе, 24 и 48 неделе. Пациентам вводили 0,2 ммоль/кг Gd-DTPA2 (Magnevist, Berlex, NJ) и просили прогуляться в течение 10 минут для транспортировки контрастного агента в ткани. через 90 минут после введения проводили dGEMRIC с использованием коленной катушки на 1,5 Т Twin Speed Excite scanner (GE Healthcare, Waukesha, WI).
Было получено 32 сагиттальных среза 3,0 мм с использованием трехмерной последовательности быстрого градиентного эха, полученная за счет намагничеснности восстановления с инверсией с углом поворотов спинов = 20°, квадратом поля зрения = 14 см, матрицей = 512 x 512, полосой частот = 62,5 кГц. Пять инверсионных задержек (T1 = 1650, 650, 350, 150, 28 мс) использовали с различным временем повторения между последовательными инверсионными пульсами (Tr) в диапазоне 360 мс - 1920 мс и 7,3/3,1 мс (Ts/Te).
Были получены мультисрезовые быстрые спин-эхо Fat Sat Dual Echo (Tr 3000 мс, Te 88,3 мс, Etl 6, Nex 1, Matrix 512 x 512) изображения, которые охватывали те же сегменты коленного сустава, что и dGEMRIC.
Компьютерный анализ dGEMRIC и Т2 картирования
Скрининговое обследование и оценка исходных показателей включали задне-передняя рентгенографию с полусогнутом состоянии согласно стандартному протоколу, 17 физикальное обследование для документирования клинических характеристик ОА коленного сустава и исключения альтернативных причин боли в коленном суставе, а также измерение массы тела и роста. На каждом визите проводили оценку боли в течение предыдущих 24 часов с использованием шкалы WOMAC-Likert версия 3.0 и общей визуально-аналоговой шкалы боли. Измеряли функциональную способность, используя таймированную ходьбу 20 м и тест вставания со стула. Мы зарегистрировали общее одновременное потребление обезболивающих средств на каждом визите при помощи бумажных календарей, предоставленных каждому участнику.
Оценка приверженности терапии
Персонал исследования анализировал инструкции по дозированию на каждом визите исследования. Участников инструктировали на каждом визите исследования вернуть ампулы, которые были распределены им на предыдущем визите. Они собирались и подсчитывались персоналом исследования. Оценку приверженности осуществляли как количество используемых возвращенных ампул, разделенных на количество дней, прошедших с последнего визита.
Контроль нежелательных явлений
Участники были проинструктированы регистрировать в своих календарях любые изменения со стороны здоровья или медицинских препаратов в ходе исследования. На каждом визите участников попросили указать на нежелательные явления, которые они перенесли после предыдущего визита. Оценка нежелательных явлений субъективно проводил главный исследователь до раскрытия распределения терапии. Нежелательные явления были зарегистрированы и классифицированы согласно пораженной системе организмы, тяжести (включая необходимость госпитализации), предполагаемому взаимодействию с испытуемым препаратом (слепая схема), предпринятых мер, статусу и исходы.
Теоретическим первичным исходом изменение времени релаксации T1 на dGEMRIC в области хряща на исходном этапе и во временную точку 24 недели. Вторичные конечные точки включали изменение времени расслабления на T1 dGEMRIC между начальным этапом и 48 неделей, изменение времени расслабления T2 на этапе 0, 24 и 48 недель, симптомы и шкалу функционирования, полученные на каждом визите, а также общий прием обезболивающих средств. Изменения анализировали групповые изменения относительно исходного уровня в качестве первичных показателей и процент изменения относительно исходного уровня в качестве дополнительных показателей.
С целью оценки тенденций при одновременном применении обезболивающих средств в группах мы переносили потребление данные таблетки в одиночную шкалу, отражающих относительную эффективность в отношении ацетаминофена.
Основным подходом для оценки всех конечных точек было проведение испытаний для определения различий между исходным уровнем и через 24 недели и исходным уровнем и через 48 недель с использованием двустороннего t-критерия Стьюдента сравнения изменений между двумя группами. Однако в случае, когда распределение исходов не соответствовало норме, мы использовали непараметрические критерии для сравнения групп.
Предварительный скрининг и проведение скрининга по телефону (кол-во = 181)
Не соответствуют требованиям (кол-во = 86)
Запланированные встречи для проведения скрининга (кол-во = 95)
Читайте также:


